Bei einer Herzschwäche (chronische Herzinsuffizienz) ist das Herz aufgrund der verringerten Pumpleistung nicht mehr in der Lage, den Körper ausreichend mit Blut und Sauerstoff zu versorgen. Je weiter die Herzinsuffizienz fortschreitet, desto schwerer ist die Beeinträchtigung. Bestimmte Nährstoffe tragen zur Energieversorgung der Herzmuskelzellen bei und helfen, die Pumpfunktion des Herzens zu verbessern.
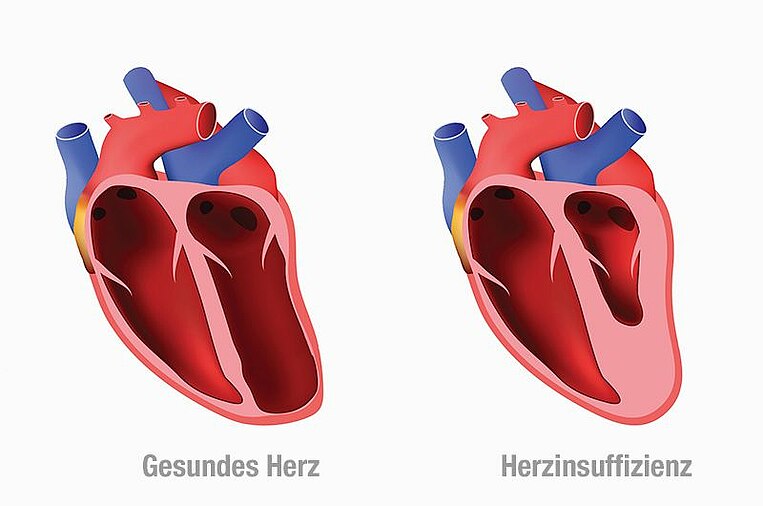
Ursachen und Symptome
Bei Herzschwäche pumpt das Herz nicht genügend Blut durch den Körper. Dabei staut es sich vor den Herzkammern. Organe und Gewebe werden schlechter durchblutet. Stehendes Blut erhöht das Risiko für Thrombosen. Bei weiterem Fortschreiten lagert sich Flüssigkeit im Körper und den Organen ein. Mögliche Folgen sind Wasseransammlungen in der Lunge, Herzrhythmusstörungen, Schlaganfall oder im schlimmsten Fall tödliches Herzversagen.
Eine Herzschwäche kann entweder die linke, rechte oder beide Herzhälften betreffen. Die häufigste Form ist die Linksherzinsuffizienz. Hierbei staut sich Blut in der Lungenvene und in der linken Herzhälfte. Sie pumpt weniger sauerstoffreiches Blut aus der Lunge in den Körperkreislauf. Eine Rechtsherzinsuffizienz betrifft die rechte Herzhälfte. Das Blut staut sich dann in den Venen. Sie transportieren das Blut aus den Organen und den Muskeln zurück zum Herzen. Von einer globalen Herzinsuffizienz spricht man, wenn beide Herzhälften betroffen sind.
Ursachen: Eine Herzschwäche ist meist Folge einer anderen Erkrankung, die den Herzmuskel oder die Blutgefäße schädigt. Häufige Ursache ist ein Herzinfarkt infolge einer Koronaren Herzkrankheit (KHK) mit durch Arteriosklerose verengten Herzkranzgefäßen. Weitere Risikofaktoren sind Bluthochdruck (arterielle Hypertonie) sowie Herzrhythmusstörungen wie Vorhofflimmern, Herzrasen (Tachykardie) oder verlangsamter Herzschlag (Bradykardie).
Symptome: Der Schweregrad wird gemäß der Klassifikation der New York Heart Association (NYHA) in vier Stadien (I bis IV) eingeteilt. Je nachdem, wie stark eine Herzschwäche ausgeprägt ist, kann sie unbemerkt bleiben oder die körperliche Leistungsfähigkeit beinträchtigen. Zu den Anzeichen zählen
- Atemnot, Schwäche, Müdigkeit und Erschöpfung nach Belastungen,
- Wassereinlagerungen (Bein- oder Bauchschwellung, Gewichtszunahme) und nächtliches Wasserlassen,
- Schwindel, Herzklopfen und Kreislaufkollaps,
- trockener Husten („Herzhusten“), besonders nachts,
- Appetitverlust, Übelkeit, Völlegefühl, Blähbauch, Verstopfung und Bauchschmerzen,
- manchmal auch Gewichtsabnahme, Gedächtnisstörungen oder Verwirrtheit.
Ziele der Behandlung
Wie wird eine Herzschwäche üblicherweise behandelt?
Kontrolle der Grunderkrankungen: Die Ursachen und Risikofaktoren der Herzschwäche müssen vorrangig kontrolliert werden – wie Bluthochdruck, Arteriosklerose, Zuckerkrankheit (Diabetes mellitus) oder hoher Cholesterinspiegel.
Die Behandlung unterstützt man mit einer angepassten Lebensweise. Dazu gehört regelmäßige Bewegung (Herztraining). Wichtig ist auch, das Rauchen aufzugeben und keinen oder nur wenig Alkohol zu trinken. Eine Gewichtsabnahme bei Übergewicht entlastet das Herz. Ein schwaches Herz gefährdet den Flüssigkeitstransport. Gewichtskontrollen helfen dann dabei, Wasseransammlungen frühzeitig zu erkennen. Betroffene sollten mit ihrem Arzt über die richtige Trinkmenge sprechen: Bei schwerer Herzinsuffizienz empfiehlt es sich, täglich nicht mehr als 2 Liter zu trinken. Darüber hinaus sollte man stark gesalzene und fettreiche Speisen wie Wurst und Fertiggerichte meiden. Auch dauerhafter Stress ist schädlich für ein geschwächtes Herz. Hier könnten unter anderem Entspannungstechniken helfen.
Daneben sind Medikamente ein Grundpfeiler der Therapie. Sie entlasten das Herz auf unterschiedliche Weise:
- ACE-Hemmer senken den Blutdruck, verzögern das Fortschreiten der Herzschwäche und sind ab NYHA-Grad I das Mittel der Wahl. Beispiele: Benazepril (Cibacen®), Ramipril (wie Triatec®) oder Enalapril (wie Renitec®).
- AT1-Blocker kommen infrage, wenn man ACE-Hemmer nicht verträgt – beispielsweise bei trockenem Reizhusten als Nebenwirkung. Beispiele: Candesartan (wie Atacand® und Blopresid®) oder Losartan (wie Lorzaar®).
- Beta-Blocker verlangsamen den Puls und senken den Blutdruck. Sie kommen bei Herzschwäche nach einem Herzinfarkt und in den NYHA-Stadien II bis IV infrage. Beispiele: Bisoprolol (wie Bisoprolol® und Concor®), Carvedilol (wie CarLich® und Carvedigamma®) oder Metoprololsuccinat (wie Metoprolol-ratiopharm®).
- Diuretika wirken entwässernd und entlasten so das Herz. Beispiele: Hydrochlorothiazid (wie Bisoprolol®, RamiLich®), Spironolacton (wie Aldactone®, Jenaspiron®).
- Herzglykoside wie Digitalis verbessern die Schlagkraft des Herzens, senken den Puls und werden bei Vorhofflimmern mit Herzrasen (Tachykardie) eingesetzt. Beispiele: Digacin® und Lanicor®.
Bei Durchblutungsstörungen des Herzens erfolgt oft eine Bypass-Operation, um das Herz wieder ausreichend mit Blut zu versorgen. Bessern sich bei einer schweren Herzschwäche die Beschwerden nicht, kann eine spezielle Schrittmachertherapie (Kardiale Resynchronisation) oder ein Schrittmacher (Defibrillator) die Zusammenarbeit der beiden Herzkammern verbessern. Hierzu ist ein operativer Eingriff notwendig.
Ziele der Mikronährstoffmedizin
Die Mikronährstofftherapie kann die Behandlung der Herzschwäche auf ideale Weise ergänzen. Vitamine, Mineralstoffe und sonstige Nährstoffe sind wichtig für die Funktion der Herzmuskelzellen: Sie können die Pumpfunktion des Herzens verbessern und helfen, Beschwerden zu lindern. Auf diese Weise tragen sie auch dazu bei, die Medikamentenwirkung zu unterstützen sowie die Dosis und die Nebenwirkungen zu verringern.
- Coenzym Q10 und L-Carnitin verbessern die Energiebereitstellung im Herzmuskel.
- Omega-3-Fettsäuren senken Risikofaktoren und Entzündungen.
- Vitamin D erhöht wahrscheinlich die Herzleistung.
- Magnesium reguliert den Blutdruck.
- L-Arginin erweitert die Blutgefäße.
- B-Vitamine senken den Risikofaktor Homocystein.
- Eisen verbessert die Leistungsfähigkeit.
Herzmedikamente können darüber hinaus Mangelzustände auslösen, die man mit den richtigen Mikronährstoffen beheben kann.
Behandlung mit Mikronährstoffen
Coenzym Q10 unterstützt den Energiestoffwechsel der Herzmuskelzellen
Wirkweise von Coenzym Q10
Coenzym Q10 ist ein vitaminähnlicher körpereigener Stoff. Er ist in den Kraftwerken der Zellen (Mitochondrien) für die Energiegewinnung notwendig. Diese liefern die Kraft für den Herzschlag. Gleichzeitig ist Coenzym Q10 ein Antioxidans und könnte so Gefäßschäden durch oxidativen Stress vorbeugen. Gefäßschäden erhöhen den Blutdruck, sodass das Herz mehr Kraft braucht, um das Blut durch den Körper zu pumpen. Coenzym Q10 wirkt blutdrucksenkend, da es die Gefäße weitet.
Untersuchungen zeigen, dass Betroffene mit Herzschwäche oft schlechter mit Coenzym Q10 versorgt sind. Auch sprechen einige Daten dafür, dass Coenzym Q10 eine ergänzende therapeutische Möglichkeit ist: Bei Betroffenen, die zusätzlich zur herkömmlichen Therapie dreimal täglich 100 Milligramm Coenzym Q10 einnahmen, verbesserte sich die Herzleistung im Vergleich zu einem Scheinmedikament. Auch das Risiko eines Herztodes nahm fast um die Hälfte ab.
Für die Zukunft sind weitere Studien zur Bestätigung der Ergebnisse notwendig. Insgesamt sammelten Forscher in einer Studienauswertung jedoch viele Hinweise, dass Coenzym Q10 einen Nutzen bei Herzschwäche haben könnte.
Info
Mit zunehmendem Alter kann der Körper die erforderlichen Mengen an Coenzym Q10 immer schlechter selbst herstellen. Im Alter von 39 bis 43 Jahren ist die Coenzym-Q10-Produktion im Vergleich zu einer 20-jährigen Person bereits um ein Drittel verringert und im Alter von 77 bis 81 Jahren um mehr als die Hälfte.
Dosierung und Einnahmeempfehlung von Coenzym Q10
Bei Herzerkrankungen und Herzschwäche empfehlen Mikronährstoff-Experten die Einnahme von 100 bis 300 Milligramm Coenzym Q10 pro Tag. In den meisten Studien erhielten die Probanden Coenzym Q10 für die Dauer von drei bis vier Monaten. Die längste Gabe erfolgte für einen Zeitraum von zwei bis vier Jahren. In diesen Studien war Coenzym Q10 gut verträglich.
Da Coenzym Q10 fettlöslich ist, nimmt man es am besten zusammen mit einer Mahlzeit ein.
Coenzym Q10: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Es liegen nicht genügend Daten zu Coenzym Q10 für Schwangere und Stillende vor. Mengen über 30 Milligramm sollten nicht ohne Rücksprache mit dem Arzt genommen werden.
Personen mit niedrigem Blutdruck oder solche, die Medikamente gegen Bluthochdruck einnehmen, müssen vorher mit dem Arzt sprechen: Coenzym Q10 wirkt blutdrucksenkend und könnte die Wirkung verstärken, zum Beispiel von Captopril (Lopirin Cor®) oder Hydrochlorothiazid (Esidrix®).
Diabetiker, die Medikamente nehmen, sollten die blutzuckersenkende Wirkung von Coenzym Q10 berücksichtigen. Engmaschige Blutzuckermessungen sind zu Beginn notwendig, um eine Unterzuckerung zu vermeiden.
Coenzym Q10 kann die Wirkung einiger Blutgerinnungshemmer herabsetzen. Dies betrifft sogenannte Cumarin-Abkömmlinge mit den Wirkstoffen Phenprocoumon (wie Marcumar®, Falithrom®) und Warfarin (Coumadin®). Sprechen Sie die Einnahme daher mit dem Arzt ab. Er kann den Quick-Wert kontrollieren und gegebenenfalls die Dosierung anpassen.
Während einer Chemotherapie sollte Coenzym Q10 ohne Wissen des Arztes nicht genommen werden. Es könnte die Wirkung beeinträchtigen.
Menschen mit Lungenerkrankungen wie Asthma, die Medikamente mit Theophyllin nehmen (wie Bronchoretard®, Tromphyllin®), sollten kein Coenzym Q10 ergänzen. Es verzögert den Abbau des Medikaments.
L-Carnitin steigert die Leistungsfähigkeit des Herzmuskels
Wirkweise von L-Carnitin
L-Carnitin wird in der Leber und den Nieren aus Aminosäuren gebildet. Außerdem kann es über die Ernährung zugeführt werden. Vor allem Vegetarier und Veganer haben jedoch oft geringe L-Carnitin-Werte, da es vorwiegend in Fleisch vorkommt. L-Carnitin ist wichtig für die Energiegewinnung: Es transportiert Fette in die Mitochondrien, damit sie dort in Energie umgewandelt werden. Ein Mangel an L-Carnitin kann Herzrhythmusstörungen begünstigen.
Eine Übersichtsarbeit von 17 Studien mit über 1.600 Teilnehmern ergab, dass L-Carnitin bei Patienten mit chronischer Herzinsuffizienz die Symptome linderte und die Leistungsfähigkeit des Herzmuskels verbesserte. Gleichzeitig sank der Spiegel eines bestimmten Hormons (Brain Natriuretic Peptide, BNP), das bei einer Herzschwäche erhöht ist und zur Verlaufskontrolle dient.
Auch verlangsamte die zwölfmonatige Ergänzung von L-Carnitin in einer weiteren Studie die Vergrößerung der linken Herzkammer (Linksherzinsuffizienz). Bei Durchblutungsstörungen (Ischämie) verringerte L-Carnitin Schädigungen des Herzmuskels. Daher ist L-Carnitin insgesamt vielversprechend bei Herzerkrankungen.
Dosierung und Einnahmeempfehlung von L-Carnitin
Bei Herzschwäche empfehlen Mikronährstoff-Experten 1.000 bis 3.000 Milligramm L-Carnitin pro Tag. Die Einnahme muss bei Herz-Kreislauf-Erkrankungen ärztlich begleitet werden: Aus L-Carnitin entsteht bei einer gestörten Darmflora der Stoff Trimethylamin-N-oxid (TMAO). Er könnte sich vor allem bei schwerer Herzschwäche mit Muskelabbau und Darmbeschwerden negativ auswirken. Daher sollte man TMAO vorher im Blut oder Urin messen.
Für eine gute Verträglichkeit empfiehlt sich die Einnahme zum Essen. Daneben ist es wichtig, die Dosis über den Tag zu verteilen – zum Beispiel zweimal 1.000 Milligramm. Mehr als 2.000 Milligramm kann der Darm nicht auf einmal aufnehmen und die Darmbakterien könnten überschüssiges L-Carnitin zu TMAO abbauen. Zudem sollten viele Vollkornprodukte und Gemüse gegessen werden: Ballaststoffe und Pflanzenstoffe schwächen die Bildung von TMAO vermutlich ab.
Wird L-Carnitin bei einem Herzinfarkt plötzlich abgesetzt, könnten sich Schäden am Herzen verschlimmern. Die zeigt ein Tierversuch. Bei einem Herzinfarkt sollte der Arzt über die Carnitin-Einnahme informiert werden.
Tipp
Besonders die Kombination von L-Carnitin und Coenzym Q10 ist vielversprechend, da sie sich in ihrer Wirkung unterstützen. In einer ersten Studie verbesserte sich durch Einnahme von 1.200 Milligramm L-Carnitin und 150 Milligramm Coenzym Q10 täglich zusammen mit einer Ernährungsumstellung das körperliche und psychische Wohlbefinden sowie die Prognose nach einem Herzinfarkt.
L-Carnitin: zu beachten bei Erkrankungen und Medikamenteneinnahme
Die L-Carnitin-Einnahme sollte auch bei anderen Herz-Kreislauf-Erkrankungen und Erkrankungen des Stoffwechsels ärztlich begleitet werden. Dazu gehören Lebererkrankungen, metabolisches Syndrom und Diabetes. Es besteht die Gefahr, dass TMAO die Krankheiten verschlimmert.
Menschen mit Nierenschwäche sollten die Einnahme von mehr als 1.000 Milligramm L-Carnitin mit dem Arzt absprechen. Die Langzeiteinnahme wurde noch nicht ausreichend untersucht.
Bei Krebs muss der Arzt über die Einnahme entscheiden: Manche Krebsarten sind mit einem überaktiven Fettstoffwechsel verbunden – zum Beispiel Prostata- oder Blasenkrebs. L-Carnitin könnte dann das Wachstum fördern. Auch ist nicht klar, wie es sich bei Darmkrebs auswirkt.
Diabetiker sollten vor der Einnahme mit dem Arzt sprechen: L-Carnitin könnte die Zuckerwerte beeinflussen. Wird es zudem gleichzeitig mit blutzuckersenkenden Medikamenten eingenommen, besteht die Gefahr einer Unterzuckerung. Eventuell muss die Dosierung angepasst werden. Hierzu zählen unter anderem Metformin (wie Diabesin®) und Sulfonylharnstoffe (wie Maninil®).
Selten kann L-Carnitin die Wirkung von Blutgerinnungshemmern vom Cumarin-Typ (Vitamin-K-Antagonisten) verstärken. Dazu zählen Ethylbiscoumacetat (Tromexan®), Phenprocoumon (wie Falithrom®, Marcumar®) und Warfarin (Coumadin®). Die Einnahme von L-Carnitin sollte daher mit dem Arzt abgesprochen werden. Dieser kann den Gerinnungsfaktor kontrollieren.
Omega-3-Fettsäuren hemmen Entzündungen in den Blutgefäßen
Wirkweise von Omega-3-Fettsäuren
Der Körper kann Omega-3-Fettsäuren nicht selbst bilden. Man muss sie über die Ernährung zuführen. Von besonderer Bedeutung sind EPA (Eicosapentaensäure) und DHA (Docosahexaensäure) aus Fisch. Sie hemmen Entzündungen in den Blutgefäßen und helfen, erhöhte Blutfette zu senken. Daneben begünstigen sie die Weitung der Blutgefäße und senken Bluthochdruck leicht. So könnten EPA und DHA bereits einer Herzschwäche vorbeugen. Aber auch bei einer bestehenden Erkrankung ist ihr Einsatz vielversprechend:
Schutz vor Herzinfarkten: Hochwertige Studien zeigen, dass Omega-3-Fettsäuren das Risiko für einen Herzinfarkt verringern. Das bestätigen auch große Übersichtsarbeiten: Dem Ergebnis zufolge verringert die Einnahme von EPA und DHA das Risiko für einen Herzinfarkt um fast die Hälfte. Darüber hinaus könnte vor allem EPA die Sterblichkeit senken.
Verbesserung der Pumpfunktion: In einer Studie mit mehr als 200 Patienten mit Linksherzinsuffizienz besserten sich durch Einnahme von 1.000 Milligramm Omega-3-Fettsäuren die gestörte Pumpfunktion sowie die BNP-Marker. BNP ist ein Hormon, das bei Belastung und Schädigung aus den Herzmuskelzellen ausgeschüttet wird. Daher wird es als Marker für Herzerkrankungen verwendet.
Dosierung und Einnahmeempfehlung von Omega-3-Fettsäuren
Für ein gesundes Herz und Gefäße empfehlen Mikronährstoff-Experten die Einnahme von 1.500 bis 2.500 Milligramm Omega-3-Fettsäuren pro Tag. Es ist wichtig, dass das Präparat einen hohen Anteil an EPA hat, da diese Fettsäure entzündungshemmend wirkt. EPA kommt zum Beispiel in Fischöl vor.
Bei einer bestehenden Herzschwäche sollte die Einnahme mit dem Arzt oder Mikronährstoff-Experten besprochen werden. Bestimmte Herzrhythmusstörungen (Vorhofflimmern) könnten bei Vorerkrankungen ab einer Menge von 1.000 Milligramm häufiger auftreten. Der Arzt kann das Risiko abwägen und begleitend die Versorgung (Omega-3-Index) kontrollieren.
Omega-3-Fettsäuren müssen zum Essen ergänzt werden, um die Aufnahme zu gewährleisten. Zudem wird vermutlich die natürliche Bindungsform (Triglyceride) besser aufgenommen als künstliche.
Tipp
Bei Fischöl-Präparaten sollte man auf die Qualität achten. Hochwertige Produkte werden mehrfach gereinigt, sodass unerwünschte Schadstoffe wie Schwermetalle entfernt sind. Krillöl ist grundsätzlich reiner. Auch Algenöl enthält wenig bis keine Schadstoffe, da Algen meist unter kontrollierten Bedingungen angebaut werden. Zudem ist es für Vegetarier und Veganer geeignet.
Den Omega-3-Index überprüfen lassen
Bei einer Herzschwäche raten Mikronährstoff-Experten dazu, die Versorgung mit Omega-3-Fettsäuren zu prüfen. Hierzu ist der Omega-3-Index ideal. Der Messwert gibt an, wie viele Omega-3-Fettsäuren (EPA und DHA) in den roten Blutzellen (Erythrozyten) eingelagert sind. Optimale Werte liegen über acht Prozent.
Omega-3-Fettsäuren: zu beachten bei Erkrankungen und Medikamenteneinnahme
Menschen mit einer akuten Leber-, Gallen- oder Bauchspeicheldrüsenentzündung sollten keine Omega-3-Fettsäuren einnehmen.
Möglicherweise senken Omega-3-Fettsäuren den Blutzucker. Diabetiker, die Medikamente einnehmen, sollten ihre Blutzuckerwerte zu Beginn der Einnahme häufiger kontrollieren, um eine Unterzuckerung zu vermeiden. Eventuell ist eine Anpassung der Medikamente nötig. Beispiele sind Metformin (wie Diabesin®, Glucophage®) und Sulfonylharnstoffe (wie Euglucon®, Maninil®).
Hoch dosierte Omega-3-Fettsäuren können die Blutungsneigung erhöhen. Daher sollten Personen mit Blutgerinnungsstörungen auf die Einnahme verzichten. Vor Operationen sollte mit einem Arzt besprochen werden, ob Präparate sicherheitshalber abgesetzt werden müssen.
Personen, die blutverdünnende Arzneimittel nehmen, sollten die Einnahme von über 1.000 Milligramm Omega-3-Fettsäuren pro Tag mit dem Arzt besprechen. Dieser kann die Gerinnungswerte kontrollieren. Dazu zählen Cumarin-Derivate (wie Marcumar® und Coumadin®), Acetylsalicylsäure (ASS, Aspirin®), Heparin (Clexane®) sowie neue orale Antikoagulanzien etwa Apixaban (Eliquis®), Dabigatran (Pradaxa®), Edoxaban (Lixiana®) und Rivaroxaban (Xarelto®).

Vitamin D könnte die Pumpleistung des Herzens verbessern
Wirkweise von Vitamin D
Der Körper kann Vitamin D mithilfe von Sonnenlicht in der Haut selbst bilden. Allerdings haben Patienten mit Herzschwäche, wie viele ältere Menschen, öfter einen Mangel. Bei einem Vitamin-D-Mangel kann es häufiger zu Herzversagen kommen. Eine gute Vitamin-D-Versorgung wirkt vermutlich auf eine Reihe an Faktoren positiv – etwa auf die Entzündungswerte, die Muskelkraft, die Fettwerte, den Blutdruck und den Flüssigkeitshaushalt.
In einer ersten Studie verbesserte Vitamin D bei einer Herzschwäche die Auswurfleistung der linken Herzkammer und damit die Pumpfunktion des Herzmuskels. Die Patienten hatten für sechs Monate täglich 4.000 Internationale Einheiten Vitamin D oder ein Scheinpräparat erhalten. In einer kleinen, hochwertigen Studie steigerte Vitamin D zudem die körperliche Leistungsfähigkeit im Sechs-Minuten-Gehtest: Die von den Patienten zurückgelegte Strecke erhöhte sich. Ähnliches ergab eine weitere Untersuchung. Gleichzeitig sank ein wichtiger Marker für eine Herzinsuffizienz (proBNP-Spiegel).
Es gibt jedoch auch Studien, die keinen Effekt zeigten. Woran dies liegt, muss noch herausgefunden werden. Möglicherweise waren die Studien zu kurz. Mikronährstoff-Experten raten bei Herzschwäche insgesamt dazu, die Vitamin-D-Werte zu kontrollieren und eine Unterversorgung entsprechend auszugleichen.
Dosierung und Einnahmeempfehlung von Vitamin D
Bei Herzschwäche werden 1.000 bis 2.000 Internationale Einheiten Vitamin D täglich empfohlen, sofern der Blutspiegel nicht bekannt ist. Damit der Körper es gut aufnehmen kann, muss Vitamin D zum Essen eingenommen werden.
Optimalerweise sollte vorher der Vitamin-D-Spiegel bestimmt werden. Nur so kann ein Arzt die richtige Dosierung festlegen. Bei einem Mangel sind für einen gewissen Zeitraum höhere Mengen nötig. Als Faustregel gilt: Zehn Tage lang 10.000 Internationale Einheiten pro Tag, zusätzlich zur körpereigenen Bildung, erhöhen den Vitamin-D-Spiegel um 10 Nanogramm pro Milliliter. Dabei ist eine tägliche Ergänzung wahrscheinlich besser als eine Hoch-Dosis-Therapie einmal im Monat oder Jahr.
Vitamin D im Blut bestimmen
Bei Herzschwäche sollte der Vitamin-D-Spiegel geprüft werden. Vitamin D wird im Blutserum gemessen, der Flüssigkeit des Blutes ohne die Blutzellen und ohne Gerinnungsfaktoren. Dabei bestimmt das Labor die Transportform – 25(OH)-Vitamin-D oder auch Calcidiol genannt.
Mikronährstoff-Experten empfehlen einen optimalen Vitamin-D-Spiegel zwischen 40 bis 60 Nanogramm pro Milliliter.
Vitamin D: zu beachten bei Erkrankungen und Einnahme von Entwässerungsmitteln
Personen mit Nierenerkrankungen sollten Vitamin D nicht ohne Rücksprache mit dem Arzt einnehmen: Sie haben einen gestörten Mineralstoffhaushalt und manchmal zu hohe Calciumspiegel im Blut. Da Vitamin D die Calciumaufnahme im Darm fördert, können die Calciumspiegel zu stark ansteigen. Auch Personen mit Nierensteinen (calciumhaltige Steine) müssen aufpassen.
Bei einigen Krankheiten ist ein gestörter Calcium- und Phosphatstoffwechsel möglich, zum Beispiel bei der Bindegewebserkrankung Sarkoidose, Nierenerkrankungen sowie einer Nebenschilddrüsenüberfunktion. Betroffene sollten dann Vitamin D nur unter ärztlicher Kontrolle ergänzen.
Entwässerungsmittel (Diuretika) aus der Wirkstoffgruppe der Thiazide verringern die Calciumausscheidung über die Nieren. Vitamin D erhöht dagegen den Calciumspiegel. Werden Vitamin D und Thiazide gemeinsam eingenommen, sollte der Arzt den Calciumgehalt im Blut regelmäßig kontrollieren. Dies gilt für die Wirkstoffe Hydrochlorothiazid (wie Esidrix®, Disalunil®), Xipamid (wie Aquaphor®, Neotri®) und Indapamid (wie Natrilix®, Preterax® N).
Magnesium hilft, den Blutdruck zu normalisieren
Wirkweise von Magnesium
Magnesium ist wichtig für das Gleichgewicht der Elektrolyte im Körper. Diese geladenen Mineralstoffe werden für die Muskelfunktion benötigt: Als Gegenspieler von Calcium verringert Magnesium den Calcium-Einstrom in die Muskelzellen und entspannt so die Muskulatur der Blutgefäße. Auf diese Weise trägt Magnesium zu einem normalen Blutdruck bei und schützt die Blutgefäße. Unflexible Gefäßinnenwände (Endothel) spielen eine wichtige Rolle bei Bluthochdruck und beim Fortschreiten einer Herzschwäche.
Geringe Magnesiumwerte könnten ein Risikofaktor für eine höhere Sterblichkeit bei Herzschwäche sein. In einer ersten Studie verbesserte die Einnahme von Magnesium über einen Zeitraum von drei Monaten die Gefäßfunktion, die körperliche Leistungsfähigkeit sowie die Lebensqualität von Patienten mit symptomatischer Herzschwäche.
Magnesium kann zudem häufige Ursachen einer Herzschwäche wie Atherosklerose und Herzrhythmusstörungen positiv beeinflussen. Gleichzeitig senkt Magnesium laut Studien den CRP-Wert. CRP (C-reaktives Protein) ist ein wichtiger Marker für gefäßschädigende Entzündungen und Herz-Kreislauf-Erkrankungen. Die Senkung könnte die Prognose bei Herzschwäche verbessern.
Dosierung und Einnahmeempfehlung von Magnesium
Bei Herzinsuffizienz werden in der Mikronährstoffmedizin 300 bis 500 Milligramm Magnesium pro Tag empfohlen, optimalerweise als Magnesiumtaurat. Das enthaltene Taurin unterstützt die Herzfunktion. Am besten bespricht man die Menge mit dem Arzt oder Mikronährstoff-Experten, denn manchmal können für einige Monate auch höhere Dosierungen nötig sein, zum Beispiel bei Bluthochdruck bis zu 700 Milligramm.
Um Magen-Darm-Beschwerden wie Durchfall zu vermeiden, sollte die Tagesdosis in mehrere Einzeldosen aufgeteilt werden. Auch ist die Einnahme zur Mahlzeit empfehlenswert.
Magnesium: Laboruntersuchungen
Zu niedrige, aber auch überhöhte Magnesiumspiegel wirken besonders bei Patienten mit Herzversagen negativ. Daher sollten ab einer Menge von 250 Milligramm pro Tag die Blutwerte kontrolliert werden: Magnesium ist hauptsächlich in den roten Blutzellen (Erythrozyten) vorhanden. Daher lässt man den Magnesiumspiegel idealerweise im Vollblut bestimmen. Es enthält alle Blutzellen. Die Normalwerte für Magnesium liegen zwischen 1,38 und 1,50 Millimol pro Liter Vollblut.
Magnesium: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei Nierenerkrankungen sollte Magnesium nicht über Präparate eingenommen werden: Geschwächte Nieren können überschüssiges Magnesium nicht gut ausscheiden. Es könnte zu einer Überversorgung kommen.
Magnesium kann die Wirkung bestimmter Medikamente herabsetzen, da es ihre Aufnahme im Darm behindert. Deshalb ist ein Einnahmeabstand von zwei Stunden wichtig. Dazu zählen Antibiotika aus der Gruppe der Tetracycline und Gyrasehemmer, mit den Beispielwirkstoffen Nitrofurantoin (Furandantin®, Nifuretten®) sowie Moxifloxacin (Avalox®). Gleiches gilt für Mittel gegen Osteoporose (Bisphosphonate) etwa Alendronat (Fosamax®, Tevanate®), Clodronat (Bonefos®) oder Etidronat (Didronel®) sowie für Chelatbildner wie Penicillamin (Metalcaptase®).
L-Arginin verbessert die Gefäßfunktion
Wirkweise von L-Arginin
Aus der Aminosäure L-Arginin stellt der Körper den gefäßerweiternden Botenstoff Stickstoffmonoxid (NO) her. Daher wird L-Arginin in der Mikronährstoffmedizin oft bei Gefäßerkrankungen wie Arteriosklerose (Arterienverkalkung) und Bluthochdruck eingesetzt. Beide tragen zu einer Herzschwäche bei.
In einer kleinen hochwertigen Studie verbesserte die zehnwöchige Einnahme von L-Arginin die Herzfunktion bei Personen mit Herzschwäche im Vergleich zu einem Scheinmedikament. Auch berichteten die Teilnehmer von einer besseren Lebensqualität. Zudem liefern kleine ältere Studien positive Ergebnisse: Unter anderem besserte sich die Herzfunktion sowie die körperliche Fitness. In eine Übersichtarbeit fanden Forscher zwar widersprüchliche Daten, sie kommen aber insgesamt zu dem Schluss, dass die Ergänzung von L-Arginin nützlich sein könnte. Größere Studien müssen allerdings folgen.
Dosierung und Einnahmeempfehlung von L-Arginin
Bei Herzschwäche können pro Tag 1.500 bis 3.000 Milligramm L-Arginin sinnvoll sein. Bei schwerer Arteriosklerose und einem Herzinfarkt sollte mit einem Arzt besprochen werden, ob die Einnahme möglich ist. Auch die Dauer der Einnahme sollte ein Fachmann festlegen: Langzeitversuche gibt es noch nicht. Die längsten Studien dauerten sechs Monate.
Am besten ist es, L-Arginin zwischen den Mahlzeiten und über den Tag verteilt einzunehmen. So wird es am besten vom Körper aufgenommen, da es nicht mit anderen Aminosäuren aus Lebensmitteln um die Aufnahme im Darm konkurriert.
Neben reinen L-Arginin-Präparaten gibt es auch Produkte mit L-Citrullin. Dies ist die Vorstufe. Vermutlich verlängert L-Citrullin die Wirkung von L-Arginin. Laut ersten Studien waren hier ebenfalls 1.500 bis 3.000 Milligramm wirksam. Bei Kombinationspräparaten sollte die Dosis dann entsprechend gesenkt werden (zum Beispiel jeweils 1.000 Milligramm L-Arginin und L-Citrullin).
Tipp
Zu viel L-Arginin kann oxidativen Stress hervorrufen. Daher sollte man begleitend auf eine gute Antioxidantien-Zufuhr achten. Wichtige Antioxidantien sind zum Beispiel Vitamin C und E sowie Pflanzenstoffe. Besser als ein einziger hoch dosierter Stoff ist eine breite Mischung natürlicher Antioxidantien.
Darüber hinaus unterstützen B-Vitamine die Wirksamkeit von L-Arginin: Der Körper benötigt sie, um den Botenstoff Stickstoffmonoxid zu produzieren. Daneben braucht man B-Vitamine für den Homocystein-Abbau. Homocystein kann die Wirkung von L-Arginin beeinträchtigen.
L-Arginin im Labor bestimmen
Bei Herzschwäche kann es sinnvoll sein, die L-Arginin-Blutwerte bestimmen zu lassen. Werte zwischen 100 und 300 Mikromol pro Liter führten in Studien zu einer Entspannung der Blutgefäße.
Zudem ist es ratsam, die Menge an asymmetrischem Dimethylarginin (ADMA) zu messen. Dieser Stoff entscheidet über die Wirkung von L-Arginin. Es wirkt am besten, wenn der ADMA-Spiegel unter 0,7 Mikromol pro Liter Blutplasma liegt. Plasma ist die Blutflüssigkeit ohne Zellen. ADMA sinkt häufig unter der klassischen Therapie (mit Blutdrucksenkern, Statinen, Beta-Blockern). Auch L-Arginin und L-Citrullin tragen zur Senkung bei.
L-Arginin: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Zur Einnahme von L-Arginin in der Schwangerschaft und Stillzeit liegen kaum Daten vor. Deshalb sollte es in dieser Zeit nicht ohne ärztliche Aufsicht eingesetzt werden.
Wenn bei schwacher Nierenfunktion die tägliche Eiweißmenge kontrolliert wird, muss dabei auch die L-Arginin-Menge berücksichtigt werden. Ohne ärztlichen Rat sollte bei einer Pankreatitis auf L-Arginin verzichtet werden. Auch bei Herpesinfektionen ist es nicht sinnvoll: Herpesviren benötigen L-Arginin für ihre Vermehrung.
Eine regelmäßige L-Arginin-Einnahme könnte bei Diabetikern die Empfindlichkeit für Insulin beeinflussen. Eventuell muss der Arzt die Dosis der Diabetesmedikamente anpassen, zum Beispiel bei folgenden Medikamenten: Metformin (Diabesin® und Glucophage®) oder Sulfonylharnstoffe (Euglucon® oder Maninil®).
Bei Krebs sollte man die Einnahme von L-Arginin mit dem Arzt besprechen. Er muss diese mit der Krebstherapie abstimmen.
Bei Einnahme von Medikamenten, die den gefäßerweiternden Botenstoff Stickstoffmonoxid freisetzen (NO-Donatoren), ist eine Rücksprache mit dem Arzt nötig. Es kann eine Anpassung der Dosierung notwendig sein. Betroffen sind Nitrate (Mono Mack®, Ismo®), Molsidomin (Corvaton®, Molsibeta®) und Nitroprussid (Nipruss®). Auch das Potenzmittel Sildenafil (Viagra®) sollte nicht mit L-Arginin eingenommen werden. Die Wirkungen könnten sich unkontrolliert verstärken.
Basisabsicherung mit B-Vitaminen
Wirkweise von B-Vitaminen
B-Vitamine sind unter anderem für die Energiegewinnung notwendig. Vor allem Vitamin B1 ist daran beteiligt, Kohlenhydrate abzubauen. Der Herzmuskel muss für seine Arbeit reichlich Energie produzieren. Möglicherweise sind Störungen des Energiestoffwechsels an der Entstehung einer Herzschwäche beteiligt. Zudem helfen B-Vitamine beim Abbau von Homocystein. Hohe Mengen des Stoffwechselprodukts werden mit Herz-Kreislauf-Erkrankungen in Verbindung gebracht, etwa mit koronarer Herzerkrankung, Herzinfarkt und Schlaganfall. Auch gilt Homocystein als unabhängiger Risikofaktor für die Entwicklung einer Herzschwäche und könnte das Sterberisiko steigern.
Nach Beobachtungstudien sind Herzpatienten mit B-Vitaminen schlechter versorgt. Dies liegt an der Schädigung der Organe durch die Herzschwäche. Es kann dann zu einer geringeren Aufnahme im Darm sowie zu höheren Verlusten über die Nieren kommen. Zusätzlich ist die Ernährung der Personen häufig unzureichend.
Vitamin B1: Ein Vitamin-B1-Mangel ist bei Personen mit Herzschwäche besonders häufig. Dies bestätigt eine Übersichtsarbeit. Laut einer weiteren Untersuchung ist etwa jeder dritte im Krankenhaus wegen Herzschwäche behandelte Patient mit Vitamin B1 unterversorgt. Die Ergänzung von Vitamin B1 könnte laut ersten Daten die Pumpleistung des Herzens sowie auftretende Symptome verbessern. Allerdings muss dies noch bewiesen werden.
Vitamin B2, B6, B12 und Folsäure: In einer Beobachtungsstudie mit 100 Herzschwäche-Patienten zeigte sich, dass mehr als ein Viertel einen Vitamin-B2- und mehr als ein Drittel einen Vitamin-B6-Mangel hatten. Bei Kontrollpersonen ohne Herzinsuffizienz war dies seltener der Fall. Auch ein leichter Vitamin-B12-Mangel trat bei 44 Prozent der Menschen mit Herzschwäche auf. Wurden Vitamin B2, B6 und Folsäure über zwölf Monate eingenommen, verringerten sich in einer ersten Studie mit rund 400 gesunden Erwachsenen Risikofaktoren für Herzgefäßerkrankungen. Dies galt insbesondere bei einem Folsäuremangel. In anderen Studien hatte die Mischung keine Wirkung.
Insgesamt gibt es bei Herzschwäche bisher nur wenige Studien zur ergänzenden Therapie mit B-Vitaminen. Experten fordern mehr Untersuchungen. Da B-Vitamine jedoch wichtig sind, sollte der Bedarf in jedem Fall gedeckt sein.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Bei Herzschwäche empfehlen Mikronährstoff-Experten ein Präparat mit allen B-Vitaminen, das den Bedarf deckt. B-Vitamine arbeiten im Stoffwechsel eng zusammen. Sinnvoll sind beispielsweise 1 bis 2 Milligramm Vitamin B1, 2 bis 5 Milligramm Vitamin B6, 200 bis 400 Mikrogramm Folsäure und 10 bis 20 Mikrogramm Vitamin B12.
Manchmal raten Mikronährstoff-Experten unter ärztlicher Kontrolle auch zu höheren Mengen, zum Beispiel zu 50 bis 100 Milligramm Vitamin B1. Diese Dosierung wurde in ersten Studien eingesetzt. Bei erhöhten Homocystein-Werten sind in Rücksprache mit dem Arzt zudem folgende Dosierungen ratsam: 1 bis 5 Milligramm Vitamin B2, 5 bis 15 Milligramm Vitamin B6, 200 bis 600 Mikrogramm Folsäure sowie 10 bis 500 Mikrogramm Vitamin B12.
Die Präparate sollten zum Essen eingenommen werden. Das verbessert die Verträglichkeit.
Tipp
Folsäure sollte als aktive 5-Methyltetrahydrofolsäure (5-MTHF) ergänzt werden. Der Körper kann sie so direkt nutzen. Denn etwa die Hälfte der Menschen haben eine genetische Veränderung, wodurch sie herkömmliche Folsäure nicht nutzen können. Das kann durch 5-MTHF umgangen werden.
Bestimmung der Homocystein- und Vitamin-B12-Werte
Da Homocystein die Blutgefäße schädigt, ist es sinnvoll, bei Herzschwäche regelmäßig den Spiegel im Blut prüfen zu lassen. Homocystein wird im Blutplasma bestimmt. Die Normwerte liegen unter 10 Mikromol pro Liter. Liegen Leberschäden vor, könnte der Homocysteinwert auf B-Vitamine nicht mehr ansprechen.
Werden regelmäßig mehr als 55 Mikrogramm Vitamin B12 eingenommen, sollten zudem die Vitamin-B12-Werte bestimmt werden. Neben einem Mangel ist eine Überversorgung möglich. Normale Vitamin-B12-Werte liegen zwischen 300 und 900 Pikogramm pro Millimeter Blutserum. Für einen Mangel bestimmt man am besten das sogenannte Holotranscobalamin. Es sollte über 54 Pikomol pro Liter im Serum betragen. Die Vitamin-B12-Werte können bei Herzschwäche aber auch erhöht sein, wenn die Leber nicht in der Lage ist, es aufzunehmen. Der Arzt sollte daher am besten mehrere Werte bestimmen (funktionelle Marker wie Homocystein).
B-Vitamine: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sollten hoch dosierte B-Vitamine nur bei einem nachgewiesenen Mangel und nach Absprache mit dem Frauenarzt ergänzt werden.
Personen mit beeinträchtigter Nieren- und Leberfunktion sollten die Einnahme von Vitamin B12 mit dem Arzt besprechen. Sie können erhöhte Blutwerte haben. Bei Nierenerkrankungen sollte Vitamin B12 zudem nur in Form von Methylcobalamin eingenommen werden: Als Cyanocobalamin könnte es in hohen Dosen schädlich sein.
Nach dem Setzen von Gefäßstützen (Stents) und nach einem Herzinfarkt ist die Gabe kombinierter B-Vitamine vermutlich positiv. Hohe Dosen an Vitamin B6 (ab 40 Milligramm pro Tag), Vitamin B12 (ab 60 Mikrogramm pro Tag) und Folsäure (ab 800 Mikrogramm pro Tag) sollten vermieden werden.
Bei Krebs und hohem Krebsrisiko (Raucher) könnte dauerhaft hoch dosiertes Vitamin B12 das Fortschreiten oder die Entwicklung der Krankheit fördern. Mengen über 55 Mikrogramm sollten dann mit dem Arzt abgesprochen sein.
Vitamin B6 kann ab einer Dosierung von 5 Milligramm die Wirkung von Antiepileptika oder Parkinson-Medikamenten abschwächen. Das gilt für Phenobarbital (Luminal®) oder Phenytoin (wie Phenhydan®, Zentropil®) oder den Wirkstoff Levodopa (L-Dopa) (wie Madopar®, Duodopa®).
Folsäure vermindert die Wirkung von Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®).
Bei Herzschwäche Eisenmangel vermeiden
Wirkweise von Eisen
Bei Herzschwäche wird Eisen schlechter aufgenommen und geht vermehrt verloren. Ein Eisenmangel kommt daher häufig vor: Laut einer großen Beobachtungsstudie ist jeder zweite Patient betroffen. Zudem steht der Mangel mit der Schwere der Herzinsuffizienz in Verbindung. Eisen ist vor allem wichtig für die Energiegewinnung und den Sauerstofftransport. Es ist Bestandteil des roten Blutfarbstoffs Hämoglobin, der wiederum Sauerstoff bindet und die Muskelzellen damit versorgt. Deshalb beeinträchtigt ein Eisenmangel tägliche Aktivitäten. Er könnte sogar die Sterblichkeit steigern.
Übersichtsarbeiten belegen einen Nutzen von Eiseninfusionen direkt in die Vene (intravenös) bei Herzschwäche: Durch den Ausgleich eines Eisenmangels verbessert sich die Herzfunktion sowie die Leistungsfähigkeit und Lebensqualität. Zudem senkt Eisen vermutlich die Wahrscheinlichkeit, wegen Herzproblemen im Krankenhaus behandelt werden zu müssen. Unklar ist jedoch noch, ob der Ausgleich des Mangels die Sterblichkeit infolge der Herzschwäche reduziert.
Viele Experten, unter anderem der Deutschen Herzstiftung, raten dazu, die Eisenwerte bei Herzschwäche routinemäßig zu prüfen und einen Mangel auszugleichen. Da sich die Beschwerden einer Herzschwäche mit denen eines Eisenmangels überschneiden, wird der Mangel oft übersehen.
Dosierung und Einnahmeempfehlung von Eisen
Bei einem Eisenmangel werden oft Eisentabletten empfohlen. Je nach Stärke des Mangels liegt die Dosierung zwischen 20 und 100 Milligramm pro Tag. Die genaue Dosis muss der Arzt anhand der Blutwerte bestimmen. Man kann Eisen auch überdosieren.
Am besten nimmt man Eisentabletten auf nüchternen Magen ein: Einige Lebensmittel wie calciumhaltige Milchprodukte oder Gerbstoffe aus Pflanzen können die Aufnahme bremsen.
Einen Eisenmangel kann man über Tabletten gut ausgleichen, wenn die Hepcidin- und Entzündungswerte niedrig sind. Liegen „stille Entzündungen“ vor, ist das nicht ausreichend möglich. Auch werden Eisenpräparate nicht immer vertagen. Dann raten Mikronährstoff-Experten zu einer Eiseninfusion ins Blut. Laut Studien hilft dies besser bei Herzschwäche.
Eisen: Laboruntersuchungen
Bei Herzschwäche sollte der Eisenwert ein bis 2-mal im Jahr geprüft werden. Am besten geeignet ist die Bestimmung von Ferritin sowie die Transferrin-Sättigung. Ferritin ist das Speichereisen, während Transferrin für den Transport von Eisen zuständig ist.
Für gesunde Frauen liegt der Ferritin-Normbereich bei 23 bis 110 Mikrogramm pro Liter Blutserum, für gesunde Männer zwischen 34 bis 310 Mikrogramm pro Liter. Bei Herzkranken setzen Experten den wünschenswerten Ferritinwert versuchsweise höher auf über 100 Mikrogramm pro Liter an.
Expertenwissen
Bei Herzkranken müssen mehrere Werte erhoben werden: Liegen Entzündungen vor, können auch zu hohe Ferritinwerte vorkommen. Bei Ferritinwerten zwischen 100 und 300 Mikrogramm pro Liter entscheidet die Transferrinsättigung. Liegt sie unter 20 Prozent, kann trotz guter Ferritinwerte ein funktionaler Eisenmangel bestehen. Achtung: Bei schwerer Arteriosklerose muss die hoch dosierte Gabe von Eisen kritisch abgewogen werden. In jedem Fall sollte die Ursache des Mangels gesucht und behoben werden.
Eisen: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei einer schweren Erkrankung der Leber oder Nieren sollte die Einnahme von Eisen mit dem Arzt besprochen werden. Gleiches gilt bei Entzündungen oder Geschwüren im Magen oder Darm sowie bei schweren Lungenerkrankungen.
Bei einer Eisenspeicherkrankheit (Hämochromatose) darf man kein Eisen einnehmen. Es kommt sonst zu einer Eisenüberladung. Das kann auch bei bestimmten Anämie-Formen passieren, die mit vielen Bluttransfusionen behandelt werden (Mittelmeeranämie).
Bei Parkinson haben Forscher Eisenablagerungen im Gehirn festgestellt. Betroffene sollten daher vor der Einnahme mit dem Arzt sprechen. Das gilt auch bei Alzheimer, Chorea Huntington oder amyotropher Lateralsklerose (ALS).
Das Gichtmedikament Allopurinol (Zyloric®, Allobeta®) kann die Speicherung von Eisen in der Leber erhöhen. Eisenpräparate sollten dann nicht eingenommen werden.
Eisen vermindert zudem die Aufnahme und Wirkung anderer Medikamente. Deshalb wird bei folgenden Medikamenten ein Einnahmeabstand von zwei bis drei Stunden empfohlen:
- Schilddrüsenmedikamente: Thyroxin (L-Thyroxin®)
- Blutdrucksenker: zum Beispiel ACE-Hemmer wie Benazepril (Lotensin HCT®) oder Captopril (Tensobon®)
- Osteoporose-Medikamente: Bisphosphonate wie Alendronat (Fosamax®) oder Pamidronat (Aredia®)
- Parkinson-Medikamente: zum Beispiel Decarboxylasehemmer mit dem Wirkstoff Carbidopa (Duodopa®) oder L-Dopa (Levopar®)
- Antibiotika: zum Beispiel Penicillin (wie Amoxibeta®, Amoxypen®), Ampicillin (Binotal®)
- Tuberkulose-Medikamente: zum Beispiel Rifampicin (Eremfat®)
- Schwermetall-Binder: Penicillamin (Metalcaptase®)
Dosierungen auf einen Blick
Mikronährstoffempfehlung pro Tag bei Herzschwäche | |
|---|---|
| Vitamine | |
Vitamin B1 | 1 bis 2 Milligramm (mg) oder nach ärztlicher Absprache: 50 bis 100 Milligramm |
Vitamin B2 | 1 bis 5 Milligramm |
Vitamin B6 | 2 bis 5 Milligramm oder nach ärztlicher Absprache: 5 bis 15 Milligramm |
Vitamin B12 | 10 bis 20 Mikrogramm (µg) oder nach ärztlicher Absprache: 250 bis 500 Mikrogramm |
Folsäure | 200 bis 400 Mikrogramm oder nach ärztlicher Absprache: 400 bis 600 Mikrogramm |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten (IE) oder je nach Spiegel |
| Mineralstoffe | |
Magnesium | 300 bis 500 Milligramm |
| Eisen | nach ärztlicher Absprache: 20 bis 100 Milligramm als Tablette oder Dosierung des Arztes als Infusion |
| Sonstige Nährstoffe | |
Omega-3-Fettsäuren | 1.500 bis 2.500 Milligramm mit einem höheren Anteil an EPA |
Coenzym Q10 | 100 bis 300 Milligramm |
L-Carnitin | 1.000 bis 3.000 Milligramm |
L-Arginin (oder L-Citrullin) | 1.500 bis 3.000 Milligramm |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei Herzschwäche | |
|---|---|
| Normalwerte | |
Omega-3-Index (Erythrozyten) | 8 bis 11 Prozent (%) |
Vitamin D (Serum) | 40 bis 60 Nanogramm pro Milliliter (ng/ml) |
Magnesium (Vollblut) | 1,38 bis 1,50 Millimol pro Liter (mmol/l) |
Homocystein (Serum) | unter 10 Mikromol pro Liter (µmol/l) |
Vitamin B12 (Serum) Holotranscobalamin (Serum) | 300 bis 900 Pikogramm pro Milliliter (pg/ml) über 54 Pikomol pro Liter (pmol/l) |
L-Arginin und asymmetrisches Dimethylarginin (ADMA) (Plasma) | 100 bis 300 Mikromol pro Liter unter 0,7 Mikromol pro Liter
|
Eisen Ferritin (Serum) Transferrin-Sättigung |
über 100 Mikrogramm pro Liter (µg/l) über 20 Prozent |
Unterstützung von Medikamenten mit Mikronährstoffen
ACE-Hemmer und AT1-Blocker begünstigen einen Zinkmangel
Bluthochdruck schädigt die Gefäße und belastet das Herz. Daher erhalten Patienten mit Herzschwäche oft blutdrucksenkende Mittel (ACE-Hemmer) wie Captopril (zum Beispiel Captogamma®, Lopirin® und Tensobon®) oder Enalapril (zum Beispiel Xanef®, Benalapril®, Enahexal® oder Alapril®). ACE-Hemmer binden Zink im Darm und können so einen Zinkmangel begünstigen.
AT1-Blocker wie Losartan (Lorzaar®) oder Candesartan (zum Beispiel Atacand® und Blopresid®) senken ebenfalls den Blutdruck. Diese Medikamente erhöhen allerdings die Ausscheidung von Zink über die Nieren und führen so auch langfristig zu einem Zinkmangel.
Mikronährstoff-Experten empfehlen begleitend zu ACE-Hemmern und AT1-Blockern 10 bis 20 Milligramm Zink pro Tag.
Betablocker stören den Coenzym-Q10-Stoffwechsel
Betablocker wie Propanolol (zum Beispiel Dociton® oder Inderal®) wirken blutdrucksenkend. Die Einnahme von Betablockern kann jedoch auch den Coenzym-Q10-Stoffwechsel stören. Umgekehrt unterstützt Coenzym Q10 die Wirksamkeit von Betablockern und senkt den Blutdruck.
In der Mikronährstoffmedizin werden 100 bis 300 Milligramm Coenzym Q10 pro Tag eingesetzt, um einem beeinträchtigten Coenzym-Q10-Stoffwechsel durch Betablocker vorzubeugen.
Diuretika erhöhen den Mineralstoffverlust
Diuretika (Entwässerungsmedikamente) scheiden überschüssiges Wasser aus. Allerdings schwemmen sogenannte Schleifendiuretika wie Furosemid (zum Beispiel Diurapid®) auch wichtige Mineralstoffe wie Magnesium, Kalium oder Zink aus. Zudem können sie den Vitamin-B1-Spiegel verringern. Thiazid-Diuretika (Hydrochlorothiazide wie Disalunil®, Esidrix®) fördern die Ausscheidung von Folsäure, Vitamin B6 und B12 und können zudem den Homocysteinspiegel erhöhen.
Deshalb raten Mikronährstoff-Experten, begleitend zu Entwässerungsmedikamenten folgende Nährstoffe einzunehmen:
- 10 bis 20 Milligramm Zink
- 200 bis 400 Milligramm Magnesium
- 40 Milligramm Vitamin B1
- 5 bis 15 Milligramm Vitamin B6
- 100 bis 200 Mikrogramm Vitamin B12
- 200 bis 400 Mikrogramm Folsäure
Dosierungen auf einen Blick
Mikronährstoffempfehlung pro Tag bei Einnahme von Medikamenten | |
|---|---|
| ACE-Hemmer | |
Zink | 10 bis 20 Milligramm (mg) |
| AT1-Blocker | |
Zink | 10 bis 20 Milligramm |
| Betablocker | |
Coenzym Q10 | 100 bis 300 Milligramm |
| Diuretika | |
Folsäure | 200 bis 400 Mikrogramm (µg) |
Vitamin B1 | 40 Milligramm |
Vitamin B6 | 5 bis 15 Milligramm |
Vitamin B12 | 100 bis 200 Mikrogramm |
Zink | 10 bis 20 Milligramm |
Magnesium | 200 bis 400 Milligramm |
Zusammenfassung
Bei einer Herzschwäche ist das Herz aufgrund einer verringerten Pumpleistung nicht mehr in der Lage, den Körper ausreichend mit Blut und Sauerstoff zu versorgen. Bestimmte Mikronährstoffe können die Energieversorgung und die Pumpfunktion des Herzens verbessern und so das Fortschreiten der Erkrankung bremsen.
Coenzym Q10 unterstützt den Energiestoffwechsel des Herzens, senkt den Blutdruck und kann die Kraft des Herzmuskels positiv beeinflussen. L-Carnitin steigert die Leistungsfähigkeit des Herzmuskels und lindert möglicherweise die Symptome bei chronischer Herzschwäche. Omega-3-Fettsäuren wie EPA und DHA hemmen Entzündungsprozesse in den Gefäßen und senken erhöhte Blutfette. Vitamin D steigert wahrscheinlich die Auswurfleistung des Herzens und die körperliche Leistungsfähigkeit.
Magnesium normalisiert den Blutdruck und L-Arginin erweitert die Blutgefäße. B-Vitamine senken den Risikomarker Homocystein und könnten so ebenfalls den Verlauf der Erkrankung verbessern. Daneben wird Herzschwäche oft von einem Eisenmangel begleitet. Die Blutwerte sollten routinemäßig kontrolliert und ein Mangel entsprechend ausgeglichen werden.
Verschiedene Medikamente, die bei Herzschwäche zum Einsatz kommen, können Nebenwirkungen verursachen. Hierzu zählt ein Mineralstoffverlust durch Einnahme von ACE-Hemmern und Entwässerungsmitteln oder ein gestörter Coenzym-Q10-Stoffwechsel durch Betablocker. Mikronährstoffe wie Zink, Coenzym Q10, Magnesium sowie B-Vitamine können helfen, solche Nebenwirkungen zu verhindern.
Verzeichnis der Studien und Quellen
Adams, M. R. et al. (1997): Oral L-arginine improves endothelium-dependent dilatation and reduces monocyte adhesion to endothelial cells in young men with coronary artery disease. Atherosclerosis 1997;129(2):261-9. https://pubmed.ncbi.nlm.nih.gov/9105569/, abgerufen am: 13.01.2023.
Ahmed, M. et al. (2015): Thiamin deficiency and heart failure: the current knowledge and gaps in literature. Heart Fail Rev. 2015 Jan;20(1):1-11. https://www.ncbi.nlm.nih.gov/pubmed/24811895, abgerufen am: 24.01.2018.
Al Saadi, T. et al. (2021): Coenzyme Q10 for heart failure. Cochrane Database of Systematic Reviews 2021 Feb 3;1. https://www.cochrane.org/CD008684/VASC_coenzyme-q10-heart-failure, abgerufen am: 11.01.2023.
Albaugh, V. L. et al. (2017): Arginine-Dual roles as an onconutrient and immunonutrient. J Surg Oncol 2017;115(3):273-80. https://pubmed.ncbi.nlm.nih.gov/27861915/, abgerufen am: 13.01.2023.
Almoznino-Sarafian, D. et al (2007): Magnesium and C-reactive protein in heart failure: an anti-inflammatory effect of magnesium administration? Eur J Nutr. 2007 Jun;46(4):230-7. https://www.ncbi.nlm.nih.gov/pubmed/17479208, abgerufen am: 23.01.2018.
Alnuwaysir, R. I. S. et al. (2021): Iron Deficiency in Heart Failure: Mechanisms and Pathophysiology. J Clin Med. 2021 Dec 27;11(1):125. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8745653/, abgerufen am: 13.01.2023.
Angkananard, T. et al. (2016): The association of serum magnesium and mortality outcomes in heart failure patients. Medicine (Baltimore). 2016 Dec; 95(50): e5406. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5268025/, abgerufen am: 23.01.2018.
Ao, M. et al. (2019): Possible involvement of thiamine insufficiency in heart failure in the institutionalized elderly [published correction appears in J Clin Biochem Nutr. 2019 Sep;65(2):170]. J Clin Biochem Nutr 2019;64(3):239-42. https://pubmed.ncbi.nlm.nih.gov/31138958/, abgerufen am: 13.01.2023.
Appleton, J. (2003): Arginine: Clinical Potential of a Semi-Essential Amino Acid. Alternative Medicine Review: a Journal of Clinical Therapeutic 7(6):512-22. https://www.researchgate.net/publication/10980028_Arginine_Clinical_Potential_of_a_Semi-Essential_Amino_Acid, abgerufen am: 13.01.2023.
Avni, T. et al. (2012): Iron supplementation for the treatment of chronic heart failure and iron deficiency: systematic review and meta-analysis. Eur J Heart Fail 2012;14(4):423-9. https://pubmed.ncbi.nlm.nih.gov/22348897/, abgerufen am: 13.01.2023.
Azizi-Namini, P. et al. (2012): The role of B vitamins in the management of heart failure. Nutr Clin Pract 2012;27(3):363-74. https://pubmed.ncbi.nlm.nih.gov/22516940/, abgerufen am: 13.01.2023.
Babar, M.Z.M. et al. (2016): Effects of Vitamin D supplementation on physical activity of patients with Heart Failure. Pak J Med Sci. 2016 Nov-Dec; 32(6): 1430–1433. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5216295/, abgerufen am: 23.01.2018.
Balderas-Munoz, K., Castillo-Martínez L, Orea-Tejeda A, et al. Improvement of ventricular function in systolic heart failure patients with oral L-citrulline supplementation. Cardiol J 2012;19(6):612-7. https://pubmed.ncbi.nlm.nih.gov/23224924/, abgerufen am: 13.01.2023.
Bautista-Ortega, J. & Ruiz-Feria, C. A. (2010): L-arginine and antioxidant vitamins E and C improve the cardiovascular performance of broiler chickens grown under chronic hypobaric hypoxia. Poult Sci 2010;89(10):2141-6. https://pubmed.ncbi.nlm.nih.gov/20852105/, abgerufen am: 13.01.2023.
Berman, M. et al. (2004): Coenzyme Q10 in patients with end-stage heart failure awaiting cardiac transplantation: a randomized, placebo-controlled study. Clin Cardiol. 2004 May;27(5):295-9. https://www.ncbi.nlm.nih.gov/pubmed/15188947, abgerufen am: 20.12.2017.
Bin-Jumah, M. N. et al. (2021): Pathobiological Relationship of Excessive Dietary Intake of Choline/L-Carnitine: A TMAO Precursor-Associated Aggravation in Heart Failure in Sarcopenic Patients. Nutrients 2021 Sep 29;13(10):3453. https://pubmed.ncbi.nlm.nih.gov/34684454/, abgerufen am: 13.01.2023.
Bistola, V. & Flippatos, G. (2020): Vitamin B12 deficiency in heart failure: another “brick in the wall”. Hellenic Journal of Cardiology 2020;61(5):338-340. https://www.sciencedirect.com/science/article/pii/S1109966620302414?via%3Dihub, abgerufen am: 13.01.2023.
Boxer, R. S. et al. (2013): A randomized controlled trial of high dose vitamin D3 in patients with heart failure. JACC Heart Fail 2013;1(1):84-90. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3845907/, abgerufen am: 13.01.2023.
Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) (2017): Nationale VersorgungsLeitlinie Chronische Herzinsuffizienz – 3. Auflage. Version 3. 2019. https://www.leitlinien.de/themen/herzinsuffizienz/3-auflage/kapitel-1, abgerufen am: 11.01.2023.
Busa, V. et al. (2020): Role of Vitamin D Supplementation in Heart Failure Patients With Vitamin D Deficiency and Its Effects on Clinical Outcomes: A Literature Review. Cureus 2020 Oct 7;12(10):e10840. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7647842/, abgerufen am: 13.01.2023.
Chopra, V. K. & Anker, S. D. (2020): Anaemia, iron deficiency and heart failure in 2020: facts and numbers. ESC Heart Fail 2020;7(5):2007-11. https://pubmed.ncbi.nlm.nih.gov/32602663/, abgerufen am: 13.01.2023.
Christ, M. M. (2017): Chronische Herzinsuffizienz. Eisenmangel leitliniengerecht therapieren. Arzneimitteltherapie 2017;35(06). https://www.arzneimitteltherapie.de/heftarchiv/2017/06/eisenmangel-leitliniengerecht-therapieren.html, abgerufen am: 11.01.2023.
Cicero, A.F.G. & Colletti, A. (2017): Nutraceuticals and Dietary Supplements to Improve Quality of Life and Outcomes in Heart Failure Patients. Curr Pharm Des. 2017;23(8):1265-1272. https://www.ncbi.nlm.nih.gov/pubmed/28120718, abgerufen am: 20.12.2017.
Cicero, A. F. G. et al. (2020): Nutraceutical support in heart failure: a position paper of the International Lipid Expert Panel (ILEP). Nutr Res Rev 2020;33(1):155-79. https://pubmed.ncbi.nlm.nih.gov/32172721/, abgerufen am: 13.01.2023.
Claxton, L. et al. (2022): Coenzyme Q10 to manage chronic heart failure with a reduced ejection fraction: a systematic review and economic evaluation. Health Technol Assess 2022;26(4):1-128. https://pubmed.ncbi.nlm.nih.gov/35076012/, abgerufen am: 13.01.2023.
Dalbeni, A. et al. (2014): Effects of six months of vitamin D supplementation in patients with heart failure: a randomized double-blind controlled trial. Nutr Metab Cardiovasc Dis. 2014 Aug;24(8):861-8. https://www.ncbi.nlm.nih.gov/pubmed/24787908, abgerufen am: 23.01.2018.
Deutsche Gesellschaft für Kardiologie – Herz-und Kreislaufforschung e.V. (2017): ESC Pocket Guidelines. Herzinsuffizienz, Version 2016. http://leitlinien.dgk.org/files/PLL_2017_HI_Auflage2.pdf, abgerufen am: 20.12.2017.
Deutsche Gesellschaft für Kardiologie – Herz- und Kreislaufforschung e.V. (2016): https://www.kardiologie.org/herz-und-gefaesse/tmao-spiegel-sagen-tod-bei-gefaesspatienten-voraus/10983840, abgerufen am: 13.01.2023.
Deutsche Herzstiftung e.V (2020): Bedrohliche Herzschwäche: Hilft Eisentherapie?. Deutsche Herzstiftung 2020 Feb 17. https://www.herzstiftung.de/service-und-aktuelles/presse/pressemitteilungen/bedrohliche-herzschwaeche-kann-eisentherapie-helfen, abgerufen am: 13.01.2023.
Deutsche Herzstiftung e.V (2021): Herzinsuffizienz? Jetzt Eisen-Wert im Blut testen lassen. Deutsche Herzstiftung 2021 Nov 25. https://www.herzstiftung.de/service-und-aktuelles/presse/pressemitteilungen/herzinsuffizienz-eisenwerte-testen, abgerufen am: 13.01.2023.
Di Lorenzo, A. et al. (2020): Clinical Evidence for Q10 Coenzyme Supplementation in Heart Failure: From Energetics to Functional Improvement. J Clin Med 2020 Apr 27;9(5):1266. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7287951/, abgerufen am: 13.01.2023.
Doutreleau, S. et al. (2006): Chronic L-arginine supplementation enhances endurance exercise tolerance in heart failure patients. Int J Sports Med 2006;27(7):567-72. https://pubmed.ncbi.nlm.nih.gov/16802253/, abgerufen am: 13.01.2023.
Flanagan, J.L. et al. (2010): Role of carnitine in disease. Nutr Metab (Lond). 2010; 7: 30. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2861661/, abgerufen am: 21.12.2017.
Fotino, A.D. et al. (2013): Effect of coenzyme Q₁₀ supplementation on heart failure: a meta-analysis. Am J Clin Nutr. 2013 Feb;97(2):268-75. https://www.ncbi.nlm.nih.gov/pubmed/23221577, abgerufen am: 20.12.2017.
Fuentes, J.C. et al. (2007): Acute and Chronic Oral Magnesium Supplementation: Effects on Endothelial Function, Exercise Capacity, and Quality of Life in Patients With Symptomatic Heart Failure. Congestive Heart Failure 2007 Jan;12(1):9-13. https://onlinelibrary.wiley.com/doi/full/10.1111/j.1527-5299.2006.04692.x, abgerufen am: 11.01.2023.
Gambardella, J. et al. (2020): Arginine and Endothelial Function. Biomedicines 2020 Aug 6;8(8):277. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7460461/, abgerufen am: 13.01.2023.
Gao, N. et al. (2022): Associations Between Vitamin D Levels and Risk of Heart Failure: A Bidirectional Mendelian Randomization Study. Front Nutr 2022 May 19;9:910949. https://pubmed.ncbi.nlm.nih.gov/35669075/, abgerufen am 13.01.2023.
Ghafourian, K. et al. (2020): Iron and Heart Failure: Diagnosis, Therapies, and Future Directions. JACC Basic Transl Sci 2020 Mar 23;5(3):300-313. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7091506/, abgerufen am: 13.01.2023.
Glück, T. & Alter, P. (2016): Marine omega-3 highly unsaturated fatty acids: From mechanisms to clinical implications in heart failure and arrhythmias. Vascul Pharmacol. 2016 Jul;82:11-9. https://www.ncbi.nlm.nih.gov/pubmed/27080538, abgerufen am: 21.12.2017.
Graham, F. J. et al. (2021): Intravenous iron for heart failure with evidence of iron deficiency: a meta-analysis of randomised trials. Clin Res Cardiol 2021;110(8):1299-1307. https://pubmed.ncbi.nlm.nih.gov/33755777/, abgerufen am: 13.01.2023.
Gröber, U. (2015): Interaktionen – Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2007): Arzneimittel und Mikronährstoffe, Medikationsorientierte Supplementierung. 1. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gutierrez-Mariscal, F. M. et al. (2020): Coenzyme Q10 Supplementation for the Reduction of Oxidative Stress: Clinical Implications in the Treatment of Chronic Diseases. Int J Mol Sci 2020 Oct 23;21(21):7870. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7660335/, abgerufen am: 13.01.2023.
Heianza, Y. et al. (2020): Long-Term Changes in Gut Microbial Metabolite Trimethylamine N-Oxide and Coronary Heart Disease Risk. J of the Am Col of Card 2020;75(7):763-72. https://www.sciencedirect.com/science/article/pii/S0735109719387595, abgerufen am: 13.01.2023.
Hu, Y. et al. (2019): Marine Omega-3 Supplementation and Cardiovascular Disease: An Updated Meta-Analysis of 13 Randomized Controlled Trials Involving 127 477 Participants. J Am Heart Assoc 2019;8(19):e013543. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6806028/, abgerufen am: 13.01.2023.
Ismahel, H. & Ismahel, N. (2021): Iron replacement therapy in heart failure: a literature review. Egypt Heart J 2021 Sep 26;73(85). https://tehj.springeropen.com/articles/10.1186/s43044-021-00211-3, abgerufen am: 13.01.2023.
Jain, A. et al. (2015): Determining the Role of Thiamine Deficiency in Systolic Heart Failure: A Meta-Analysis and Systematic Review. J Card Fail. 2015 Dec;21(12):1000-7. https://www.ncbi.nlm.nih.gov/pubmed/26497757, abgerufen am: 24.01.2018.
Johansson, P. et al. (2016): Fluid restriction in patients with heart failure: how should we think? Eur J Cardiovasc Nurs. 2016 Aug;15(5):301-4. https://www.ncbi.nlm.nih.gov/pubmed/27169459, abgerufen am: 14.12.2017.
Kaplan. P. et al. (2020): Homocysteine and Mitochondria in Cardiovascular and Cerebrovascular Systems. Int J Mol Sci 2020 Oct 18;21(20):7698. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7589705/, abgerufen am: 13.01.2023.
Katta, N. et al. (2016): Does Long-Term Furosemide Therapy Cause Thiamine Deficiency in Patients with Heart Failure? A Focused Review. Am J Med 2016;129(7):753.e7-753.e11. https://pubmed.ncbi.nlm.nih.gov/26899752/, abgerufen am: 13.01.2023.
Keith, M.E. et al. (2009): B-vitamin deficiency in hospitalized patients with heart failure. J Am Diet Assoc. 2009 Aug;109(8):1406-10. https://www.ncbi.nlm.nih.gov/pubmed/19631047, abgerufen am: 24.01.2018.
Khan, M. S. et al. (2021): Dietary interventions and nutritional supplements for heart failure: a systematic appraisal and evidence map. Eur J Heart Fail 2021;23(9):1468-76. https://pubmed.ncbi.nlm.nih.gov/34173307/, abgerufen am: 13.01.2023.
Khan, S. U. et al (2021): Effect of omega-3 fatty acids on cardiovascular outcomes: A systematic review and meta-analysis. EClinicalMedicine 2021 Jul 8;38:100997. https://pubmed.ncbi.nlm.nih.gov/34505026/, abgerufen am: 13.01.2023.
Kim, I. Y. et al. (2015): Acute ingestion of citrulline stimulates nitric oxide synthesis but does not increase blood flow in healthy young and older adults with heart failure. Am J Physiol Endocrinol Metab 2015;309(11):E915-E924. https://pubmed.ncbi.nlm.nih.gov/26442881/, abgerufen am: 13.01.2023.
Klip, I. T. et al. (2013): Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J 2013;165(4):575-582.e3. https://pubmed.ncbi.nlm.nih.gov/23537975/, abgerufen am: 13.01.2023.
Lee, R. et al. (2018): Nutritional Assessment and Dietary Interventions in Older Patientswith Heart Failure. Curr Cardiovasc Risk Rep 2018;12(12):1-8. https://link.springer.com/content/pdf/10.1007/s12170-018-0580-y.pdf, abgerufen am: 11.01.2023.
Liu, M. & Dudley, S. C. Jr. (2020): Magnesium, Oxidative Stress, Inflammation, and Cardiovascular Disease. Antioxidants 2020; 9(10):907. https://www.mdpi.com/2076-3921/9/10/907/htm, abgerufen am: 13.01.2023.
Loncar, G. et al. (2021): Iron deficiency in heart failure. ESC Heart Fail 2021;8(4):2368-79. https://pubmed.ncbi.nlm.nih.gov/33932115/, abgerufen am: 13.01.2023.
Luo, T. et al. (2013): A study on the efficacy and safety assessment of propionyl-L-carnitine tablets in treatment of intermittent claudication. Thromb Res. 2013 Oct;132(4):427-32. https://www.ncbi.nlm.nih.gov/pubmed/23998557, abgerufen am: 21.12.2017.
McGurk, K. A. et al. (2022): Effect of taurine administration on symptoms, severity, or clinical outcome of dilated cardiomyopathy and heart failure in humans: a systematic review. Wellcome Open Res 2022 Jul 7;7:9. https://pubmed.ncbi.nlm.nih.gov/35855073/, abgerufen am: 13.01.2023.
Mei, Z. et al. (2022): Comparative efficacy of intravenous and oral iron supplements for the treatment of iron deficiency in patients with heart failure: A network meta-analysis of randomized controlled trials. Pharmacol Res 2022;182:106345. https://pubmed.ncbi.nlm.nih.gov/35810949/, abgerufen am: 13.01.2023.
Moretti, R. & Caruso, P. (2019): The Controversial Role of Homocysteine in Neurology: From Labs to Clinical Practice. Int J Mol Sci 2019 Jan 8;20(1):231. https://pubmed.ncbi.nlm.nih.gov/30626145/, abgerufen am: 13.01.2023.
Mortensen, S.A. et al. (2014): The effect of coenzyme Q10 on morbidity and mortality in chronic heart failure: results from Q-SYMBIO: a randomized double-blind trial. JACC Heart Fail. 2014 Dec;2(6):641-9. https://www.ncbi.nlm.nih.gov/pubmed/25282031, abgerufen am: 20.12.2017.
Naghedi, A. et al. (): Effect of vitamin D supplements on left ventricular ejection fraction in patients with heart failure: A systematic review and meta-analysis of randomized controlled trials. Revista Portuguesa de Cardiologia 2021 Jun;40(6):447-55. https://www.sciencedirect.com/science/article/pii/S0870255121001530, abgerufen am: 13.01.2023.
Naito, Y. et al. (2022): Crosstalk between Iron and Arteriosclerosis. J Atheroscler Thromb 2022;29(3):308-14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8894107/, abgerufen am: 13.01.2023.
Oeing C.U. et al. (2016): The new ESC Guidelines for acute and chronic heart failure. Herz. 2016 Dec;41(8):655-663. https://www.ncbi.nlm.nih.gov/pubmed/27858115, abgerufen am: 20.12.2017.
Oleck, S. & Ventura, H. (2016): Coenzyme Q10 and Utility in Heart Failure: Just Another Supplement? Curr Heart Fail Rep. 2016 Aug;13(4):190-5. https://www.ncbi.nlm.nih.gov/pubmed/27333901, abgerufen am: 20.12.2017.
Olsson, L. G. et al. (2005): Six minute corridor walk test as an outcome measure for the assessment of treatment in randomized, blinded intervention trials of chronic heart failure: a systematic review. Eur Heart J 2005;26(8):778-93. https://pubmed.ncbi.nlm.nih.gov/15774495/, abgerufen am: 13.01.2023.
Orozco-Gutiérrez, J. J. et al. (2010): Effect of L-arginine or L-citrulline oral supplementation on blood pressure and right ventricular function in heart failure patients with preserved ejection fraction. Cardiol J 2010;17(6):612-8. https://pubmed.ncbi.nlm.nih.gov/21154265/, abgerufen am: 13.01.2023.
Pan, W. et al. (2020): Prognostic Value of Asymmetric Dimethylarginine in Patients with Heart Failure: A Systematic Review and Meta-analysis. Biomed Res Int 2020 Jul 4;2020:6960107. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7355346/, abgerufen am: 13.01.2023.
Piquereau, J. et al. (2021): Metabolic Therapy of Heart Failure: Is There a Future for B Vitamins?. Int J Mol Sci 2021 Dec 21;23(1):30. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8744601/, abgerufen am: 13.01.2023.
Rahman, A. et al. (2016): Malnutrition and Cachexia in Heart Failure. JPEN J Parenter Enteral Nutr 2016;40(4):475-86. https://pubmed.ncbi.nlm.nih.gov/25634161/, abgerufen am: 13.01.2023.
Rizzo, C. et al. (2021): Iron Deficiency: A New Target for Patients With Heart Failure. Front Cardiovasc Med. 2021 Aug 10;8:709872. https://pubmed.ncbi.nlm.nih.gov/34447793/, abgerufen am: 16.01.2023.
Rodrigues-Krause, J. et al. (2018): Association of l-Arginine Supplementation with Markers of Endothelial Function in Patients with Cardiovascular or Metabolic Disorders: A Systematic Review and Meta-Analysis. Nutrients 2018 Dec 20;11(1):15. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6357192/, abgerufen am: 13.01.2023.
Salmani, M. et al. (2021): Effect of l-arginine on cardiac reverse remodeling and quality of life in patients with heart failure. Clin Nutr 2021;40(5):3037-44. https://pubmed.ncbi.nlm.nih.gov/33610421/, abgerufen am: 13.01.2023.
Serban, M.C. et al. (2016): Impact of L-carnitine on plasma lipoprotein(a) concentrations: A systematic review and meta-analysis of randomized controlled trials. Sci Rep. 2016; 6: 19188. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4709689, abgerufen am: 21.12.2017.
Sharifi, M.A. (2017): Effects of a therapeutic lifestyle change diet and supplementation with Q10 plus L-carnitine on quality of life in patients with myocardial infarction: A randomized clinical trial. J J Cardiovasc Thorac Res. 2017;9(1):21-28. https://www.ncbi.nlm.nih.gov/pubmed/28451084, abgerufen am: 21.12.2017.
Sharma, A. et al. (2016): Coenzyme Q10 and Heart Failure: A State-of-the-Art Review. Circ Heart Fail. 2016 Apr;9(4):e002639. https://www.ncbi.nlm.nih.gov/pubmed/27012265, abgerufen am: 20.12.2017.
Shiraseb, F. et al. (2022): Effect of l-Arginine Supplementation on Blood Pressure in Adults: A Systematic Review and Dose-Response Meta-analysis of Randomized Clinical Trials. Adv Nutr 2022;13(4):1226-42. https://pubmed.ncbi.nlm.nih.gov/34967840/, abgerufen am: 13.01.2023.
Singh, R.B. et al. (1996): A randomised, double-blind, placebo-controlled trial of L-carnitine in suspected acute myocardial infarction. Postgrad Med J. 1996 Jan; 72(843): 45–50. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2398308/, abgerufen am: 21.12.2017.
Smithline, H. A. et al. (2019): Supplemental thiamine for the treatment of acute heart failure syndrome: a randomized controlled trial. BMC Complement Altern Med 2019 Ma 6;19(1):96. https://pubmed.ncbi.nlm.nih.gov/31060559/, abgerufen am: 13.01.2023.
Song, X., et al. (2017): Efficacy and Safety of L-Carnitine Treatment for Chronic Heart Failure: A Meta-Analysis of Randomized Controlled Trials. Biomed Res Int. 2017;2017:6274854. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5406747/, abgerufen am: 13.01.2023.
Toko, H. et al. (2020): Omega-3 fatty acid prevents the development of heart failure by changing fatty acid composition in the heart. Sci Rep 2020 Sep 23;10(1):15553. https://pubmed.ncbi.nlm.nih.gov/32968201/, abgerufen am 13.01.2023.
Trasobares, E. et al. (2007): Effects of angiotensin-converting enzyme inhibitors (ACE i) on zinc metabolism in patients with heart failure. J Trace Elem Med Biol. 2007;21 Suppl 1:53-5. https://www.ncbi.nlm.nih.gov/pubmed/18039498, abgerufen am: 24.01.2018.
Turrini, F. et al. (2017): Effects of Cholecalciferol Supplementation in Patients with stable heart failure and Low Vitamin D levels (ECSPLOIT-D): a double-blind, randomized, placebo-controlled pilot study. Minerva Cardioangiol. 2017 Dec;65(6):553-562. https://www.ncbi.nlm.nih.gov/pubmed/28565886, abgerufen am: 23.01.2018.
van der Waal, H.H. et al. (2015): Vitamin B12 and folate deficiency in chronic heart failure. Heart. 2015 Feb;101(4):302-10. https://www.ncbi.nlm.nih.gov/pubmed/25324534, abgerufen am: 24.01.2018.
Vizzardi, E. et al. (2009): Homocysteine and heart failure: an overview. Recent Pat Cardiovasc Drug Discov. 2009 Jan;4(1):15-21. https://www.ncbi.nlm.nih.gov/pubmed/19149701, abgerufen am: 24.01.1018.
Voultsos, P. et al. (2022): Magnesium Disorders and Prognosis in Heart Failure: A Systematic Review. Cardiol Rev 2022;30(6):281-5. https://pubmed.ncbi.nlm.nih.gov/34001688/, abgerufen am: 13.01.2023.
Wang, L. et al. (2012): Circulating 25-hydroxy-vitamin D and risk of cardiovascular disease: a meta-analysis of prospective studies. Circ Cardiovasc Qual Outcomes 2012;5(6):819-29. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3510675/, abgerufen am: 13.01.2023.
Watanabe, S. et al. (2016): Associations With Eicosapentaenoic Acid to Arachidonic Acid Ratio and Mortality in Hospitalized Heart Failure Patients. J Card Fail. 2016 Dec;22(12):962-969. https://www.ncbi.nlm.nih.gov/pubmed/27138463, abgerufen am: 21.12.2017.
Wei, M.Y. & Jacobson, T.A. (2011): Effects of eicosapentaenoic acid versus docosahexaenoic acid on serum lipids: a systematic review and meta-analysis. Curr Atheroscler Rep. 2011 Dec;13(6):474-83. https://www.ncbi.nlm.nih.gov/pubmed/21975919/. Abgerufen am: 27.02.2018.
Wilson, A. M. et al. (2007): L-arginine supplementation in peripheral arterial disease: no benefit and possible harm. Circulation 2007;116(2):188-95. https://pubmed.ncbi.nlm.nih.gov/17592080/, abgerufen am: 13.01.2023.
Woo, J. S. et al. (2022): Effect of vitamin D on endothelial and ventricular function in chronic heart failure patients: A prospective, randomized, placebo-controlled trial. Medicine (Baltimore) 2022 Jul 22;101(29):e29623. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9302363/, abgerufen am: 13.01.2023.
Wong, A.P. (2016): Myocardial energetics and the role of micronutrients in heart failure: a critical review. Am J Cardiovasc Dis. 2016; 6(3): 81–92. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5030388/, abgerufen am: 20.12.2017.
Wong, E. K. C. et al. (2022): High-Dose Thiamine Supplementation in Older Patients With Heart Failure: A Pilot Randomized Controlled Crossover Trial (THIAMINE-HF). CJC Open 2022 Feb 18;4(6):532-9. https://pubmed.ncbi.nlm.nih.gov/35734514/, abgerufen am: 13.01.2023.
Xu, M. et al. (2022): The effects of thiamine supplementation on patients with heart failure: A systematic review and meta-analysis of randomized controlled trials. Complementary Therapies in Medicine 2022;70:102853. https://www.sciencedirect.com/science/article/pii/S0965229922000553, abgerufen am: 13.01.2023.
Yamani, N. et al. (2021): Effect of iron supplementation in patients with heart failure and iron deficiency: A systematic review and meta-analysis. Int J Cardiol Heart Vasc 2021 Sep 24;36:100871. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8450242/, abgerufen am: 13.01.2023.
Zhang, Y. et al. (2021): TMAO: how gut microbiota contributes to heart failure. Transl Res 2021;228:109-25. https://pubmed.ncbi.nlm.nih.gov/32841736/, abgerufen am: 13.01.2023.
Zheng, S. et al. (2022): Long-chain omega-3 polyunsaturated fatty acids and the risk of heart failure. Ther Adv Chronic Dis 2022 Mar 18;13:20406223221081616. https://pubmed.ncbi.nlm.nih.gov/35321400/, abgerufen am: 13.01.2023.
Zittermann, A. et al. (2017): Effect of vitamin D on all-cause mortality in heart failure (EVITA): a 3-year randomized clinical trial with 4000 IU vitamin D daily. Eur Heart J 2017;38(29):2279-86. https://pubmed.ncbi.nlm.nih.gov/28498942/, abgerufen am: 13.01.2023.
Zozina, V. I. et al. (2018): Coenzyme Q10 in Cardiovascular and Metabolic Diseases: Current State of the Problem. Curr Cardiol Rev 2018;14(3):164-74. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6131403/, abgerufen am: 13.01.2023.





