Bei einer Osteoporose (Knochenschwund) ist der Knochenstoffwechsel gestört: Die Knochenmasse nimmt schneller ab, als es dem normalen Alterungsprozess entspricht. In der Folge steigt das Risiko für Knochenbrüche. Die Mikronährstoffmedizin trägt zu einer höheren Knochendichte bei und verbessert außerdem die Wirkung der Medikamente. Lesen Sie, wie viel Calcium bei Osteoporose nötig ist und welche Vitamine die Osteoporose-Therapie außerdem unterstützen können.

Ursachen und Symptome von Osteoporose
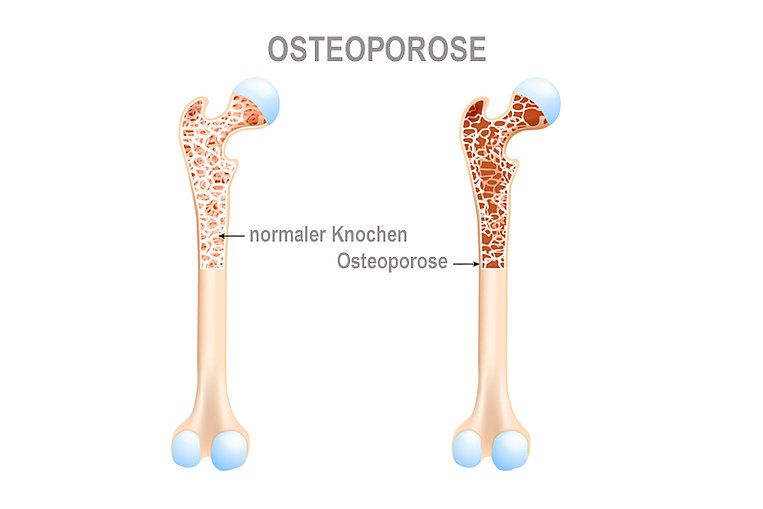
Wie entsteht Osteoporose?
Osteoporose ist eine Erkrankung des Skeletts, die laut Definition durch einen gestörten Knochenstoffwechsel gekennzeichnet ist. Die Knochensubstanz wird schneller abgebaut als aufgebaut. Die Knochen werden dann porös und brechen leichter. Der Knochenschwund ist zwar ein natürlicher Prozess im Alter, bei einer Osteoporose tritt er jedoch überdurchschnittlich stark auf. Ärzte unterscheiden zwei Osteoporose-Arten:
PrimäreOsteoporose: Die Ursache ist meistens ein Zusammenspiel verschiedener Risikofaktoren wie
- hohes Lebensalter und erbliche Veranlagung
- Bewegungsmangel und Bettlägerigkeit
- calciumarme Ernährung und Vitamin-D-Mangel
- Rauchen und hoher Konsum von Alkohol
- Schwermetallbelastung, etwa mit Cadmium
- geringes Körpergewicht
- Geschlecht – Frauen erkranken nach den Wechseljahren häufiger (postmenopausale Osteoporose)
Info
Das weibliche Hormon Östrogen verlangsamt den Knochenabbau. Mit der allerletzten Monatsblutung (Menopause) sinkt jedoch bei Frauen dessen Spiegel und das Osteoporose-Risiko steigt deutlich an. Auch bei Männern bewirkt die abnehmende Testosteronmenge im Alter einen leichten Knochenbau, allerdings weniger stark als bei Frauen.
SekundäreOsteoporose: Sie entsteht als Folge einer anderen Erkrankung wie
- chronisch-entzündlicher Darmerkrankungen (zum Beispiel Morbus Crohn, Colitis ulcerosa), Lebensmittelunverträglichkeiten (zum Beispiel Zöliakie)
- Diabetes mellitus
- rheumatoide Arthritis
- Herzschwäche
- Hormonstörungen wie ein Überschuss an Cortisol (Hyperkortisolismus, Cushing Syndrom), Schilddrüsenüberfunktion oder Überfunktion der Nebenschilddrüse
- bestimmte Krebsarten und Knochenmetastasen
Aber auch Medikamente können eine Osteoporose versuchen, wenn sie regelmäßig für eine längere Zeit eingenommen werden. Dazu gehören Kortison (Glucocorticoide) wie Prednisolon, Antidepressiva, Antiepileptika, Neuroleptika (Haloperidol), Protonenpumpenhemmer, Antiöstrogene bei hormonabhängigem Krebs und Schleifendiuretika.
Anzeichen von Osteoporose: Symptome erkennen
Der Abbau der Knochenstruktur kann zur Diagnostik durch eine Knochendichtemessung festgestellt werden. Dabei vergleicht der Arzt die gemessene Knochendichte mit Referenzwerten, die für das jeweilige Alter typisch sind.
Zu Beginn verursacht eine Osteoporose meistens keine Beschwerden. Im weiteren Verlauf treten folgende Symptome auf:
- Knochen- und Gelenkschmerzen, wie Schmerzen in den Beinen, im Fuß, in der Hüfte, im Rücken oder in der Schulter
- Haltungsänderung und Skelettverformung wie Rundrücken oder Hohlkreuz sowie O- oder X-Beine
- abnehmende Körpergröße und typische Falten am Rücken (Tannenbaum-Phänomen)
- Knochenbrüche ohne Sturz oder Unfall, denn die Knochen können bereits bei stärkerer Belastung oder spontan ohne äußere Einwirkung brechen
Osteoporose muss behandelt werden, sonst können sich die Betroffenen im Endstadium nicht mehr selbstständig bewegen und sind pflegebedürftig.
Ziele der Behandlung
Klassische Osteoporose-Therapie
Osteoporose ist nicht heilbar. Der weitere Abbau der Knochenmasse kann jedoch verlangsamt werden. Das beugt einer Verschlechterung der Symptome vor. Verschiedene Maßnahmen werden dafür kombiniert:
Ernährung: In der Leitlinie zur Osteoporose-Behandlung wird die Zufuhr von Calcium und Vitamin D aufgeführt. Dies sollte über die Nahrung und gegebenenfalls über Nahrungsergänzungsmittel erfolgen. Untergewicht sollte vermieden werden.
Bewegung: Sportliche Betätigungen wie Gymnastik und Krafttraining erhalten bei Osteoporose Beweglichkeit und Muskelmasse. Daneben sind Sportarten mit leichten Erschütterungen ideal, wie Gehen, Wandern oder Treppensteigen. Wird der Knochen belastet, fördert dies den Erhalt. Wenig Bewegung beschleunigt dagegen den Knochenabbau.
Medikamente: Sie können den Knochenabbau verhindern oder den Knochenaufbau unterstützen. Zu den älteren Wirkstoffen zählen die Bisphosphonate wie Alendronat (zum Beispiel Fosamax®), Ibandronat (zum Beispiel Bonviva®), Risedronat (zum Beispiel Actonel®) und Zoledronat (zum Beispiel Aclasta®). Neuere Wirkstoffe sind Raloxifen (wie Evista® und Optruma®), Denosumab (wie Prolia®), Strontiumranelat (wie Protelos®), Parathormon 1-84 (wie Preotact®) und Teriparatid (wie Forsteo®).
Bei einer sekundären Osteoporose muss zudem die Grunderkrankung behandelt werden. Gegebenenfalls werden knochenschädigende Medikamente abgesetzt oder vom Arzt eine Alternative verschrieben.
Ziele der Mikronährstoffmedizin: Knochen stärken
Ziel der Mikronährstoffmedizin bei Osteoporose ist es, möglichst viel Knochensubstanz zu erhalten. Calcium und Vitamin D sind wichtige Komponenten der Basistherapie. Weniger bekannt ist, dass viele weitere Vitamine und Mineralstoffe zum Knochenstoffwechsel beitragen. Für gesunde Knochen braucht der Körper vor allem:
- Calcium als Baustoff der Knochen
- Vitamin D zur Aufnahme von Calcium aus dem Darm
- Vitamin K2 zur Einlagerung von Calcium in den Knochen
- Magnesium, Bor, Mangan, Kupfer und Zink für den Knochenstoffwechsel
- Isoflavone als „Östrogenersatz“ nach den Wechseljahren bei Frauen
- B-Vitamine gegen knochenschädigendes Homocystein
Darüber hinaus können Vitamin D und Vitamin K die Wirkung von Osteoporose-Medikamenten verbessern.
Info
Die Krankenkassen bezahlen bei einer Osteoporose-Diagnose eine ergänzende Therapie mit Calcium und Vitamin D. Allerdings übernimmt die Krankenkasse erst beimanifesterOsteoporose die Kosten. Das bedeutet, dass bereits ein Knochenbruch aufgetreten sein muss. Eine ausreichende Versorgung mit Calcium und Vitamin D ist aber schon zur Vorbeugung von Knochenbrüchen durch Osteoporose wichtig. Zudem enthalten die Präparate (Arzneimittel), welche die Krankenkassen bezahlen, keineweiterenknochenstärkendenMikronährstoffe wie Vitamin K2. Daher empfehlen Mikronährstoff-Experten meistens ein komplexes Nahrungsergänzungsmittel für die Knochen.

Osteoporose-Behandlung mit Mikronährstoffen
Calcium bei Osteoporose – unverzichtbar für das Knochensystem
Wirkweise von Calcium
Calcium ist der wichtigste Baustein unserer Knochen. Bei einem Calciummangel im Blut bedient sich der Körper am Knochen wie an einem Steinbruch, um die Calciumspiegel konstant zu halten. Verantwortlich für die Calciumfreisetzung aus dem Knochen ist die Nebenschilddrüse: Sie schüttet mehr Parathormon aus, welches dann den Calciumspiegel erhöht.
Die Folge ist: Die Knochen werden weich und biegen sich; in extremen Fällen brechen sie. Ein Calciummangel ist daher ein Risikofaktor für Osteoporose und Knochenbrüche. Dies bestätigt eine Auswertung mehrerer hochwertiger Studien: Liegt die Zufuhr von Calcium unter 500 Milligramm pro Tag, sind Knochenbrüche häufiger. Eine Calcium- und Vitamin-D-Einnahme kann die Knochendichte erhöhen und vor allem bei Menschen in Pflegeheimen die Rate der Knochenbrüche senken; das zeigen zwei Studienübersichten.
In den offiziellen deutschen und europäischen Leitlinien wird Calcium als Bestandteil der Osteoporose-Therapie ausdrücklich empfohlen. Es sollte vorzugsweise über die Nahrung aufgenommen werden. Wenn die Nahrung zu wenig enthält, sind Calciumpräparate nötig.
Calcium ist außerdem für die Weiterleitung von Reizen verantwortlich, die für die Anspannung der Muskeln sorgen. Das Zusammenspiel von Muskeln und Knochen (sowie Sehnen und Gelenken) verringert Stürze und somit auch die Gefahr für Knochenbrüche. Calcium trägt also auf verschiedenen Wegen dazu bei, die Mobilität im Alter zu erhalten.
Dosierung und Einnahmeempfehlung von Calcium

Laut den Osteoporose-Leitlinien sollten täglich 700 bis 1.200 Milligramm Calcium aufgenommen werden. Dazu zählen auch Calciumquellen aus der Nahrung, wie Milch, Käse oder Mineralwasser. Wie viel Calcium pro Tag bei Osteoporose eingenommen werden sollte, hängt daher von der Ernährung ab. Ein Ernährungsplan, der von einem Experten ausgewertet wird, hilft, die Dosierung festzulegen.
Durchschnittlich aber beträgt die tägliche Calciumzufuhr bei Frauen 964 Milligramm. Ab 50 Jahren sinkt diese stetig, sodass dieser Wert bei 65 Prozent der Frauen darunter liegt. Deshalb empfehlen Mikronährstoff-Experten für Frauen ab 50 Jahren ein Calciumpräparat mit zum Beispiel 300 bis 500 Milligramm. Insgesamt sollte man aber nicht mehr als 2.000 Milligramm Calcium zuführen (Ernährung und Präparate).
Calciumpräparate sollten zum Essen ergänzt werden. Eine Einzeldosis darf dabei nicht mehr als 500 Milligramm enthalten (vor allem bei bestehender Arteriosklerose). Am besten verteilt man eine höhere Dosis deshalb über den Tag: Kapseln können beispielsweise geöffnet und das Pulver in Wasser eingerührt werden. Nimmt man Osteoporose-Medikamente ein (Bisphosphonate wie Fosamax®), muss ein Abstand von zwei bis drei Stunden dazwischen liegen.
Tipp
Welches Calcium bei Osteoporose? Besonders sinnvoll könnte CalciumausAlgen in Kombination mit regelmäßiger Bewegung, Vitamin D und K2 sein. Algen enthalten weitere wichtige Mineralstoffe für die Knochen, zum Beispiel Bor und Magnesium. In einer ersten Studie zeigte die Knochendichtemessung bessere Werte, wenn die Teilnehmer Algencalcium zwischen einem und sieben Jahre lang einnahmen.
Daneben ist organischesCalcium bei Osteoporose geeignet: Es wird schnell im Darm aufgenommen und hat eine hohe Bioverfügbarkeit. Beispiele sind Calciumgluconat und Calciumcitrat.
Calcium im Labor bestimmen lassen
Ob die Versorgung mit Calcium gut ist, kann nur schlecht im Blut ermittelt werden. Der Körper reguliert die Blutwerte streng, indem er es aus den Knochen abbaut. Dann steigen die Werte unter Umständen sogar an. Eine Knochendichtemessung gibt am besten Aufschluss über die Langzeitversorgung mit Calcium.
Eine Blutuntersuchung kann aber Auskunft über eine Überdosierung liefern, wenn zum Beispiel dauerhaft mehr als 2.000 Milligramm pro Tag eigenommen werden oder eine Erkrankung vorliegt. Grenzwerte liegen zwischen 2,2 und 2,65 Millimol pro Liter Blutplasma (Flüssigkeit des Blutes).
Daneben kann man die Calciumausscheidung im Urin kontrollieren. Dafür muss der Urin 24 Stunden gesammelt werden. Dafür muss der Urin 24 Stunden gesammelt werden. Beim Mann sind unter 7,5 Millimol Calcium normal, bei Frauen unter 6,2 Millimol.
Calcium: zu beachten bei Erkrankungen und Medikamenteneinnahme
Menschen mit Nierenerkrankungen müssen bei der Einnahme von Calcium vorher den Arzt fragen: Kranke Nieren können überschüssiges Calcium nicht gut ausscheiden. Zu viel Calcium kann bei calciumhaltigen Nierensteinen zudem einen Rückfall begünstigen. Darüber sollte ebenfalls mit dem Arzt gesprochen werden. Er kann die Calciummenge im Urin bestimmen. Ergänzt man bei Nierensteinen Calcium, ist das basische Citrat sehr wahrscheinlich die beste Form.
Calcium sollte bei zu hohen Blutwerten (Hypercalcämie) nicht eingenommen werden. Das kommt zum Beispiel vor bei einer Überfunktion der Nebenschilddrüse, bei der Bindegewebserkrankung Sarkoidose sowie bei Knochenmetastasen und Knochenmarkkrebs (multiples Myelom).
Darüber hinaus verringert Calcium die Aufnahme von Medikamenten, etwa von manchen Antibiotika (zum Beispiel Tetracyclin®, Doxycylin®, Amoxilan®) sowie Schilddrüsenhormonen (L-Thyroxin Aventis®, Euthyrox®). Ein Einnahmeabstand von zwei bis drei Stunden sollte deshalb eingehalten werden.
Die Ausscheidung von Calcium über die Nieren wird durch einige Blutdruck- und Entwässerungsmedikamente herabgesetzt. Dazu gehören Thiazide (wie Disalunil® oder Esidrix®). In Kombination mit Calciumpräparaten können die Calciumwerte im Blut zu stark ansteigen. Auch Medikamente mit Lithium können zu erhöhten Werten führen. Ähnliches gilt für calciumhaltige Mittel gegen Sodbrennen (Antazida mit Calciumcarbonat). Sprechen Sie vorher mit Ihrem Arzt.
Vitamin D für die Calciumaufnahme und gegen Osteoporose-Schmerzen?
Wirkweise von Vitamin D
Vitamin D erhöht die Calciumaufnahme im Darm und ist damit unentbehrlich für dessen Wirkung. Lebensmittel liefern jedoch kaum Vitamin D. Der Körper muss es mithilfe von Sonnenstrahlung in der Haut selbst herstellen. Die UV-Strahlung ist aber zwischen Oktober und April nicht stark genug, weshalb viele einen Vitamin-D-Mangel haben. Außerdem nimmt die Fähigkeit, Vitamin D herzustellen, mit dem Alter ab. Bei Betroffenen wird sehr häufig ein Vitamin-D-Mangel beobachtet. Daher sollte bei Osteoporose besonders im Alter Vitamin D ergänzt werden.
Dafür spricht auch eine große Studienauswertung: Das Risiko von Knochenbrüchen konnte durch die Einnahme von Vitamin D mit Calcium um 15 Prozent gesenkt werden. Vitamin D allein schützt vermutlich nicht vor einem Knochenbruch, so das Ergebnis einer weiteren großen Studienauswertung. In den offiziellen Leitlinien zur Behandlung von Osteoporose wird ebenfalls betont, dass Vitamin D mit Calcium kombiniert werden sollte.
Darüber hinaus könnte ein Vitamin-D-Mangel mit den Schmerzen bei Osteoporose in Zusammenhang stehen: Auch andere Schmerzen wurden durch Vitamin D in Studien abgeschwächt. Denkbar ist daher, dass man mit guten Vitamin-D-Spiegeln auch Osteoporose-Schmerzen lindern kann. Daneben verbessert eine gute Vitamin-D und Calcium-Versorgung die Muskelfunktion, sodass deutlich weniger Stürze beobachtet wurden.
Dosierung und Einnahmeempfehlung von Vitamin D
Die Dosierung von Vitamin D bei Osteoporose sollte laut Leitlinien bei 800 bis 1.000 Internationalen Einheiten täglich liegen. Bei Personen mit bereits erlittenem Knochenbruch (Fraktur) sind bis zu 2.000 Internationale Einheiten empfehlenswert.
Mikronährstoff-Experten empfehlen jedoch immer, den Vitamin-D-Spiegel im Blut bestimmen zu lassen. Denn danach richtet sich, wie viel Vitamin D bei Osteoporose nötig ist. Bei einem starken Mangel braucht man höhere Dosierungen, um ihn zu beheben.
Da Vitamin D ein fettlösliches Vitamin ist, muss es zum Essen eingenommen werden: Das Fett aus der Nahrung ist wichtig für die Aufnahme im Darm.
Vitamin D im Labor bestimmen lassen

Bei Osteoporose wird empfohlen, den Vitamin-D-Spiegel regelmäßig überprüfen zu lassen – am besten zweimal im Jahr (Frühling und Herbst). Dazu wird die Transportform im Blutserum gemessen, das sogenannte 25(OH)-Vitamin-D (Calcidiol). Blutserum ist die Flüssigkeit des Blutes ohne Blutzellen. Der Wert sollte für gesunde Knochen auf jeden Fall bei etwa 30 Nanogramm pro Milliliter liegen.
Einige Mikronährstoff-Experten empfehlen auch Werte zwischen 40 und 60 Nanogramm pro Milliliter, wenn es um die Wirkungen von Vitamin D außerhalb der Knochen geht. Jedoch ist noch nicht klar, warum das Sturzrisiko in diesem Bereich auch steigen könnte. Bei Menschen, die auf höhere Vitamin-D-Dosierungen mit einer verschlechterten Muskelkoordination reagieren (zum Beispiel mit Stolpern), könnte daher ein Wert von 30 bis 40 Nanogramm pro Milliliter besser sein. Der Therapeut sollte die Vor- und Nachteile abwägen.
Vitamin D: zu beachten bei Erkrankungen und Medikamenteneinnahme
Personen mit Nierenerkrankungen sollten die Einnahme von Vitamin D mit dem Arzt besprechen: Es erhöht die Calciumaufnahme in das Blut. Betroffene könnten aber bereits zu hohe Calciumspiegel haben. Auch bei calciumhaltigen Nierensteinen sollte man vorher den Arzt fragen. Er kann die Calciumwerte im Blut und Urin überwachen.
Einige Erkrankungen verursachen eine Vitamin-D-Unverträglichkeit und hohe Calciumspiegel. Vitamin D sollte dann nur unter ärztlicher Kontrolle eingesetzt werden. Dies betrifft die entzündliche Bindegewebserkrankung Sarkoidose sowie andere Erkrankungen mit entzündlichen Knötchen (Granulomen), beispielsweise Tuberkulose. Vorsicht gilt auch bei einer Überfunktion der Nebenschilddrüse sowie bei Knochenmetastasen und Knochenmarkkrebs.
Einige Entwässerungsmedikamente (Thiazide) senken die Calciumausscheidung über die Nieren. Das bedeutet, Calcium bleibt im Blut. Vitamin D sollte dann nur mit Thiaziden eingenommen werden, wenn der Calciumspiegel kontrolliert wird. Dazu gehören Hydrochlorothiazid (Disalunil®, Esidrix®), Indapamid (Inda Puren®, Sicco®) und Xipamid (Aquaphor®, Neotri®).
Vitamin K2 bringt bei Osteoporose Calcium an den richtigen Ort
Wirkweise von Vitamin K
Vitamin K sorgt dafür, dass Calcium in die Knochen eingelagert wird und dass sich der Abbau verlangsamt. Ein Mangel an Vitamin K kann das Risiko einer Osteoporose und von Knochenbrüchen erhöhen – so das Ergebnis mehrerer Beobachtungsstudien. Besonders die Unterform Vitamin K2 wird empfohlen: Es bleibt länger im Blut als Vitamin K1 und wirkt deshalb an den Knochen.
Die Einnahme von Vitamin K2 kann dazu beitragen, den Verlust an Knochenmasse zu reduzieren. Das zeigen einige hochwertige Studien mit Frauen in den Wechseljahren sowie Männern. Zwei Studienübersichten untermauen den Erfolg: Die Einnahme von Vitamin K2 könnte die Knochendichte verbessern und das Risiko für einen Knochenbruch (Fraktur) senken. Außerdem verstärkte Vitamin K in einer Studienübersicht den positiven Effekt von Calcium. Die Kombination führte sogar zu einer Zunahme der Knochendichte der Lendenwirbelsäule. Sehr wahrscheinlich wirkt ein Kombinationspräparat mit Vitamin K somit besser als Calcium und Vitamin D alleine. Weitere Studien müssen das nun weiter absichern.
Dosierung und Einnahmeempfehlung von Vitamin K
Bei Osteoporose werden in der Mikronährstoffmedizin zwischen 60 und 240 Mikrogramm Vitamin K pro Tag eingesetzt – idealerweise als Vitamin K2 (MK-7). Zum Teil wurden in Studien sogar deutlich höhere Dosierungen verwendet. Eine hohe Dosierung sollte jedoch nur unter ärztlicher Kontrolle erfolgen.
Da Vitamin K ein fettlösliches Vitamin ist, ist die Einnahme zum Essen wichtig: Das Fett aus den Lebensmitteln sorgt für eine gute Aufnahme im Darm.
Info
Calcium, Vitamin D und Vitamin K2 kombinieren: Hoch dosiertes Calcium und Vitamin D könnten das Risiko für Arterienverkalkung steigern. Denn Calcium kann fälschlicherweise in die Blutgefäße eingelagert werden statt in die Knochen. Es gibt aber zahlreiche Studien, welche die Sicherheit der hier empfohlenen Dosierungen belegen. Um zusätzlich sicherzugehen, sollten Calcium und Vitamin D mit Vitamin K2 kombiniert werden: Vitamin K2 bewirkt, dass sich Calcium in die Knochen einlagert. Weitere Studien müssen dazu aber noch Ergebnisse liefern.
Vitamin K: zu beachten bei Medikamenteneinnahme
Vitamin K kann in Wechselwirkung mit bestimmten Blutverdünnern treten. Hierzu zählen sogenannte Vitamin-K-Antagonisten mit den Wirkstoffen Phenprocoumon (wie Marcumar®, Falithrom® und Marcuphen®) sowie Warfarin (Coumadin®). Wenn Sie auf diese Medikamente angewiesen sind, müssen Sie vor der Einnahme von Vitamin K2 Rücksprache mit dem Arzt halten – eine Einnahme kann möglich sein. Was es aber zu beachten gibt, erfahren Sie im Text zu Vitamin K.
Knochendichte erhöhen – weitere Mineralstoffe?
Wirkweise von Magnesium, Bor, Mangan, Kupfer und Zink
Neben Calcium ist in der Mikronährstoffmedizin bei Osteoporose eine Basisabsicherung mit weiteren Mineralstoffen wichtig. Sie unterstützen die Knochengesundheit auf unterschiedliche Weise.
Der Körper braucht Magnesium, um Vitamin D zu aktivieren, zu speichern und zu transportieren. Ein Magnesiummangel trägt zur Entstehung von Osteoporose bei, was einige Beobachtungsstudien zeigen. Umgekehrt senkt Magnesium laut einer großen Beobachtungsstudie das Risiko für einen Knochenbruch bei Osteoporose.
Bor senkte in einer ersten Studie bei Osteoporose Calciumverluste über die Nieren. Daneben ist es wichtig, damit der Körper Vitamin D bilden kann: In einer Vorstudie bekamen Teilnehmer nach einer borarmen Phase Bor. Der Vitamin-D-Spiegel stieg um fast 40 Prozent. Bei Tieren erhöhte Bor außerdem die Knochenmasse und wirkte dem Knochenschwund entgegen.
Darüber hinaus zeigte eine Vorstudie mit Frauen in den Wechseljahren, dass die kombinierte Einnahme von Mangan, Kupfer und Zink zusammen mit Calcium wirksamer war, um den Abbau von Knochenmasse zu verzögern, im Vergleich zu Calcium allein. Positive Ergebnisse gibt es jeweils auch für Zink und Kupfer. Vor allem Frauen ab 50 Jahren mit einer geringen Knochendichte haben vermutlich niedrige Manganspiegel.
Dosierung und Einnahmeempfehlung von Magnesium, Bor, Mangan, Kupfer und Zink
Die Mineralstoffe Magnesium, Bor, Mangan, Kupfer und Zink sollten grundsätzlich als basische Formen eingenommen werden – also als Citrate. Sie gelangen schneller ins Blut. Zudem könnten sie einer Übersäuerung vorbeugen.
Folgende Dosierungen sind bei Osteoporose empfehlenswert:
- 150 bis 250 Milligramm Magnesium
- 2 bis 3 Milligramm Bor
- 2 bis 5 Milligramm Mangan
- 1 bis 3 Milligramm Kupfer
- 5 bis 15 Milligramm Zink
Für eine bessere Magenverträglichkeit sollten die Mineralstoffe zum Essen ergänzt werden. Nimmt man Osteoporose-Medikamente (Bisphosphonate wie Fosamax®), muss ein Abstand von zwei bis drei Stunden dazwischen liegen.
Magnesium im Labor bestimmen lassen
Die Magnesiumwerte sollten bei Osteoporose im optimalen Bereich liegen. Zu hohe und zu niedrige Werte schädigen den Knochen. Magnesium kommt im Körper hauptsächlich in der Zelle vor. Deshalb sollte der Arzt es am besten im Vollblut bestimmen. Die Normalwerte im Vollblut liegen zwischen 1,38 und 1,5 Millimol pro Liter.
Mineralstoffe: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei einer Nierenschwäche oder anderen Nierenerkrankungen können Mineralstoffe häufig nicht normal ausgeschieden werden. Sie sollten deshalb nicht eingenommen werden.
Bei einer Schilddrüsenunterfunktion sollte Bor nur in Rücksprache mit dem Arzt genommen werden. Eine hohe Boraufnahme könnte die Kropfbildung fördern. Daneben könnte Bor die Insulinwirkung verbessern. Diabetiker, die Medikamente nehmen, sollten deshalb die Blutzuckerwerte engmaschig prüfen, um Unterzuckerungen zu vermeiden.
Bei schweren Leber- und Gallenerkrankungen sollte Mangan nicht ergänzt werden. Eine kranke Leber hat Probleme, Mangan zu verstoffwechseln und auszuscheiden. Arbeiter in der Industrie (wie Stahl, Keramik, Leder) sind möglicherweise mit Mangan belastet und sollten es nicht zusätzlich aufnehmen.
Bei Nervenkrankheiten wie Alzheimer und Parkinson sollten ohne ärztlichen Rat kein Mangan und Kupfer eingenommen werden. Eine dauerhafte Überversorgung könnte am Krankheitsprozess beteiligt sein.
Personen mit der seltenen Kupferspeicherkrankheit (Morbus Wilson) dürfen kein Kupfer ergänzen. Die Kupferausscheidung ist bei dieser Erkrankung gestört.
Zink und Magnesium können bestimmte Antibiotika binden, was sie unwirksam macht. Deshalb empfiehlt sich ein Abstand von mindestens zwei Stunden zwischen der Einnahme. Dazu gehören Gyrasehemmer, zum Beispiel Ciprofloxacin (wie Ciloxan®, Ciprobay®), Enoxacin (wie Enoxor®), Levofloxacin (wie Tavanic®) und Moxifloxacin (wie Avalox®), sowie Tetracykline, zum Beispiel Tetracyclin (wie Achromycin®, Supramycin®), Doxycyclin (wie Supracyclin®, Vibramycin®) und Minocyclin (wie Aknosan®, Skinocyclin®). Betroffen sind auch Chelatbildner wie Penicillamin (Metalcaptase®).
Wechseljahre: Knochen im Alter stärken mit Soja und Rotklee für Frauen
Wirkweise von Isoflavonen
Der Östrogenmangel in den Wechseljahren führt bei Frauen zu einem verstärkten Abbau der Knochen. Pflanzliche Isoflavone aus Soja oder Rotklee können dem entgegenwirken, denn sie entfalten im Körper eine ähnliche Wirkung wie Östrogene: Isoflavone aktivieren Östrogen-Rezeptoren und fördern die Einlagerung von Calcium in die Knochen. Daher könnten sie die knochenschützende Wirkung des Östrogens nach den Wechseljahren teilweise ersetzen.
Übersichtsarbeiten zeigen, dass die Einnahme von Soja-Isoflavonen die Abnahme der Knochendichte bei Frauen nach den Wechseljahren verlangsamen kann. Auch könnte sich die Knochendichte erhöhen. Dies bestätigt eine weitere Auswertung: Die Teilnehmerinnen nahmen zwischen 47 und 150 Milligramm Isoflavone aus Soja über einen Zeitraum von sechs bis zwölf Monaten zu sich.
Die knochenschützenden Wirkungen der Isoflavone sind vielversprechend, müssen jedoch durch weitere hochwertige Studien bestätigt werden. Es ist zum Beispiel noch unklar, ob die Wirkung für alle Frauen und Knochen gleich ist und wie die ideale Dosierung lautet.
Dosierung und Einnahmeempfehlung von Isoflavonen
Mikronährstoff-Experten empfehlen bei Osteoporose besonders für Frauen in den Wechseljahren eine tägliche Dosierung von 35 bis 90 Milligramm Isoflavonen, beispielsweise aus Soja oder Rotklee. Kapseln mit Isoflavonen sollten zusammen mit einer Mahlzeit eingenommen werden. So ist die Verträglichkeit besser als auf leeren Magen.
Tipp
Hochwertige Präparate enthalten Isoflavone aus Soja- oder Rotklee-Extrakt. Bei einem Extrakt ist die Menge an Isoflavonen genau angegeben. Bei einem Pulver oder Sojabohnen können die Gehalte jedoch schwanken, sodass nie genau bekannt ist, wie viel Isoflavone eingenommen werden.
Isoflavone: zu beachten bei Erkrankungen und Medikamenteneinnahme
Frauen, die Brustkrebs hatten, sollten keine Isoflavone einnehmen: Isoflavone haben eine ähnliche Wirkung wie Östrogen und könnten das Rückfallrisiko für hormonabhängige Krebsformen erhöhen. Bei einer erblichen Veranlagung für solche Erkrankungen sollte ein Arzt gefragt werden.
Isoflavone reduzieren die Wirkung von Antiöstrogenen wie die des Krebsmittels Tamoxifen (Kessar®, Mandofen®, Nolvadex®, Tamokadin®). Daher sind Isoflavone in diesem Fall nicht geeignet.
Soja-Isoflavone können zudem die Aufnahme von Schilddrüsenmedikamenten mit L-Thyroxin (wie L-Thyroxin Henning®) aus dem Darm beeinträchtigen und die Wirksamkeit vermindern. In Rücksprache mit dem Arzt könnte deshalb eine Anpassung der Medikamentendosierung nötig sein.
Homocystein mit B-Vitaminen senken, bevor es Knochen schädigt
Wirkweise von B-Vitaminen
Homocystein ist ein Zellgift. Es schädigt nicht nur die Gefäßwände, sondern auch die Knochen: Hohe Homocysteinwerte im Blut stehen in Zusammenhang mit mehr Knochenbrüchen bei Osteoporose. Der genaue Mechanismus ist jedoch noch nicht geklärt.
In einer großen Beobachtungsstudie haben Wissenschaftler die Höhe der Homocysteinwerte mit dem Risiko für Brüche des Hüftknochens verglichen: Bei den höchsten Werten war das Risiko für Männer fast viermal und für Frauen fast doppelt so hoch im Vergleich zu den niedrigsten Homocysteinwerten. Andere Forscher fanden in Übersichtsarbeiten zwar keinen Zusammenhang mit Homocystein, jedoch mit geringen Folsäurewerten. Allerdings könnten zu hohe Vitamin-B12-Werte auch negativ wirken.
Um Homocystein abzubauen, braucht der Körper Folsäure, Vitamin B2, B6 und B12. Ihr Knochenschutz wird von einer hochwertigen Studie untermauert: Osteoporose-Betroffene, die Vitamin B12 und Folsäure ergänzten, hatten ein geringeres Risiko für Brüche des Hüftgelenks. Ob die Einnahme von B-Vitaminen die Knochendichte erhöht, ist aber strittig: In einer hochwertigen Studie profitierten nur Frauen über 80, welche die Vitamine regelmäßig eingenommen hatten. In anderen Studien wurde kein Effekt festgestellt. Forscher vermuten, dass eine langfristige Versorgung mit B-Vitaminen sowie die Ausgangsversorgung ausschlaggebend sind. Daher sollte kein Mangel vorliegen.
Dosierung und Einnahmeempfehlung bei einem erhöhten Homocysteinspiegel
Um für den Abbau von Homocystein gut mit B-Vitaminen versorgt zu sein, empfehlen Mikronährstoff-Experten die tägliche Einnahme von:
- 1 bis 3 Milligramm Vitamin B2
- 2 bis 3 Milligramm Vitamin B6
- 200 bis 400 Mikrogramm Folsäure als 5-Methyltetrahydrofolat (5-MTHF)
- 5 bis 10 Mikrogramm Vitamin B12 als Methylcobalamin
Sind die Homocysteinwerte bereits erhöht, verordnen Experten für einen festgelegten Zeitraum höhere Dosierungen. Alles darüber erfahren Sie hier.
B-Vitamine sollten am besten zu den Mahlzeiten eingenommen werden, da sie auf nüchternen Magen weniger gut verträglich sein können.
Tipp
Manche Menschen haben eine genetische Veränderung und können Folsäure nicht gut aktivieren. Frauen mit dieser Genveränderung haben ein höheres Risiko, an Osteoporose zu erkranken. Daher sollte Folsäure als aktives 5-Methyltetrahydrofolat (5-MTHF) eingenommen werden. Dadurch lässt sich die genetische Veränderung umgehen.
Homocysteinspiegel im Labor bestimmen lassen
Da erhöhtes Homocystein die Knochen zusätzlich schädigen kann, sollte bei Osteoporose der Homocysteinwert kontrolliert werden. Der Wert gibt indirekt Auskunft über die Versorgung mit B-Vitaminen. Homocystein wird im Blutplasma bestimmt, also im flüssigen Teil des Blutes ohne Blutzellen. Die Werte sollten zwischen 5 und 9 Mikromol pro Liter liegen.
B-Vitamine: zu beachten in der Schwangerschaft und Stillzeit sowie bei Erkrankungen und Medikamenteneinnahme
Die Dosis der Vitamine B2, B6 und B12 sollte während der Schwangerschaft und Stillzeit mit dem Frauenarzt abgestimmt werden.
Nierenpatienten sollten bei Vitamin B12 den Arzt fragen: Sie könnten zu hohe Blutwerte haben. Außerdem sollten sie Vitamin B12 nicht in Form von Cyanocobalamin ergänzen. Es ist für Nierenpatienten vermutlich hoch dosiert schädlich.
Folsäure kann die Wirkung von Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®) hemmen.
Dosierungen bei Osteoporose auf einen Blick
Empfehlung am Tag bei Osteoporose | |
|---|---|
Vitamine | |
Vitamin D | 800 bis 2.000 Internationale Einheiten (IE) |
Vitamin K2 | 60 bis 240 Mikrogramm (µg) |
Vitamin B2 | 1 bis 3 Milligramm (mg) |
Vitamin B6 | 5 bis 15 Milligramm |
Folsäure | 200 bis 400 Mikrogramm als 5-Methyltetrahydrofolat (5-MTHF) |
Vitamin B12 | 5 bis 10 Mikrogramm als Methylcobalamin |
Mineralstoffe | |
Calcium | 700 bis 1.200 Milligramm |
Magnesium | 150 bis 250 Milligramm |
Bor | 2 bis 3 Milligramm |
Mangan | 2 bis 5 Milligramm |
Kupfer | 1 bis 3 Milligramm |
Zink | 5 bis 15 Milligramm |
Pflanzenstoffe | |
Isoflavone | 35 bis 90 Milligramm |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Laboruntersuchungen bei Osteoporose | |
|---|---|
Normalwerte | |
Calcium Plasma 24-h-Urin |
2,2 und 2,65 Millimol pro Liter (mmol/l) Männer: unter 7,5 Millimol Frauen: unter 6,2 Millimol |
Vitamin D | 40 bis 60 Nanogramm pro Milliliter (ng/ml) |
Homocystein | 5 und 9 Mikromol pro Liter (µmol/l) |
Unterstützung von Osteoporose-Medikamenten mit Mikronährstoffen
Vitamin K2 und D verbessern die Wirkung von Bisphosphonaten
Erste Studien zeigen, dass Bisphosphonate bei der Behandlung von Osteoporose besser wirken, wenn sie mit Vitamin K2 kombiniert werden. Das gilt besonders für Personen mit einem Vitamin-K-Mangel. Empfohlen werden zwischen 50 und 200 Mikrogramm Vitamin K2 pro Tag begleitend zu Bisphosphonaten. Dazu zählen beispielsweise Alendronat (wie Fosamax®), Ibandronat (wie Bonviva®) oder Risedronat (wie Actonel®).
Auch Vitamin D unterstützt die Wirkung der Bisphosphonate und kann eventuell Nebenwirkungen reduzieren. Zwar bremsen Bisphosphonate den Knochenabbau, können als Nebenwirkungen jedoch gesunde Knochen an den Zähnen angreifen (Kiefernekrose) und zu niedrigen Calciumspiegeln führen. Laut einer großen Beobachtungsstudie mit Frauen in den Wechseljahren ist eine ausreichende Versorgung mit Vitamin D notwendig, um die positiven Wirkungen der Medikamente auf die Knochendichte bei Osteoporose sicherzustellen.
Mikronährstoff-Experten empfehlen daher bei einer Bisphosphonat-Therapie die Einnahme von 60 bis 100 Mikrogramm Vitamin K2, 1.000 bis 2.000 Internationale Einheiten Vitamin D sowie 500 Milligramm Calcium pro Tag. Bei Calcium ist ein Einnahmeabstand von mindestens zwei Stunden wichtig.
Info
Die in der Osteoporose-Therapie eingesetzten Bisphosphonate enthalten oft Vitamin D. Es ist hier jedoch meistens zu gering dosiert – zum Beispiel 2.800 Internationale Einheiten pro Woche (oder 400 Internationale Einheiten auf den Tag heruntergerechnet). Mikronährstoff-Experten empfehlen deshalb zusätzliches Vitamin D. Die Vitamin-D-Menge in den Bisphosphonat-Tabletten muss jedoch bei der Gesamtdosis berücksichtigt werden.
Dosierungen auf einen Blick
Empfehlung der Mikronährstoffmedizin am Tag bei Medikamenten | |
|---|---|
Vitamin K2 | 60 bis 100 Mikrogramm (µg) |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten (IE) |
Calcium | 500 Milligramm (mg) |

Zusammenfassung
Bei Osteoporose ist der Knochenstoffwechsel gestört, sodass die Knochensubstanz schneller abgebaut wird als dem Alter entspricht. Die Mikronährstoffmedizin kann dazu beitragen, die Knochensubstanz bei Osteoporose zu verbessern. Calcium ist der wichtigste Baustoff der Knochen. Vitamin D wird benötigt, damit ausreichend Calcium aus dem Darm aufgenommen werden kann. Wichtig ist zudem Vitamin K2, das die Einlagerung von Calcium an den richtigen Stellen fördert – nämlich in den Knochen. Weitere wichtige Mineralstoffe für die Knochen sind Magnesium, Bor, Mangan, Kupfer und Zink.
Besonders häufig von Osteoporose betroffen sind Frauen in den Wechseljahren. Dafür sind sinkende Östrogenspiegel verantwortlich. Isoflavone haben eine ähnliche Wirkung wie Östrogen und können die Knochendichte stärken. B-Vitamine inklusive Folsäure tragen außerdem dazu bei, die Homocysteinwerte zu senken. Hohes Homocystein schädigt vermutlich die Knochen.
Vitamin D, Vitamin K2 und Calcium können außerdem die Wirkung von Osteoporose-Medikamenten (Bisphosphonaten) unterstützen. Mikronährstoff-Experten empfehlen deshalb die begleitende Einnahme. Wichtig ist allerdings ein Einnahmeabstand zwischen Bisphosphonaten und Calcium.
Verzeichnis der Studien und Quellen
Aller, R. et al. (2004): Effects of a high-fiber diet on symptoms of irritable bowel syndrome: a randomized clinical trial. Nutrition 2004; 20: 735–737. https://www.ncbi.nlm.nih.gov/pubmed/15325678, abgerufen am: 08.05.2018.
Ärzte Zeitung (Hrsg.) (2011): Bisphosphonat-Therapie: Da muss der Vitamin-D-Spiegel stimmen. Online-Veröffentlichung. https://www.aerztezeitung.de/medizin/krankheiten/skelett_und_weichteilkrankheiten/osteoporose/article/659161/bisphosphonat-therapie-muss-vitamin-d-spiegel-stimmen.html, abgerufen am 06.08.2018.
Atmaca, A. et al. (2008): Soy isoflavones in the management of postmenopausal osteoporosis. Menopause. 2008 Jul-Aug;15(4 Pt 1):748-57. https://www.ncbi.nlm.nih.gov/pubmed/18277912, abgerufen am 06.08.2018.
AWMF online (2017): Leitlinie des Dachverbands der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e.V. https://register.awmf.org/assets/guidelines/183-001l_S3_Osteoporose-Prophylaxe-Diagnostik-Therapie_2019-02.pdf, abgerufen am 30.06.2023.
Baranska, A. et al. (2022): The Role of Soy Isoflavones in the Prevention of Bone Loss in Postmenopausal Women: A Systematic Review with Meta-Analysis of Randomized Controlled Trials. J Clin Med. 2022 Aug 10;11(16):4676. https://pubmed.ncbi.nlm.nih.gov/36012916/, abgerufen am 30.06.2023.
Baranska, A. et al. (2022): The Role of Soy Isoflavones in the Prevention of Bone Loss in Postmenopausal Women: A Systematic Review with Meta-Analysis of Randomized Controlled Trials. J Clin Med. 2022 Aug; 11(16): 4676. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9409780/, abgerufen am 30.06.2023.
Biesalski, H. K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H. K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Bundesverband deutscher Internisten e. V. (Hrsg.) (2018) Osteoporose: Therapie. Online-Veröffentlichung. https://www.internisten-im-netz.de/krankheiten/osteoporose/therapie.html, abgerufen am 06.08.2018.
Candelas, G. et al. (2012): Calcium supplementation and kidney stone risk in osteoporosis: a systematic literature. Clin Exp Rheumatol. 2012 Nov-Dec;30(6):954-61. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3775240/#__sec4title, abgerufen am 06.08.2018.
Castiglioni, S. et al. (2013): Magnesium and Osteoporosis: Current State of Knowledge and Future Research Directions. Nutrients. 2013 Aug; 5(8): 3022–3033. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3775240/#__sec4title, abgerufen am 06.08.2018.
Charoenngam, N. et al. (2019): Vitamin D for skeletal and non-skeletal health: What we should know. J Clin Orthop Trauma. 2019 Nov-Dec; 10(6): 1082–1093. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6834997/, abgerufen am 30.06.2023.
Chung, M. et al. (2016): Calcium Intake and Cardiovascular Disease Risk: An Updated Systematic Review and Meta-analysis. Ann Intern Med. 2016 Dec 20;165(12):856-866. https://www.ncbi.nlm.nih.gov/pubmed/27776363, abgerufen am 06.08.2018.
Cockayne, S. et al. (2006): Vitamin K and the prevention of fractures: systematic review and meta-analysis of randomized controlled trials. Arch Intern Med. 166(12):1256-1261. https://www.ncbi.nlm.nih.gov/pubmed/16801507, abgerufen am 23.06.2017.
Dachverband Osteologie e.V. (2014): DVO Leitlinie Osteoporose 2014 Kurzfassung und Langfassung. Online-Veröffentlichung. http://www.dv-osteologie.org/uploads/Leitlinie%202014/DVO-Leitlinie%20Osteoporose%202014%20Kurzfassung%20und%20Langfassung%20Version%201a%2012%2001%202016.pdf, abgerufen am 06.08.2018.
Dessordi, R. et al. (2017): Boron supplementation improves bone health of non-obese diabetic mice. J Trace Elem Med Biol. 2017 Jan;39:169-175. https://www.ncbi.nlm.nih.gov/pubmed/27908411, abgerufen am 06.08.2018.
Domke, A. et al. (2004): Verwendung von Mineralstoffen in Lebensmitteln – Toxikologische und ernährungsphysiologische Aspekte. BfR-Wissenschaft 04/2004. https://www.bfr.bund.de/cm/350/verwendung_von_mineralstoffen_in_lebensmitteln_bfr_wissenschaft_4_2004.pdf, abgerufen am 06.08.2018.
Duan, B. L. et al. (2020): Determination of vitamin D and analysis of risk factors for osteoporosis in patients with chronic pain. World J Clin Cases. 2020 Jun 6; 8(11): 2150–2161. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7281063/, abgerufen am 30.06.2023.
Eleni, A. & Panagiotis, P. (2020): A systematic review and meta-analysis of vitamin D and calcium in preventing osteoporotic fractures. Clin Rheumatol. 2020 Dec;39(12):3571-3579. https://pubmed.ncbi.nlm.nih.gov/32447604/, abgerufen am 30.06.2023.
Enneman, A. et al. (2015): Effect of Vitamin B12 and Folic Acid Supplementation on Bone Mineral Density and Quantitative Ultrasound Parameters in Older People with an Elevated Plasma Homocysteine Level: B-PROOF, a Randomized Controlled Trial. Calcif Tissue Int. 2015; 96(5): 401–409. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4415946/, abgerufen am 06.08.2018.
European Food Safety Authority (Hrsg.) (2015): Isoflavone in Nahrungsergänzungsmitteln für Frauen nach der Menopause: kein Hinweis auf schädliche Wirkung. Online-Veröffentlichung. http://www.efsa.europa.eu/de/press/news/151021, abgerufen am 06.08.2018.
Fassbender, W. et al. (2016): Supplement: Perspektiven der Diabetologie Diabetes und Osteoporose: Verzweigtes Zusammenwirken. Dtsch Arztebl 2016; 113(43). https://www.aerzteblatt.de/archiv/183173/Diabetes-und-Osteoporose-Verzweigtes-Zusammenwirken, abgerufen am 06.08.2018.
Fusaro, M. et al. (2017): Vitamin K and bone. Clin Cases Miner Bone Metab. 2017 May-Aug; 14(2): 200–206. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5726210/, abgerufen am 06.08.2018.
Gerhard, I. (2016): Osteoporose und Brustkrebs Prävention und Therapie mit Vitamin D und K2. gynäkologie + geburtshilfe 2016; 21 (4). https://www.natum.de/files/15013-2016_21_04_i.pdf, abgerufen am 21.03.2018.
Gosch, M. et al. (2018): CME ZertifizierteFortbildung. Management der Osteoporose nach Fragilitätsfrakturen. Z Gerontol Geriat 2018 · 51:113–125. https://doi.org/10.1007/s00391-017-1355-7, abgerufen am 21.03.2018.
Gröber, U. (2007): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 3. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2011): Arzneimittel – Mikronährstoffe Bisphosphonate und Vitamin D3. Deutsche Apotheker Zeitung, 10/2011, Online-Veröffentlichung. https://www.deutsche-apotheker-zeitung.de/daz-az/2011/daz-10-2011/bisphosphonate-und-vitamin-d3, abgerufen am 06.08.2018.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Groenendijk, I. et al. (2022): Impact of magnesium on bone health in older adults: A systematic review and meta-analysis. Bone. 2022 Jan;154:116233. https://pubmed.ncbi.nlm.nih.gov/34666201/, abgerufen am 30.06.2023.
Haghighi, H. et al. (2013): Calcium and vitamin D supplementation and risk of kidney stone formation in postmenopausal women. Iran J Kidney Dis. 2013 May 21;7(3):210-3. https://www.ncbi.nlm.nih.gov/pubmed/23689153, abgerufen am 06.08.2018.
Heyde, I. et al. (2013): Fragen aus der Praxis: Verordnungsfähigkeit von Calcium und Vitamin D3. Deutsche Apotheker Zeitung 12/2013, Online-Veröffentlichung. https://www.deutsche-apotheker-zeitung.de/daz-az/2013/daz-12-2013/verordnungsfaehigkeit-von-calcium-und-vitamin-d3, abgerufen am 06.08.2018.
Hu, L. et al. (2021): The combined effect of vitamin K and calcium on bone mineral density in humans: a meta-analysis of randomized controlled trials. Review J Orthop Surg Res. 2021 Oct 14;16(1):592. https://pubmed.ncbi.nlm.nih.gov/34649591/, abgerufen am 30.06.2023.
Huang, Y. (2018): Combined treatment of vitamin K and teriparatide on bone metabolism and biomechanics in rats with osteoporosis. Exp Ther Med. 2018 Jan; 15(1): 315–319. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5768059/, abgerufen am 06.08.2018.
Ilesanmi-Oyelere B. L. & Kruger, M.C. (2023): B vitamins and homocysteine as determinants of bone health: A literature review of human studies. J Hum Nutr Diet. 2023 Jun;36(3):1031-1044. https://pubmed.ncbi.nlm.nih.gov/36056551/, abgerufen am 30.06.2023.
Inaba, S. et al. (2015): Low-Dose Daily Intake of Vitamin K(2) (Menaquinone-7) Improves Osteocalcin γ-Carboxylation: A Double-Blind, Randomized Controlled Trials. J Nutr Sci Vitaminol (Tokyo). 2015;61(6):471-80. https://www.ncbi.nlm.nih.gov/pubmed/26875489, abgerufen am 06.08.2018.
Inoue, T. et al. (2001): Inverse correlation between the changes of lumbar bone mineral density and serum undercarboxylated osteocalcin after vitamin K2 (menatetrenone) treatment in children treated with glucocorticoid and alfacalcidol. Endocr J. 48(1):11-8. https://www.ncbi.nlm.nih.gov/pubmed/11403096, abgerufen am 23.06.2017.
Iwamoto, J. (2003): Combined treatment with vitamin k2 and bisphosphonate in postmenopausal women with osteoporosis. Yonsei Med J. 2003 Oct 30;44(5):751-6. https://www.ncbi.nlm.nih.gov/pubmed/14584089, abgerufen am 06.08.2018.
Iwamoto, J. (2014): Vitamin K2 Therapy for Postmenopausal Osteoporosis. Nutrients. 2014 May; 6(5): 1971–1980. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4042573/, abgerufen am 06.08.2018.
Johri, N. et al. (2017): Vitamin D deficiency is prevalent among idiopathic stone formers, but does correction pose any risk? Urolithiasis. 2017 Dec;45(6):535-543. https://www.ncbi.nlm.nih.gov/pubmed/27981376, abgerufen am 06.08.2018.
Kaats, G. R. et al. (2016): A 7-Year Longitudinal Trial of the Safety and Efficacy of a Vitamin/Mineral Enhanced Plant-Sourced Calcium Supplement. J Am Coll Nutr. 2016;35(2):91-9. https://www.ncbi.nlm.nih.gov/pubmed/26885697, abgerufen am 06.08.2018.
Kim J. K. et al. (2021): Cardiovascular risks associated with calcium supplementation in patients with osteoporosis: a nationwide cohort study. European Heart Journal - Cardiovascular Pharmacotherapy, 2022 Sep 3;8(6):568-577. https://academic.oup.com/ehjcvp/article-abstract/8/6/568/6318367, abgerufen am 15.07.2023.
Knapen, M.H. et al. (2013): Three-year low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women. Osteoporos Int. 24(9):2499-507. https://www.ncbi.nlm.nih.gov/pubmed/23525894, abgerufen am 23.06.2017.
Koitaya, N. et al. (2014): Low-dose vitamin K2 (MK-4) supplementation for 12 months improves bone metabolism and prevents forearm bone loss in postmenopausal Japanese women. J Bone Miner Metab. 32(2):142-50. https://www.ncbi.nlm.nih.gov/pubmed/23702931, abgerufen am 23.06.2017.
Kozyrakis, D. et al. (2017): Do Calcium Supplements Predispose to Urolithiasis? Curr Urol Rep. 2017 Mar;18(3):17. https://www.ncbi.nlm.nih.gov/pubmed/28233226, abgerufen am 06.08.2018.
Lehmann, L. et al. (2017): Isoflavonhaltige Nahrungsergänzungsmittel. Leitthema Bundesgesundheitsbl 2017 · 60:305–313. https://doi.org/10.1007/s00103-016-2497-2, abgerufen am 21.3.2018.
Li, Z. et al. (2021): Vitamin B6 as a novel risk biomarker of fractured ankles. Medicine 100(40):p e27442, October 08, 2021. https://journals.lww.com/md-journal/fulltext/2021/10080/vitamin_b6_as_a_novel_risk_biomarker_of_fractured.35.aspx#, abgerufen am 22.06.2023.
Lutsey, P. L. (2013): Vitamin D, Calcium, and Atherosclerotic Risk: Evidence from serum levels and supplementation studies. Curr Atheroscler Rep. 2013 Jan; 15(1): 293.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3531793/, abgerufen am 30.06.2023.
Ma, M. L. et al. (2022): Efficacy of vitamin K2 in the prevention and treatment of postmenopausal osteoporosis: A systematic review and meta-analysis of randomized controlled trials. Front Public Health. 2022 Aug 11;10:979649. https://pubmed.ncbi.nlm.nih.gov/36033779/, abgerufen am 30.06.2023
Ma, M.L. et al. (2022): Efficacy of vitamin K2 in the prevention and treatment of postmenopausal osteoporosis: A systematic review and meta-analysis of randomized controlled trials. Front Public Health. 2022; 10: 979649. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9403798/, abgerufen am 30.06.2023.
Manoj, P. et al. (2022): What is the impact of daily oral supplementation of vitamin D3 (cholecalciferol) plus calcium on the incidence of hip fracture in older people? A systematic review and meta-analysis. Int J Older People Nurs. 2023 Jan;18(1):e12492. https://pubmed.ncbi.nlm.nih.gov/35842938/, abgerufen am 30.06.2023.
Maresz, K. (2015): Proper Calcium Use: Vitamin K2 as a Promoter of Bone and Cardiovascular Health. Integr Med (Encinitas). 14(1):34-9. https://www.ncbi.nlm.nih.gov/pubmed/26770129, abgerufen am 23.06.2017.
Mayo, B. et al. (2019): Equol: A Bacterial Metabolite from The Daidzein Isoflavone and Its Presumed Beneficial Health Effects. Nutrients. 2019 Sep; 11(9): 2231. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6770660/, abgerufen am 30.06.2023.
McLean, R. R. et al. (2004): Homocysteine as a predictive factor for hip fracture in older persons. N Engl J Med. 2004 May 13;350(20):2042-9. https://www.ncbi.nlm.nih.gov/pubmed/15141042, abgerufen am 06.08.2018.
Meyer, H. et al. (2019): Association of High Intakes of Vitamins B6 and B12 From Food and Supplements With Risk of Hip Fracture Among Postmenopausal Women in the Nurses’ Health Study. JAMA Netw Open. 2019;2(5):e193591. https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2733176, abgerufen am 22.06.2023.
Meyer, H.E. et al. (2019): Association of High Intakes of Vitamins B6 and B12 From Food and Supplements With Risk of Hip Fracture Among Postmenopausal Women in the Nurses' Health Study. JAMA Netw Open. 2019 May 3;2(5):e193591. https://pubmed.ncbi.nlm.nih.gov/31074816/, abgerufen am 22.06.2023.
Michael, W. et al. (2020): An Evidence-Based Review of Vitamin D for Common and High-Mortality Conditions. The Journal of the American Board of Family Medicine December 2022, 35 (6) 1217-1229. https://www.jabfm.org/content/35/6/1217.long, abgerufen am 30.06.2023.
Nakano, M. et al. (2021): Zinc Pharmacotherapy for Elderly Osteoporotic Patients with Zinc Deficiency in a Clinical Setting. Nutrients. 2021 Jun; 13(6): 1814. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8229639/, abgerufen am 30.06.2023.
Narvaez, J. et al. (2020): Vitamin D Megadose: Definition, Efficacy in Bone Metabolism, Risk of Falls and Fractures. Open Access Rheumatol. 2020; 12: 105–115. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7295536/, abgerufen am 30.06.2023.
Oregon State University (Hrsg.) (2018): Manganese. Online-Veröffentlichung. http://lpi.oregonstate.edu/mic/minerals/manganese#osteoporosis-prevention, abgerufen am 06.08.2018.
Perez-Lopez, F.R. et al. (2012): EMAS position statement: Vitamin D and postmenopausal health. Maturitas Volume 71, Issue 1, January 2012, Pages 83-88. https://www.sciencedirect.com/science/article/abs/pii/S0378512211003653, abgerufen am 30.06.2023.
Pizzorno, L. (2015): Nothing Boring About Boron. Integr Med (Encinitas). 2015 Aug; 14(4): 35–48. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4712861/, abgerufen am 06.08.2018.
Prentice, R. L. et al. (2013): Health risks and benefits from calcium and vitamin D supplementation: Women's Health Initiative clinical trial and cohort study. Osteoporosis International Feb 2013, 24(2), pp 567–580. https://www.ncbi.nlm.nih.gov/pubmed/23208074, abgerufen am 06.08.2018.
Ralston, S. H. et al. (2011): Randomized trial of alendronate plus vitamin D3 versus standard care in osteoporotic postmenopausal women with vitamin D insufficiency. Calcif Tissue Int. 2011 Jun;88(6):485-94. https://www.ncbi.nlm.nih.gov/pubmed/21479913, abgerufen am 06.08.2018.
Rondanelli, M. et al. (2020): Pivotal role of boron supplementation on bone health: A narrative review. J Trace Elem Med Biol. 2020 Dec;62:126577. https://pubmed.ncbi.nlm.nih.gov/32540741/, abgerufen am 30.06.2023.
Rondanelli, M. et al. (2021): Copper as Dietary Supplement for Bone Metabolism: A Review. Nutrients. 2021 Jul; 13(7): 2246. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8308383/, abgerufen am 30.06.2023.
Rønn, S. H. et al. (2016): Vitamin K2 (menaquinone-7) prevents age-related deterioration of trabecular bone microarchitecture at the tibia in postmenopausal women. Eur J Endocrinol. 2016 Dec;175(6):541-549. https://www.ncbi.nlm.nih.gov/pubmed/27625301, abgerufen am 06.08.2018.
Salma. et al. (2022): Effect of Vitamin K on Bone Mineral Density and Fracture Risk in Adults: Systematic Review and Meta-Analysis. Biomedicines. 2022 May 1;10(5):1048. https://pubmed.ncbi.nlm.nih.gov/35625785/, abgerufen am 30.06.2023.
Sansai, K. et al. (2020): Effects of isoflavone interventions on bone mineral density in postmenopausal women: a systematic review and meta-analysis of randomized controlled trials. Osteoporos Int. 2020 Oct;31(10):1853-1864. https://pubmed.ncbi.nlm.nih.gov/32524173/, abgerufen am 30.06.2023.
Scheiber, M.D. et al. (1999): Isoflavones and postmenopausal bone health: a viable alternative to estrogen therapy? Menopause. 1999 Fall;6(3):233-41. https://www.ncbi.nlm.nih.gov/pubmed/10486794, abgerufen am 06.08.2018.
Shin, C. & Kim, K. (2015): The Risks and Benefits of Calcium Supplementation. Endocrinol Metab (Seoul) 2015 Mar; 30(1): 27–34. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4384676/, abgerufen am 06.08.2018.
Smith, L.M. et al. (2017): Medium doses of daily vitamin D decrease falls and higher doses of daily vitamin D3 increase falls: A randomized clinical trial. J Steroid Biochem Mol Biol. 2017 Oct;173:317-322. https://pubmed.ncbi.nlm.nih.gov/28323044/, abgerufen am 22.06.2023.
Sorensen, M.D. (2014): Calcium intake and urinary stone disease. Transl Androl Urol. 2014 Sep;3(3):235-40. doi: 10.3978/j.issn.2223-4683.2014.06.05. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4708574/, abgerufen am 06.08.2018.
Stiftung für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2018): Osteoporose. Online-Information: https://www.gesundheitsinformation.de/osteoporose.2610.de.html, abgerufen am 06.08.2018.
Suzuki, K. et al. (2013): Clinical results of alendronate monotherapy and combined therapy with menatetrenone (VitK₂) in postmenopausal RA patients. Mod Rheumatol. 2013 May;23(3):450-5. https://www.ncbi.nlm.nih.gov/pubmed/22692649, abgerufen am 06.08.2018.
Taku, K. et al. (2010): Effect of soy isoflavone extract supplements on bone mineral density in menopausal women: meta-analysis of randomized controlled trials. Asia Pac J Clin Nutr. 2010;19(1):33-42. https://www.ncbi.nlm.nih.gov/pubmed/20199985, abgerufen am 06.08.2018.
Toker, H. et al. (2016): The effect of boron on alveolar bone loss in osteoporotic rats. Journal of Dental Sciences 11(3), September 2016, Pages 331-337. https://www.sciencedirect.com/science/article/pii/S1991790216300198, abgerufen am 06.08.2018.
Uwitonze, A.M. et al. (2018): Role of Magnesium in Vitamin D Activation and Function. The Journal of the American Osteopathic Association, March 2018, Vol. 118, 181-189. https://www.ncbi.nlm.nih.gov/pubmed/29480918, abgerufen am 06.08.2018.
Van Wijngaarden, J.P. et al. (2013): Vitamin B12, folate, homocysteine, and bone health in adults and elderly people: a systematic review with meta-analyses. J Nutr Metab .2013;2013:486186. https://pubmed.ncbi.nlm.nih.gov/23509616/, abgerufen am 22.06.2023.
Veronese, N. et al. (2017): Dietary magnesium intake and fracture risk: data from a large prospective study. Br J Nutr. 2017 Jun;117(11):1570-1576. https://www.ncbi.nlm.nih.gov/pubmed/28631583, abgerufen am 06.08.2018.
Voulgaridou, G. et al. (2023): Vitamin D and Calcium in Osteoporosis, and the Role of Bone Turnover Markers: A Narrative Review of Recent Data from RCTs. Diseases 2023, 11(1), 29. https://www.mdpi.com/2079-9721/11/1/29, abgerufen am 30.06.2023.
Wallace, R.B. et al. (2011): Urinary tract stone occurrence in the Women's Health Initiative (WHI) randomized clinical trial of calcium and vitamin D supplements. Am J Clin Nutr. 2011 Jul;94(1):270-7. https://www.ncbi.nlm.nih.gov/pubmed/21525191, abgerufen am 06.08.2018.
Wang, C. et al. (2022): Relationship between blood manganese and bone mineral density and bone mineral content in adults: A population-based cross-sectional study. PLoS One. 2022 Oct 21;17(10):e0276551. https://pubmed.ncbi.nlm.nih.gov/36269752/, abgerufen am 30.06.2023.
Wang, J. et al. (2018): Vitamin D in Vascular Calcification: A Double-Edged Sword? Nutrients. 2018 May; 10(5): 652. Published online 2018 May 22. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5986531/, abgerufen am 30.06.2023.
Weaver, C.M. et al. (2016): Calcium plus vitamin D supplementation and risk of fractures: an updated meta-analysis from the National Osteoporosis Foundation. Osteoporos Int. 2016 Jan;27(1):367-76. https://www.ncbi.nlm.nih.gov/pubmed/26510847, abgerufen am 06.08.2018.
Wei, F. L. et al. (2022): Association Between Vitamin D Supplementation and Fall Prevention. Front Endocrinol (Lausanne). 2022 Aug 10;13:919839. https://pubmed.ncbi.nlm.nih.gov/36034418/, abgerufen am 30.06.2023.
Wei, P. et al. (2012): Systematic review of soy isoflavone supplements on osteoporosis in women. Asian Pac J Trop Med. 2012 Mar;5(3):243-8. https://www.ncbi.nlm.nih.gov/pubmed/22305793, abgerufen am 06.08.2018.
Williams, C. et al. (2001): Why oral calcium supplements may reduce renal stone disease: report of a clinical pilot study. J Clin Pathol. 2001 Jan; 54(1): 54–62. https://www.ncbi.nlm.nih.gov/pubmed/11271790, abgerufen am 06.08.2018.
Wuttke, W. et al. (2002): Phytoöstrogene – eine Alternative zur Standardhormonersatztherapie? Gynäkologe 2002, 35:1007–1020. https://doi.org/10.1007/s00129-002-1270-9, abgerufen am 21.02.2018.
Xiao, Q. et al. (2022): L-shaped association of serum 25-hydroxyvitamin D concentrations with cardiovascular and all-cause mortality in individuals with osteoarthritis: results from the NHANES database prospective cohort study. BMC Med. 2022 Sep 21;20(1):308. https://pubmed.ncbi.nlm.nih.gov/36127705/, abgerufen am 30.06.2023.
Zhang, H. et al. (2014): Association of homocysteine, vitamin B12, and folate with bone mineral density in postmenopausal women: a meta-analysis. Arch Gynecol Obstet. 2014 May;289(5):1003-9. https://pubmed.ncbi.nlm.nih.gov/24193243/, abgerufen am 22.06.2023.
Zhang, Y. et al. (2020): Effect of Low-Dose Vitamin K2 Supplementation on Bone Mineral Density in Middle-Aged and Elderly Chinese: A Randomized Controlled Study. Calcif Tissue Int. 2020 May;106(5):476-485. https://pubmed.ncbi.nlm.nih.gov/32060566/, abgerufen am 30.06.2023.
Zhao, F. et al. (2021): Correlation of oxidative stress-related biomarkers with postmenopausal osteoporosis: a systematic review and meta-analysis. Arch Osteoporos. 2021 Jan 5;16(1):4. https://pubmed.ncbi.nlm.nih.gov/33400044/, abgerufen am 30.06.2023.
Zheng, X. et al. (2016): Soy Isoflavones and Osteoporotic Bone Loss: A Review with an Emphasis on Modulation of Bone Remodeling. J Med Food. 2016 Jan 1; 19(1): 1–14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4717511/, abgerufen am 06.08.2018.