Darmparasiten greifen den Darm an und rauben Nährstoffe. Unbehandelt können sie den Körper schwächen. Darmparasiten sind behandelbar, allerdings ist es oft schwierig, die Parasiten vollständig aus dem Körper zu entfernen. Die Mikronährstoffmedizin leistet einen wertvollen Beitrag zur unterstützenden Behandlung. Erfahren Sie hier, welche Mikronährstoffe zum Einsatz kommen und wie sie richtig angewendet werden.

Ursachen und Symptome bei Darmparasiten
Arten und Übertragungswege
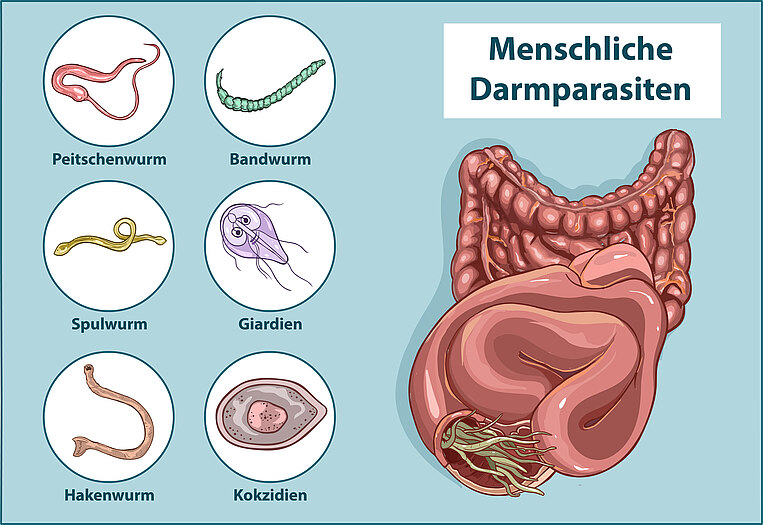
Darmparasiten leben und vermehren sich im Darm ihres Wirts. Zu Parasiten zählen verschiedene Würmer und einzellige Lebewesen (Protozoen). Bei Würmern im Darm unterscheidet man drei Gruppen:
- Rundwürmer wie Spulwürmer, Madenwürmer, Peitschenwürmer, Fadenwürmer und Hakenwürmer
- Saugwürmer wie Egel
- Bandwürmer wie der Fuchsbandwurm und Schweinefinnenbandwurm
Zu den einzelligen Darmparasiten gehören beispielsweise Amöben, Kryptosporidien und Blastocystis. Zudem kommen Giardien-Arten wie Lamblien häufig vor.
Die Ursache für Parasiten im Darm ist meist mangelnde Hygiene sowie infizierte Lebensmittel. Auch über Haustiere, verunreinigte Gegenstände und durch sexuelle Kontakte ist eine Übertragung möglich. Manche Wurmeier können auch eingeatmet werden. Darmparasiten sind also ansteckend. Oft infiziert man sich beim Reisen in Ländern mit mangelhaften Hygienestandards.
Info
Darmparasiten beim Menschen sind ein weltweites Problem. Die Weltgesundheitsorganisation (WHO) schätzt, dass im Jahr 2018 1,5 Billionen Menschen von Wurmerkrankungen betroffen waren. Darunter sind vor allem Menschen, die in tropischen Ländern und Armut leben. Aber auch in Europa treten Wurmerkrankungen auf. Durch die besseren hygienischen Bedingungen ist eine Infektion jedoch generell seltener.
Parasiten im Darm – Symptome
Würmer im Darm können sich über lange Zeit still verhalten und keine Symptome auslösen.
Kommt es zu Symptomen, zeigen sie sich meist im Magen-Darm-Trakt: Durchfall, Verstopfung, Erbrechen, Blähungen und Bauchschmerzen deuten auf einen Parasitenbefall hin. Auch ein Gewichtsverlust, Fieber und Darmentzündungen können auftreten. Madenwürmer verursachen zudem starken Juckreiz und Entzündungen im Analbereich. Unbehandelt können die Parasiten den Dickdarm befallen und bei Frauen zu Infektionen im Genitalbereich führen. Manche Darmparasiten wandern über die Lunge, dann kommt es zu Reizhusten oder Bronchitis. Andere Parasiten können auch das Blut erreichen und Organe befallen.
Weitere Symptome von Parasiten im Darm sind Gereiztheit, Nervosität, Schlafprobleme und Heißhunger ohne Gewichtszunahme. Darüber hinaus geben sie Abfallstoffe ab: Diese belasten das Immunsystem und Organe, die für die Entgiftung notwendig sind – beispielsweise die Leber. Auch die Milz und Lungen können durch Darmparasiten angegriffen werden. Im schlimmsten Fall kann die Infektion tödlich enden, wenn sie nicht behandelt wird.
Darmparasiten bei Menschen sind in jedem Alter gefährlich und müssen sorgfältig behandelt werden, weil man sich und die Umgebung sonst immer wieder ansteckt.
Wurmeier und Würmer im Stuhl erkennen
Einige Würmer kann man im Stuhl direkt erkennen, wie Madenwürmer oder Fadenwürmer. Sie sind weiß, die Größe ist sehr variabel und reicht von einigen Millimetern bis zu einem halben Meter. Viele Würmer bewegen sich im Stuhl. Da sie manchmal schwer zu sehen sind, wäscht der Fachmann in einem Sieb den Stuhl weg, und kann dann die Wurmart bestimmen. Auch einen Bandwurm kann man im Stuhl erkennen. Er zerfällt am Ende zu kleinen rechteckigen Bändern oder Segmenten, die Wurmeier enthalten. Viele Wurmeier im Stuhl sieht man nicht, dazu braucht der Experte ein Mikroskop.
Ziele der Behandlung
Darmparasiten mit Medikamenten behandeln
Eine Infektion mit Würmern wird mit Anti-Wurmmitteln (Antihelminthika) behandelt. Zum Einsatz kommen zum Beispiel Medikamente mit den Wirkstoffen Mebendazol (Vermox®), Pyrvinium (Molevac®, Pyrcon®) und Pyrantel (Helmex®). Die Mittel gegen Würmer bewirken bereits nach einmaliger Anwendung, dass die Parasiten über den Stuhl ausgeschieden werden. Da die Darmparasiten möglicherweise Eier hinterlassen haben, wird die Einnahme nach 14 bis 28 Tagen meist wiederholt. Ziel ist es, eine erneute Infektion zu vermeiden.
Zur Behandlung von einzelligen Darmparasiten werden zusätzlich zu den Anti-Wurmmitteln Antibiotika eingesetzt. Häufig verwendete Medikamente enthalten Metronidazol (zum Beispiel Arilin®, Clont®) und Paromomycin (Humatin®).
Info
Bislang gibt es keine Impfstoffe gegen Parasiten im Darm. Zu den wichtigsten Maßnahmen zur Vorbeugung gehören hygienische Maßnahmen wie regelmäßiges Händewaschen und das heiße Waschen von Bettwäsche und Kleidung von infizierten Personen, da Würmer im Darm ansteckend sind.
Ziele der Mikronährstoffmedizin
Mikronährstoffe unterstützen die Darmparasiten-Behandlung mit Medikamenten. Bestimmte Vitamine und Mineralstoffe stärken das Immunsystem. Ein starkes Immunsystem unterstützt wiederum die Bekämpfung der Parasiten. Zudem können bestimmte Stoffe die Darmflora wiederherstellen und stärken sowie die Schäden beheben. Einige Pflanzenstoffe aus Ingwer oder Nelke helfen außerdem, die Ansiedlung von Würmern oder einzelligen Parasiten im Darm zu bremsen, weil sie ihren Stoffwechsel stören.
Darmparasiten können eine schlechte Vitamin- und Mineralstoffversorgung bewirken. Zum einen nutzen sie die Vitamine selbst, zum anderen führt Durchfall zu Nährstoffverlusten. Ziel der Mikronährstoffmedizin ist es daher auch, einen Mangel nach der medikamentösen Therapie zu vermeiden. Meist empfehlen Mikronährstoff-Experten ein Nahrungsergänzungsmittel zur Basisabsicherung.
Bewährt haben sich besonders:
- Probiotika schützen vor Darmparasiten.
- Ballaststoffe fördern den Aufbau der Darmflora.
- Nelke, Thymian, Curcumin, Grüntee und Ingwer unterstützen die Beseitigung der Darmparasiten-
- Quercetin lindert Entzündungen im Darm.
- B-Vitamine helfen beim Wiederaufbau der Darmschleimhaut.
- Zink ist wichtig für ein funktionierendes Immunsystem.
Behandlung mit Mikronährstoffen
Probiotika: Schutzschirm gegen Parasiten im Darm
Wirkweise von Probiotika
Probiotika enthalten lebende Mikroorganismen, meist Bakterien. Sie entfalten gesundheitsfördernde Wirkungen: Probiotika beeinflussen die Zusammensetzung der Darmflora (Mikrobiota) und stärken das Immunsystem, sodass der Körper vor Parasiten besser geschützt ist. Probiotika verhindern auch, dass sich Parasiten im Darm anheften können. Daneben produzieren Probiotika abwehrende Substanzen.
Studien zeigen:
- Die Zusammensetzung der Darmflora ändert sich durch Parasiten im Darm.
- Die Darmflora kann das Ausmaß des Parasitenbefalls und die Entzündung im Darm beeinflussen. Labor- und Tierstudien bestätigen die Annahme, dass einige probiotische Bakterien das Wachstum und die Entwicklung von Einzellern (zum Beispiel Giardien) und Würmern hemmen. Probiotika könnten daher Symptome lindern und die Behandlung unterstützen.
- Die Darmflora scheint das Risiko eines Parasitenbefalls maßgeblich zu beeinflussen – so die Ergebnisse von Beobachtungsstudien. Forscher vermuten daher, dass sich Probiotika auch für die Vorbeugung eignen. In anderen Studien war jedoch kein Effekt sichtbar.
Ob Probiotika bei Menschen mit Darmparasiten helfen, kann derzeit noch nicht gesagt werden: Es liegen bereits erste Studien vor, die dafür sprechen, dass probiotische Bakterien die Dauer der Symptome verkürzen und zum Wiederaufbau einer gesunden Darmflora beitragen. Daher sind sie unterstützend zu einer fachgerechten Parasitentherapie einen Versuch wert. Große Studien fehlen aber noch.
Dosierung und Einnahmeempfehlung von Probiotika
Bei Darmparasiten empfehlen Mikronährstoff-Experten die Einnahme probiotischer Nahrungsergänzungsmittel mit mindestens einer Milliarde (1 x 109) Bakterien. Sind in dem Präparat weniger enthalten, kommen möglicherweise nicht genug lebende Bakterien im Darm an. Meist beträgt die Dosierung daher 10 bis 15 Milliarden (10 x 109 bis 15 x 109) Bakterien.
Zudem raten Mikronährstoff-Experten zu einem Präparat, das möglichst viele verschiedene Bakterienarten enthält: Nach derzeitigem Kenntnisstand ist die Überlebenswahrscheinlichkeit im Darm so am größten. In den ersten Untersuchungen an Tieren schnitten Laktobazillen, Bifidobakterien, Enterokokken und Hefen positiv ab.
Probiotische Präparate sollten idealerweise mit einer leichten Mahlzeit eingenommen werden – zum Beispiel Obst. Als Pulver können sie in Wasser oder Joghurt eingerührt werden. Probiotika sind zudem als Kapseln erhältlich. Achten Sie dann darauf, dass die Kapseln magensäureresistent sind.
Probiotika: zu beachten in der Schwangerschaft, bei Erkrankungen und Antibiotika
Bei Bluthochdruck in der Schwangerschaft sind Probiotika zu wenig getestet. Sie könnten die Beschwerden verstärken. In diesem Fall sollte man lieber auf Ballaststoffe ausweichen.
Personen mit einer Histaminintoleranz könnten durch die Einnahme probiotischer Bakterien mit Beschwerden reagieren. Bestimmte Bakterien produzieren Histamin im Darm, darunter Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis, Lactobacillus fermentum, Enterococcus faecium, Enterococcus faecalis und Escherichia coli.
Patienten mit einem stark unterdrücktem Immunsystem oder mit zentralen Venenzugängen (etwa bei Chemotherapie) sollten keine Probiotika ergänzen. Das gilt ebenfalls für Personen mit Herzklappenerkrankungen und dem Kurzdarmsyndrom.
Probiotika sollten nicht gleichzeitig mit Antibiotika eingenommen werden, da Antibiotika die probiotischen Bakterien abtöten würden. Um ihre Wirkung nicht zu beeinträchtigen, halten Sie einen Einnahmeabstand von zwei bis drei Stunden ein.
Darmreinigung mit Ballaststoffen
Wirkweise von Ballaststoffen
Bestimmte Ballaststoffe werden als Präbiotikum bezeichnet, weil sie die Mikrobiota im Darm beeinflussen: Zum Beispiel kommen resistente Stärke, Inulin oder Pektin unverdaut in den Dickdarm. Dort werden sie von den Darmbakterien verstoffwechselt. Dabei entstehen kurzkettige Fettsäuren wie Buttersäure (Butyrat). Säuren sind für bestimmte Darmparasiten schädlich. Zudem ernährt Butyrat die Darmschleimhaut und wirkt entzündungshemmend. Darmparasiten dagegen fördern eine Entzündung.
Ballaststoffe unterstützen damit eine gesunde Darmschleimhaut sowie die Abwehr von Parasiten. Sie verbessern außerdem die Darmbewegung, wodurch die Ausscheidung der Parasiten erleichtert wird. Daneben fördern sie den Wiederaufbau der Darmflora nach dem Parasitenbefall. Das verhindert dauerhafte Beschwerden nach der Infektion.
Im Tierversuch verringerten Ballaststoffe den Befall mit Parasiten wie Kokzidien, Kryptosporidien und Giardien. Ein anderer Tierversuch zeigt, dass sie zudem in der Lage sind, bei einem Befall mit Giardien die Heilung der Darmschleimhaut zu fördern. Zudem siedelten sich mehr Laktobazillen im Darm an – ein Zeichen für eine gesunde Darmflora. Auch kam es zu einer Gewichtszunahme: Die Tiere hatten zuvor durch die Parasiten stark an Gewicht verloren. In einigen wenigen Versuchen gab es allerdings auch ungünstige Effekte mit Ballaststoffen.
Studien am Menschen gibt es bislang keine dazu. Da präbiotische Ballaststoffe wie resistente Stärke aber generell die Darmgesundheit fördern und bei vielen anderen Darmerkrankungen bereits mit Erfolg getestet wurden, könnte sich die Einnahme lohnen – am besten zusammen mit Probiotika.
Dosierung und Einnahmeempfehlung von Ballaststoffen
Zur begleitenden Behandlung bei Darmparasiten empfehlen Mikronährstoff-Experten täglich bis zu 25 Gramm Ballaststoffe, zum Beispiel resistente Stärke. Die Einnahme sollte auf drei bis vier Portionen verteilt werden – beispielsweise morgens, mittags und abends. Resistente Stärke kann entweder in Wasser oder in kalte oder warme Speisen eingerührt werden, zum Beispiel in Joghurt oder in Suppe.
Tipp
Es gibt resistente Stärke vom Typ 1, 2, 3 und 4. Bei Darmparasiten ist die resistente Stärke vom Typ 3 vermutlich am wirksamsten. Resistente Stärke Typ 3 zeigte in Labor-Experimenten die größte Ausbeute an der entzündungshemmenden Buttersäure.

Um Blähungen zu vermeiden, ist es empfehlenswert, die Menge langsam zu steigern: Zu Beginn kann täglich ein Drittel der empfohlenen Tagesmenge (8 Gramm) eingenommen werden. Wird die Menge gut vertragen, kann sie nach vier bis sieben Tagen verdoppelt und später verdreifacht werden.
Resistente Stärke: zu beachten bei Erkrankungen
Bei akuten Entzündungen im Darm (zum Beispiel bei Divertikulitis oder akuten chronisch-entzündlichen Darmentzündungen) sollte die Einnahme von resistenter Stärke mit dem Arzt besprochen werden.
Nelke, Thymian, Ingwer und Co. gegen Würmer?
Wirkweise von Heilpflanzen
Viele Heilpflanzen wie Nelke, Thymian und Ingwer enthalten ätherische Öle (Terpene) und Bitterstoffe. Diese können im Darm helfen, Würmer und einzellige Parasiten zu bekämpfen.
Nelke enthält hauptsächlich das ätherische Öl Eugenol. Eugenol hemmte im Labor das Wachstum einzelliger Darmparasiten wie Giardien und verkürzte deren Lebensdauer. Zudem hinderte der Stoff Würmer wie Nematoden daran, aus ihren Eiern zu schlüpfen.
Thymian enthält das ätherische Öl Thymol, das die Muskeln der Würmer im Darm lähmt. Sie können sich dann nicht „festhalten“ und werden ausgeschieden. Zudem wirkt Thymol entzündungshemmend. Auch bei einzelligen Parasiten (Giardien, Ruhramöben und einigen Leishmanien) hatte Thymian eine Wirkung. Die Daten stammen aus Tierversuchen.
Ingwer ist bei Magen-Darm-Problemen ein bekanntes Hausmittel. Er enthält ätherische Öle und den Bitterstoff Gingerol. In Labor- und Tierversuchen verringerte Ingwer-Extrakt die Anzahl an einzelligen Lamblien. Auch die Darmschleimhaut regenerierte sich. Zudem könnte Ingwer-Extrakt bei der Behandlung des einzelligen Darmparasiten Blastocystis sowie von Bandwürmern, Faden- und Spulwürmern helfen. Das zeigten Labor- oder Tierversuche.
Curcumin wird aus der Gelbwurzel (Kurkuma) gewonnen. Es lindert Entzündungen im Darm und wirkte in Labor- und Tierversuchen gegen Band- und Saugwürmer. Curcumin greift die Oberfläche an, den Stoffwechsel, die Entwicklung der Eier oder macht die Würmer unbeweglich.
Grüntee ist reich an Catechinen wie EGCG. In Laborversuchen verursachten Catechine Schäden an den Energiekraftwerken (Mitochondrien) von Leishmanien oder blockierten Enzyme. Catechine wirkten in Tierversuchen auch gegen viele andere einzellige Parasiten.
Der Einsatz von Bitterstoffen für den Darm hat eine lange Tradition bei Darmparasiten. Allerdings fehlen bislang Studien an Menschen. Zur begleitenden Behandlung kann die Einnahme dennoch einen Versuch wert sein.
Tipp
Knoblauch ist wegen des Geruchs nicht jedermanns Sache. Er ist aber ein wichtiges traditionelles Mittel gegen Parasiten. Die schwefelhaltigen Verbindungen wirkten in Labor und Tierversuchen gegen Würmer und einzellige Parasiten (Giardien, Leishmanien und Trichomonaden).
Dosierung und Einnahmeempfehlung von Heilpflanzen
Zur unterstützenden Behandlung von Parasiten im Darm könnten folgende tägliche Dosierungen sinnvoll sein:
- 250 Milligramm Nelkenpulver
- 300 bis 600 Milligramm Thymian-Extrakt
- 100 bis 300 Milligramm Ingwer-Extrakt
- 100 bis 250 Milligramm Curcumin
- 100 bis 250 Milligramm Grüntee-Extrakt
Um Verdauungsbeschwerden zu vermeiden, empfiehlt sich die Einnahme zu den Mahlzeiten. Es gibt sowohl Präparate mit einem Trocken-Extrakt (Pulver) als auch in flüssiger Form (Öl). Öle dürfen nur verdünnt eingesetzt werden. Vor allem Nelkenpulver und Thymian sollten nur für einige Wochen angewendet werden. Auch dürfen die Heilpflanzen nicht überdosiert werden.
Nelke, Thymian, Curcumin, Ingwer und Grüntee: zu beachten in der Schwangerschaft, Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Schwangere und Stillende sollten kein Curcumin und keine Extrakte oder Pulver aus Nelken, Grüntee oder Thymian einnehmen. Es fehlen Untersuchungen, die eine Unbedenklichkeit belegen. Die Einnahme von Ingwer-Extrakt sollte während der Schwangerschaft und Stillzeit mit dem Arzt abgesprochen sein.
Ingwer und Curcumin regen die Gallensaftbildung an. Dies kann bei bestehenden Gallensteinen zu Koliken führen. Bei Lebererkrankungen sollte ein Arzt gefragt werden, ob Grüntee-Extrakt eingenommen werden kann. In seltenen Fällen können ab 800 Milligramm EGCG die Leberwerte steigen.
Zur Vorsicht sollten Personen mit Herzrhythmusstörungen auf Ingwerpräparate verzichten. In Einzelfällen beobachteten Forscher Herzrhythmusstörungen oder Herz-Kreislauf-Symptome.
Diabetiker sollten bei der Einnahme von Ingwer-Extrakt den Blutzuckerspiegel häufiger messen. Durch Ingwer sprechen die Zellen besser auf Insulin an. Gleiches gilt für Nelke. Bei der Einnahme von Medikamenten könnte in Rücksprache mit dem Arzt auch eine Anpassung der Dosis nötig sein.
Nelkenpulver und Ingwer-Extrakt könnten die Zeit bis zur Blutgerinnung verlängern. Bei Verletzungen bluten die Wunden dann länger. Personen, die an einer Bluterkrankheit (Hämophilie) leiden, sollten die Einnahme mit dem Arzt absprechen.
Die Heilpflanzen beeinflussen möglicherweise Wirkungen von Medikamenten oder ihren Abbau. Sprechen Sie daher eine Einnahme von Pflanzenextrakten mit dem Arzt oder Apotheker ab, wenn Sie Medikamente einnehmen. Weitere Informationen finden Sie auch unter Grüntee, Ingwer und Curcumin.
Quercetin schwächt Entzündungen und oxidativen Stress ab
Wirkweise von Quercetin
Der Pflanzenstoff Quercetin kann durch seine entzündungshemmende Wirkung bei Darmparasiten helfen: Bei einer Darmparasitose kommt es im Darm zu starken Entzündungen und oxidativem Stress. Quercetin ist ein natürliches Antioxidans, das freie Radikale unschädlich macht. Es liegen Hinweise aus Laborversuchen vor, dass Quercetin Schädigungen im Darm und in der Leber, ausgelöst durch die Parasiten, herabsetzen kann. Daneben können höhere Mengen an Quercetin auch das Wachstum vieler Parasiten bremsen.
Studien am Menschen fehlen aber bislang. Aufgrund erster positiver Hinweise könnte sich ein Anwendungsversuch jedoch lohnen.
Expertenwissen
Für die Wirkung von Quercetin gegen Parasiten werden verschiedene Mechanismen diskutiert: Es fängt zum Beispiel das benötigte Eisen ab, stört den Stoffwechsel und schädigt die Erbsubstanz bei Leishmanien. In hoher Dosis wirkt Quercetin auch prooxidativ. Dabei werden bei Leishmanien die Mitochondrien außer Funktion gesetzt. Laborversuche zeigen eine Wirkung auf einzellige Darmparasiten wie Toxoplasma, Babesia, Ruhramöben, Giardien und Leishmanien.
Dosierung und Einnahmeempfehlung von Quercetin
Zur unterstützenden Behandlung von Darmparasiten können zwischen 100 und 200 Milligramm Quercetin pro Tag sinnvoll sein. Quercetin-Kapseln sollten mit den Mahlzeiten eingenommen werden. Dadurch ist Quercetin besser verträglich für den Magen.
Tipp
Oft empfehlen Mikronährstoff-Experten die Kombination mit anderen Antioxidantien – zum Beispiel mit Rutin oder Vitaminen wie Vitamin C.
Quercetin: zu beachten in der Schwangerschaft, Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Schwangere und Stillende sollten auf die Einnahme von Quercetin verzichten. Es fehlen Untersuchungen, die die Unbedenklichkeit belegen.
Bei Nierenerkrankungen sollte Quercetin nur in Absprache mit einem Arzt eingenommen werden. Schwache Nieren können Quercetin nicht gut ausscheiden.
Laut Laborversuchen hemmt Quercetin ein Enzym der Leber, das den Abbau von Medikamenten fördert. Die Einnahme von Quercetin mit Medikamenten sollte daher mit dem Arzt abgesprochen sein. Betroffen sind beispielsweise Benzodiazepine (wie Lorazepam (Tavor®), Calciumkanalblocker (wie Amlodipin (Norvasc®)), Immunsuppressiva (zum Beispiel Azathioprin (Colinsan®)), Statine (wie Simvastatin (Zocor®)) und Antibiotika (wie Gyrasehemmer und Chinolone oder Makrolidantibiotika (wie Claromycin®)). Quercetin sollte außerdem nicht mit dem Herzmedikament Digoxin (Digacin®, Lanicor®) genommen werden.
Auch eine erhöhte Blutungsneigung bei Einnahme von Blutverdünnern wie Phenprocoumon (Marcumar®, Falithrom®) ist vorstellbar, aber nicht bewiesen.
B-Vitamine schützen die Darmschleimhaut bei Wurmerkrankungen
Wirkweise von B-Vitaminen
B-Vitamine fördern die Zellteilung und Regeneration der Darmschleimhaut. Daher können sie bei einem Parasitenbefall zum Wiederaufbau des geschädigten Darms beitragen. Oft liegt bei Darmparasiten allerdings ein Mangel vor: Beobachtungsstudien zeigen, dass Würmer die Nährstoffaufnahme beeinträchtigen (Malabsorption). Sie entziehen dem Körper die Vitamine für ihre eigene Versorgung.
Ein Befall mit Fischbandwürmern führt zum Beispiel zu einem Vitamin-B12-Mangel und kann dadurch eine Blutarmut (Anämie) auslösen. Auch ein Folsäuremangel kann durch Fischbandwürmer begünstigt werden.
Möglicherweise verursachen Lamblien und Madenwürmer öfter Symptome, wenn ein Vitamin-B12-Mangel besteht. Darauf weist eine Beobachtungsstudie hin, in der Forscher Stuhlproben von infizierten Kindern auswerteten. Ein Befall mit Lamblien kann sich durch Blähungen äußern, Madenwürmer können Juckreiz am After verursachen. Kinder mit höheren Vitamin-B12-Werten hatten dagegen keine Beschwerden.
Umgekehrt kann eine allgemeine Mangelernährung die Anfälligkeit für Darmparasiten steigern. Das ergab die Auswertung mehrerer Studien. Insgesamt sollte bei einem Befall mit Darmparasiten auf die Versorgung mit B-Vitaminen geachtet werden, damit langfristig kein Mangel entsteht.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Um einen Mangel zu vermeiden, empfehlen Mikronährstoff-Experten die Einnahme von täglich 15 bis 25 Mikrogramm Vitamin B12 (als Methylcobalamin) und 400 Mikrogramm Folsäure (als direkt verwertbare 5-Methyl-Tetrahydrofolsäure (5-MTHF). Da oft ein kombinierter Mangel an B-Vitaminen vorliegt, ist ein Vitamin-B-Komplex zur Basisabsicherung sinnvoll. Dazu gehören zum Beispiel auch Biotin, Niacin und Pantothensäure.
Da sich Darmparasiten von Vitaminen ernähren, sollte die klassische Therapie im ersten Schritt erfolgen. Vor allem, wenn es um den Ausgleich eines Mangels geht. Andernfalls würde der Parasit „gefüttert“ werden.
B-Vitamine werden am besten zu den Mahlzeiten eingenommen. Das verbessert die Verträglichkeit.
B-Vitamine: zu beachten in der Schwangerschaft, bei Erkrankungen und Medikamenten
Vitamin B12 sollte in der genannten höheren Dosierung während der Schwangerschaft und Stillzeit nur bei einem nachgewiesenen Mangel und nach Absprache mit dem Arzt eingenommen werden.
Personen mit Nierenerkrankungen sollten Vitamin B12 in Form von Methylcobalamin einnehmen, nicht aber als Cyanocobalamin. Es gibt Hinweise darauf, dass Cyanocobalamin in hohen Dosen für Nierenpatienten schädlich ist.
Eine gute Folsäureversorgung kann vor Krebs schützen. Unter bestimmten Bedingungen kann dauerhaft hoch dosierte Folsäure jedoch auch das Fortschreiten von Krebs begünstigen. Daher sollte bei Krebs die Ergänzung von Folsäure über 200 Mikrogramm pro Tag mit dem Arzt abgesprochen sein. Eine Rücksprache gilt bei Krebs auch für Vitamin B12.
Folsäure vermindert die Wirkung bestimmter Antibiotika und sollte deshalb nicht während einer solchen Therapie eingenommen werden. Dazu gehören die Wirkstoffe Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®).
Zink könnte durch bestimmte Darmparasiten bedingten Durchfall lindern
Wirkweise von Zink
Darmparasiten rauben nicht nur Vitamine, sondern auch Mineralstoffe wie Zink. Zink ist wichtig für das Immunsystem. Fehlt es, können Immunzellen schlechter arbeiten. Dann ist die Abwehr geschwächt, sodass sich Darmparasiten leichter ansiedeln können. Ein Zinkmangel stört zudem die Barrierefunktion im Darm und löst Entzündungen aus.
Beobachtungsstudien zeigen, dass ein Befall mit Parasiten zu geringen Zinkwerten im Blut führen kann. Die Parasiten nutzen Zink für ihren eigenen Stoffwechsel. Bei Durchfall geht außerdem Zink verloren. Möglicherweise wird Zink zudem vermehrt verbraucht, da der Körper oxidativen Stress durch die Infektion entgiften muss. Es gibt aber auch Studien, die diese Zusammenhänge nicht bestätigen.
Studien zur Einnahme von Zink bei Parasiteninfektionen liefern ebenfalls widersprüchliche Ergebnisse. Patienten, die Zink ergänzten, litten seltener an Durchfall. Bei einigen Parasiten nahm die Dauer der Infektion ab (zum Beispiel bei Giardien). Allerdings dauerten andere Infektionen länger (zum Beispiel mit Amöben und Spulwürmern). Zink wirkte daher je nach Umständen unterschiedlich.
Um zu klären, ob Zink hilft, sind weitere Studien notwendig. Da Zink für ein gesundes Immunsystem wichtig ist, sollte ein Mangel nach dem Parasitenbefall unbedingt ausgeglichen werden.
Dosierung und Einnahmeempfehlung von Zink
Für ein starkes Immunsystem nach der klassischen Parasiten-Beseitigung empfehlen Mikronährstoff-Experten die Einnahme von 10 bis 15 Milligramm Zink pro Tag.
Bei bestimmten Parasiten (Giardien) verkürzten 20 Milligramm Zink täglich zudem die Infektion. Allerdings war diese Dosierung nicht bei jeder Parasitenart sinnvoll (etwa nicht bei Amöben und Spulwürmern). Hier verlangsamte Zink die Heilung. Deshalb sollte die Einnahme von hoch dosiertem Zink mit dem Arzt besprochen werden.
Zink sollte zu den Mahlzeiten eingenommen werden, da es auf nüchternen Magen weniger gut verträglich ist.

Zink: zu beachten bei Medikamenteneinnahme und Erkrankungen
Zink bindet einige Antibiotika und Medikamente gegen Osteoporose (Bisphosphonate). Dadurch werden sie unwirksam. Betroffen sind zum Beispiel Gyrasehemmer wie Ciprofloxacin (etwa Ciloxan®, Ciprobay®) und Levofloxacin (zum Beispiel Tavanic®) und Bisphosphonate wie Clodronat (zum Beispiel Bonefos®) und Ibandronat (Bondronat®). Halten Sie einen Einnahmeabstand von mindestens zwei Stunden ein.
Schwache Nieren können Zink nur schwer ausscheiden. Bei Nierenerkrankungen sollte auf eine Ergänzung von Zink daher verzichtet werden. Es könnte sich sonst im Körper anreichern.
Bei Nervenerkrankungen wie Parkinson, Alzheimer und amyotropher Lateralsklerose ist der Zinkstoffwechsel verändert. Da man nicht weiß, welche Rolle das spielt, sollte die Einnahme mit dem Arzt besprochen werden. Eine Rücksprache gilt auch bei Krebs.
Dosierungen auf einen Blick
Empfehlung pro Tag bei Darmparasiten | |
|---|---|
Vitamine | |
Vitamin B12 | 25 Mikrogramm (μg) (idealerweise nach der Parasitenbehandlung) |
Folsäure | 400 Mikrogramm (idealerweise nach der Parasitenbehandlung) |
Mineralstoffe | |
Zink | 10 bis 15 Milligramm (mg) (nach ärztlicher Rücksprache) |
Pflanzenstoffe | |
Nelkenpulver | 250 Milligramm |
Thymian-Extrakt | 300 bis 600 Milligramm |
Ingwer-Extrakt | 100 bis 300 Milligramm |
Curcumin | 100 bis 250 Milligramm |
Grüntee-Extrakt | 100 bis 250 Milligramm |
Quercetin | 100 bis 200 Milligramm |
Probiotika und Ballaststoffe | |
Probiotika (mit Laktobazillen, Bifidobakterien, Enterokokken und Hefen) | 10 bis 15 Milliarden (10 x 109 bis 15 x 109) koloniebildende Einheiten (KBE) |
Ballaststoffe wie resistente Stärke | bis zu 25 Gramm (g) |
Zusammenfassung
Darmparasiten wie Würmer oder einzellige Lebewesen können den Darm schädigen und vor allem Magen-Darm-Probleme auslösen. Zudem verursachen die Parasiten oft einen Nährstoffmangel und Folgekrankheiten wie Blutarmut. Ziel der Mikronährstoffmedizin ist es vor allem, diesen Mangel auszugleichen. Zudem gibt es Stoffe, die die klassische Therapie unterstützen.
Probiotika können die Darmflora nach einem Parasitenbefall wiederaufbauen. Aus dem Ballaststoff resistente Stärke bilden Darmbakterien entzündungshemmende Fettsäuren. Auch der Pflanzenstoff Quercetin hilft, die Entzündung der Darmschleimhaut zu lindern. Ätherische Öle aus Nelke, Thymian, Curcumin, Grüntee und Ingwer sind traditionelle Heilmittel zur unterstützenden Behandlung von Darmparasiten. Ihre Wirkungen sind vielversprechend, müssen aber noch durch hochwertige Studien bestätigt werden.
Nach einer überstandenen Parasiteninfektion helfen B-Vitamine, den Nährstoffmangel auszugleichen. Zink reduziert möglicherweise Durchfall und gleicht einen Zinkmangel aus. Die Einnahme ist aber nur bei bestimmten Parasiten in Rücksprache mit dem Arzt sinnvoll.
Verzeichnis der Studien und Quellen
Abadi Amare Reda (2018): Probiotics for the Control of Helminth Zoonosis. J Vet Med. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5831688/, abgerufen am: 21.02.2020.
Abdel-Ghaffar, F. et al. (2011): The effects of different plant extracts on intestinal cestodes and on trematodes. Parasitol Res 2011 Apr:108:979-84. https://www.ncbi.nlm.nih.gov/pubmed/21107861, abgerufen am 16.08.2019.
Abdel-Hafeez, E. et al. (2015): In vivo antiprotozoan effects of garlic (Allium sativum) and ginger (Zingiber officinale) extracts on experimentally infected mice with Blastocystis spp. Parasitol Res 2015 Sep:114:3439-44. https://www.ncbi.nlm.nih.gov/pubmed/26085068, abgerufen am 16.08.2019.
Abdel-Rahman, F. et al. (2013): Nematicidal activity of terpenoids. J Environ Sci Health B 2013:48:16-22. https://www.ncbi.nlm.nih.gov/pubmed/23030436, abgerufen am 16.08.2019.
Aboulaila, M. et al. (2010): Inhibitory effects of (-)-epigallocatechin-3-gallate from green tea on the growth of Babesia parasites. Parasitology 2010 Apr;137(5):785-91 https://pubmed.ncbi.nlm.nih.gov/20025823/, abgerufen am 05.05.2021.
Adhyapak, M. & Kachole, M. (2016): Investigation of adverse effects of interactions between herbal drugs and natural blood clotting mechanism. J Thromb Thorombolysis 2016 May:41:644-7. https://www.ncbi.nlm.nih.gov/pubmed/26340850, abgerufen am 16.08.2019.
Alkazmi, L.M. et al. (2020): Syzygium aromaticum L. (Myrtaceae): Traditional Uses, Bioactive Chemical Constituents, Pharmacological and Toxicological Activities. Biomolecules 2020 Feb;10(2):202. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7072209/, abgerufen am 12.05.2021.
Al-Megrin et al. (2021): Preventive role of probiotic bacteria against gastrointestinal diseases in mice caused by Giardia lamblia. Biosci Rep 2021 Feb 26;41(2):BSR20204114. https://pubmed.ncbi.nlm.nih.gov/33600560/, abgerufen am 12.05.2021.
Allen, P.C. et al. (1997): Interaction of dietary flaxseed with coccidia infections in chickens. Poult Sci 1997 Jun;76(6):822-7.https://pubmed.ncbi.nlm.nih.gov/9181614/, abgerufen am 12.0.2021.
Allen, P.C. et al. (2000): Effects of nutritionally balanced and stabilized flaxmeal-based diets on Eimeria tenella infections in chickens. Poult Sci 2000 Apr;79(4):489-92 https://pubmed.ncbi.nlm.nih.gov/10780643/, abgerufen am 05.05.2021.
Amare Reda, A. (2018): Probiotics for the Control of Helminth Zoonosis. J Vet Med 2018 Jan. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5831688/, abgerufen am 14.08.2019.
André, W. et al. (2017): Anthelmintic effect of thymol and thymol acetate on sheep gastrointestinal nematodes and their toxicity in mice. Rev Bras Parasitol Vet 2017 Jul-Sep:26:323-30. https://www.ncbi.nlm.nih.gov/pubmed/28977246, abgerufen 16.08.2019.
AWMF Online (2018): Diagnostik und Therapie der Amöbiasis. https://www.awmf.org/uploads/tx_szleitlinien/042-002l_S1_Amoebiasis_Diagnostik-Therpie_2019-01.pdf, abgerufen am: 21.02.2020.
Basripuzi, H. et al. (2013): Evaluation of enhanced virgin coconut oil and senduduk (Melastoma malabathricum) as anthelmintics against caprine
strongyle nematodes. Tropical Biomedicine 2013 Apr:30:516-25. http://www.msptm.org/files/516_-_525_Basripuzi_HB.pdf, abgerufen am 16.08.2019.
Batiha, G. et al. (2020): Syzygium aromaticum L. (Myrtaceae): Traditional Uses, Bioactive Chemical Constituents, Pharmacological and Toxicological Activities. Biomolecules. 2020 Jan 30;10(2):202. https://pubmed.ncbi.nlm.nih.gov/32019140/, abgerufen am 02.11.2023.
Batiha, G.E. et al. (2020): The Pharmacological Activity, Biochemical Properties, and Pharmacokinetics of the Major Natural Polyphenolic Flavonoid: Quercetin. Foods. 2020 Mar; 9(3): 374. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7143931/, abgerufen am 02.11.2023.
Bazh, E.K.H. et al. (2013): In vitro and in vivo screening of anthelmintic activity of ginger and curcumin on Ascaridia galli. Parasitol Res 2013 Nov;112(11):3679-86. https://pubmed.ncbi.nlm.nih.gov/24046262/, abgerufen am 12.05.2021.
Bellete, B. et al. (2012): Antifungal effect of the essential oil of Thymus broussonetii Boiss endogenous species of Morocco.
Nat Prod Res 2012:26:1692-6. https://www.ncbi.nlm.nih.gov/pubmed/22007627, abgerufen am 16.08.2019.
Birkett, A. et al. (2000): Changes to the quantity and processing of starchy foods in a western diet can increase polysaccharides escaping digestion and improve in vitro fermentation variables. Br J Nutr 2000 Jul:84:63-72. https://www.ncbi.nlm.nih.gov/pubmed/10961162, abgerufen am 16.08.2019.
Braga, P. & Ricci, D. (2011): Thymol-induced alterations in Candida albicans imaged by atomic force microscopy. Methodes Mol Biol 2011:736:401-10. https://www.ncbi.nlm.nih.gov/pubmed/21660740, abgerufen am 16.08.2019.
Burgess, S. et al. (2017): Parasitic Protozoa and Interactions with the Host Intestinal Microbiota. Infect immun 2017 Aug:85:e00101-17. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5520446/, abgerufen am 14.08.2019.
Carter, S. et al. (2021): Natural Products That Target the Arginase in Leishmania Parasites Hold Therapeutic Promise. Microorganisms. 2021 Jan 28;9(2):267. https://pubmed.ncbi.nlm.nih.gov/33525448/, abgerufen am 02.11.2023.
Cummings, J. et al. (1996): Digestion and physiological properties of resistant starch in the human large bowel. Br J Nutr 1996 May:75:733-47. https://www.ncbi.nlm.nih.gov/pubmed/8695600, abgerufen am 16.08.2019.
Da Silva Lima, R. & Block, J. (2019): Coconut oil: what do we really know about it so far? Food Quality and Safety 2019 May:3:61-72. https://academic.oup.com/fqs/article/3/2/61/5475954, abgerufen am 16.08.2019.
De Morais, S. et al. (2014): Thymol and eugenol derivatives as potential antileishmanial agents. Bioorg Med Chem 2014 Nov:22:6250-5. https://www.ncbi.nlm.nih.gov/pubmed/25281268, abgerufen am 16.08.2019.
Depieri Cataneo, A. et al. (2019): Quercetin promotes antipromastigote effect by increasing the ROS production and anti-amastigote by upregulating Nrf2/HO-1 expression, affecting iron availability. Biomedicin & Pharmacotherapy Volume 113 2019 Mar. https://www.sciencedirect.com/science/article/pii/S0753332218365181?via%253Dihub, abgerufen am 15.08.2019.
Dodson, H.C. et al. (2011): Quercetin, a fluorescent bioflavanoid, inhibits Trypanosoma brucei hexokinase 1. Exp Parasitol 2011 Feb;127(2):423-8. https://pubmed.ncbi.nlm.nih.gov/20971104/, abgerufen am 12.05.2021.
Dos Reis, M.B.G. et al. (2013): Inhibition of Leishmania (Leishmania) amazonensis and rat arginases by green tea EGCG, (+)-catechin and (-)-epicatechin: a comparative structural analysis of enzyme-inhibitor interactions. PLoS One 2013 Nov 8;8(11):e78387. https://pubmed.ncbi.nlm.nih.gov/24260115/, abgerufen am 12.05.2021.
Dyab, A. et al. (2016): Anti-giardial therapeutic potential of dichloromethane extracts of Zingiber officinale and Curcuma longa in vitro and in vivo. Parasitol Res 2016 Jul:115:2637-45. https://www.ncbi.nlm.nih.gov/pubmed/26984104, abgerufen am 16.08.2019.
El-Bahy, N.M. et al. (2015): Anthelmintic activity of ginger, curcumin, and praziquentel against Raillietina cesticillus (in vitro and in vivo). Parasitol Res 2015 Jul;114(7):2427-34. https://pubmed.ncbi.nlm.nih.gov/26063529/, abgerufen am 12.05.2021.
El-Kady, A. et al. (2019): Eugenol, a potential schistosomicidal agent with anti-inflammatory and antifibrotic effects against Schistosoma mansoni, induced liver pathology. Infect Drug Resist 2019 Mar:12:709-19. https://www.ncbi.nlm.nih.gov/pubmed/30992676, abgerufen am 16.08.2019.
European Medicines Agency (2011): Assessment report on Syzygium aromaticum (L.) Merill et L.M. Perry, flos and Syzygium aromaticum (L.) Merill et L.M. Perry, floris aetheroleum. Online Portal: https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-syzygium-aromaticum-l-merill-et-lm-perry-flos-syzygium-aromaticum-l-merill_en.pdf, abgerufen am 16.08.2019.
European Medicines Agency (2013): Assessment report on Thymus vulgaris L., vulgaris zygis L., herba. Online Portal: https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-thymus-vulgaris-l-vulgaris-zygis-l-herba_en.pdf, abgerufen am 16.08.2019.
Faixová, D. et al. (2021): Antiparasitic Effects of Selected Isoflavones on Flatworms. Helminthologica 2021 Mar;58(1):1–16. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7912234/, abgerufen am 12.05.2021.
Fekete, E. et al. (2021): Giardia spp. and the Gut Microbiota: Dangerous Liaisons. Front Microbiol 2021 Jan 12;11:618106. https://pubmed.ncbi.nlm.nih.gov/33510729/, abgerufen am 12.05.2021.
Fernanda Fonseca-Silva, Job D. F. Inacio et al. (2011): Reactive Oxygen Species Production and Mitochondrial Dysfunction Contribute to Quercetin Induced Death in Leishmania amazonensis. PLoS One 2011; 6(2): e14666. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3035610/, abgerufen am: 21.02.2020.
Ferreira, L. et al. (2016): Thymus vulgaris L. essential oil and its main component thymol: Anthelmintic effects against Haemonchus contortus from sheep.
Vet Parasitol 2016 Sep:228:70-6. https://www.ncbi.nlm.nih.gov/pubmed/27692335, abgerufen am 16.08.2018.
Flores-Huerta, N. et al. (2018): Flavonoids as a Natural Treatment Against Entamoeba histolytica. Front Cell Infect Microbiol 2018;8:209. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024094/, abgerufen am 12.05.2021.
Fonseca-Silva, F. et al. (2011): Reactive Oxygen Species Production and Mitochondrial Dysfunction Contribute to Quercetin Induced Death in Leishmania amazonensis. PLoS One 2011 Feb:6. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3035610/, abgerufen am 15.08.2019.
Garcia-Bustos, J. et al. (2019): An appraisal of natural products active against parasitic nematodes of animals. Parasit Vectors 2019 Jun:12. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6580475/, abgerufen am 14.08.2019.
Goodman, K. & Salt, W. (1990): Vitamin B12 deficiency. Important new concepts in recognition. Postgrad Med 1990 Sep:88:147-50. https://www.ncbi.nlm.nih.gov/pubmed/2204895, abgerufen am 15.08.2019.
Grazioso, C. et al. (1993): The effect of zinc supplementation on parasitic reinfestation of Guatemalan schoolchildren. Am J Clin Nutr 1993 May:57:673-8. https://www.ncbi.nlm.nih.gov/pubmed/8480685, abgerufen am 15.08.2019.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gusalus, K. et al. (2015): Manipulation of Host Diet To Reduce Gastrointestinal Colonization by the Opportunistic Pathogen Candida albicans. mSphere 2015 Nov:1. https://www.ncbi.nlm.nih.gov/pubmed/27303684, abgerufen am 16.08.2019.
Haddad, M. et al. (2011): Curcuma as a parasiticidal agent: a review. Planta Med 2011 Apr;77(6):672-8. https://pubmed.ncbi.nlm.nih.gov/21104602/, abgerufen am 12.05.2021.
Ibrahim, M. et al. (2017): Impact of Childhood Malnutrition on Host Defense and Infection. Clin Microbiol Rev 2017 Oct:30:919-71. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5608884/, abgerufen am 15.08.2019.
Imperatori, F. et al. (2019): Leishmanicidal activity of green tea leaves and pomegranate peel extracts on L. infantum. Nat Prod Res 2019 Dec;33(24):3465-3471. https://pubmed.ncbi.nlm.nih.gov/29863902/, abgerufen am 12.05.2021.
Inacio, J.D.F. et al. (2013): In vitro and in vivo effects of (-)-epigallocatechin 3-O-gallate on Leishmania amazonensis. J Nat Prod 2013 Oct 25;76(10):1993-6. https://pubmed.ncbi.nlm.nih.gov/24106750/, abgerufen am 12.05.2021.
Inacio, J.D.F. et al. (2019): (-)-Epigallocatechin 3- O-Gallate as a New Approach for the Treatment of Visceral Leishmaniasis. J Nat Prod 2019 Sep 27;82(9):2664-2667. https://pubmed.ncbi.nlm.nih.gov/31503486/, abgerufen am 12.05.2021.
Islamuddin, M. et al. (2016): Immunotherapeutic Potential of Eugenol Emulsion in Experimental Visceral Leishmaniasis. PLoS Negl Trop Dis 2016 Oct:10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5077126/, abgerufen am 16.08.2019.
Jang, S.I. et al. (2007): Anticoccidial effect of green tea-based diets against Eimeria maxima. Vet Parasitol 2007 Mar 15;144(1-2):172-5. https://pubmed.ncbi.nlm.nih.gov/17027157/, abgerufen am 05.05.2021.
Jenkins, D. et al. (1998): Physiological effects of resistant starches on fecal bulk, short chain fatty acids, blood lipids and glycemic index. J Am Coll Nutr 1998 Dec:17:609-16. https://www.ncbi.nlm.nih.gov/pubmed/9853541, abgerufen am 16.08.2019.
Jimenez, J. et al. (2012): Diphyllobothrium pacificum Infection is Seldom Associated with Megaloblastic Anemia. Am J Trop Med Hyg 2012 Nov:87:897-901. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3516266/, abgerufen am 15.08.2019.
Koski, K. & Scott, M. (2001): Gastrointestinal nematodes, nutrition and immunity: breaking the negative spiral. Annu Rev Nutr 2001:21:297-321. https://www.ncbi.nlm.nih.gov/pubmed/11375439, abgerufen am 15.08.2019.
Kronenberger, T. et al. (2013): Targeting the vitamin biosynthesis pathways for the treatment of malaria. Future Med Chem 2013 May:5:769-79. https://www.ncbi.nlm.nih.gov/pubmed/23651091, abgerufen am 15.08.2019.
Landkreis Diepholz (Hrsg.): Merkblatt zum Wurmbefall beim Menschen.
https://www.diepholz.de/medien/dokumente/merkblatt_zu_wurmbefall_beim_menschen.pdf, abgerufen am 02.11.2023.
Leitch, G.J. et al. (1989): Dietary fiber and giardiasis: dietary fiber reduces rate of intestinal infection by Giardia lamblia in the gerbil. Am J Trop Med Hyg 1989 Nov;41(5):512-20. https://pubmed.ncbi.nlm.nih.gov/2554737/, abgerufen am 12.05.2021.
Lin, R.-J. et al. (2010): Larvicidal activities of ginger (Zingiber officinale) against Angiostrongylus cantonensis. Acta Trop Jul-Aug 2010;115(1-2):69-76. https://pubmed.ncbi.nlm.nih.gov/20045669/, abgerufen am 12.05.2021.
Lin, R.-J. et al. (2014): Anthelmintic constituents from ginger (Zingiber officinale) against Hymenolepis nana. Acta Trop 2014 Dec;140:50-60. https://pubmed.ncbi.nlm.nih.gov/25063389/, abgerufen am 12.05.2021.
Long, K. et al. (2007): Effect of vitamin A and zinc supplementation on gastrointestinal parasitic infections among Mexican children. Pediatrics 2007 Oct:120:e846-55. https://www.ncbi.nlm.nih.gov/pubmed/17908741, abgerufen am 15.08.2019.
Machado, M. et al. (2011): Anti-Giardia activity of Syzygium aromaticum essential oil and eugenol: effects on growth, viability,
adherence and ultrastructure. Exp Parasitol 2011 Apr:127:732-9. https://www.ncbi.nlm.nih.gov/pubmed/21272580, abgerufen am 16.08.2019.
Mahluji, S. et al. (2013): Effects of ginger (Zingiber officinale) on plasma glucose level, HbA1c and insulin sensitivity in type 2 diabetic patients. Int J Food Sci Nutr 2013 Sep:64:682-6. https://www.ncbi.nlm.nih.gov/pubmed/23496212, abgerufen am 16.08.2019.
Mendogça-Filho, R. et al. (2004): Leishmanicidal activity of polyphenolic-rich extract from husk fiber of Cocos nucifera Linn. (Palmae). Res Microbiol 2004 Apr:155:136-43. https://www.ncbi.nlm.nih.gov/pubmed/15059625, abgerufen am 16.08.2019.
Martínez-Castillo, M. et al. (2018): Flavonoids as a Natural Treatment Against Entamoeba histolytica. Front Cell Infect Microbiol 2018 Jun:8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024094/, abgerufen am 15.08.2019.
Marwa K. Ibrahim, Mara Zambruni et al. (2017): Impact of Childhood Malnutrition on Host Defense and Infection. Clin Microbiol Rev. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5608884/, abgerufen am: 21.02.2020.
McClemens, J. et al. (2013): Lactobacillus rhamnosus Ingestion Promotes Innate Host Defense in an Enteric Parasitic Infection. Clin Vaccine Immunol 2013 Jun:20:818-26. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3675974/, abgerufen am 19.08.2019.
Mentschel, J. & Claus, R. (2003): Increased butyrate formation in the pig colon by feeding raw potato starch leads to a reduction of
colonocyte apoptosis and a shift to the stem cell compartment. Metabolism 2003 Nov:52:1400-5. https://www.ncbi.nlm.nih.gov/pubmed/14624397, abgerufen am 16.08.2019.
Moghaddas, E. (2019): In Vitro and In Vivo Effectiveness of Carvacrol, Thymol and Linalool against Leishmania infantum. Molecules 2019 Jun;24(11):2072. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6600403/, abgerufen am 12.05.2021.
Mohajeri, M. (2018): Synthesis and In vitro Leishmanicidal Activities of Six Quercetin Derivatives. Adv Biomed Res 2018;7:64. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5952540/, abgerufen am 12.05.2021.
Mohan, R. et al. (2019): Water-soluble polyphenol-rich clove extract lowers pre- and post-prandial blood glucose levels in healthy and prediabetic volunteers: an open label pilot study. BMC Complement Altern Med 2019 May:19. https://www.ncbi.nlm.nih.gov/pubmed/31064377, abgerufen am 16.08.2019.
Müller, I. & Hyde, J. (2013): Folate metabolism in human malaria parasites--75 years on. Mol Biochem Parasitol 2013 Mar:188:63-77. https://www.ncbi.nlm.nih.gov/pubmed/23500968, abgerufen am 15.08.2019.
Muir, J. et al. (2004): Combining wheat bran with resistant starch has more beneficial effects on fecal indexes than
does wheat bran alone. Am J Clin Nutr 2004 Jun:79:1020-8. https://www.ncbi.nlm.nih.gov/pubmed/15159232, abgerufen am 16.08.2019.
Ning, Y. et al. (2015): Synergistic effects of tea catechin epigallocatechin gallate and antimycotics against oral Candida species. Arch Oral Biol 2015 Oct;60(10):1565-70. https://pubmed.ncbi.nlm.nih.gov/26263544/, abgerufen am 12.05.2021.
Nugent, A. (2005): Health properties of resistant starch. Nutrition Bulletin 2005 Feb:30. https://onlinelibrary.wiley.com/doi/full/10.1111/j.1467-3010.2005.00481.x, abgerufen am 16.08.2019.
Olivares, J. et al. (2002): Vitamin B12 and folic acid in children with intestinal parasitic infection. J Am Coll Nutr 2002 Apr:21:109-13. https://www.ncbi.nlm.nih.gov/pubmed/11999537, abgerufen am 15.08.2019.
Pearson, R. (2019): Giardiasis. Online Portal. https://www.msdmanuals.com/de-de/profi/infektionskrankheiten/intestinale-protozoen-und-mikrosporidien/giardiasis, abgerufen am 15.08.2019.
Petkevicius, S. et al. (1999): The effect of increasing levels of insoluble dietary fibre on the establishment and persistence of Oesophagostomum dentatum in pigs. Parasite 1999 Mar;6(1):17-26 https://pubmed.ncbi.nlm.nih.gov/10229933/, abgerufen am 05.05.2021.
Petkevicius, S. et al. (2004): Effects of short-chain fatty acids and lactic acids on survival of Oesophagostomum dentatum in pigs. Vet Parasitol 2004 Aug 6;122(4):293-301. https://pubmed.ncbi.nlm.nih.gov/15262007/, abgerufen am 05.05.2021.
Dashti, N. & Zarebavani, M. (2021): Probiotics in the management of Giardia duodenalis: an update on potential mechanisms and outcomes. Naunyn Schmiedebergs Arch Pharmacol. 2021 Sep;394(9):1869-1878. https://pubmed.ncbi.nlm.nih.gov/34324017/, abgerufen am 02.11.2023.
Rai, M. et al. (2020): Curcumin and curcumin-loaded nanoparticles: antipathogenic and antiparasitic activities. Expert Rev Anti Infect Ther. 2020 Apr;18(4):367-379. https://pubmed.ncbi.nlm.nih.gov/32067524/, abgerufen am 02.11.2023.
Rasooli, I. & Mirmostafa, S. (2003): Bacterial susceptibility to and chemical composition of essential oils from Thymus kotschyanus and Thymus persicus. J Agric Food Chem 2003 Apr:51:2200-5. https://www.ncbi.nlm.nih.gov/pubmed/12670156, abgerufen am 16.08.2019.
Rosado, J. et al. (2009): Interaction of zinc or vitamin A supplementation and specific parasite infections on Mexican infants' growth: a randomized clinical trial. Eur J Clin Nutr 2009 Oct:63:1176-84. https://www.ncbi.nlm.nih.gov/pubmed/19623197, abgerufen am 15.08.2019.
Saini, M et al. (2022): Pyridoxal Kinase of Disease-causing Human Parasites: Structural and Functional Insights to Understand its Role in Drug Discovery. Curr Protein Pept Sci. 2022;23(4):271-289. https://pubmed.ncbi.nlm.nih.gov/35598242/, abgerufen am 02.11.2023.
Schaffner, D.W. et al. (2018): Probiotic Product Enhances Susceptibility of Mice to Cryptosporidiosis. Appl Environ Microbiol 2018 Nov 1;84(21):e01408-18. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6193388/, abgerufen am 12.05.2021.
Schilcher, H. et al. (2016): Leitfaden Phytotherapie. 5. Aufl. Elsevier GmbH München - Jena.
Seleem, D. et al. (2016): In vitro evaluation of antifungal activity of monolaurin against Candida albicans biofilms. PeerJ 2016 Jun. https://www.ncbi.nlm.nih.gov/pubmed/27366648, abgerufen am 16.08.2019.
Shi, H. et al. (1998): Energy restriction and zinc deficiency impair the functions of murine T cells and antigen-presenting cells during gastrointestinal nematode infection. J Nutr 1998 Jan:128:20-7. https://www.ncbi.nlm.nih.gov/pubmed/9430597, abgerufen am 15.08.2019.
Shukla, G. et al. (2016): Prebiotic inulin supplementation modulates the immune response and restores gut morphology in Giardia
duodenalis-infected malnourished mice. Parasitiol Res 2016 Nov;115(11):4189-98. https://www.ncbi.nlm.nih.gov/pubmed/27473837, abgerufen am 16.08.2019.
Soto, J. et al. (2014): The flavonoid (-)-epicatechin affects cytoskeleton proteins and functions in Entamoeba histolytica. J Proteomics 2014 Dec 5;111:74-85. https://pubmed.ncbi.nlm.nih.gov/24887480/, abgerufen am 12.05.2021.
Srinivasan, P. et al. (2016): Household and personal factors are sources of heterogenity in intestinal parasite clearance among Mexican children 6-15 months of age supplemented with vitamin A and zinc. Acta Trop 2016 Apr:156:48-56. https://www.ncbi.nlm.nih.gov/pubmed/26772449, abgerufen am 15.08.2019.
Stacey L. Burgess, Carol A. Gilchrist et al. (2017): Parasitic Protozoa and Interactions with the Host Intestinal Microbiota. Infect Immun 2017 Aug; 85(8): e00101-17. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5520446/, abgerufen am: 21.02.2020.
Topping, D. & Clifton P. (2001): Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides. Physiol Rev 2001 Jul:81:1031-64. https://www.ncbi.nlm.nih.gov/pubmed/11427691, abgerufen am 16.08.2019.
Travers, M. et al. (2011): Probiotics for the Control of Parasites: An Overview. J Parasitol Res 2011 Sep. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3182331/, abgerufen am 19.08.2019.
Veenemans, J. et al. (2011): Protection against Diarrhea Associated with Giardia intestinalis Is Lost with Multi-Nutrient Supplementation: A Study in Tanzanian Children. PLoS Negl Trop Dis 2011 Jun:5. https://www.ncbi.nlm.nih.gov/pubmed/21666789, abgerufen am 15.08.2019.
Verma, A. et al. (2012): Real-time analysis of gut flora in Entamoeba histolytica infected patients of Northern India. BMC Microbiol 2012 Aug. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3534334/, abgerufen am 19.08.2019.
Widjajakusuma, E. et al. (2019): Phytochemical screening and preliminary clinical trials of the aqueous extract mixture of Andrographis
paniculata (Burm. f.) Wall. ex Nees and Syzygium polyanthum (Wight.) Walp leaves in metformin treated patients with type 2 diabetes. Phytomedicine 2019 Mar:55:137-47. https://www.ncbi.nlm.nih.gov/pubmed/30668423, abgerufen am 16.08.2019.
Widmer, G. et. al. (2019): Deprivation of dietary fiber enhances susceptibility of mice to cryptosporidiosis. PLoS Negl Trop Dis 2019 Sep;13(9):e0007411. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6785118/, abgerufen am 12.05.2021.
Williams, A. R. et al. (2021): Emerging interactions between diet, gastrointestinal helminth infection, and the gut microbiota in livestock. BMC Vet Res 2021;17:62. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7845040/, abgerufen am 12.05.2021.
Wils-Plotz, E.L. et al. (2013): Modulation of the intestinal environment, innate immune response, and barrier function by dietary threonine and purified fiber during a coccidiosis challenge in broiler chicks. Poultry Science 2013 Mar 1;92(3):735-45. https://www.sciencedirect.com/science/article/pii/S0032579119395744, abgerufen am: 12.05.2021.
Yones, D. et al. (2015): Effect of enteric parasitic infection on serum trace elements and nutritional status in upper Egyptian children. Trop Parasitol 2015 Jan-Jun:5:29-35. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4326990/, abgerufen am 15.08.2019.