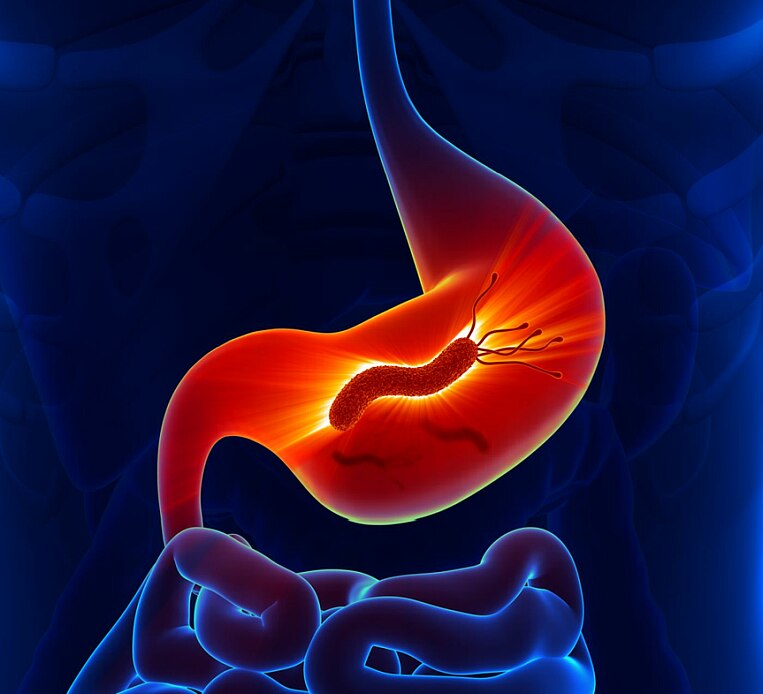
Der Magen ist wegen der Magensäure fast steril. Erstaunlicherweise leben dort ebenfalls Bakterien, wie Helicobacter pylori. Das Bakterium löst oft eine anhaltende (chronische) Magenschleimhautentzündung und Bauchbeschwerden aus. Hier hilft dann nur eine Antibiotika-Therapie, um den Erreger zu vertreiben. Mit Vitaminen, Pflanzenstoffen und Probiotika lässt sich eine solche Eradikationstherapie begleiten und die Gesundheit des Magen-Darm-Traktes fördern.
Tipp
Liegt der Magenschleimhautentzündung (Gastritis) eine andere Ursache zugrunde, schauen Sie in den Text zu „chronische Gastritis“. Dort erfahren Sie alles über Mikronährstoffmedizin bei einer chronischen Gastritis. Zum Beispiel kann man den drohenden Vitaminmangel ausgleichen und die Schleimhaut schützen.
Ursachen und Symptome
Definition: Helicobacter-pylori-Infektion
Das Bakterium Helicobacter pylori kann sich in der Schleimhaut des Magens ansiedeln. Es produziert Ammoniak und Zellgifte, welche die Schleimhaut des Magens zerstören. Diese kann dann das Gewebe nicht mehr vor der Magensäure schützen. Das Bakterium dringt ein, reizt und zerstört das Gewebe noch weiter.
Info
Mithilfe der normalerweise sehr aggressiven Magensäure werden wichtige Inhaltsstoffe aus der Nahrung aufgeschlossen. Die Magenwand wird dabei durch ihre Schleimhaut geschützt. Hat sie ein Loch, wird das eigene Gewebe durch die Magensäure geschädigt.
Das Immunsystem kann die Bakterien nicht erreichen, sodass die Infektion chronisch wird. In Deutschland sind 5 Prozent der Kinder und 24 Prozent der Erwachsenen infiziert. Der Erreger wird von Mensch zu Mensch übertragen – wie genau, ist noch unklar.
Anzeichen einer Infektion mit Helicobacter pylori
Die Infektion kann je nach Bakterienstamm symptomlos sein, aber auch dauerhaft Beschwerden verursachen. Dann kommt es zu einer anhaltenden Entzündung der Magenschleimhaut (chronische Gastritis). Typische Symptome sind Völlegefühl, Appetitlosigkeit und Schmerzen (Brennen und Drücken) hinter dem Brustbein oder Übelkeit. Auch Oberbauchbeschwerden, Aufstoßen und Mundgeruch können Hinweise sein.
Folgeerkrankungen
Wenn eine Infektion mit chronischen Beschwerden nicht behandelt wird, drohen Folgeerkrankungen. Das Bakterium ist an 75 Prozent der Magengeschwüre und an 90 Prozent der Zwölffingerdarmgeschwüre beteiligt. Mögliche Folgen der Infektion mit Helicobacter pylori sind auch sehr selten Magen- oder Lymphdrüsenkrebs (Lymphom).
Daneben diskutieren Wissenschaftler einen Zusammenhang mit Verdauungsstörungen (Dyspepsie) sowie dem Reizdarm- und Leaky-Gut-Syndrom. Nach neuen Erkenntnissen hat Helicobacter pylori auch Einfluss auf die Magen-Darm-Flora (Mikrobiota).
Tipp
Eine Schädigung der Magenschleimhaut kann langfristig einen Vitamin-B12-Mangel begünstigen. Für die Aufnahme von Vitamin B12 im Darm ist ein spezielles Transporteiweiß nötig. Dieses wird im Magen gebildet – allerdings nur, wenn die Zellen der Magenschleimhaut intakt sind.
Ziele der Behandlung
Helicobacter-pylori-Infektion: Behandlung mit Medikamenten
Helicobacter pylori wird nur behandelt, wenn Symptome auftreten. Die Infektion kann in der Regel durch Antibiotika geheilt werden. Dies nennt man „Eradikation“.
Leider haben sich in letzter Zeit viele antibiotikaresistente Helicobacter-Stämme verbreitet. Ein Antibiotikum reicht oft nicht mehr aus. Der Arzt verschreibt deshalb eine Kombinationstherapie aus zwei verschiedenen Antibiotika und einem Magensäureblocker (Protonenpumpenhemmer; PPI). Man nennt dies auch Tripel-Therapie. Sie besteht aus einem PPI, dem Antibiotikum Clarithromycin und einem weiteren Antibiotikum (Metronidazol oder Amoxicillin).
Sollte die Therapie nicht anschlagen, werden andere oder auch vier Wirkstoffe miteinander kombiniert. Eine Alternative ist die sogenannte Bismut-Quadrupeltherapie. Sie kommt bei einer Resistenz gegen Clarithromycin in Betracht und besteht aus einem Magensäureblocker und den antibiotischen Wirkstoffen Tetrazyklin und Metronidazol sowie dem chemischen Element Bismut (auch Wismut genannt).
Die speziellen Präparate, die bei der Eradikationstherapie angewendet werden, enthalten bereits eine Mischung der verschiedenen Wirkstoffe. Beispiele sind OMEP® Plus Amoxicillin+Clarithromycin, Pylera® und ZacPac®.
Ziele der Mikronährstoffmedizin
Die Behandlung einer Helicobacter-Infektion mit Medikamenten ist nicht immer erfolgreich. Deshalb sind Stoffe interessant, die die Bekämpfung des Erregers unterstützen. Die Mikronährstoffmedizin kann dazu einen wichtigen Beitrag leisten.
Bestimmte Vitamine, Probiotika und sekundäre Pflanzenstoffe können die Wirkung der Therapie verstärken. Zum Beispiel machen bestimmte Vitamine Helicobacter pylori empfindlicher, indem sie seine eigenen Schutzmechanismen vor der Magensäure aufheben. Daneben schützen Vitamine und sekundäre Pflanzenstoffe vor weiteren Gewebeschäden im Magen.
Folgende Stoffe haben sich bewährt:
- Vitamin C und E können den Behandlungserfolg steigern.
- Vitamin D könnte die Therapie verbessern.
- Probiotika helfen dabei, Helicobacter pylori zu verdrängen.
- N-Acetylcystein macht die Bakterien empfindlicher gegen Antibiotika.
- Cranberry verringert die Anhaftung an die Schleimhaut.
- Curcumin lindert Bauchbeschwerden und unterstützt die Helicobacter-pylori-Eradikation.
- Flavonoide wirken antioxidativ und schützen den Magen.
Info
Neben den genannten Mikronährstoffen beeinflusst die Ernährung allgemein eine Infektion. Denn eine ungünstige Ernährung kann sich nachteilig auswirken. Beispielsweise zeigen Tierstudien, dass ein hoher Salzkonsum die Besiedelung mit Helicobacter pylori fördert. Auch könnten Menschen, die viel rotes und verarbeitetes Fleisch essen, anfälliger sein: Bestimmte Verbindungen (Nitrosamine), die beispielsweise durch die Magensäure entstehen, fördern das Fortschreiten der Infektion sowie Gewebeschäden. Darüber hinaus wurde eine kohlenhydratreiche und zuckerhaltige Ernährung mit mehr Helicobacter-pylori-Infektionen in Verbindung gebracht. Typische Hausmittel gegen die Infektion sind Ingwer, Knoblauch und Kurkuma.

Behandlung mit Mikronährstoffen
Vitamin C und E können den Behandlungserfolg steigern
Wirkweise von Vitamin C und E
Bei Entzündungen werden viele reaktive Sauerstoffspezies (freie Radikale) freigesetzt. Das belastet die antioxidativen Schutzsysteme. Denn Antioxidantien fangen permanent freie Radikale ab, werden dabei aber verbraucht. Vitamin C und E wirken antioxidativ und unterstützen deshalb die Schutzmechanismen. Auch stärken Vitamin C und E das Immunsystem und lindern Entzündungen.
Im Kampf gegen Helicobacter pylori spielt Vitamin C eine wichtige Rolle: Es macht das Bakterium empfindlicher. Vitamin C trägt dazu bei, den eigenen Säureschutz des Bakteriums abzuschwächen: Helicobacter pylori hat ein spezielles Enzym (Urease), das eine Art giftige Wolke aus Ammoniak um das Bakterium herum produziert. Dadurch wird die Magensäure neutralisiert und das Bakterium kann überleben. Vitamin C hemmt das Enzym und macht Helicobacter pylori angreifbarer.
Beobachtungsstudien zeigen: Menschen mit schlechter Vitamin-C-Versorgung sind anfälliger für Magenerkrankungen. Die Studien zeigen außerdem, dass Menschen mit Helicobacter pylori niedrigere Vitamin-C-Spiegel haben: Forscher vermuten, dass Vitamin C bei Betroffenen schlechter aufgenommen und vermehrt verbraucht wird. Bei einer Vitamin-C-reichen Ernährung kommt es laut Beobachtungsstudien außerdem seltener zu Folgeerkrankungen. Dies betrifft zum Beispiel Magenkrebs. Forscher stellten in zwei Auswertungen der verfügbaren Studien fest, dass die gezielte Einnahme von Vitamin C und Vitamin E den Behandlungserfolg mit Antibiotika verbessern könnte. Unklar aber ist, warum der Effekt nicht in allen Studien gefunden wurde.
Fazit: Auch wenn das Ausmaß der Wirkung noch nicht klar ist, können Vitamin C und E versuchsweise eingesetzt werden, um die Therapie zu unterstützen. Ein Vitamin-C-Mangel sollte bei einer Helicobacter-pylori-Infektion in jedem Fall vermieden werden: Es ist der wichtigste Schutzstoff der Magenschleimhaut.
Vitamin C und E: Dosierung und Einnahmeempfehlung
Mikronährstoff-Experten empfehlen eine Tagesdosis von 500 bis 1.000 Milligramm Vitamin C, um eine Helicobacter-pylori-Eradikationstherapie zu unterstützen. Behandelt wurde in Studien ein bis vier Wochen lang. Am besten nimmt man Vitamin C zweimal täglich ein (jeweils 500 Milligramm).
Zusätzlich können täglich 30 bis 50 Milligramm Vitamin E eingenommen werden. Manchmal empfehlen Ärzte für die Zeit der Therapie auch eine höhere Vitamin-E-Dosierung – zum Beispiel 200 Milligramm. Dies sollte jedoch in jedem Fall in Rücksprache mit dem Arzt erfolgen, da Vitamin E auf Dauer überdosiert werden kann.
Vitamin C lässt sich sehr gut zu den Mahlzeiten einnehmen, aber auch dazwischen. In Verbindung mit einer Mahlzeit ist die Verträglichkeit jedoch besser. Für Vitamin E ist die Einnahme zum Essen in jedem Fall empfehlenswert, da das Vitamin fettlöslich ist und so besser aufgenommen wird.
Tipp
Die Kombination von Vitamin C und E mit dem Antibiotikum Metronidazol ist wenig untersucht. Es kann noch nicht ausgeschlossen werden, dass Vitamin C und E den Erfolg der Behandlung mit Metronidazol beeinträchtigen könnten. Zur Kombination mit Amoxicillin und Clarithromycin liegen bereits positive Daten vor.
Vitamin C: im Labor bestimmen
Bei einer Helicobacter-pylori-Infektion kann es sinnvoll sein, die Vitamin-C-Versorgung zu kontrollieren. Dazu bestimmt der Arzt die Vitamin-C-Menge in den weißen Blutkörperchen (Leukozyten). Der Wert sollte über 25 Mikrogramm pro 100 Millionen Leukozyten liegen. Wird der Vitamin-C-Spiegel im Plasma bestimmt, sollte er über 22 Mikromol pro Liter liegen (optimalerweise über 60).
Vitamin C und E: zu beachten in der Schwangerschaft und Stillzeit bei Erkrankungen und Medikamenteneinnahme
Vitamin C wird für Schwangere bis 110 Milligramm empfohlen und für Stillende bis 150 Milligramm. Höhere Dosen sollte man zur Sicherheit mit dem Arzt absprechen. Mengen bis 1.800 Milligramm pro Tag sind aber wahrscheinlich sicher. Auch sollten Schwangere ohne Rücksprache mit dem Arzt nicht mehr als 30 Milligramm Vitamin E einnehmen. Höhere Dosierungen könnten zu Komplikationen wie einem vorzeitigen Blasensprung führen.
Da Vitamin C die Eisenaufnahme verbessert, sollten Menschen mit krankhafter Eisenüberladung (Hämochromatose) Vitamin C nur unter ärztlicher Aufsicht einnehmen.
Bei Nierenschwäche sollten nicht über 500 Milligramm Vitamin C pro Tag eingenommen werden. Die kranke Niere kann damit nicht umgehen.
Eine Vitamin-C-Ergänzung muss bei Krebs mit dem Arzt abgesprochen sein. Sie könnte die Wirkung der Krebsmedikamente hemmen, wie die des Blutkrebs-Medikaments Bortezomib (Velcade®) sowie die von Doxorubicin (wie Adriblastin®, Ribodoxo®) und Cisplatin (wie Cis-GRY®).
Vitamin E sollte bei Rauchern wegen einer möglichen Gefahr für Hirnblutungen nicht über 50 Milligramm pro Tag dosiert werden. Zudem wurde ein leicht erhöhtes Lungenkrebsrisiko gefunden. Aufgrund eines erhöhten Blutungsrisikos, sollten hoch dosierte Vitamin-E-Präparate etwa 14 Tage vor einem operativen Eingriff abgesetzt werden.
Bei einer schweren Verdauungsschwäche (Malabsorption) werden zu wenig Vitamin E und K aufgenommen. Ein Vitamin-K-Mangel führt zu einer hohen Blutungsgefahr. Der Vitamin-K-Mangel muss erst ausgeglichen werden, bevor Vitamin E eingesetzt werden kann. Beim Ausgleich des Mangels an Vitamin E und K sollten die Gerinnungswerte kontrolliert werden.
Ein Vitamin-D-Mangel beeinträchtigt die Therapie
Wirkweise von Vitamin D
Vitamin D ist ein wichtiger Regulator für das Immunsystem. Es wird gebraucht für die Abwehr von Bakterien wie Helicobacter pylori. Vitamin D ist außerdem wichtig, damit der Körper Stoffe bilden kann, die Bakterien abtöten. Darüber hinaus lindert Vitamin D Entzündungen. Ein Mangel könnte demnach die Abwehr beeinträchtigen und Entzündungen der Magenschleimhaut fördern. Eine Auswertung von Beobachtungsstudien zeigt, dass Menschen mit einer schlechten Vitamin-D-Versorgung anfälliger für eine Infektion mit Helicobacter pylori sind.
Außerdem halten Forscher einen Vitamin-D-Mangel für einen Risikofaktor, der das Ansprechen der Therapie beeinträchtigt. Eine Übersichtsarbeit zeigt: Der durchschnittliche Vitamin-D-Spiegel war bei Personen mit erfolgreicher Helicobacter-pylori-Therapie höher als bei Personen ohne Erfolg.
Es gibt bereits eine erste Studie zur Vitamin-D-Einnahme: Die gezielte Ergänzung steigerte die Anzahl erfolgreicher Eradikationen durch eine Tripeltherapie um 14 bis 19 Prozent.
Fazit: Noch gibt es kaum Studien, in denen getestet wurde, ob Vitamin-D-Präparate die Therapie unterstützen. Erste Ergebnisse sind vielversprechend. Die Forscher raten dazu, den Vitamin-D-Spiegel zu messen und bei niedrigen Werten, Vitamin D zu ergänzen.
Vitamin D: Dosierung und Einnahmeempfehlung
Ist der Vitamin-D-Spiegel nicht bekannt, raten Mikronährstoff-Experten zur Ergänzung von 1.000 bis 2.000 Internationalen Einheiten pro Tag. Zwar kann der Körper Vitamin D durch Sonnenstrahlung in der Haut selbst herstellen, dies ist jedoch meist eingeschränkt (zum Beispiel im Winter, durch Sonnencreme oder im Sommer in den Abendstunden).
Bei einem Mangel ist für eine gewisse Zeit eine höhere Dosierung nötig, die der Arzt nach der Messung der Vitamin-D-Werte festlegt.
Vitamin D sollte zum Essen eingenommen werden: Das Fett aus einer Mahlzeit ist nötig, damit das Vitamin im Darm gut aufgenommen wird.
Vitamin D im Labor bestimmen lassen
Mikronährstoff-Experten raten, die Blutwerte regelmäßig kontrollieren zu lassen – idealerweise zweimal im Jahr (Frühjahr und Herbst). Dazu wird die Transportform 25(OH)-Vitamin D im Blutserum bestimmt. Serum ist die Flüssigkeit des Blutes nach der Gerinnung ohne Zellen. Werte zwischen 40 und 60 Nanogramm pro Milliliter sind für einen bestmöglichen gesundheitlichen Nutzen ratsam.
Vitamin D: zu beachten bei Erkrankungen und Medikamenteneinnahme
Personen mit Nierenerkrankungen sollten Vitamin D nicht ohne ärztliche Rücksprache einnehmen: Sie haben manchmal zu hohe Calciumspiegel im Blut. Da Vitamin D die Calciumaufnahme im Darm fördert, können die Calciumspiegel zu stark steigen. Auch Personen mit calciumhaltigen Nierensteinen müssen aufpassen.
Bei einigen Krankheiten ist ein gestörter Calcium- und Phosphatstoffwechsel möglich, zum Beispiel bei der Bindegewebserkrankung Sarkoidose sowie einer Nebenschilddrüsenüberfunktion. Betroffene sollten dann Vitamin D nur unter ärztlicher Kontrolle ergänzen.
Entwässerungsmedikamente (Diuretika) aus der Gruppe der Thiazide senken die Ausscheidung von Calcium über die Nieren. Vitamin D darf nur zusammen mit Thiaziden eingenommen werden, wenn der Calciumspiegel regelmäßig überprüft wird. Dies gilt für die Wirkstoffe Hydrochlorothiazid (wie Esidrix®), Xipamid (wie Aquaphor®) und Indapamid (wie Natrilix®).
Probiotika können Helicobacter pylori im Magen verdrängen
Wirkweise von Probiotika
In der Schleimhaut des Magens können bestimmte Bakterienarten überleben. Helicobacter pylori ist sehr aggressiv und verdrängt andere Arten. Man erforscht deshalb den Einsatz von Probiotika, um Helicobacter pylori wieder zurückzudrängen.
Probiotika sind Mikroorganismen wie Hefen (Saccharomyces) und Bakterien (Lactobacillus und Bifidobakterium). Sie helfen, im Magen-Darm-Trakt eine gesunde Bakterienflora aufrechtzuerhalten. Das hemmt eine übermäßige Besiedlung mit krankmachenden Bakterien. Verschiedene Laktobazillen und Bifidobakterien produzieren antibiotische und abwehrende Substanzen. Außerdem verhindern sie die Anheftung von Helicobacter pylori an die Schleimhaut und verdrängen ihn.
Zahlreiche Übersichtsarbeiten zeigen, dass die begleitende Einnahme von Probiotika bei Erwachsenen und Kindern den Erfolg einer antibiotischen Helicobacter-Therapie steigern kann. Probiotika helfen auch dabei, Schleimhautschäden zu verhindern und das Abheilen von Magengeschwüren zu fördern.
Außerdem traten durch Probiotika weniger Nebenwirkungen für die Darmflora bei einer Antibiotika-Therapie auf. Das betrifft Beschwerden wie Verstopfung und Durchfall sowie Störungen des Geschmacks. Probiotika sind in der Mikronährstoffmedizin gängige Mittel, um Antibiotika-bedingtem Durchfall vorzubeugen. Verwendet wurden Laktobazillen, Bifidobakterien und Hefen (Saccharomyces).
Fazit: Die Wirkung von Probiotika bei der Behandlung von Helicobacter ist gut untersucht. Probiotika können die Therapie mit Antibiotika ideal unterstützen. Nach erfolgreicher Entfernung des Erregers helfen Probiotika zudem dabei, die durch die Antibiotika geschädigte Darmflora wiederaufzubauen.
Probiotika: Dosierung und Einnahmeempfehlung
Zur Unterstützung einer Helicobacter-pylori-Eradikationstherapie und einer anschließenden Sanierung des Darms empfehlen Mikronährstoff-Experten eine tägliche Dosis von 1 bis 20 Milliarden (1 bis 20 x 109) koloniebildende Einheiten. Sinnvoll ist eine Mischung aus Laktobazillen, Bifidobakterien und der Hefe Saccharomyces boulardii.
Wichtig ist, dass Probiotika nicht zeitgleich mit Antibiotika eingenommen werden. Andernfalls würden die probiotischen Bakterien absterben. Ein Einnahmeabstand von zwei bis drei Stunden ist deshalb nötig. Hefen als Probiotika sind davon nicht betroffen.
Grundsätzlich müssen Probiotika regelmäßig eingenommen werden für einen gesundheitsfördernden Effekt. Empfehlenswert ist die Ergänzung zum Essen. Wird die Einnahme beendet, nimmt auch die Menge der probiotischen Bakterien im Verdauungstrakt wieder ab.
Tipp
Es ist außerdem ratsam, parallel zu Probiotika auch Präbiotika zu ergänzen. Präbiotika sind spezielle Ballaststoffe, die den Probiotika als Nahrung dienen – zum Beispiel resistente Stärke oder resistente Dextrine.
Probiotika: zu beachten in der Schwangerschaft und bei Erkrankungen
Bei Schwangerschaftsbluthochdruck sind Probiotika zu wenig getestet. Sie könnten die Beschwerden verstärken. In diesem Fall sollte lieber auf Probiotika-haltige Milchprodukte oder Ballaststoffe ausgewichen werden.
Einige probiotische Bakterien bilden möglicherweise Histamin im Darm. Daher kann eine Probiotikaeinnahme bei einer Histaminintoleranz Beschwerden hervorrufen. Folgende Bakterienarten betrifft es: Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis und Enterococcus faecium.
Für Menschen, die ein geschwächtes Immunsystem haben, könnten Probiotika gefährlich werden. Daher sollten geschwächte Personen mit stark unterdrücktem Immunsystem nur in Rücksprache mit dem behandelnden Arzt Probiotika einnehmen. Personen mit zentralen Venenzugängen (zum Beispiel bei Chemotherapie), Herzklappenerkrankungen und Kurzdarmsyndrom sollten keine Probiotika bekommen.
N-Acetylcystein macht die Bakterien angreifbarer
Wirkweise von N-Acetylcystein
Helicobacter pylori versteckt sich in der Schleimhaut des Magens vor dem Immunsystem und Medikamenten. N-Acetylcystein (NAC) ist in der Lage, eine spezielle von Bakterien gebildete Schleimschicht (Biofilm) anzugreifen. Daneben wird vermutlich die Schleimschicht des Magens aufgelockert. Bakterien sind dann für die Antibiotika besser zugänglich.
Hochwertige Studien zeigen: Eine NAC-Einnahme kann eine Helicobacter-pylori-Eradikationstherapie unterstützen. Zu diesem Schluss kamen Forscher durch die Auswertung der verfügbaren Daten. Eine andere Forschergruppe schlussfolgert jedoch, dass die verfügbaren Daten bisher nicht ausreichen, um einen Nutzen zu beweisen. Denn es gibt auch Studien, in denen NAC die Therapie nicht verbesserte. Möglicherweise könnte eine einwöchige Vorbehandlung mit NAC nötig sein, damit die Schleimschicht des Magens aufgelockert wird.
Fazit: NAC könnte die Therapie mit Antibiotika unterstützen. Eine abschließende Einschätzung lassen die Studienergebnisse jedoch noch nicht zu.
N-Acetylcystein: Dosierung und Einnahmeempfehlung
Begleitend zur Eradikationstherapie können bei einer Helicobacter-pylori-Infektion pro Tag 200 bis 600 Milligramm NAC sinnvoll sein. Die Rücksprache mit einem Arzt wird empfohlen: Bei einem bereits vorhandenen Magengeschwür könnte NAC Blutungen begünstigen.
NAC darf nicht zeitgleich mit bestimmten Antibiotika eingenommen werden. Das kann die Wirkung verringern. Es wird empfohlen, einen Abstand von zwei Stunden oder mehr einzuhalten. Betroffen sind zum Beispiel Tetracycline (Tetracyclin Wolff®), Aminoglykoside wie Streptomycin (Strepto-Fatol®) oder Penicilline (Penicillin Sandoz®).
NAC sollte zu den Mahlzeiten eingenommen werden – am besten aufgeteilt in mehrere kleine Dosen über den Tag verteilt.
N-Acetylcystein: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Bislang gibt es nur wenige Anhaltspunkte zur Sicherheit von N-Acetylcystein in der Schwangerschaft und Stillzeit. Die Einnahme sollte in jedem Fall mit einem Arzt abgesprochen werden.
Sprechen Sie auch in den folgenden Fällen die Einnahme mit dem Arzt ab:
- Asthma: Es kann zu allergischen Reaktionen mit einer Verengung der Atemwege kommen.
- Histaminintoleranz: N-Acetylcystein könnte die Intoleranz verschlimmern.
- Magen-Darm-Geschwür: Personen mit Geschwüren oder Krampfadern im Magen-Darm-Trakt. Es bestehen Bedenken, dass die Einnahme von N-Acetylcystein Blutungen auslösen könnte.
- Leberschwäche: Bei schwacher Leberfunktion wird NAC langsamer abgebaut, daher sollte die Dosis gesenkt werden.
N-Acetylcystein darf nicht zusammen mit Hustenstillern eingenommen werden. Hustenstiller schränken den Hustenreflex ein. Dadurch besteht die Gefahr, dass der Schleim in den Atemwegen nicht abgehustet werden kann und sich anstaut. Dazu gehören zum Beispiel die Wirkstoffe Codein (Codicaps®, Tussoret®), Noscapin (Capval®) und Dextromethorphan (Dextro Bolder®, Silomat®).
Die zeitgleiche Einnahme von N-Acetylcystein und Antibiotika kann die Wirkung einiger Antibiotika verringern. Daher wird empfohlen, einen Abstand von mindestens zwei Stunden einzuhalten. Betroffen sind zum Beispiel Tetracyclin (Tetracyclin Wolff®), Streptomycin (Strepto-Fatol®) und Penicillin (Penicillin Sandoz®).
Arzneimittel mit Nitroglycerin (wie Corangin®, Nitrangin®) erweitern die Blutgefäße. N-Acetylcystein kann die Wirkung verstärken, sodass der Blutdruck zu stark sinkt. Daher sollte N-Acetylcystein zusammen mit Nitroglycerin nur nach ärztlicher Rücksprache eingenommen werden. Es kann eine Anpassung der Dosis nötig sein.
Cranberry-Extrakt hemmt die Anheftung von Helicobacter pylori an die Schleimhaut
Wirkweise von Cranberry-Extrakt
In Cranberrys sind viele gesundheitsfördernde Substanzen enthalten, die auch eine Helicobacter-pylori-Therapie unterstützen können. Die Stoffe hemmen zum Beispiel das Anheften der Bakterien an die Schleimhaut im Magen. Hier stehen Proanthocyanidine (PAC) im Vordergrund. Aber auch die Gerbstoffe dürften zur Wirkung beitragen: Sie sind antibakteriell. Daneben verdichten und entwässern die Gerbstoffe die Schleimhaut, was diese wiederum schützt. Außerdem wirkt Cranberry antioxidativ, wodurch auch der durch die Infektion ausgelöste oxidative Stress bekämpft wird.
Zwei hochwertige Studien lassen vermuten, dass Cranberrysaft Helicobacter pylori zurückdrängen kann. Dazu tranken die Teilnehmer regelmäßig für zwei bis drei Monate täglich 500 Milliliter Cranberrysaft. Kapseln mit Cranberry-Extrakt als Pulver hatten in dieser Studie keine Wirkung. In einer Übersichtsarbeit schlussfolgerten Forscher, dass die Ergebnisse noch nicht ausreichen, um den Erfolg von Cranberry allein zu belegen.
Kombination mit Antibiotika: In einer Vorstudie konnten Kapseln mit Cranberry-Extrakt in Verbindung mit einer Antibiotika-Therapie aber punkten. Auch eine hochwertige Studie mit Cranberrysaft belegt, dass Antibiotika gegen Helicobacter pylori mit dem Saft wirksamer waren.
Fazit: Die Studienergebnisse sind insgesamt vielversprechend. Die Pflanzenstoffe aus Cranberry könnten helfen, die Bakterien im Magen zu verringern und dadurch den Therapieerfolg zu verbessern. Große hochwertige Studien müssen zur abschließenden Bestätigung jedoch folgen.
Cranberry-Extrakt: Dosierung und Einnahmeempfehlung
Zur Unterstützung der Therapie empfehlen Mikronährstoff-Experten die Ergänzung von Cranberry-Extrakt. Sinnvoll sind 200 bis 400 Milligramm pro Tag. Achten Sie auf einen PAC-Gehalt von 40 bis 80 Milligramm im Präparat. Dies entspricht dem PAC-Gehalt von 250 bis 500 Milliliter Cranberrysaft. Die Rücksprache mit einem Arzt ist sinnvoll. Cranberry-Extrakt gibt es meist als Kapseln.
Alternativ könnte auch der Fruchtsaft aus Cranberry helfen. Allerdings enthält er viel Säure. Wird der Saft regelmäßig getrunken, kann die Fruchtsäure den Zahnschmelz angreifen und Magenprobleme fördern. Zudem ist der saure Geschmack nicht jedermanns Sache. Deshalb gibt es Fruchtsaftzubereitungen. Sie sind jedoch wegen des Zuckers nicht zu empfehlen.
Cranberry-Extrakt: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Cranberrys sind während der Schwangerschaft und Stillzeit sicher. Die Einnahme von Präparaten mit Cranberry-Extrakt sollte dennoch sicherheitshalber mit dem Arzt besprochen werden.
Wer auf den Wirkstoff Acetylsalicysäure (Aspirin®) allergisch reagiert, sollte auch auf die Einnahme von Cranberrys verzichten. Die Beeren enthalten große Mengen davon.
Personen, die von Nierensteinen betroffen sind, sollten Cranberrys in hohen Mengen nicht ohne Rücksprache mit dem Arzt verzehren. Die Beeren enthalten Oxalsäure. Diese kann in höheren Mengen die Bildung neuer Nierensteine begünstigen.
Proanthocyanidine (PAC) aus Cranberrys werden in der Leber verstoffwechselt. Wer Cranberry-Extrakt zusammen mit Medikamenten einnimmt, die ebenfalls in der Leber verstoffwechselt werden, sollte sicherheitshalber Rücksprache mit einem Arzt halten. Wechselwirkungen sind möglich, sodass ein zeitlicher Abstand wichtig ist. Dazu zählen zum Beispiel die Wirkstoffe Ibuprofen (wie Dolormin®), Diclofenac (wie Voltaren®) und Diazepam (beispielsweise Valium®).
Auch könnten PAC die Wirkung des Blutverdünners Warfarin (Coumadin®) verstärken. Wer Warfarin einnimmt, sollte eine Therapie mit Cranberry-Extrakt ärztlich beaufsichtigen lassen.
Curcumin unterstützt die Eradikationstherapie
Wirkweise von Curcumin
Curcumin ist der Pflanzenstoff aus der Gelbwurzel (Kurkuma). Es unterstützt körpereigene Enzyme dabei, oxidativen Stress abzufangen. Curcumin wirkt außerdem entzündungshemmend und kann so die Zellen des Magens vor einer schweren Gastritis und Magengeschwüren schützen.
In hochwertigen Studien wurden die entzündungshemmenden Wirkungen von Curcumin begleitend zur Triple-Therapie gegen Helicobacter pylori bestätigt. Die Forscher konnten feststellen, dass im Blut weniger Spuren von oxidativem Stress zu finden waren, wenn Curcumin eingenommen wurde. In einer anderen hochwertigen Studie hatten auch die Bauchbeschwerden der Patienten abgenommen. Ob Curcumin aber direkt den Erfolg der Therapie verbessert, ist noch nicht geklärt: Die Studien liefern widersprüchliche Ergebnisse.
Fazit: Da Curcumin stark entzündungshemmend wirkt, kann die Ergänzung bei einer Helicobacter-pylori-Infektion sinnvoll sein. Weitere Studien müssen aber noch zeigen, wie gut Curcumin den Therapieerfolg fördern kann.
Curcumin: Dosierung und Einnahmeempfehlung
Begleitend zu einer Helicobacter-pylori-Eradikationstherapie empfehlen Mikronährstoff-Experten eine tägliche Dosis von 250 bis 500 Milligramm Curcumin für die Zeit der Therapie. Fette in der Nahrung erhöhen die Aufnahme von Curcumin im Darm. Aus diesem Grund wird empfohlen, Curcumin zusammen mit einer Mahlzeit einzunehmen.
Idealerweise sollte man nach drei Monaten eine Einnahmepause machen. Dauerhaft sollte man nicht über 180 Milligramm einnehmen. Bei einigen empfindlichen Menschen könnte Curcumin die Leberwerte verschlechtern.

Curcumin: zu beachten bei Schwangerschaft, Erkrankungen und Medikamenteneinnahme
Die aktuelle Studienlage ist noch nicht ausreichend, um Curcumin für Schwangere oder Stillende empfehlen zu können. Daher sollten die Pflanzenstoffe nur in Rücksprache mit dem Arzt eingenommen werden. Die Zufuhr über Lebensmittel ist allerdings unbedenklich.
Curcumin sollte nicht bei vorhandenen Gallensteinen eingenommen werden: Es regt die Produktion von Gallensäuren an. Wenn ein Stein den gesteigerten Gallenfluss behindert, kann das schwere Beschwerden (Gallenkolik) auslösen. Ein „Zuviel“ an Galle kann auch Durchfälle verursachen. Deshalb sollten Menschen mit Durchfallerkrankungen oder Personen, die zu einer Überproduktion an Gallensaft neigen, besser auf Curcumin verzichten.
Wechselwirkungen von Curcumin mit Medikamenten sind möglich, aber bislang nicht eindeutig in Studien an Menschen nachgewiesen. In Laborstudien hemmte Curcumin Enzyme der Leber, die normalerweise Medikamente verstoffwechseln. Sprechen Sie daher mit dem Arzt, bevor Sie Curcumin zusammen mit Medikamenten einnehmen.
Bei Ratten beeinflusste Curcumin die Verfügbarkeit von Warfarin (Coumadin®) und Clopidogrel (Iscover®, Plavix®). Ein Einfluss auf die Blutgerinnung konnte allerdings nicht festgestellt werden. Zur Sicherheit empfiehlt es sich, den Gerinnungswert im Blut kontrollieren zu lassen.
Flavonoide verringern oxidativen Stress für die Magenschleimhaut
Wirkweise von Flavonoiden
Helicobacter pylori verursacht in der Schleimhaut des Magens erheblichen oxidativen Stress. Über viele Jahre hinweg kann dies zu Krebs führen. Flavonoide haben starke antioxidative Eigenschaften: Sie fangen freie Radikale ab und verringern dadurch oxidativen Stress. Sie schützen außerdem die Schleimhaut vor den Schäden, die der Erreger verursacht.
Zudem wirkten einige Flavonoide in Laborversuchen antibiotisch auf Helicobacter pylori (wie Apigenin, Chrysin, Kaempferol und Hesperetin). Flavonoide sind grundsätzlich in Obst und Gemüse weit verbreitet – zum Beispiel in Grüntee, Trauben, Granatapfel und Citrusfrüchten.
Seit längerer Zeit ist bekannt, dass eine Flavonoid-reiche Pflanzenkost vor Magenkrebs schützen kann. Vor allem bei Frauen war der Effekt in großen Beobachtungsstudien deutlich. Das Trinken von grünem und schwarzem Tee scheint außerdem vor einer Helicobacter-pylori-Infektion zu schützen. Vor allem grüner Tee hilft, den Keim zurückzudrängen: Der Pflanzenstoff Epigallocatechingallat (EGCG) förderte im Labor die Wirkung von Antibiotika gegen Helicobacter pylori.
In Labor- und Tierversuchen wurden zudem weitere Flavonoide entdeckt, die die Wirkung der Antibiotika Carithromycin, Amoxicillin und Metronidazol verstärken. Dazu zählen Kaempferol, Quercetin und Rutin. Ihre entzündungshemmende Wirkung schwächt außerdem die Gastritis ab.
Fazit: Insgesamt könnte eine Flavonoid-reiche Ernährung bei einer Helicobacter-pylori-Infektion nützlich sein und auch vor Magenkrebs schützen. Es fehlen aber noch hochwertige Studien. Eine pflanzenbasierte Ernährung sollte aber immer die Grundlage für eine gute Gesundheit sein.
Flavonoide: Dosierung und Einnahmeempfehlung
Mikronährstoff-Experten empfehlen bei einer Infektion mit Helicobacter pylori eine Flavonoid-reiche Ernährung. Laut Studien zeigte sich bei einer Zufuhr von 150 Milligramm Flavonoiden pro Tag ein geringeres Risiko für Magenkrebs.
Alternativ gibt es Mikronährstoffpräparate, die eine Kombination verschiedener niedrig dosierter Flavonoid-reicher Extrakte enthalten. Sinnvoll sind zum Beispiel Granatapfel-, Traubenkern- oder Grüntee-Extrakt. Die Dosierungen sind dann aufeinander abgestimmt.
Flavonoid-Präparate sollten zusammen mit einer Mahlzeit eingenommen werden, um die Verträglichkeit zu verbessern.
Dosierungen auf einen Blick
Empfehlung pro Tag bei einer Helicobacter-pylori-Infektion | |
|---|---|
Vitamine | |
Vitamin C | 500 bis 1.000 Milligramm (mg) |
Vitamin E | 30 bis 50 Milligramm (in Rücksprache mit dem Arzt auch 200 Milligramm) |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten (IE) (oder je nach Spiegel) |
Pflanzenstoffe | |
Cranberry-Extrakt | 200 bis 400 Milligramm (40 bis 80 Milligramm PAC) |
Curcumin | 250 bis 500 Milligramm |
Flavonoide | zum Beispiel 150 Milligramm über die Ernährung |
Sonstige | |
Probiotika | 1 bis 20 Milliarden (1 bis 20 x 109) koloniebildende Einheiten (KBE) |
N-Acetylcystein (NAC) | 200 bis 600 Milligramm |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei einer Helicobacter-pylori-Infektion | |
|---|---|
Normalwerte | |
Vitamin C (Plasma) Vitamin C (Leukozyten) | über 60 Mikromol pro Liter (µmol/l) über 25 Mikrogramm auf 100 Millionen Leukozyten (µg/108) |
Vitamin D als 25(OH)-Vitamin D (Serum) | 40 bis 60 Nanogramm pro Milliliter (ng/ml) |
Zusammenfassung
Der Magen kann sich gegen den Keim Helicobacter pylori kaum wehren. In vielen Fällen kommt es zu Beschwerden, etwa zu einer chronischen Gastritis. Über viele Jahre hinweg drohen Folgeerkrankungen wie ein Magengeschwür oder sehr selten Krebs. Um Helicobacter pylori sicher zu entfernen, ist eine Antibiotika-Therapie unverzichtbar. Allerdings ist sie nicht immer erfolgreich. Bestimmte Vitamine und andere Stoffe können helfen, den Körper bei einer solchen Eradikationstherapie zu unterstützen.
Vor allem Vitamin C macht Helicobacter pylori im Magen angreifbarer, indem es den Säureschutz des Keims abschwächt. Daneben verringert Vitamin C in Kombination mit Vitamin E oxidativen Stress, der bei der Erkrankung vermehrt entsteht und das Gewebe zusätzlich schädigt. Darüber hinaus sollte kein Vitamin-D-Mangel vorliegen: Die Daten zeigen, dass eine Therapie erfolgreicher war, wenn Betroffene damit gut versorgt sind.
Probiotika verdrängen Helicobacter pylori und stehen der Darmflora schützend zur Seite: Die eingesetzten Antibiotika stören die Darmflora. Nebenwirkungen wie Durchfall können deshalb durch Probiotika verhindert oder abgeschwächt werden.
N-Acetylcystein lockert den Schleim um Helicobacter pylori herum auf und macht das Bakterium dadurch empfindlicher gegen Antibiotika. Cranberry-Extrakt hemmt die Anheftung an die Schleimhaut und verbessert ebenfalls den Therapieerfolg. Curcumin und Flavonoide wirken antioxidativ und lindern die Bauchbeschwerden.
Verzeichnis der Studien und Quellen
Aditi, A. & Graham, D.Y. (2012): Vitamin C, gastritis, and gastric disease: a historical review and update. Dig Dis Sci. 2012 Oct;57(10):2504-15. https://www.ncbi.nlm.nih.gov/pubmed/22543844, abgerufen am: 16.09.2019.
Aerzteblatt.de (2016): Helicobacter pylori beeinflusst mikrobielle Besiedlung in Mund und Dünndarm. Deutscher Ärzteverlag GmbH. https://www.aerzteblatt.de/nachrichten/72042/Helicobacter-pylori-beeinflusst-mikrobielle-Besiedlung-in-Mund-und-Duenndarm, abgerufen am: 06.12.2019.
Apotheken Umschau (2015): Magen-Zwölffingerdarmgeschwür. https://www.apotheken-umschau.de/Magengeschwuer, abgerufen am: 16.09.2019.
Apotheken Umschau (2017): Magenschleimhautentzündung: Therapie. https://www.apotheken-umschau.de/Magen/Magenschleimhautentzuendung-Therapie-109939_4.html, abgerufen am: 16.09.2019.
Bischoff, A. (2009): Helicobacter-Pylori-Infektion: Eradikation – wann und womit? Dtsch Arztebl. 2009;106(46):A-2321. https://www.aerzteblatt.de/archiv/66762/Helicobacter-Pylori-Infektion-Eradikation-wann-und-womit, abgerufen am: 06.12.2019.
Boyanova, L. et al. (2015): Honey and green/black tea consumption may reduce the risk of Helicobacter pylori infection. Diagn Microbiol Infect Dis. 2015 May. https://www.ncbi.nlm.nih.gov/pubmed/25779680, abgerufen am: 06.12.2019.
Budzyński, J. & Kłopocka, M. (2014): Brain-gut axis in the pathogenesis of Helicobacter pylori infection. World J Gastroenterol. 2014 May 14;20(18):5212-25. https://www.ncbi.nlm.nih.gov/pubmed/24833851, abgerufen am: 06.12.2019.
Camilleri, M. & Tack, J.F. (2010): Current medical treatments of dyspepsia and irritable bowel syndrome. Gastroenterol Clin North Am. 2010 Sep;39(3):481-93. https://www.ncbi.nlm.nih.gov/pubmed/20951913, abgerufen am: 06.12.2019.
Chang, Y.L. et al. (2020): Efficacy of second-line regimens for Helicobacter pylori eradication treatment: a systemic review and network meta-analysis. BMJ Open Gastroenterol. 2020 Sep;7(1):e000472. https://pubmed.ncbi.nlm.nih.gov/32883715/, abgerufen am 05.01.2022.
Chen, C.C. et al. (2020): Comparison of the effect of clarithromycin triple therapy with or without N-acetylcysteine in the eradication of Helicobacter pylori: a randomized controlled trial. Therap Adv Gastroenterol. 2020;13:1756284820927306. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7406927/, abgerufen am 05.01.2022.
Chuang, C.H. et al. (2002): Vitamin C and E supplements to lansoprazole-amoxicillin-metronidazole triple therapy may reduce the eradication rate of metronidazole-susceptible Helicobacter pylori infection. Helicobacter. 2002 Oct;7(5):310-6. https://www.ncbi.nlm.nih.gov/pubmed/12390211, abgerufen am: 06.12.2019.
Demirci, H. (2015): Influence of vitamin C and E supplementation on the eradication rates of triple and quadruple eradication regimens for Helicobacter pylori infection. https://www.ncbi.nlm.nih.gov/pubmed/26510082, abgerufen am: 06.12.2019.
Deutsche Apothekerzeitung (2016): Helicobacter-Therapie unter Umständen auch bei Beschwerdefreiheit. https://www.deutsche-apotheker-zeitung.de/news/artikel/2016/03/16/eradikation, abgerufen am: 16.09.2019.
El Shahawy, M.S. et al. (2019): Value of supplementing vitamin C to the triple therapy on the eradication rates of Helicobacter pylori infection. Adv Dig Med. 2020;7:124–31. https://onlinelibrary.wiley.com/doi/full/10.1002/aid2.13148, abgerufen am 05.01.2022.
ePrax GmbH (2018): Patienteninformation für ACC akut 600 Hexal Brausetabletten. http://www.beipackzettel.de/medikament/ACC%2520akut%2520600%2520Hexal%2520Brausetabletten/A17976, abgerufen am 05.01.2022.
Everett, S.M. et al. (2002):Antioxidant vitamin supplements do not reduce reactive oxygen species activity in Helicobacter pylori gastritis in the short term. Br J Nutr. 2002 Jan;87(1):3-11. https://www.ncbi.nlm.nih.gov/pubmed/11898768, abgerufen am: 16.09.2019.
Fischbach, W. & Malfertheiner, P. (2018): Helicobacter Pylori Infection. Dtsch Arztebl Int. 2018 Jun;115(25): 429–36. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6056709/, abgerufen am 05.01.2022.
Fischbach, W. et al. (2016): S2k-Leitlinie Helicobacter pylori und gastroduodenale Ulkuskrankheit1. Z Gastroenterol 2016;54:327–63. https://www.awmf.org/uploads/tx_szleitlinien/021-001l_S2k_Helicobacter-pylori-gastroduodenale_Ulkuskrankheit_2018-08-abgelaufen.pdf, abgerufen am 05.01.2022.
Fontes, L.E.S. et al. (2019): N-acetylcysteine as an adjuvant therapy for Helicobacter pylori eradication. Cochrane Database Syst Rev. 2019 Feb 12;2(2):CD012357. https://pubmed.ncbi.nlm.nih.gov/30746681/, abgerufen am 05.01.2022.
Gao, T. et al. (2021): Effects of cranberry beverages on oxidative stress and gut microbiota in subjects with Helicobacter pylori infection: a randomized, double-blind, placebo-controlled trial. Food Funct. 2021 Aug 2;12(15):6878-88. https://pubmed.ncbi.nlm.nih.gov/34126630/, abgerufen am 05.01.2022.
García, A. et al. (2014): Biofilm and Helicobacter pylori: from environment to human host. World J Gastroenterol. 2014 May 21;20(19):5632-8. https://www.ncbi.nlm.nih.gov/pubmed/24914322, abgerufen am: 16.09.2019.
Giovanni, B. (2018): Helicobacter pylori Infection and Gastric Dysbiosis: Can Probiotics Administration Be Useful to Treat This Condition? Can J Infect Dis Med Microbiol. 2018; 2018: 6237239. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6151681/, abgerufen am: 16.09.2019.
Goderska, K. et al. (2018): Helicobacter pylori treatment: antibiotics or probiotics. Appl Microbiol Biotechnol. 2018;102(1):1–7. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5748437/, abgerufen am: 16.09.2019.
González, A. et al. (2019): Identifying potential novel drugs against Helicobacter pylori by targeting the essential response regulator HsrA. Sci Rep. 2019; 9: 11294. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6683298/, abgerufen am: 16.09.2019.
González, A. et al. (2021): Fighting the Antibiotic Crisis: Flavonoids as Promising Antibacterial Drugs Against Helicobacter pylori Infection. Front Cell Infect Microbiol. 2021;11:709749. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8329489/, abgerufen am 05.01.2022.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2014): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 3. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Hassani AR, Ordouzadeh N et al. (2009): In vitro inhibition of Helicobacter pylori urease with non and semi fermented Camellia sinensis. Indian J Med Microbiol. https://www.ncbi.nlm.nih.gov/pubmed/19172056, abgerufen am: 06.12.2019.
Howell, A.B. (2020): Clinical evidence supporting cranberry as a complementary approach to Helicobacter pylori management. FoodFrontiers. 2020;1:329–31. https://onlinelibrary.wiley.com/doi/full/10.1002/fft2.47, abgerufen am 05.01.2022.
Hu, W. (2017): Critical Role of Vitamin D3 in Helicobacter pylori Eradication in Stomachs. FASEB Journal. Special Issue: Experimental Biology 2017 Meeting Abstracts. 2017 Apr;31(S1):1067.6. https://faseb.onlinelibrary.wiley.com/doi/abs/10.1096/fasebj.31.1_supplement.1067.6, abgerufen am 05.01.2022.
Huang, B. et al. (2019): Effect of 25-hydroxyvitamin D on Helicobacter pylori eradication in patients with type 2 diabetes. Wien Klin Wochenschr. 2019; 131(3): 75–80. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6394653/, abgerufen am 05.01.2022.
Hussain, A. et al. (2018): Vitamin C: A Preventative, Therapeutic Agent Against Helicobacter pylori. Cureus. 10(7): e3062. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6166909/, abgerufen am: 16.09.2019.
Ji, J. & Yang, H. (2020): Using Probiotics as Supplementation for Helicobacter pylori Antibiotic Therapy. Int J Mol Sci. 2020 Feb 8;21(3):1136. https://pubmed.ncbi.nlm.nih.gov/32046317/, abgerufen am 05.01.2022.
Judaki, A. (2017): Curcumin in combination with triple therapy regimes ameliorates oxidative stress and histopathologic chnages in chronic gastritis-associated Helicobacter pylori ingfection. Arq. Gastroenterol. vol.54 no.3 São Paulo. http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-28032017005004102&lng=en&nrm=iso&tlng=en, abgerufen am: 16.09.2019.
Kakiuchi, T. et al. (2020): Effect of probiotics during vonoprazan-containing triple therapy on gut microbiota in Helicobacter pylori infection: A randomized controlled trial. Helicobacter . 2020 Jun;25(3):e12690. https://pubmed.ncbi.nlm.nih.gov/32207209/, abgerufen am 05.01.2022.
Karbasi, A. (2013):Effect of oral N-acetyl cysteine on eradication of Helicobacter pylori in patients with dyspepsia.Minerva Gastroenterol Dietol.59(1):107-12. https://www.ncbi.nlm.nih.gov/pubmed/23478248, abgerufen am: 16.09.2019.
Khoder, G. (2016): Potential role of probiotics in the management of gastric ulcer. Exp Ther Med. 12(1): 3–17. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4906699/, abgerufen am: 16.09.2019.
Khonche, A. (2016): Adjunctive Therapy with Curcumin for Peptic Ulcer: a Randomized Controlled Trial.Drug Res (Stuttg).66(8):444-8. https://www.ncbi.nlm.nih.gov/pubmed/27351245, abgerufen am: 16.09.2019.
Koosirirat C, Linpisarn S et al. (2010): Investigation of the anti-inflammatory effect of Curcuma longa in Helicobacter pylori-infected patients. Int Immunopharmacol. 2010 Jul. https://www.ncbi.nlm.nih.gov/pubmed/20438867, abgerufen am: 06.12.2019.
Kwiecien, S. et al. (2019): Curcumin: A Potent Protectant against Esophageal and Gastric Disorders. Int J Mol Sci. 2019 Mar; 20(6): 1477. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6471759/, abgerufen am 05.01.2022.
Lau, C.S. et al. (2016): Probiotics improve the efficacy of standard triple therapy in the eradication of Helicobacter pylori: a meta-analysis.Infect Drug Resist. 9:275-289. https://www.ncbi.nlm.nih.gov/pubmed/27994474, abgerufen am: 16.09.2019.
Li, Z.X. et al. (2020): Suppression of Helicobacter pylori infection by daily cranberry intake: A double-blind, randomized, placebo-controlled trial. Journal of Gastroenterology and Hepatology. 2021;36(4):927–35. https://onlinelibrary.wiley.com/doi/full/10.1111/jgh.15212, abgerufen am 05.01.2022.
López-Lázaro, M. (2008): Anticancer and carcinogenic properties of curcumin: Considerations for ist clinical development as a cancer chemopreventive and chemotherapeutic agent. Mol. Nutr. Food Res. 2008;52:103-127. https://personal.us.es/mlopezlazaro/2008.%20Mol%20Nutr%20Food%20Res.%20Curcumin.pdf, abgerufen am 05.01.2022.
Magsi, I. et al. (2021): Response of Helicobacter Pylori Eradication Treatment in Patients With Normal and Below-Normal Serum Vitamin D Levels. Cureus. 2021 Apr;13(4):e14777. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8169094/, abgerufen am 05.01.2022.
Mayyas, A. et al. (2021): Novel in vitro and in vivo anti-Helicobacter pylori effects of pomegranate peel ethanol extract. Vet World. 2021 Jan;14(1):120–8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7896906/, abgerufen am 05.01.2022.
Mei, H. & Tu, H. (2018): Vitamin C and Helicobacter pylori Infection: Current Knowledge and Future Prospects. Front Physiol. 2018; 9: 1103. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6102328/, abgerufen am 05.01.2022.
Mohammad Hosein Farzaei, Mohammad Abdollahi, and Roja Rahimi (2015): Role of dietary polyphenols in the management of peptic ulcer. World J Gastroenterol. 2015 Jun 7. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4458761/, abgerufen am: 06.12.2019.
Nikbazm, R. et al. (2021): The effect of cranberry supplementation on Helicobacter pylori eradication in H. pylori positive subjects: a systematic review and meta-analysis of randomised controlled trials. Br J Nutr . 2021 Oct 21;1-10. https://pubmed.ncbi.nlm.nih.gov/34670631/, abgerufen am 05.01.2022.
Panahi, Y. et al. (2021): Effect of Curcumin on Severity of Functional Dyspepsia: a Triple Blinded Clinical Trial. Adv Exp Med Biol. 2021;1308:119-26. https://pubmed.ncbi.nlm.nih.gov/33861441/, abgerufen am 05.01.2022.
Parsons, B.N. et al. (2017): Comparison of the human gastric microbiota in hypochlorhydric states arising as a result of Helicobacter pylori-induced atrophic gastritis, autoimmune atrophic gastritis and proton pump inhibitor use. PLoS Pathog. 2017 Nov;13(11): e1006653. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5667734/, abgerufen am: 06.12.2019.
Puljula, E. Et al. (2020): Antimicrobial Activities of Ellagitannins against Clostridiales perfringens, Escherichia coli, Lactobacillus plantarum and Staphylococcus aureus. Molecules. 2020 Aug; 25(16): 3714. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7465317/, abgerufen am 05.01.2022.
Rueda-Robles, A. et al. (2021): Impact of Dietary Patterns on H. pylori Infection and the Modulation of Microbiota to Counteract Its Effect. A Narrative Review. Pathogens. 2021 Jul;10(7):875. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8308520/, abgerufen am 05.01.2022.
Serafim, C. et al. (2020): A Review of the Role of Flavonoids in Peptic Ulcer (2010-2020). Molecules. 2020 Nov; 25(22):5431. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7699562/, abgerufen am 05.01.2022.
Seyyedmajidi, M.(2016): Addition of cranberry to proton pump inhibitor-based triple therapy for Helicobacter pylori eradication. J Res Pharm Pract.5(4): 248–251. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5084481, abgerufen am: 06.12.2019.
Sezikli, M. (2011):Efficacy of vitamins supplementation to therapy on Helicobacter pylori eradication in patients with low antioxidant capacity.Clin Res Hepatol Gastroenterol.35(11):745-9. https://www.ncbi.nlm.nih.gov/pubmed/21856267, abgerufen am: 16.09.2019.
Sgouras, D. et al. (2019): Activity and Functional Importance of Helicobacter pylori Virulence Factors. Adv Exp Med Biol. 2019;1149:35-56. https://pubmed.ncbi.nlm.nih.gov/31016624/, abgerufen am 05.01.2022.
Shafrir, A. et al. (2021): The Association between Serum Vitamin D Levels and Helicobacter pylori Presence and Eradication. Nutrients. 2021 Jan; 13(1): 278. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7835846/, abgerufen am 05.01.2022.
Shahawy, M.S.E. et al. (2021): Influence of adding vitamin D3 to standard clarithromycin-based triple therapy on the eradication rates of Helicobacter pylori infection. Arab J Gastroenterol . 2021 Sep;22(3):209-14. https://pubmed.ncbi.nlm.nih.gov/34521593/, abgerufen am 05.01.2022.
Sharaf, M. et al. (2021): Co-delivery of hesperidin and clarithromycin in a nanostructured lipid carrier for the eradication of Helicobacter pylori in vitro. Bioorg Chem. 2021 Jul;112:104896. https://pubmed.ncbi.nlm.nih.gov/33901764/, abgerufen am 05.01.2022.
Shariati A, Fallah F et al. (2019): The possible role of bacteria, viruses, and parasites in initiation and exacerbation of irritable bowel syndrome. J Cell Physiol. 2019 Jun. https://www.ncbi.nlm.nih.gov/pubmed/30480810, abgerufen am: 06.12.2019.
Shi, X. et al. (2019): Efficacy and safety of probiotics in eradicating Helicobacter pylori: A network meta-analysis. Medicine (Baltimore). 2019 Apr;98(15):e15180. https://pubmed.ncbi.nlm.nih.gov/30985706/, abgerufen am 05.01.2022.
Shmuely, H. (2007): Effect of cranberry juice on eradication of Helicobacter pylori in patients treated with antibiotics and a proton pump inhibitor. Mol Nutr Food Res. 51(6):746-51. https://www.ncbi.nlm.nih.gov/pubmed/17487928, abgerufen am: 16.09.2019.
Shmuley, H. et al. (2016): Non-pharmacological treatment of Helicobacter pylori. World J Gastrointest Pharmacol Ther. 2016 May 6;7(2):171-8. https://pubmed.ncbi.nlm.nih.gov/27158532/, abgerufen am 05.01.2022.
Sivam, G.P. (2001): Protection against Helicobacter pylori and other bacterial infections by garlic. J Nutr. 2001 Mar;131(3s):1106S-8S. https://pubmed.ncbi.nlm.nih.gov/11238826/, abgerufen am 05.01.2022.
Surmeli, D.M. et al. (2019): Vitamin D deficiency and risk of Helicobacter pylori infection in older adults: a cross-sectional study. Aging Clin Exp Res. 2019 Jul;31(7):985-91. https://pubmed.ncbi.nlm.nih.gov/30267333/, abgerufen am 05.01.2022.
Tuorkey, M.J. (2014): Curcumin a potent cancer preventive agent: Mechanisms of cancer cell killing. Interv Med Appl Sci. 2014 Dec;6(4):139–46. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4274352/, abgerufen am 05.01.2022.
Turk J Gastroenterol. 26(6):456-60. abgerufen am 16.09.2019. https://www.ncbi.nlm.nih.gov/pubmed/26510082, abgerufen am: 16.09.2019.
Ullah, H. et al. (2021): Vegetable Extracts and Nutrients Useful in the Recovery from Helicobacter pylori Infection: A Systematic Review on Clinical Trials. Molecules. 2021 Apr;26(8):2272. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8070974/, abgerufen am 05.01.2022.
Vural, A. et al. (2017): Long-Term Protective Effect of N-Acetylcysteine against Amikacin-Induced Ototoxicity in End-Stage Renal Disease: A Randomized Trial. Perit Dial Int. Jan-Feb 2018;38(1):57-62. https://pubmed.ncbi.nlm.nih.gov/29097487/, abgerufen am 05.01.2022.
Wirth, H.P. & Yang, M. (2016): Different Pathophysiology of Gastritis in East and West? A Western Perspective. Inflamm Intest Dis. 2016 Oct;1(3):113–22. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5988118/, abgerufen am: 06.12.2019.
Woo HD, Lee J et al. (2014): Dietary flavonoids and gastric cancer risk in a Korean population. Nutrients. 2014 Nov. https://www.ncbi.nlm.nih.gov/pubmed/25389898, abgerufen am: 06.12.2019.
Yang, L. et al. (2019): Effect of vitamin D on Helicobacter pylori infection and eradication: A meta-analysis. Helicobacter. 2019 Oct;24(5):e12655. https://pubmed.ncbi.nlm.nih.gov/31411799/, abgerufen am 05.01.2022.
Yeon, MJ. (2019): Anti-inflammatory effects of Kaempferol on Helicobacter pylori-induced inflammation.Biosci Biotechnol Biochem. 83(1). https://www.ncbi.nlm.nih.gov/pubmed/30286691, abgerufen am: 16.09.2019.
Yildirim, O. et al. (2017): The influence of vitamin D deficiency on eradication rates of Helicobacter pylori. Adv Clin Exp Med. 2017 Dec;26(9):1377-81. https://pubmed.ncbi.nlm.nih.gov/29442458/, abgerufen am 05.01.2022.
Yoon, H. (2016): Effects of N-acetylcysteine on First-Line Sequential Therapy for Helicobacter pylori Infection: A Randomized Controlled Pilot Trial. Gut Liver. 10(4): 520–525. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4933410/, abgerufen am: 16.09.2019.
Yu, M. et al. (2019): Efficacy of Lactobacillus-supplemented triple therapy for H. pylori eradication: A meta-analysis of randomized controlled trials. PLoS One. 2019 Oct 2;14(10):e0223309. https://pubmed.ncbi.nlm.nih.gov/31577828/, abgerufen am 05.01.2022.
Zhang, L. (2005): Efficacy of cranberry juice on Helicobacter pylori infection: a double-blind, randomized placebo-controlled trial.Helicobacter. 10(2):139-45. https://www.ncbi.nlm.nih.gov/pubmed/15810945, abgerufen am: 16.09.2019.
Zhang, M. et al. (2020): Meta-analysis of the efficacy of probiotic-supplemented therapy on the eradication of H. pylori and incidence of therapy-associated side effects. Microb Pathog . 2020 Oct;147:104403. https://pubmed.ncbi.nlm.nih.gov/32707316/, abgerufen am 05.01.2022.
Zheng, M. et al. (2021): Virulence factors impair epithelial junctions during bacterial infection. J Clin Lab Anal. 2021 Feb;35(2):e23627. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7891540/, abgerufen am 05.01.2022.
Zhou, A. et al. (2020): Vitamin D3 Inhibits Helicobacter pylori Infection by Activating the VitD3/VDR-CAMP Pathway in Mice. Front Cell Infect Microbiol. 2020; 10: 566730. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7646218/, abgerufen am 05.01.2022.
Zhou, B.G. et al. (2019): Saccharomyces boulardii as an adjuvant therapy for Helicobacter pylori eradication: A systematic review and meta-analysis with trial sequential analysis. Helicobacter. 2019 Oct;24(5):e12651. https://pubmed.ncbi.nlm.nih.gov/31414551/, abgerufen am 05.01.2022.