Bei einer Leberzirrhose wird das Lebergewebe durch Bindegewebe ersetzt, wodurch die Leber nach und nach ihre Funktion einbüßt. Die Erkrankung ist nicht heilbar, allerdings lassen sich das Fortschreiten verlangsamen und schwerwiegende Folgeerkrankungen vermeiden. Auch die Mikronährstoffmedizin kann hierzu einen wertvollen Beitrag leisten. Lesen Sie hier, von welchen Vitaminen, Mineralstoffen und Aminosäuren Sie bei einer Leberzirrhose besonders profitieren.
Ursachen und Symptome
Was ist eine Leberzirrhose und welche Ursachen hat sie?

Bei einer Leberzirrhose wird das Lebergewebe zerstört und zunehmend durch Bindegewebe ersetzt: Die Leber vernarbt und schrumpft. Deshalb wird eine Leberzirrhose auch Schrumpfleber genannt. Die Leberzirrhose tritt meist als Endstadium verschiedener chronischer Lebererkrankungen auf.
In Deutschland zählt die nicht alkoholische Fettleber noch weit vor der alkoholischen Fettleber zu den häufigsten Ursachen einer Leberzirrhose. Während die alkoholische Fettleber Folge eines Alkoholmissbrauchs ist, tritt die nicht alkoholische Fettlebererkrankung meist bei Menschen mit starkem Übergewicht (Adipositas) oder mit einem Diabetes Typ 2 auf.
Weitere Ursachen für eine Leberzirrhose sind Infektionen mit bestimmten Hepatitisviren, erbliche Stoffwechsel- sowie Autoimmunerkrankungen und Giftstoffe. Auch einige Medikamente, insbesondere der Wirkstoff Paracetamol, können die Leber schädigen und bei einer Überdosierung zu Leberversagen führen.
Info
Wurde bei Ihnen eine beginnende Fettleber festgestellt? Dann finden Sie alle Informationen über Mikronährstoffmedizin bei einer Fettleber hier.
Wie äußert sich eine Leberzirrhose?
Bei einer Leberzirrhose können verschiedene Symptome auftreten:
- Müdigkeit, Abgeschlagenheit
- Druck- und Völlegefühl im Oberbauch
- Blähungen, Übelkeit
- Gewichtsverlust, Unterernährung, verringertes Geschmacksempfinden
- Ödeme (Wassereinlagerungen), Wasser im Bauch (Aszites)
- Gelbsucht
- eingeschränkte Nierenfunktion (Nierenschwäche), Nierenversagen
Typisch sind auch charakteristische Veränderungen der Haut, die sogenannten Leberhautzeichen:
- Gefäßspinnen an Oberkörper, Hals und Gesicht (rote Gefäßknötchen, von denen sich kleine Gefäße spinnennetzartig nach außen ziehen)
- rot gefärbte Handinnenflächen
- auffallend rote, glänzende Lippen und Zunge (Lacklippen, Lackzunge)
- Juckreiz
- Weißfärbung der Nägel
- sehr dünne, zerknitterte Haut (Geldscheinhaut) mit deutlich sichtbaren Blutgefäßen
Welche Folgeerkrankungen können bei einer Leberzirrhose auftreten?
Die Leber spielt eine wichtige Rolle bei der Entgiftung des Körpers. Bei einer Leberzirrhose kann die Leber dieser Aufgabe nicht mehr ausreichend nachkommen. Schädliches Ammoniak sammelt sich an, gelangt ins Gehirn und beeinträchtigt dessen Funktion (hepatische Enzephalopathie). Es kommt zu neurologischen Beschwerden wie Muskelzuckungen, Gangunsicherheit und Zittern. Im Endstadium sind die Betroffenen zunehmend verwirrt und orientierungslos. Es kann bis zur Bewusstlosigkeit (Leberkoma) kommen.
Außerdem ist die Leberzirrhose für die Mehrheit aller Leberkrebs-Erkrankungen (Leberzellkarzinom) verantwortlich.
Eine weitere Folge der Leberzirrhose sind Krampfadern in den Organen. Sie entstehen durch einen erhöhten Blutdruck innerhalb des Leberkreislaufs (Pfortaderhochdruck). Die Krampfadern bilden sich in Speiseröhre (Ösophagusvarizen) und Magen. Von ihnen können gefährliche Blutungen ausgehen.
Ziele der Behandlung
Wie wird eine Leberzirrhose klassisch behandelt?
Eine Leberzirrhose ist nicht heilbar und bereits entstandene Schäden können nicht mehr rückgängig gemacht werden. Ziel ist es deshalb, das Fortschreiten der Leberzirrhose sowie Folgeerkrankungen zu verhindern. Dafür müssen vor allem die Ursachen der Erkrankung beseitigt werden.
Wird die Erkrankung durch übermäßigen Alkoholkonsum ausgelöst, ist der Verzicht auf Alkohol unerlässlich. Bei einer Hepatitis-Infektion kommen Medikamente gegen die Viren zum Einsatz, bei einer Autoimmunerkrankung erhalten die Betroffenen Arzneimittel, die das Immunsystem unterdrücken.
Grundsätzlich ist es wichtig, Stoffe zu meiden, die die Leber weiter schädigen können. Hierzu zählen neben Alkohol auch viele Medikamente: Menschen, die an einer Leberzirrhose leiden, sollten deshalb ihre Medikation vom behandelnden Arzt überprüfen lassen. Auch eine gesunde Ernährung mit einer ausreichenden Vitamin- und Nährstoffzufuhr wirkt sich günstig auf die Erkrankung aus.
Zusätzlich werden die Symptome behandelt – wie der Bluthochdruck in der Leber, Flüssigkeitsansammlungen im Bauch oder die Funktionsstörung des Gehirns aufgrund der Ammoniak-Vergiftung (hepatische Enzephalopathie). Im schlimmsten Fall muss eine neue Leber transplantiert werden.
Info
Eiweißarm oder normale Eiweißzufuhr? Früher verordnete man Menschen mit einer Leberzirrhose eine eiweißarme Diät, da sich eine hepatische Enzephalopathie durch eine sehr eiweißreiche Ernährung verschlechtern kann. Im Eiweißstoffwechsel entsteht Ammoniak, das die kranke Leber nicht mehr entgiften kann. Heute ist dies nicht mehr üblich, da eine ausreichende Eiweißzufuhr wiederum wichtig für einen guten Allgemeinzustand ist.
Es ist jedoch bei der Einnahme von Aminosäuren und viel Eiweiß ratsam, die Darmfunktion zu unterstützen. Ein gesunder Darm könnte die Produktion von Ammoniak reduzieren. Der Körper ist mit jeder zusätzlichen Ammoniakbelastung überfordert. Zum Beispiel helfen möglicherweise Präparate mit nützlichen Darmbakterien (Probiotika) oder Laktulose. Laktulose ist ein Zucker, der abführend wirkt und die Darmflora positiv beeinflusst (präbiotisch). Damit verhindert er die Produktion und Aufnahme von schädlichem Ammoniak aus dem Darm und Blut. Die Wirkung von Laktulose kann durch das Antibiotikum Rifaximin verbessert werden. Zusätzlich sollte man den Ammoniakspiegel regelmäßig prüfen lassen.
Ziele der Mikronährstoffmedizin

Lebererkrankungen sind häufig mit einer Mangelernährung verbunden. Neben einer ausreichenden Kalorienzufuhr ist insbesondere die Versorgung mit B-Vitaminen, fettlöslichen Vitaminen und Antioxidantien gefährdet: Die Leber ist für die Verdauung und Verstoffwechselung von Nährstoffen absolut notwendig. Hinzu kommt, dass sich alkoholkranke Menschen häufig sehr einseitig und nährstoffarm ernähren.
Die Mikronährstoffmedizin zielt darauf ab, solche Mangelzustände zu verhindern oder auszugleichen. Zudem kann sie die Ammoniakentgiftung fördern, den Muskelaufbau stärken und entzündlichen Vorgängen entgegenwirken:
- B-Vitamine sowie die fettlöslichen Vitamine A, D und K gleichen die leberbedingten Mangelzustände aus.
- Antioxidantien wie Vitamin C, Vitamin E, Selen, Zink und Glutathion schützen die Leber vor Sauerstoffradikalen, welche die Erkrankung begünstigen.
- Mariendistel und andere Heilpflanzen verbessern die Leberwerte.
- Verzweigtkettige Aminosäuren (BCAA) sind wichtig für den Muskelaufbau. Zusammen mit den Aminosäuren Ornithin und Aspartat (LOLA) unterstützen sie den Körper bei der Entgiftung von Ammoniak.
- Taurin lindert Muskelkrämpfe infolge der Lebererkrankung.
- Cholin verbessert die Regenerationsfähigkeit und den Fettstoffwechsel der Leber.
- Carnitin fördert den Energie- und Fettstoffwechsel.
- Probiotika unterstützen die Entgiftung.
Die Maßnahmen sollten möglichst früh begonnen werden, weil die Leber dann noch ausreichend regenerative Fähigkeiten hat. Einige Mikronährstoffe eignen sich auch für eine Kombinationstherapie mit klassischen Mitteln (zum Beispiel Laktulose, BCAA, LOLA und Rifaximin oder auch Zink und LOLA).
Behandlung mit Mikronährstoffen
Vitamin-B-Mangel-Gefahr: verringerte Speicherleistung der Leber und geringe Aufnahme
Wirkweise von B-Vitaminen
B-Vitamine sind am Energie- und Zuckerstoffwechsel beteiligt. Ihre Zufuhr über die Ernährung, Aufnahme im Darm sowie die Speicherung in der Leber sind vor allem bei einer alkoholischen Leberzirrhose oft beeinträchtigt. Ein Mangel an B-Vitaminen (wie B12- und Folsäure) ist bei chronischen Lebererkrankungen mit schlechteren Leberwerten verbunden. Es drohen schwerwiegende Folgeerkrankungen: Vitamin-B1-Mangel führt zur Schädigung der Nerven (Wernicke-Korsakow-Syndrom/Enzephalopathie); Vitamin-B12-Mangel löst Blutarmut (Anämie) aus.
Zahlreiche Beobachtungsstudien belegen, dass ein Mangel an Vitamin B6, B12 und Folsäure den Homocysteinspiegel steigen lässt. Homocystein ist ein kritischer Stoff, der natürlicherweise im Stoffwechsel entsteht und fortlaufend entgiftet werden muss. Hohe Spiegel sind bei einer Leberzirrhose oft mit einem schweren Krankheitsverlauf verbunden.
Erste Studienergebnisse weisen außerdem darauf hin, dass sich durch die Einnahme von Vitamin B1 die Blutzuckerwerte von Patienten mit einer Leberzirrhose verbessern. Es sind jedoch weitere Studien erforderlich, um den Einfluss des Vitamin-B-Status auf den Verlauf chronischer Lebererkrankungen zu untersuchen.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Empfohlen wird die Einnahme eines Kombinationspräparats, bei dem die Dosis aller B-Vitamine aufeinander abgestimmt ist. Es sollte mindestens den täglichen Bedarf decken – zum Beispiel jeweils 3 bis 6 Milligramm Vitamin B1, B2, und B6, 200 bis 400 Mikrogramm Folsäure und 5 bis 10 Mikrogramm Vitamin B12.
Bei schwerer Leberzirrhose und Vitaminmangel empfehlen Mikronährstoff-Experten höhere Dosierungen wie 10 bis 25 Milligramm Vitamin B1, B2 und B6, 400 bis 800 Mikrogramm Folsäure sowie ab 10 Mikrogramm Vitamin B12. Entscheidend ist die regelmäßige Kontrolle der Blutwerte.
Im Fall einer hepatischen Enzephalopathie muss Vitamin B1 im Krankenhaus anfangs noch höher dosiert werden (zum Beispiel dreimal täglich 100 bis 200 Milligramm) – am besten über die Vene, denn die Aufnahme im Darm ist begrenzt. Wirkt die Therapie, werden nach circa 3 bis 5 Tagen Präparate zum Einnehmen empfohlen (zum Beispiel für 30 Tage 200 bis 300 Milligramm Vitamin B1).
Im Falle einer hepatischen Enzephalopathie muss hoch dosiertes Vitamin B1 (etwa 100 Milligramm) direkt über die Vene zugeführt werden. Die Weiterbehandlung erfolgt für weitere 30 Tage mit jeweils 300 Milligramm Vitamin B1 in Form eines Nahrungsergänzungsmittels.
Tipp
Folsäure als aktive 5-Methyltetrahydrofolsäure (5-MTHF): Viele Menschen können Folsäure aufgrund eines Gendefekts nicht ausreichend aktivieren. Deshalb empfiehlt sich die Einnahme der bereits aktiven Form 5-MTHF.
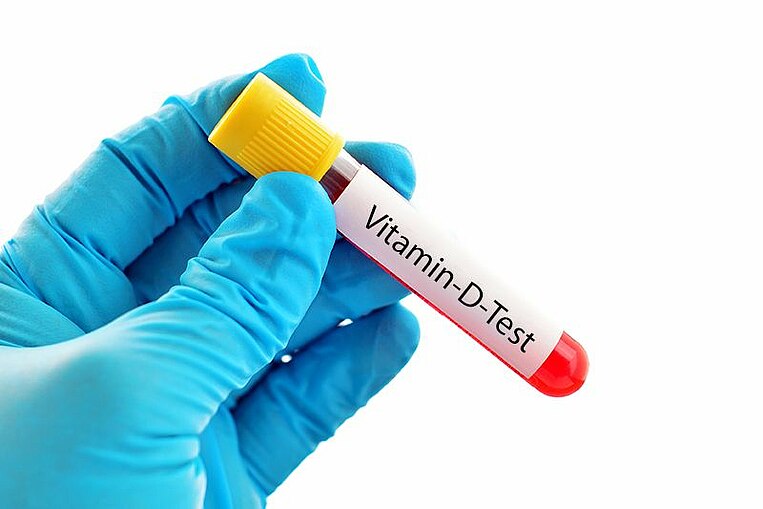
B-Vitamine und Homocystein im Labor bestimmen lassen
Um einen Mangel zu erkennen, können die einzelnen B-Vitamine im Blut bestimmt werden. Vor allem Vitamin B12 sollte regelmäßig überprüft werden, da es in der Leber gespeichert wird. Am besten misst der Arzt Vitamin B12 als Holotranscobalamin. Normale Werte liegen über 54 Pikomol pro Liter Blut. Betroffene mit einer fortgeschrittenen Leberzirrhose können jedoch auch zu hohe Werte haben.
Expertenwissen
Man vermutet, dass die sterbenden Leberzellen gespeichertes Vitamin B12 ins Blut abgeben. Zudem kann die kranke Leber Vitamin B12 weder speichern noch über Leber und Galle ausscheiden. Es bleibt deshalb im Blut. Vermutlich handelt es sich dabei um Haptocorrin, eine Vitamin-B12-Form, die nicht direkt genutzt werden kann. Ob der Körper dann von einem klinischen Vitamin-B12-Mangel betroffen ist, wurde nicht untersucht. In diesem Fall kann man sich jedoch am Homocysteinwert orientieren.
Bei einer Leberzirrhose kann es zudem sinnvoll sein, die Homocysteinwerte regelmäßig überprüfen zu lassen. Homocystein ist ein indirektes Maß für die Versorgung mit B-Vitaminen und wird im Blutplasma bestimmt, dem flüssigen Teil des Blutes ohne Blutzellen. Als Normwerte gelten 5 bis 9 Mikromol pro Liter.
B-Vitamine: zu beachten während der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
B-Vitamine sollten in hoher Dosierung in der Schwangerschaft und Stillzeit nur bei einem nachgewiesenen Mangel und nach Absprache mit dem Frauenarzt eingenommen werden.
Personen mit beeinträchtigter Nierenfunktion können erhöhte Vitamin-B12-Blutwerte haben. Sie sollten vor der Einnahme mit dem Arzt sprechen. Zudem ist Vitamin B12 in Form von Cyanocobalamin für sie vermutlich schädlich. Sie sollten stattdessen Methylcobalamin wählen.
Bei Krebs und hohem Krebsrisiko (Raucher) könnten dauerhaft hoch dosiertes Vitamin B12 und Folsäure das Fortschreiten oder die Entwicklung fördern. Daher sollte die Ergänzung von Vitamin B12 über 55 Mikrogramm und Folsäure über 500 Mikrogramm pro Tag mit dem Arzt abgesprochen sein.
Vitamin B6 kann in hoher Dosierung (ab 5 Milligramm pro Tag) die Wirkung von Antiepileptika (Phenobarbital (Luminal®) und Phenytoin (Phenhydan®)) sowie von Parkinsonmitteln (wie L-Dopa, zum Beispiel Levopar®, Madopar®) abschwächen.
Gegen Infektionskrankheiten werden Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®) eingesetzt. Folsäure vermindert die Wirkung dieser Medikamente.
Fettlösliche Vitamine: Leberpatienten oft mangelhaft versorgt
Wirkweise der fettlöslichen Vitamine D, K und A
Bei chronischen Lebererkrankungen ist häufig die Aufnahme von Fetten und damit auch von fettlöslichen Vitaminen wie Vitamin D, K und A eingeschränkt: In der Leber wird normalerweise die für die Fettverwertung benötigte Gallensäure gebildet. Zudem werden fettlösliche Vitamine in der Leber gespeichert. Die Speicherung ist bei einer Leberzirrhose vermindert, sodass es häufig zu einem Mangel kommt.
Vitamin D: Forscher werteten mehrere Beobachtungsstudien aus und fanden heraus, dass ein Vitamin-D-Mangel mit einer erhöhten Sterblichkeit bei Leberzirrhose verbunden ist. Erste Ergebnisse weisen auch darauf hin, dass eine Vitamin-D-Einnahme die Gewebeveränderungen in der Leber günstig beeinflussen und das Fortschreiten eindämmen könnte. Ebenso könnte Vitamin D den Muskelschwund sowie den Kraftverlust bei einer Leberzirrhose aufhalten. Allerdings ist der Nutzen noch nicht endgültig bewertet.
Vitamin K: Vitamin K ist an der Blutgerinnung beteiligt. Ein Mangel kann dementsprechend zu einer höheren Neigung zu Blutungen führen. Es gibt vereinzelte Hinweise darauf, dass Vitamin K die Blutgerinnung bei Patienten mit Leberzirrhose normalisiert. Insgesamt ist die Datenlage jedoch noch unsicher.
Vitamin A: Vitamin A verbessert bei einer Leberzirrhose möglicherweise den Geschmackssinn. Ein verringertes Geruchs- und Geschmacksempfinden kann bei Betroffenen eine Mangelernährung begünstigen. Darüber hinaus wird ein Zusammenhang zwischen einem Vitamin-A-Mangel und dem Fortschreiten der Lebervernarbung vermutet.
Dosierung und Einnahmeempfehlung der Vitamine D, K und A
Als Faustregel für Vitamin D ist bei Leberzirrhose eine Dosis von 1.000 bis 2.000 Internationale Einheiten ratsam. Vorher sollte man seinen Spiegel bei einem Arzt bestimmen lassen, um die richtige Dosierung zu finden. Alles darüber erfahren Sie hier.
Auch empfehlen Mikronährstoff-Experten unter engmaschiger Verlaufskontrolle täglich 400 Mikrogramm Vitamin A oder alternativ rund 9 Milligramm Beta-Carotin. Aus Beta-Carotin kann der Körper selbst Vitamin A herstellen. Zudem sind je nach Schweregrad der Leberzirrhose 60 bis 300 Mikrogramm Vitamin K sinnvoll. Idealerweise sollten die Spiegel im Blut sowie die Gerinnungswerte kontrolliert werden.
Da die Aufnahme der fettlöslichen Vitamine im Darm eingeschränkt sein kann, legt der Experte auch manchmal höhere Dosierungen fest. Präparate sollte man zu einer fetthaltigen Mahlzeit einnehmen, da sie so am besten im Darm aufgenommen werden.
Expertenwissen
Bei einer Fettleber ist ein stark veränderter Vitamin-A-Stoffwechsel möglich: Nach neueren Studien sind bestimmte Genmutationen (PNPLA3 Gen, Variation p.I148M) an der Entwicklung beteiligt. Diese führen im Serum zu niedrigen Vitamin-A-Spiegeln. In Leberzellen wird Vitamin A jedoch vermehrt als Retinylpalmitat angereichert. Dort verursacht es Stoffwechseländerungen. Folgen sind ein Fortschreiten der Fettleber und eine erhöhte Leberkrebsrate. Unklar ist, wie zusätzliches Vitamin A hier wirkt. Daher sollte es bei Fettlebererkrankungen mit Bedacht eingesetzt werden. Beta-Carotin könnte eine Alternative sein, sollte aber ebenfalls vorsichtig genutzt werden.
Fettlösliche Vitamine im Labor bestimmen lassen
Zwar herrscht bei Lebererkrankungen im Blut oft ein Mangel an Vitamin A, allerdings kann es – vor allem bei einer Fettleber – auch zu einer Überversorgung in der Leber kommen. Zu viel Vitamin A wirkt sich dann nachteilig aus. Daher sollte der Arzt zum einen die Blutspiegel an Vitamin A kontrollieren. Normal sind bei Frauen 40 bis 70 und bei Männern 42,5 bis 83 Mikrogramm pro Deziliter Blutserum. Zum anderen wird das Vitamin-A-bindende Eiweiß (Retinol-bindendes Protein) als Marker für die Gesundheit der Leber diskutiert. Die Werte sollten nicht erhöht sein, wenn man bei einer Fettleber Vitamin A einnimmt.
Normale Vitamin-K-Werte im Blut liegen bei 1 Nanomol pro Liter, können allerdings sehr stark schwanken. Deshalb sollten noch andere Marker bestimmt werden (zum Beispiel Prothrombinzeit (INR-Wert)).
Auch empfehlen Mikronährstoff-Experten, den Vitamin-D-Wert zweimal im Jahr kontrollieren zu lassen, damit ein Mangel rechtzeitig erkannt wird. Dafür bestimmt man die Transportform dieses Vitamins im Blut – das sogenannte 25(OH)-Vitamin D (Calcidiol). Optimalerweise sollte der Vitamin-D-Spiegel bei 40 bis 60 Nanogramm pro Milliliter liegen (oder 100 bis 150 Nanomol pro Liter).
Vitamin D, K und A: zu beachten während der Schwangerschaft, bei Erkrankungen und Medikamenteneinnahme
Vitamin A sollte in der Schwangerschaft nur bei einem nachgewiesenen Mangel und in Rücksprache mit dem Arzt eingenommen werden. Bei der Vorstufe Beta-Carotin ist keine Überdosierung von Vitamin A möglich. Es wird vom Körper nur bei Bedarf zu Vitamin A umgewandelt.
Raucher sollten inklusive der verzehrten Lebensmittel 10 Milligramm Beta-Carotin pro Tag nicht überschreiten. Vor allem bei Alkoholikern, die rauchen, könnte es das Lungenkrebsrisiko erhöhen.
Bei einer Nierenschwäche ist von einer Vitamin-A- oder Beta-Carotin-Einnahme abzuraten: Der Abbau ist gestört. Auch Vitamin D sollte dann nur nach Rücksprache mit dem Arzt eingenommen werden: Betroffene haben manchmal zu hohe Calciumspiegel im Blut. Da Vitamin D die Calciumaufnahme im Darm fördert, können die Calciumspiegel zu stark steigen. Personen mit Nierensteinen (calciumhaltige Steine) müssen ebenfalls aufpassen.
Bei einigen Krankheiten ist ein gestörter Calcium- und Phosphatstoffwechsel möglich, zum Beispiel bei der Bindegewebserkrankung Sarkoidose sowie einer Nebenschilddrüsenüberfunktion. Betroffene sollten Vitamin D nur unter ärztlicher Kontrolle ergänzen.
Wenn Sie auf die folgenden Medikamente angewiesen sind, sollten Sie die Einnahme entsprechender Vitaminpräparate mit Ihrem Arzt besprechen. Es kann zu Wechselwirkungen kommen:
- Vitamin D zusammen mit Entwässerungsmedikamenten aus der Wirkstoffgruppe der Thiazide (wie Hydrochlorothiazid (zum Beispiel Disalunil®) und Indapamid (zum Beispiel Inda Puren®)) können zu überhöhten Calciumwerten führen.
- Vitamin K bei Blutverdünnern aus der Klasse der Cumarine mit den Wirkstoffen Phenprocoumon (zum Beispiel Marcumar®) oder Warfarin (Coumadin®) kann die Wirkung verschlechtern.
- Vitamin A und Medikamente zur Behandlung von Hauterkrankungen wie Schuppenflechte (Psoriasis) könnten zusammen zu einer Überdosierung führen. Die Medikamente enthalten bereits eine spezielle Vitamin-A-Form (Retinoide).
Vitamin E, C und andere Antioxidantien können vor weiteren Leberschäden schützen
Wirkweise von Antioxidantien
Durch übermäßigen Alkoholkonsum oder durch bereits bestehende Leberzellschäden und Entzündungen wird der Körper hohem oxidativem Stress ausgesetzt. Dadurch erschöpfen die Vorräte an Antioxidantien. Oxidativer Stress ist wahrscheinlich für das Fortschreiten der Erkrankung mit verantwortlich. Laut zwei Beobachtungsstudien gibt es bei Personen mit nicht alkoholischer Fettleber und einer daraus folgenden Leberentzündung (Steatohepatitis) erhöhte Marker für oxidativen Stress.
Die gezielte Zufuhr von Vitamin E, C und anderen Antioxidantien wie Glutathion und Grüntee-Catechinen kann oxidativem Stress entgegenwirken.
Vitamin E: Der Nutzen einer Vitamin-E-Ergänzung scheint von der Art des Leberschadens abzuhängen. So profitierten Patienten mit einer nicht alkoholischen Fettleber laut mehrerer Übersichtsarbeiten von einer Verbesserung der Leberwerte. In einer hochwertigen Studie verringerten sich die Entzündungswerte, die Leberverfettung und der Zirrhoseprozess. Allerdings konnte nicht immer ein Effekt auf diesen Prozess festgestellt werden. Bei Patienten mit einer fortgeschrittenen alkoholbedingten Leberzirrhose gab es keinen Nutzen.
Vitamin C: Erste Studien weisen darauf hin, dass Vitamin C die Funktion der Blutgefäße verbessern und den bei vielen Betroffenen erhöhten Blutdruck im Leberkreislauf senken kann. Vitamin C ist auch notwendig, um Vitamin E zu regenerieren. Eine hochwertige Studie zeigt bei nicht alkoholischer Fettleber eine Verbesserung der Leberwerte durch die kombinierte Einnahme von Vitamin E und C. In einer Vorstudie waren die beiden Vitamine sogar erfolgreicher als ein übliches Medikament (Ursodeoxycholsäure) bei Lebererkrankungen.
Glutathion: Das Antioxidans Glutathion wird in der Leber hergestellt. Bei Leberpatienten könnte dies beeinträchtigt sein. Niedrige Glutathionswerte sind mit einem schlechteren Leberzustand verbunden. Es gibt erste Hinweise darauf, dass die Einnahme von Glutathion bei einer nicht alkoholabhängigen Fettleber die Leberwerte verbessern kann. Jedoch fanden andere Forscher keinen Effekt.
Insgesamt weisen einige Studien darauf hin, dass verschiedene Antioxidantien eine Leberzirrhose günstig beeinflussen können. Allerdings ist der Nutzen für alle Leberpatienten noch nicht eindeutig bewiesen. Da ein Sicherheitsrisiko nicht bekannt ist, könnte eine Einnahme versucht werden.
Dosierung und Einnahmeempfehlung von Antioxidantien
Mikronährstoff-Experten empfehlen bei einer Leberzirrhose eine Dosis von 300 bis 670 Milligramm Vitamin E pro Tag. Eine solche Vitamin-E-Therapie (über 50 Milligramm) sollte aber mit einem Arzt oder Mikronährstoff-Experten abgesprochen werden. Leberpatienten können Gerinnungsstörungen haben, sodass der Arzt die Gerinnungswerte prüfen sollte, wenn hoch dosiertes Vitamin E eingenommen wird. Vitamin E verringert die Blutgerinnung. Für Raucher sind mehr als 50 Milligramm Vitamin E pro Tag wegen der möglichen Gefahr einer Hirnblutung und eines leicht erhöhten Lungenkrebsrisikos nicht geeignet.
Vitamin C kann täglich in einer Menge von 1.000 bis 2.000 Milligramm ergänzt werden. Für Glutathion empfiehlt sich eine Dosis von 100 bis 300 Milligramm pro Tag.
Vitamin E wird idealerweise mit Vitamin C kombiniert: Vitamin C regeneriert Vitamin E, nachdem dieses ein freies Radikal abgefangen hat. In Kombinationspräparaten ist die Dosis an Antioxidantien optimal aufeinander abgestimmt und oft deutlich niedriger.
Nehmen Sie Vitamin E zum Essen ein, da es zusammen mit Fett am besten aufgenommen wird. Glutathion sollte man mindestens eine Stunde vor oder zwei Stunden nach einer Mahlzeit zu sich nehmen, da seine Aufnahme durch andere Nahrungsbestandteile gehemmt wird.
Antioxidantien: zu beachten in der Schwangerschaft und Stillzeit sowie bei Erkrankungen und Medikamenteneinnahme
Vitamin C wird für Schwangere bis 110 Milligramm empfohlen und für Stillende bis 150 Milligramm. Eine Rücksprache mit dem Arzt ist bei höheren Mengen angebracht. Wahrscheinlich sind in der Schwangerschaft und Stillzeit Dosierungen bis maximal 1.800 Milligramm pro Tag aber sicher.
Bei Nierenschwäche sollten nicht mehr als 500 Milligramm Vitamin C pro Tag eingenommen werden. Kranke Nieren können damit nicht umgehen. Bei einer Neigung zu Nierensteinen sollten nicht mehr als 1.000 Milligramm Vitamin C pro Tag ergänzt werden.
Da Vitamin C die Eisenaufnahme verbessert, sollten bei Menschen mit krankhafter Eisenüberladung (Hämochromatose) höhere Vitamin-C-Gaben nur unter ärztlicher Aufsicht erfolgen.
Hoch dosiertes Vitamin E (über 400 Milligramm) kann die Wirkung von Insulin verbessern. Diabetiker, die Insulin spritzen, sollten dann häufig den Blutzucker messen, um eine Unterzuckerung zu vermeiden.
Bei Einnahme hoher Vitamin-E-Mengen (über 300 Milligramm) oder von mehr als 1.000 Milligramm Vitamin C kann es zu Wechselwirkungen mit Blutverdünnern kommen. Sprechen Sie dann mit Ihrem Arzt. Dazu gehören beispielsweise die Wirkstoffe Warfarin (wie Coumadin®), Phenprocoumon (wie Marcumar®), Acetylsalicylsäure (wie Aspirin®), Dabigatran (wie Pradaxa®) und Rivaroxaban (wie Xarelto®).
Aufgrund eines erhöhten Blutungsrisikos sollte hoch dosiertes Vitamin E 14 Tage vor einem operativen Eingriff in Absprache mit dem Arzt abgesetzt werden. Auch bei einem starken Vitamin-K-Mangel droht eine hohe Blutungsgefahr. Vitamin E sollte dann nur eingenommen werden, wenn der Vitamin-K-Mangel ausgeglichen worden ist.
Vitamin C und E könnten die Wirkung von Krebsmedikamenten beeinträchtigen, wie die des Blutkrebs-Medikaments Bortezomib (Velcade®) sowie von Doxorubicin (wie Adriblastin®, Ribodoxo®), Methotrexat (wie Bendatrexat®, Lantarel®) und Cisplatin (wie Cis-GRY®). Die Ergänzung sollte bei Krebs deshalb mit dem Arzt abgesprochen sein.
Zink und Selen verlangsamen den Krankheitsfortschritt
Wirkweise von Zink und Selen
Zink und Selen sind an vielen Stoffwechselwegen in der Leber beteiligt. Bei einer Leberzirrhose kommt es häufig zu einer Mangelsituation, die sich negativ auf den Krankheitsverlauf auswirken kann. Es besteht der Verdacht, dass ein Zinkmangel bei erhöhten Kupferspiegeln die Entstehung von Leberkrebs begünstigt. Die Schutzwirkung von Selen und Zink beruht vermutlich auf ihren antioxidativen Eigenschaften. In den meisten Laborversuchen wirkte sich Selen positiv auf eine Entzündung, Verfettung oder Fibrose der Leber aus. Außerdem ist Zink notwendig für die Ammoniak-Entgiftung.
Zink: Eine hochwertige Studie zeigt, dass hoch dosiertes Zink (50 Milligramm) das Fortschreiten der Erkrankung aufhalten und die übermäßige Ansammlung von Kupfer verhindern könnte. Zudem verbesserten sich in einer hochwertigen Studie die Leberwerte und der Schweregrad der Leberzirrhose. Das konnte eine Übersichtsarbeit jedoch nicht bestätigen. Eine Senkung der Sterblichkeit wurde auch nicht festgestellt.
Tipp
Möglicherweise wirkt Zink besser, wenn es mit Laktulose kombiniert wird. Zink fördert zwar die Ammoniak-Entgiftung im Körper. Aber der gebundene Ammoniak muss auch ausgeschieden werden. Das kann mit Laktulose erreicht werden, wie Forscher in einer Übersichtsstudie schlussfolgern. So verringerte Zink in zwei Studienübersichten in Kombination mit Laktulose die Beeinträchtigung des Gehirns (hepatische Enzephalopathie).
Selen: Eine positive Wirkung von Selen wurde im Tierversuch an Mäusen gezeigt: Dort konnte die Gabe von Selen die Schädigung der Leber durch Alkohol abschwächen und das Absterben von Leberzellen verhindern. Ein erster Vorversuch am Menschen zeigt, dass Selen offensichtlich in Form von Natriumselenat besser wirkt als in Form von Selenomethionin. Menschen mit Lebererkrankungen können einen Mangel an Selen haben.
Dosierung und Einnahmeempfehlung von Zink und Selen
Mikronährstoff-Experten empfehlen pro Tag 5 bis 15 Milligramm Zink. Bei einer Leberzirrhose könnte die tägliche Zufuhr von 70 bis 100 Mikrogramm Selen positiv wirken. Idealerweise sollten die Zink- und Selenwerte im Blut regelmäßig kontrolliert werden, sodass die Behandlung gezielt erfolgen kann und die Mikronährstoffe auf Dauer nicht überdosiert werden.
Gut aufgenommen werden bei Zirrhose Zink-Histidin oder Zink-Aspartat. Zink- und Selenpräparate sollten am besten zu einer Mahlzeit eingenommen werden, da sie auf leeren Magen Magenprobleme verursachen können. Außerdem ist die Zinkaufnahme in Kombination mit Lebensmitteln – insbesondere tierischen Produkten – besser.
Tipp
Hoch dosiertes Vitamin C wandelt Selenit in eine nicht aufnehmbare Form um. So sollte zwischen der Einnahme von Selenit und Vitamin C ein Abstand von ein bis zwei Stunden liegen. Achten Sie bei einem Kombipräparat mit Vitamin C darauf, dass das Präparat Natriumselenat enthält.
Zink und Selen im Labor bestimmen lassen
Bei Leberzirrhose ist es sinnvoll, die Zinkspiegel zu überwachen. Zink ist vor allem in den roten Blutkörperchen enthalten. Daher misst man es am besten im Vollblut. Ein normaler Spiegel liegt zwischen 4 und 7,5 Milligramm pro Liter. Allerdings sind die Blutwerte nur bedingt aussagekräftig. Wenn der Gehalt im Blut abnimmt, wird meistens Zink aus den Speichern in Knochen und Haut freigesetzt. Daher sollte man neben der Laborkontrolle auch die Zinkzufuhr über die Ernährung betrachten. Dadurch kann der Arzt die Blutwerte deuten.
Zudem sollte der Selenspiegel überprüft werden: Erste Studienergebnisse deuten darauf hin, dass die Selenspiegel mit zunehmender Schwere der Erkrankung steigen. Es besteht deshalb die Gefahr einer Überversorgung. Die Messung kann im Blutserum (ohne Blutzellen) oder im Vollblut erfolgen. Der Wert aus dem Vollblut ist aussagekräftiger, da er die Langzeitversorgung widerspiegelt. Werte im Vollblut sollten zwischen 120 und 150 Mikrogramm pro Liter liegen.
Zink und Selen: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei einer chronischen Nierenschwäche oder anderen Nierenerkrankungen sollten Mineralstoffe nicht zusätzlich über Präparate eingenommen werden. Geschwächte Nieren können überschüssiges Zink und Selen nicht richtig ausscheiden.
Zu hohe sowie zu niedrige Selenwerte könnten das Risiko für Diabetes beeinflussen. Ohne Blutkontrolle sollten Menschen mit hoher Diabetes-Gefahr kein Selen einnehmen. Bei einem bereits vorhandenen Diabetes wird zur Rücksprache mit dem Arzt geraten.
Zink kann bestimmte Medikamente binden und unwirksam machen. Dazu zählen: Antibiotika (Gyrasehemmer wie Ciprofloxacin (wie Ciloxan®) und Tetrazykline wie Tetracyclin (wie Achromycin®)) sowie Osteoporose-Medikamente mit Bisphosphonaten wie Alendronat (wie Fosamax®). Betroffen sind auch Chelatbildner wie Penicillamin (Metalcaptase®). Deshalb empfiehlt sich ein Abstand von mindestens zwei Stunden zwischen der Einnahme dieser Medikamente und Zinkpräparaten.
Mariendistel und andere Heilpflanzen schützen die Leber
Wirkweise von Mariendistel und anderen Pflanzen
Mariendistel ist eine traditionelle Heilpflanze bei Lebererkrankungen. Sie enthält Silymarin, ein Gemisch aus Pflanzenstoffen. Silymarin wirkt leberschützend: Es ist ein Radikalfänger und beeinflusst Enzyme, die mit der Entwicklung von Zellschäden und Gewebeveränderungen in der Leber zusammenhängen. Darüber hinaus hemmt Silymarin Entzündungen.
Es gibt sowohl Studien zur Ergänzung bei einer Fettleber als auch bei Leberzirrhose. In einigen Studien besserten sich die Leberenzym-Werte sowie der oxidative Stress. Laut einem Übersichtsartikel war die Behandlung mit Silymarin zudem mit einer Reduktion von Todesfällen durch Leberzirrhose verbunden.
Weitere schützende Pflanzen und Pflanzenstoffe, die aber noch nicht bei einer Leberzirrhose untersucht wurden, sind:
- Artischockenblätter: Vor allem bei einer Fettleber empfehlen Mikronährstoff-Experten Artischocken-Extrakt. Dadurch könnte die Fettansammlung in der Leber verringert werden.
- Catechine aus grünem Tee (EGCG): Bei nicht alkoholischer Fettleber könnte Grüntee-Extrakt erhöhte Leberwerte senken und das Abnehmen erleichtern. Das zeigt eine Übersichtsarbeit. Andere Arbeiten bestätigten das jedoch bisher nicht.
- Curcumin: Forscher schlussfolgern in einem Überblicksartikel, dass Curcumin die Leberwerte bei einer Fettleber verbessern könnte. Außerdem gibt es Hinweise, dass es die Leber vor Schäden durch übermäßigen Alkoholkonsum schützt.
Insgesamt gibt es zu Mariendistel bei Leberzirrhose einige positive Studien. Ist eine Fettleber der Grund für die Zirrhose, könnten zudem andere Pflanzenstoffe sinnvoll sein, insbesondere Artischocke, Grüntee-Catechine und Curcumin. Teilweise sind die Daten jedoch noch widersprüchlich.
Dosierung und Einnahmeempfehlung von Mariendistel und anderen Pflanzen
Mikronährstoff-Experten empfehlen meist ein Präparat mit Mariendistel-Extrakt im Gegensatz zu Pulver. So liegen die wichtigen Inhaltsstoffe in höherer Konzentration vor. Sinnvoll sind 200 bis 400 Milligramm Silymarin täglich. Das entspricht je nach Präparat etwa 400 bis 800 Milligramm Mariendistel-Extrakt.
Bei nicht alkoholischer Fettleber schlagen einige Mikronährstoff-Experten unter ärztlicher Begleitung außerdem folgende tägliche Dosierungen vor:
Artischocken-Extrakt: 500 bis 2.000 Milligramm
Grüntee-EGCG: 70 bis 200 Milligramm (bei fortgeschrittener Zirrhose unter ärztlicher Begleitung)
Curcumin: 250 bis 1.000 Milligramm
Pflanzenextrakte sollten zum Essen eingenommen werden.
Tipp
Es gibt auch Pflanzenstoffe, welche die Entgiftungsfunktion der Leber unterstützen können. Dazu gehören neben Mariendistel und Artischocke auch Carotinoide wie Lycopin und Brokkoli. Erfahren Sie hier, wie Sie diese einsetzen, um die Entgiftungsfunktion der Leber zu fördern.
Mariendistel- und andere Pflanzenextrakte: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Für Schwangere und Stillende gibt es keine ausreichenden Daten zur Sicherheit von Mariendistel und anderen Pflanzenextrakten. Die Einnahme wird deshalb nicht empfohlen.
Mariendistel-Extrakt sollte bei Überempfindlichkeit gegen den Wirkstoff Silymarin oder bei einer Allergie gegen Korbblütler nicht eingenommen werden.
Grundsätzlich ist es empfehlenswert, die Einnahme von Medikamenten und Mariendistel-Extrakt mit dem Arzt zu besprechen. In hoher Dosierung hemmt Silymarin Cytochrom-P450-Enzyme. Diese Enzyme werden im Rahmen ihrer Entgiftungsfunktion aber zum Abbau verschiedener Medikamente benötigt. Auch gibt es Hinweise auf Wechselwirkungen zwischen Mariendistel-Extrakt und Krebsmedikamenten oder einer Strahlentherapie.
Informationen zu Wechselwirkungen mit Artischocke, Grüntee und Curcumin finden Sie in den entsprechenden Texten.
Ornithin und Aspartat für die Entgiftung von Ammoniak
Wirkweise von Ornithin und Aspartat
Die beiden Aminosäuren Ornithin und Aspartat (L-Ornithin-L-Aspartat, LOLA) helfen vermutlich, den schädlichen Ammoniakspiegel zu senken. Dadurch können sie den Verlauf einer leberbedingten Hirnleistungsstörung (hepatische Enzephalopathie) oder Muskelschwund günstig beeinflussen.
Laut zweier Übersichtsarbeiten kann LOLA die Genesungszeit bei der Hirnleistungsstörung verkürzen. Auch hat sie wahrscheinlich einen günstigen Einfluss auf schwerwiegende Komplikationen, die geistige Leistung und das Sterberisiko. Eine andere Übersichtsarbeit zeigt zudem, dass LOLA das Fortschreiten der Hirnleistungsstörung verhindert. Bei Patienten, bei denen der Bluthochdruck in der Leberpfortader mit einer Operation behandelt wurde (TIPS), hat LOLA jedoch vermutlich keine Wirkung.
Insgesamt ist die Datenlage bereits gut. Es muss aber weiter erforscht werden, wann LOLA am besten hilft. Möglicherweise unterstützt es vor allem in den ersten Tagen der Behandlung die Standardtherapie (Laktulose, Metronidazol) und könnte den Krankhausaufenthalt bei einer Verschlechterung der Hirnleistungsstörung verkürzen.
Expertenwissen
Die Fähigkeit der Leber, mit LOLA giftiges Ammoniak zu entfernen, hängt auch von der Versorgung mit Zink ab. Bei einem Mangel kann L-Ornithin nicht mehr zur Entgiftung genutzt werden. Achtung: Die Bluteiweiße wie Albumin transportieren Zink. Es ist vermutlich sinnvoll, die Eiweißwerte mit verzweigtkettigen Aminosäuren (BCAA) anzuheben, damit Zink transportiert werden kann.
Dosierung und Einnahmeempfehlung von Aspartat und Ornithin
Mikronährstoff-Experten raten bei einer leberbedingten Hirnleistungsstörung zur Gabe von 20.000 bis 40.000 Milligramm LOLA direkt über die Vene. Die Einnahme von Präparaten ist zwar ebenfalls möglich (zum Beispiel 15.000 bis 18.000 Milligramm), jedoch weniger vielversprechend.
Zur Unterstützung der Entgiftung und damit zur Vorbeugung der Hirnleistungsstörung ist eine Einnahmemenge von dreimal täglich 2.000 bis 3.000 Milligramm LOLA sinnvoll. Werden mehr als 6.000 Milligramm ergänzt, kann es in seltenen Fällen zu Durchfall kommen. Verteilen Sie deshalb die Menge über den Tag.
Ein Arzt sollte die Therapie mit LOLA überwachen, da bei einer eingeschränkten Leberfunktion eine Störung des Aminosäure-Gleichgewichts vorliegen kann.
Ornithin: zu beachten in der Schwangerschaft und Stillzeit sowie bei Erkrankungen
Ornithin sollte in der Schwangerschaft und Stillzeit nicht ergänzt werden. Es gibt zu wenige Daten.
Bei einer eingeschränkten Nierenfunktion sollte Ornithin nur in Rücksprache mit dem Arzt eingenommen werden. Die Nieren sind für die Ausscheidung von Aminosäure-Stoffwechselprodukten zuständig. Funktionieren diese nicht, könnten sie sich im Körper anreichern.
Diabetiker sollten bei der Einnahme von Ornithin auf ihren Blutzucker achten. Im Tierversuch beeinflusste es den Zuckerstoffwechsel.
Ornithin sollte bei Demenzerkrankungen wie Alzheimer zur Sicherheit nicht eingesetzt werden. Der Stoffwechsel von Ornithin kann gestört sein. Auch bei Krebs sollte Ornithin nicht eingenommen werden: Polyamine, die aus Ornithin gebildet werden, können das Krebswachstum anregen.
Bei bestimmten Erbkrankheiten mit einem gestörten Ornithin-Stoffwechsel sollte es nicht eingenommen werden. Dazu gehören das HHH-Syndrom (Hyperornithinämie-Hyperammonämie-Homocitrullinurie) und ein genetischer Enzymdefekt der Ornithin-Transcarbamylase (OTC). Auch bei der Augenkrankheit „Gyratatrophie“ oder Schäden der Netzhaut sollte man auf die Einnahme von hoch dosiertem Ornithin verzichten oder vorher mit dem Arzt sprechen. Ein Blutspiegel über 600 Mikromol pro Liter könnte problematisch sein.
Verzweigtkettige Aminosäuren unterstützen Ernährungszustand und Entgiftung
Wirkweise von verzweigtkettigen Aminosäuren

Bei einer Leberzirrhose kann die Leber ihre Entgiftungsfunktion nicht mehr richtig erfüllen: Giftiges Ammoniak reichert sich an und schädigt Gehirn und Stoffwechsel. Verzweigtkettige Aminosäuren (BCAA) wie Leucin, Isoleucin oder Valin tragen zur Entgiftung von Ammoniak bei. Bei einer Leberzirrhose werden BCAA verbraucht, sodass der Körper davon nicht ausreichend für die Eiweißproduktion hat. Anzeichen sind fallende Albuminwerte. Albumin ist ein wichtiges Körpereiweiß.
Eine aktuelle Übersichtsarbeit zeigt, dass die Zufuhr von verzweigtkettigen Aminosäuren das Risiko für eine Schädigung des Gehirns durch Ammoniak (hepatische Enzephalopathie) deutlich senken kann. Die Effekte waren nur bei Personen sichtbar, bei denen das Gehirn schon schwer gestört war. Auf die Sterblichkeit oder die Lebensqualität fand man jedoch keinen eindeutigen Einfluss. Dennoch weisen erste Daten darauf hin, dass sich verzweigtkettige Aminosäuren positiv auf den Krankheitsverlauf und die Schwere einer Leberzirrhose auswirken können. Zudem könnte Leucin laut zwei Übersichtsarbeiten den Muskelaufbau unterstützen sowie die Muskelkraft verbessern.
Insgesamt zeigen jedoch nicht alle Studien günstige Wirkungen, weshalb der Arzt den Albumin-, Ammoniak- und Aminosäurespiegel überwachen sollte. Verschlechtern sich die Ammoniakspiegel, muss über Alternativen nachgedacht werden. Im letzten Stadium der Zirrhose sind BCAA vermutlich nicht sinnvoll.
Expertenwissen
Möglicherweise haben BCAAs auch negative Effekte. Sie werden zwar für die Glutamatproduktion gebraucht, was wiederum für die Ammoniakentgiftung des Gehirns notwendig ist. Es können sich jedoch in der Folge noch weitere Imbalancen ergeben:
- Bei der Glutamatproduktion aus BCAA werden Ausgangsverbindungen für den Citrat-Zyklus verbraucht (α-Ketoglutarat). Der begleitende Einsatz von anderen Aminosäuren zur Ammoniakentgiftung (wie Ornithin-Aspartat) und von Zink könnte dem entgegenwirken. Dadurch wird der Harnstoffzyklus ermöglicht und der Citrat-Zyklus unterstützt.
- Bei der Ammoniakentgiftung fallen größere Mengen an Glutamin im Muskel an. Es wird über den Darm entsorgt. Darmzellen und Darmbakterien produzieren daraus wieder Ammoniak, das aufgenommen wird. Dann könnten statt BCAA Laktulose und bestimmte Antibiotika besser helfen.
Dosierung und Einnahmeempfehlung von verzweigtkettigen Aminosäuren
Zur unterstützenden Behandlung einer Leberzirrhose empfehlen Mikronährstoff-Experten eine Dosis von 250 bis 300 Milligramm verzweigtkettige Aminosäuren pro Kilogramm Körpergewicht täglich. Bei einem Gewicht von 60 Kilogramm sind dies umgerechnet 15.000 Milligramm (15 Gramm).
Verzweigtkettige Aminosäuren dürfen bei Leberzirrhose nur in Rücksprache mit dem Arzt oder Mikronährstoff-Experten eingenommen werden. Bei Leberzirrhose mit Diabetes (nächtlicher Zucker über 200 Milligramm pro Deziliter) könnten BCAA die Zuckerwerte erhöhen. Man vermutet, dass sie zur Insulinresistenz beitragen. Bei Betroffenen sind die Blutwerte an BCAA oft erhöht. Daher sollte der Arzt vor der Behandlung das Aminosäureprofil im Blut messen. Gleiches gilt bei Diabetes-Vorstufen (metabolisches Syndrom).
Verzweigtkettige Aminosäuren: zu beachten in der Schwangerschaft und Stillzeit sowie bei Erkrankungen
Schwangere und Stillende sollten auf die Einnahme von verzweigtkettigen Aminosäuren verzichten. Es liegen keine ausreichenden Daten vor.
Personen mit Nierenerkrankungen müssen oft auf die Eiweißzufuhr achten. Für sie gelten dann Höchstgrenzen. Verzweigtkettige Aminosäuren müssen dabei zur täglichen Eiweißdosis dazugerechnet werden. Eine Rücksprache mit dem Arzt ist sinnvoll.
Bei Herz-Kreislauf-Erkrankungen sollten BCAA nicht ohne ärztlichen Rat eingesetzt werden. Die Aminosäuren könnten eine Entzündung der Gefäße verstärken.
Bei Krankheiten mit gestörtem Serotonin- oder Dopamin-Stoffwechsel sollte die Einnahme hoch dosierter verzweigtkettiger Aminosäuren (mehr als 5.000 Milligramm) mit dem Arzt besprochen werden. Dazu gehören Depressionen, Migräne oder Parkinson. Verzweigtkettige Aminosäuren im Blut hemmen die Aufnahme der Aminosäuren Tyrosin und Tryptophan ins Gehirn. Beide Aminosäuren sind Vorstufen von Serotonin und Dopamin. Eine Rücksprache gilt auch für die Nervenkrankheit amyotrophe Lateralsklerose (ALS).
Manche Krebsarten (wie Leukämie) könnten verzweigtkettige Aminosäuren als Energiequelle nutzen. Bis weitere Daten vorliegen, sollten sie nicht ohne ärztlichen Rat bei Krebs eingesetzt werden.
Bei der seltenen Ahornsirupkrankheit (auch Verzweigtkettenkrankheit) dürfen keine verzweigtkettigen Aminosäuren eingenommen werden. Betroffene können sie nicht abbauen. Auch bei der seltenen Leucin-induzierten Hypoglykämie sind BCAA eher nicht geeignet. Dann unterzuckert der Körper, wenn zu viel Leucin zugeführt wird.
Probiotika unterstützen die Lebergesundheit und helfen bei der Entgiftung
Wirkweise von Probiotika
Bei einer Leberzirrhose beobachten Forscher eine Darmflorastörung: Die Anzahl an nützlichen Keimen wie Laktobazillen und Bifidobakterien ist reduziert, während potenziell schädliche Keime erhöht sind. Probiotika enthalten gesundheitsförderliche Keime, die eine gesunde Darmflora begünstigen. Über die sogenannte Darm-Leber-Achse beeinflusst das auch die Leber. Die Hauptmechanismen sind vermutlich, dass Probiotika die Darmbarriere stärken: Es gelangen dann weniger Bakterien und Schadstoffe aus dem Darm ins Blut. Zudem können Probiotika Ammoniak-produzierende Bakterien verdrängen. Dadurch wird die Leber weniger durch Ammoniak belastet.
Laut zwei Übersichtsarbeiten könnten Probiotika das Fortschreiten der Leberzirrhose hemmen. Besonders bei Komplikationen scheinen Probiotika vorteilhaft zu sein: Laut Übersichtsarbeiten reduziert die Einnahme den Ammoniakgehalt im Blut und die Schädigung des Gehirns (hepatische Enzephalopathie). Möglicherweise senkt eine gesunde Darmflora auch Bluthochdruck innerhalb des Leberkreislaufs, wie eine weitere Übersichtsarbeit zeigt.
Auch in den offiziellen Leitlinien wird darauf hingewiesen, dass Probiotika bei einer hepatischen Enzephalopathie ähnlich gut wirken könnten wie Laktulose. Weitere hochwertige Studien müssen jedoch die Wirkung bei Leberzirrhose noch belegen und offene Fragen klären.
Dosierung und Einnahmeempfehlungen von Probiotika
Mikronährstoff-Experten empfehlen bei einer Leberzirrhose ein Probiotikum mit 1 bis 20 Milliarden (1 bis 20 x 10⁹) koloniebildenden Einheiten pro Tag. Das Präparat sollte Bifidobakterien und Laktobazillen enthalten.
Probiotika nimmt man am besten zum Essen oder mit ausreichend Wasser ein. Das schützt sie vor der Magensäure, sodass mehr Bakterien lebend in den Darm gelangen. Die Einnahme muss längerfristig erfolgen: Setzt man das Präparat ab, lässt auch die Wirkung nach.
Tipp
Probiotika eignen sich auch gut, um zusammen mit Ballaststoffen (Präbiotika) die Therapie mit verzweigtkettigen Aminosäuren bei Leberzirrhose zu begleiten. Dies kann ergänzende positive Effekte haben. Präbiotika ernähren probiotische Bakterien und verbessern das Darmmilieu.
Probiotika: zu beachten in der Schwangerschaft, bei Erkrankungen und Medikamenteneinnahme
Probiotika könnten Bluthochdruck in der Schwangerschaft verstärken. In diesem Fall sollte man lieber darauf verzichten oder auf Ballaststoffe ausweichen.
Für Menschen, die ein stark geschwächtes Immunsystem haben, könnten Probiotika gefährlich werden (Sepsis, Bakteriämie). Sie sollten daher nur in Rücksprache mit dem Arzt Probiotika einnehmen. Patienten mit zentralen Venenzugängen (zum Beispiel bei Chemotherapie), Herzklappenerkrankungen und Kurzdarmsyndrom sollten keine Probiotika bekommen.
Einige Bakterien bilden Histamin im Darm und könnten daher bei einer Histaminintoleranz Symptome auslösen. Dazu gehören Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis und Enterococcus faecium.
Probiotika sollten nicht gleichzeitig mit Antibiotika eingenommen werden, da Antibiotika die probiotischen Bakterien abtöten würden. Halten Sie einen Abstand von zwei bis drei Stunden ein.
Taurin lindert Muskelkrämpfe bei Leberzirrhose
Wirkweise von Taurin
Taurin ist wichtig für gesunde Leberzellen. Es wird unter anderem gebraucht, damit Cholesterin und andere Fette ausgeschieden werden können. In Tierstudien reduzierte Taurin Fetteinlagerungen in der Leber sowie Zellschäden. Zudem wirkt Taurin antioxidativ und entzündungshemmend. Daher könnte es die Vernarbung der Leber hemmen. Personen mit Lebererkrankungen bilden häufig weniger Taurin.
Eine erste Studie zeigt bei Menschen, dass eine Taurineinnahme Bluthochdruck im Leberkreislauf senken könnte. Bei Schäden durch eine chronische Leberentzündung (Hepatitis) wirkte Taurin ebenfalls positiv: Es verbesserte Blutwerte der Leberenzyme und Fette. Auch sanken Marker für oxidativen Stress.
Darüber hinaus schützt Taurin die Muskelzellen. So senkte die Einnahme in einer ersten hochwertigen Studie die Häufigkeit, Dauer und Stärke von Muskelkrämpfen bei Personen mit chronischen Lebererkrankungen. Auch Autoren einer Studienübersicht sprechen sich für Taurin gegen Muskelkrämpfe aus.
Zusammengefasst könnte Taurin den Zustand der Leber bessern. Vor allem zur Linderung der Muskelkrämpfe ist es vielversprechend.
Dosierung und Einnahmeempfehlung von Taurin
Bei Leberzirrhose werde in enger Absprache mit dem Mikronährstoff-Experten 1.000 bis 3.000 Milligramm Taurin pro Tag empfohlen. Taurin kann zu oder zwischen den Mahlzeiten genommen werden. Zusammen mit dem Essen verbessert sich jedoch die Verträglichkeit für den Magen.
Taurin sollte nicht mit Alkohol eingenommen werden. Beide Stoffe könnten ihre Wirkung gegenseitig verstärken und zum Beispiel eine nachlassende Reaktionsfähigkeit oder Auswirkungen auf das Herz-Kreislauf-System zur Folge haben.
Taurin: zu beachten bei Schwangerschaft und Stillzeit sowie Erkrankungen
Da es keine ausreichenden Informationen zu Taurin in der Schwangerschaft und Stillzeit gibt, sollten Frauen in dieser Zeit vorsichtshalber auf Präparate verzichten.
Kranke und schwache Nieren können Taurin schlecht ausscheiden. Eine Ergänzung sollte bei Nierenschwäche und Dialyse daher nur nach Abwägung durch den Arzt erfolgen.
Taurin senkte in Tierstudien den Blutzucker. Diabetiker sollten zur Sicherheit bei einer Taurineinnahme den Blutzuckerspiegel engmaschiger kontrollieren. Dann kann im Fall einer Unterzuckerung eventuell die Dosis von Medikamenten oder von Taurin angepasst werden.
Bei einem bekannten Herzinfarkt sollte die Einnahme von Taurin mit einem Arzt besprochen werden. Es gibt Hinweise aus einer Tierstudie, dass erhöhte Taurinspiegel mit einem Herzinfarkt in Zusammenhang stehen könnten. Noch ist nicht klar, wie die Ergebnisse zu bewerten sind.
Taurin wirkte in Tierstudien sowohl krampflösend als auch krampfsteigernd. Epileptiker sollten zur Sicherheit die Einnahme mit dem Arzt absprechen.
Cholin unterstützt die Regeneration der Leber und den Fettstoffwechsel
Wirkweise von Cholin
Cholin ist Bestandteil von Phosphatidylcholin, das in den Hüllen der Leberzellen sowie in deren Energiekraftwerken gebraucht wird. Im Stoffwechsel liefert es zudem bestimmte Bausteine (Methylgruppen). Diese fördern zum Beispiel den Abbau des schädlichen Homocysteins oder die Regulation der Nerven- und Genaktivität (durch Methylierung). Cholin ist außerdem für den Fettstoffwechsel wichtig: Es hilft, Fette aus der Leber ins Blut zu bringen (als VLDL). Eine Unterversorgung mit Cholin kann zu einer Fettleber führen. Darüber hinaus wirkt es antioxidativ und entzündungshemmend.
Fettleber: In einer Übersichtsarbeit vermuten Forscher, dass Cholin (als Soja-Lecithin) die Leberwerte und den Zuckerstoffwechsel bessert. Auch die Krankheitsbeschwerden, Entzündungszeichen sowie die Vernarbung der Leber (Zirrhose) waren geringer.
Hepatitis: Bei Virus-Hepatitis-C-Patienten bewirkte Cholin mit einer antiviralen Therapie eine geringere Rückfallrate. Auch bei einer autoimmunen Hepatitisform, die unzureichend auf die Standarttherapie ansprach, besserten sich die Beschwerden. Andere Studien waren jedoch erfolglos.
Nervenschäden (hepatische Enzephalopathie): Forscher fanden bei Nervenschäden durch Leberzirrhose niedrigere Cholinspiegel im Gehirn. Erste Studien deuten darauf hin, dass die Einnahme von Cholin die Genesungszeit hierbei verkürzen könnte. Zudem sank das Risiko, an der Erkrankung zu versterben.
Klar ist, dass Cholin für die Leber wichtig ist. Eine Wirkung auf eine Zirrhose ist jedoch nicht gesichert. Vermutlich erhöht eine cholinarme Ernährung das Risiko für eine Fettleber. Zudem neigen Menschen mit gestörtem Cholinstoffwechsel zu Leberschäden. Sie profitieren wahrscheinlich von einer Einnahme.
Dosierung und Einnahmeempfehlung von Cholin
Mikronährstoff-Experten empfehlen versuchsweise zur unterstützenden Behandlung von Lebererkrankungen eine Dosis von 150 bis 300 Milligramm Cholin pro Tag. Empfehlenswert ist die Einnahme zum Essen.
Der Einsatz sollte ärztlich kontrolliert werden: Hoch dosiertes Cholin (1.000 Milligramm) könnte die Blutgerinnung beeinflussen. Bei fortgeschrittenen Lebererkrankungen steigt das Blutungsrisiko.
Ist die Darmflora gestört, entsteht aus Cholin ein Stoff (TMAO), der eine Fettleber verschlimmern könnte. Zudem wurden bei einer Fettleber auch erhöhte Cholinwerte gefunden – vor allem bei übergewichtigen Diabetikern. Der Arzt sollte die Behandlung von den Symptomen abhängig machen und die Fetteinlagerungen sowie die TMAO-Werte im Blut verfolgen.
Expertenwissen
Aus Cholin kann der Stoff TMAO (Trimethylamin-N-oxid) entstehen, der mit negativen gesundheitlichen Folgen in Verbindung steht (wie Herz-Kreislauf-Erkrankungen und Diabetes). Eine ungünstige Darmflora trägt dazu bei, weshalb einige Forscher vorschlagen, die Darmflora zu stärken. Hierzu liegen noch keine endgültigen Daten vor. Es gibt bereits erste Versuche mit Bifidobakterien und Laktobazillen sowie mit abgetöteten Bakterien. Auf lange Sicht kann es sinnvoll sein, den TMAO-Spiegel im Blutplasma zu überwachen. Die Referenzwerte werden vom jeweiligen Labor vorgegeben.
Cholin: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Zur Einnahme von Cholin in der Schwangerschaft und Stillzeit gibt es zu wenige Daten. Daher sollte es nur nach Rücksprache mit dem Arzt eingenommen werden.
Beim Abbau von Cholin entstehen Stoffe, die den Körper schädigen, wenn sie nicht ausgeschieden werden. Bei geschädigten Nieren könnte die Nierenleistung nicht ausreichen, um diese Stoffe auszuscheiden. Sie würden sich im Blut anreichern („Harnvergiftung“). Daher sollten Personen mit Nierenerkrankungen auf Mikronährstoffpräparate mit Cholin verzichten.
Bei Herz-Kreislauf-Erkrankungen, Gallensteinen oder Diabetes sollte eine regelmäßige Einnahme von Cholin ärztlich begleitet werden. Der aus Cholin entstehende Stoff TMAO könnte das Risiko für diese Erkrankungen weiter erhöhen.
Krebspatienten sollten kein hoch dosiertes Cholin einnehmen. Bei bestimmten Krebszellen ist der Cholinstoffwechsel verändert. Wie sich eine Zufuhr über die normale Ernährung hinaus auswirkt, ist nicht untersucht.
Carnitin für Entgiftung und Energiestoffwechsel
Wirkweise von Carnitin
Carnitin spielt eine wichtige Rolle im Energiestoffwechsel: Es fördert die Verbrennung von Fettsäuren in den Kraftwerken der Zellen (Mitochondrien), die für die Energiegewinnung verantwortlich sind. Dabei verhindert es, dass sich giftige Verbindungen anreichern. Darüber hinaus hat Carnitin antioxidative Eigenschaften, verbessert die Stabilität der Zellmembran und schützt unsere Nervenzellen. Außerdem ist das Risiko eines Carnitinmangels bei Personen mit Leberzirrhose höher, da die Leber das meiste bildet.
Mehrere Übersichtsarbeiten deuten darauf hin, dass die Einnahme von Carnitin bei einer Leberzirrhose hilfreich sein könnte: Je nach Studie reduzierte Carnitin Fetteinlagerungen in der Leber sowie Leberenzyme oder verbesserte die Lebensqualität. Komplikationen wie Muskelschwund und Muskelkrämpfe könnten zudem gelindert werden. In Übersichtsarbeiten zur leberbedingten Hirnleistungsstörung scheint die Ergänzung von Carnitin den Ammoniakspiegel zu senken und die Gehirnfunktion zu verbessern.
Insgesamt ist die Wirkung von Carnitin bei einer Leberzirrhose allerdings noch nicht bewiesen. Am besten belegt ist die Senkung des Ammoniakspiegels. Carnitin könnte jedoch die Lebensqualität verbessern. Anzeichen für einen Mangel sind zum Beispiel Krämpfe oder Muskelschwund.
Dosierung und Einnahmeempfehlung von Carnitin
Mikronährstoff-Experten empfehlen 1.000 bis 1.200 Milligramm Carnitin pro Tag. Carnitin kann auch direkt über die Vene gegeben werden. Bei der Einnahme über Präparate sollte die Gesamtmenge über den Tag verteilt werden – idealerweise zum Essen. Der Arzt oder Mikronährstoff-Experte sollte die Therapie begleiten, da auch eine Verschlechterung der Fettleber durch Carnitin möglich ist (TMAO-Bildung bei gestörter Darmflora).
Tipp
Die Wirkung von Carnitin könnte durch andere Mikronährstoffe verbessert werden. In Kombination miteinander würden wahrscheinlich mehrere Faktoren einer Leberzirrhose verbessert werden. Studien liegen vor für die Kombination von Carnitin mit der Aminosäure Serin, dem Antioxidans N-Acetylcystein und einer Vitamin-B3-Variante (Nicotinamid-Ribosid). Für eindeutige Empfehlungen stehen jedoch noch weitere Studien aus.
Carnitin: zu beachten in der Schwangerschaft, bei Erkrankungen und Medikamenteneinnahme
Aus Carnitin entstehen bei einer gestörten Darmflora Substanzen, die in großen Mengen negativ bei Herz-Kreislauf- und Stoffwechselerkrankungen sein könnten (Trimethylamin-N-oxid = TMAO). Eine regelmäßige Einnahme sollte bei Herz-Kreislauf-Erkrankungen (wie Arteriosklerose) nur auf ärztlichen Rat hin erfolgen. Das gilt auch bei Gallensteinen.
Schwangere mit Bluthochdruck oder Diabetes sollten ohne ärztliche Rücksprache nicht mehr als 500 Milligramm Carnitin einnehmen (TMAO-Bildung).
Bei Funktionsstörungen der Niere sollte die Einnahme von mehr als 1.000 Milligramm Carnitin mit dem Arzt abgesprochen werden: Die Langzeiteinnahme wurde bei ihnen noch nicht gut untersucht.
Bei Prostata - oder Blasenkrebs ist der Fettstoffwechsel aktiviert. Bei solchen Krebsarten sollte Carnitin nicht eingenommen werden. Auch ist noch nicht klar, wie sich eine langfristige Carnitin-Zufuhr auf Darmkrebs auswirkt.
Wird Carnitin bei einem Herzinfarkt plötzlich abgesetzt, könnten sich Schäden am Herzen verschlimmern. Dies zeigt ein Tierversuch. Der Arzt sollte daher über die Einnahme informiert werden.
Carnitin kann bei Diabetes oder Diabetes-Vorstufen (metabolischem Syndrom) die Zuckerwerte verbessern oder verschlechtern. Wird es gleichzeitig mit blutzuckersenkenden Medikamenten eingenommen, besteht die Gefahr einer Unterzuckerung. Das gilt für Medikamente wie Metformin (Diabesin® und Glucophage®) und Sulfonylharnstoffe (Euglucon® oder Maninil®). Eventuell muss die Dosierung angepasst werden. Eine regelmäßige Kontrolle des Blutzuckerspiegels ist empfehlenswert. Bei einer Verschlechterung der Werte sollte ein Mikronährstoff-Experte kontaktiert werden.
Carnitin kann in sehr seltenen Fällen die Wirkung von Blutgerinnungshemmern vom Cumarin-Typ (Vitamin-K-Antagonisten) verstärken. Dazu zählen zum Beispiel Phenprocoumon (Marcuphen®, Falithrom®) und Warfarin (Coumadin®). Die Einnahme sollte dann mit dem Arzt abgesprochen werden.
Dosierungen auf einen Blick
Empfehlung pro Tag bei Leberzirrhose und hepatischer Enzephalopathie | |
|---|---|
Vitamine | |
Vitamin B1 | bei Leberzirrhose: 3 bis 6 Milligramm (mg) oder je nach Status bei hepatischer Enzephalopathie: für 3 bis 5 Tage 300 bis 600 |
Vitamin B2 | 3 bis 6 Milligramm oder je nach Status |
Vitamin B6 | 3 bis 6 Milligramm oder je nach Status |
Vitamin B12 | 5 bis 10 Mikrogramm (µg) oder je nach Status |
Folsäure | 200 bis 400 Mikrogramm oder je nach Status |
Vitamin A | 400 Mikrogramm (alternativ: 9 Milligramm Beta-Carotin) |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten (IE) oder je nach Status |
Vitamin K | 60 bis 300 Mikrogramm |
Vitamin E | 300 bis 670 Milligramm |
Vitamin C | 1.000 bis 2.000 Milligramm |
Mineralstoffe | |
Selen | 70 bis 100 Mikrogramm |
Zink | 5 bis 15 Milligramm |
Pflanzenextrakte und Pflanzenstoffe | |
Silymarin (aus Mariendistel-Extrakt) | 200 bis 400 Milligramm |
Artischocken-Extrakt | 500 bis 2.000 Milligramm |
Grüntee-Catechine (EGCG) | 70 bis 200 Milligramm |
Curcumin | 250 bis 1.000 Milligramm |
Sonstige | |
Cholin | 150 bis 300 Milligramm |
Glutathion | 100 bis 300 Milligramm |
Verzweigtkettige Aminosäuren | 250 bis 300 Milligramm pro Kilogramm Körpergewicht (mg/kg) |
Taurin | 1.000 bis 3.000 Milligramm |
Aspartat und Ornithin (L-Ornithin-L-Aspartat (LOLA)) | bei Leberzirrhose: 6.000 bis 9.000 Milligramm bei hepatischer Enzephalopathie: 20.000 bis 40.000 Milligramm |
Carnitin | 1.000 bis 1.200 Milligramm |
Probiotika | 1 bis 20 Milliarden (1 bis 20 x 109) koloniebildende Einheiten (KBE) |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei Leberzirrhose | |
|---|---|
Normalwerte | |
Vitamin B12 (HoloTC) (Serum) | über 54 Pikomol pro Liter (pmol/l) |
Homocystein (Plasma) | 5 bis 9 Mikromol pro Liter (µmol/l) |
Vitamin A (Serum) | 40 bis 70 (Frauen) Mikrogramm pro Deziliter (µg/dl) 42,5 bis 83 (Männer) Mikrogramm pro Deziliter |
Vitamin K (Serum) | 1 Nanomol pro Liter (nmol/l) |
Vitamin D (Serum) | 40 bis 60 Nanogramm pro Milliliter (ng/ml) |
Selen (Vollblut) | 120 bis 150 Mikrogramm pro Liter (µg/l) im Vollblut |
Zink (Vollblut) | 4 bis 7,5 Milligramm pro Liter (mg/l) |
Zusammenfassung
Eine Leberzirrhose und ihre Folgeerkrankungen lassen sich mithilfe der Mikronährstoffmedizin wirksam lindern. B-Vitamine und die fettlöslichen Vitamine A, D und K können Mangelzustände ausgleichen und der Vernarbung der Leber entgegenwirken. Vitamin C und E, Glutathion sowie andere Antioxidantien, darunter auch die Mineralstoffe Selen und Zink, entgiften freie Sauerstoffradikale, die eine Leberzirrhose begünstigen können.
Auch schützen bestimmte Pflanzen oder Pflanzenstoffe die Leber und könnten die Leberwerte verbessern. Dazu gehören Silymarin aus Mariendistel, Artischocken, Grüntee-Catechine und Curcumin.
Verzweigtkettige Aminosäuren (BCAA) unterstützen den Muskelaufbau und helfen bei der Entgiftung. Der Aminosäure-Abkömmling Taurin lindert Muskelkrämpfe. Ebenso unterstützen Ornithin und Aspartat die Entgiftung von Ammoniak, das eine leberbedingte Schädigung des Gehirns (hepatische Enzephalopathie) hervorrufen kann. Cholin hilft bei der Regeneration der Leber. Carnitin verbessert den Energie- und Fettstoffwechsel.
Verzeichnis der Studien und Quellen
Abdel-Maboud, M. et al. (2020): The efficacy of vitamin E in reducing non-alcoholic fatty liver disease: a systematic review, meta-analysis, and meta-regression. Therap Adv Gastroenterol 2020 Dec 7;13:1756284820974917. https://pubmed.ncbi.nlm.nih.gov/33335561/, abgerufen am: 23.06.2021.
Abe, R.A.M. et al. (2021): The Role of Vitamins in Non-Alcoholic Fatty Liver Disease: A Systematic Review. Cureus. 2021 Aug 3;13(8):e16855. https://pubmed.ncbi.nlm.nih.gov/34522493/, abgerufen am 08.08.2022.
Abraldes, J.G. et al. (2023): Update in the Treatment of the Complications of Cirrhosis. Clin Gastroenterol Hepatol. 21(8), 2100–2109. https://pubmed.ncbi.nlm.nih.gov/36972759/, abgerufen am 30.10.2023.
Agrawal, A. et al. (2012): Secondary prophylaxis of hepatic encephalopathy in cirrhosis: an open-label, randomized controlled trial of lactulose, probiotics, and no therapy. Am J Gastroenterol. 2012 Jul;107(7):1043-50. https://pubmed.ncbi.nlm.nih.gov/22710579/, abgerufen am 06.04.2023.
Ahire, K. & Sonawale, A. (2017): Comparison of Rifaximin Plus Lactulose with the Lactulose Alone for the Treatment of Hepatic Encephalopathy. J Assoc Physicians India. 2017 Aug;65(8):42-6. https://pubmed.ncbi.nlm.nih.gov/28799305/, abgerufen am 08.08.2022.
Ahluwalia, V. et al. (2016): Impaired Gut-Liver-Brain Axis in Patients with Cirrhosis. Sci Rep. 2016 May 26;6:26800. https://pubmed.ncbi.nlm.nih.gov/27225869/, abgerufen am 08.08.2022.
Alswat, K.A. et al. (2019): Position statement on the diagnosis and management of non-alcoholic fatty liver disease. Saudi Med J. 2019;40(6):531–40. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC6778754/, abgerufen am 08.08.2022.
Amanullah, I. et al. (2019): Effect of vitamin E in non-alcoholic fatty liver disease: a systematic review and meta-analysis of randomised controlled trials. Postgrad Med J 2019 Nov;95(1129):601-11. https://pubmed.ncbi.nlm.nih.gov/31434683/, abgerufen am: 23.06.2021.
Asghari, S. et al. (2020): Systemic redox imbalance in patients with nonalcoholic fatty liver disease. Eur J Clin Invest. 2020 Apr;50(4):e13211. https://pubmed.ncbi.nlm.nih.gov/32017057/, abgerufen am 08.08.2022.
Bae, M. et al. (2018): Food components with antifibrotic activity and implications in prevention of liver disease. J Nutr Biochem 2018 May; 55:1-11. https://www.ncbi.nlm.nih.gov/pubmed/29268106, abgerufen am: 07.08.2018.
Bajaj, J.S. et al. (2014): Randomised clinical trial: Lactobacillus GG modulates gut microbiome, metabolome and endotoxemia in patients with cirrhosis. Aliment Pharmacol Ther. 2014 May;39(10):1113-25. https://pubmed.ncbi.nlm.nih.gov/24628464/, abgerufen am 06.04.2023.
Bakir, M.B. et al. (2019): Evaluating the therapeutic potential of one-carbon donors in nonalcoholic fatty liver disease. Eur J Pharmacol. 2019 Mar 15;847:72-82.https://pubmed.ncbi.nlm.nih.gov/30689994/, abgerufen am 08.08.2022.
Barbakadze, G. et al. (2019): COMPARATIVE ANALYSIS OF EFFICIENCY OF URSODEOXYCHOLIC ACID AND COMBINATION OF VITAMIN E AND VITAMIN C IN TREATMENT OF NON-DIABETIC NONALCOHOLIC STEATOHEPATITIS. Georgian Med News. 2019 Mar;(288):81-5. https://pubmed.ncbi.nlm.nih.gov/31101782/, abgerufen am 08.08.2022.
Bémeur, C. & Butterworth, R. F. (2014): Nutrition in the management of cirrhosis and its neurological complications. J Clin Exp Hepatol 2014 Jun;4(2):141-50. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4116712/, abgerufen am: 07.09.2018.
Berasain, C. & Avila, M.A. (2021): Vitamin A in Nonalcoholic Fatty Liver Disease: A Key Player in an Offside Position? Cell Mol Gastroenterol Hepatol. 2021;11(1):291–3. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7768560/, abgerufen am 08.08.2022.
Bhanji, R.A. et al. (2016): Hyperhomocysteinemia is associated with severity of cirrhosis and negative impact after liver transplantation. Liver Int 2016 May;36(5):696-704. https://www.ncbi.nlm.nih.gov/pubmed/26473801, abgerufen am: 07.09.2018.
Biesalski, H. K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H. K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Biswas, D. et al. (2020): Adverse Outcomes in Obese Cardiac Surgery Patients Correlates With Altered Branched-Chain Amino Acid Catabolism in Adipose Tissue and Heart. Front Endocrinol (Lausanne). 2020 Aug 7;11:534. https://pubmed.ncbi.nlm.nih.gov/32903728/, abgerufen am 08.08.2022.
Bjelakovic, G. et al. (2010): Meta-Analysis: antioxidant supplements for liver disease – the Cochrane Hepato-Biliary Group. Aliment Pharmacol Ther 2010 Aug;32(3):356-67. https://www.ncbi.nlm.nih.gov/pubmed/20497142, abgerufen am: 07.09.2018.
Bjelakovic, G. et al. (2011): Antioxidant supplements for liver disease. Cochrane Database Syst Rev 2011 Mar 16;(3):CD007749. https://www.ncbi.nlm.nih.gov/pubmed/21412909, abgerufen am: 07.09.2018.
Bjelakovic, G. et al. (2017): Vitamin D supplementation for chronic liver diseases in adults. Cochrane Database Syst Rev. 2017 Nov 3;11(11):CD011564. https://pubmed.ncbi.nlm.nih.gov/29099543, abgerufen am 08.08.2022.
Bjelakovic, M. et al. (2021): Vitamin D supplementation for chronic liver diseases in adults. Cochrane Database Syst Rev. 2021 Aug 25;8(8):CD011564. https://pubmed.ncbi.nlm.nih.gov/34431511/, abgerufen am 08.08.2022.
Blanco Vela, C.I. & Poo Ramirez, J.L. (2011): Efficacy of oral L-ornithine L-aspartate in cirrhotic patients with hyperammonemic hepatic encephalopathy. Ann Hepatol. 2011 Jun;10 Suppl 2:S55-9. https://pubmed.ncbi.nlm.nih.gov/22228883/, abgerufen am 06.04.2023.
Bloom, A. et al. (2021): Zinc supplementation and its benefits in the management of chronic liver disease: An in-depth literature review. Annals of Hepatology. 2021 Nov-Dec;25:100549. https://www.sciencedirect.com/science/article/pii/S1665268121002489?via%3Dihub, abgerufen am 08.08.2022.
Bloomgarden, Z. (2018): Diabetes and branched-chain amino acids: What is the link? J Diabetes. 2018 May;10(5):350-2. https://pubmed.ncbi.nlm.nih.gov/29369529/, abgerufen am 08.08.2022.
Brown, A.C. (2017): Liver toxicity related to herbs and dietary supplements: Online table of case reports. Part 2 of 5 series. Food Chem Toxicol 2017 Sep;107:472-501. https://pubmed.ncbi.nlm.nih.gov/27402097/, abgerufen am: 23.06.2021.
Bundesinstitut für Risikobewertung (BfR) (2019): Nahrungsergänzungsmittel - Isolierte verzweigtkettige Aminosäuren können bei hoher Aufnahme die Gesundheit beeinträchtigen. Stellungnahme Nr. 052/2019 des BfR vom 20. Dezember 2019. https://mobil.bfr.bund.de/cm/343/nahrungsergaenzungsmittel-isolierte-verzweigtkettige-aminosaeuren-koennen-bei-hoher-aufnahme-die-gesundheit-beeintraechtigen.pdf, abgerufen am 18.11.2020.
Burgerstein, L. et al. (2012): Handbuch Nährstoffe – Vorbeugen und heilen durch ausgewogene Ernährung: Alles über Spurenelemente, Vitamine und Mineralstoffe. 12. Aufl. Trias.
Burk, R.F. et al. (2015): Selenium deficiency occurs in some patients with moderate-to-severe cirrhosis and can be corrected by administration of selenite but not selenoethionine: a randomized controlled trial. Am J Clin Nutr 2015 Nov;102(5):1126-1133. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4625587/, abgerufen am: 07.08.2018.
Butterworth, R.F. (2019): L-Ornithine L-Aspartate for the Treatment of Sarcopenia in Chronic Liver Disease: The Taming of a Vicious Cycle. Can J Gastroenterol Hepatol. 2019 Apr 28;2019:8182195. https://pubmed.ncbi.nlm.nih.gov/31183339/, abgerufen am 08.08.2022.
Butterworth, R.F. (2020): Beneficial effects of L-ornithine L-aspartate for prevention of overt hepatic encephalopathy in patients with cirrhosis: a systematic review with meta-analysis. Metab Brain Dis. 2020; 35(1): 75–81. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6974495/, abgerufen am 06.04.2023
Butterworth, R.F. & McPhail, M.J.W. (2019): L-Ornithine L-Aspartate (LOLA) for Hepatic Encephalopathy in Cirrhosis: Results of Randomized Controlled Trials and Meta-Analyses. Drugs. 2019 Feb;79(Suppl 1):31-7. https://pubmed.ncbi.nlm.nih.gov/30706425/, abgerufen am 08.08.2022.
Calmet, F. et al. (2019): Nutrition in Patients With Cirrhosis. Gastroenterol Hepatol (N Y). 2019 May;15(5):248-54. https://pubmed.ncbi.nlm.nih.gov/31360138/, abgerufen am 08.08.2022.
Cao, Q. et al. (2018): Effect of probiotic treatment on cirrhotic patients with minimal hepatic encephalopathy: A meta-analysis. Hepatobiliary Pancreat Dis Int. 2018 Feb;17(1):9-16. https://pubmed.ncbi.nlm.nih.gov/29428113/, abgerufen am 06.04.2023.
Carlsson, B. et al. (2020): Review article: the emerging role of genetics in precision medicine for patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2020 Jun;51(12):1305-20. https://pubmed.ncbi.nlm.nih.gov/32383295/, abgerufen am 08.08.2022.
Chalasani, N. et al. (2012): The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology 2012 Jun;55(6):2005-23. https://www.ncbi.nlm.nih.gov/pubmed/22488764, abgerufen am: 06.02.2019.
Chang, T.Y. et al. (2022): Optimal Dietary Intake Composition of Choline and Betaine Is Associated with Minimized Visceral Obesity-Related Hepatic Steatosis in a Case-Control Study. Nutrients. 2022 Jan 8;14(2):261. https://pubmed.ncbi.nlm.nih.gov/35057441/, abgerufen am 08.08.2022.
Charlton, M. (2006): Branched-chain amino acid enriched supplementation as therapy for liver disease. J Nutr 2006 Jan;136(1):295-8. https://www.ncbi.nlm.nih.gov/pubmed/16365102, abgerufen am: 07.09.2018.
Chavarria, L. et al. (2013): Brain magnetic resonance spectroscopy in episodic hepatic encephalopathy. J Cereb Blood Flow Metab. 2013 Feb;33(2):272-7. https://pubmed.ncbi.nlm.nih.gov/23168529/, abgerufen am 08.08.2022.
Chavez-Tapia, N.C. et al. (2013): A systematic review and meta-analysis of the use of oral zinc in the treatment of hepatic encephalopathy. Nutr J 2013 Jun 6;12(74):12-74. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3689058/, abgerufen am 23.06.2021.
Chen, C. et al. (2018): Potential Biological Effects of (-)-Epigallocatechin-3-gallate on the Treatment of Nonalcoholic Fatty Liver Disease. Mol Nutr Food Res 2018;62(1):1700483. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6120134/, abgerufen am: 23.06.2021.
Chen, Y. et al. (2019): FMO3 and its metabolite TMAO contribute to the formation of gallstones. Biochim Biophys Acta Mol Basis Dis. 2019 Oct 1;1865(10):2576-85. https://pubmed.ncbi.nlm.nih.gov/31251986/, abgerufen am 08.08.2022.
Chen, Y.L. et al. (2011): Folate and vitamin B12 improved alcohol-induced hyperhomocysteinemia in rats. Nutrition 2011 Oct;27(10):1034-9. https://pubmed.ncbi.nlm.nih.gov/21353475/, abgerufen am: 23.06.2021.
Chen, Y.M. et al. (2016): Associations of gut-flora-dependent metabolite trimethylamine-N-oxide, betaine and choline with non-alcoholic fatty liver disease in adults. Sci Rep 6, 19076 (2016). https://www.nature.com/articles/srep19076, abgerufen am 08.08.2022.
Clugston, R.D. (2020): Carotenoids and fatty liver disease: Current knowledge and research gaps. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 2020 Nov;1865(11):158597. https://www.sciencedirect.com/science/article/pii/S1388198119302483?via%3Dihub, abgerufen am 08.08.2022.
Coelho, J.M. et al. (2020): Association between serum and dietary antioxidant micronutrients and advanced liver fibrosis in non-alcoholic fatty liver disease: an observational study. PeerJ 2020 Sep 17;8:e9838. https://pubmed.ncbi.nlm.nih.gov/32995080/, abgerufen am: 23.06.2021.
Colpo, E. et al. (2015): Effect of antioxidant potential on severity of cirrhosis in humans. Nutr Hosp 2015 Nov 1;32(5):2294-300. https://www.ncbi.nlm.nih.gov/pubmed/26545691, abgerufen am: 07.08.2018.
Cosentino, R.G. et al. (2021): Branched-chain Amino Acids and Relationship With Inflammation in Youth With Obesity: A Randomized Controlled Intervention Study. J Clin Endocrinol Metab. 2021 Oct 21;106(11):3129-39. https://pubmed.ncbi.nlm.nih.gov/34286837/, abgerufen am 08.08.2022.
Cummings, N.E. et al. (2018): Restoration of metabolic health by decreased consumption of branched-chain amino acids. J Physiol. 2018 Feb 15;596(4):623-45. https://pubmed.ncbi.nlm.nih.gov/29266268/, abgerufen am 08.08.2022.
da Silva, R.P. et al. (2020): One-Carbon Metabolism in Fatty Liver Disease and Fibrosis: One-Carbon to Rule Them All. J Nutr. 2020 May 1;150(5):994-1003. https://pubmed.ncbi.nlm.nih.gov/32119738/, abgerufen am 08.08.2022.
Davenport, C. et al. (2015): Choline intakes exceeding recommendations during human lactation improve breast milk choline content by increasing PEMT pathway metabolites. J Nutr Biochem 2015 Sep;26(9):903-11. https://www.ncbi.nlm.nih.gov/pubmed/26025328, abgerufen am: 07.09.2018.
Day, K. et al. (2021): Selenotranscriptome Network in Non-alcoholic Fatty Liver Disease. Front Nutr. 2021 Nov 17;8:744825. https://pubmed.ncbi.nlm.nih.gov/34869521/, abgerufen am 08.08.2022.
De la Maza, M.P. et al. (1995): Effects of long-term vitamin E supplementation in alcoholic cirrhosis. J Am Coll Nutr 1995;14(2):192-6. https://www.ncbi.nlm.nih.gov/pubmed/7790695, abgerufen am: 07.09.2018.
de la O, V. et al. (2020): Effect of branched-chain amino acid supplementation, dietary intake and circulating levels in cardiometabolic diseases: an updated review. Curr Opin Clin Nutr Metab Care. 2020 Jan;23(1):35-50. https://pubmed.ncbi.nlm.nih.gov/31688095/, abgerufen am 08.08.2022.
Del Ben, M. et al. (2017): The role of nutraceuticals for the treatment of non-alcoholic fatty liver disease. Br J Clin Pharmacol 2017 Jan;83(1):88-95. www.ncbi.nlm.nih.gov/pmc/articles/PMC5338137/, abgerufen am: 07.09.2018.
Deutsche Gesellschaft für Ernährung e. V. (DGE) (2020): Vitamin A. https://www.dge.de/wissenschaft/referenzwerte/vitamin-a-b-carotin/?L=0, abgerufen am 08.08.2022.
Dhiman, R.K. et al. (2014): Probiotic VSL#3 reduces liver disease severity and hospitalization in patients with cirrhosis: a randomized, controlled trial. Gastroenterology. 2014 Dec;147(6):1327-37.e3. https://pubmed.ncbi.nlm.nih.gov/25450083/, abgerufen a, 06.04.2023.
Dhiman, R.K. et al. (2020): Comparative Efficacy of Treatment Options for Minimal Hepatic Encephalopathy: A Systematic Review and Network Meta-Analysis. Clin Gastroenterol Hepatol. 2020 Apr;18(4):800-812.e25. https://pubmed.ncbi.nlm.nih.gov/31476436/, abgerufen am 06.04.2023.
Diglio, D.C. et al. (2020): Role of zinc supplementation in the management of chronic liver diseases: A systematic review and meta-analysis. Ann Hepatol. Mar-Apr 2020;19(2):190-6. https://pubmed.ncbi.nlm.nih.gov/31611064/, abgerufen am 08.08.2022.
DocMedicus Verlag (Hrsg) (o.J.): Zink. http://www.vitalstoff-lexikon.de/Spurenelemente/Zink/, abgerufen am 08.08.2022.
Du, Y. et al. (2021): Epigallocatechin-3-Gallate Dampens Non-Alcoholic Fatty Liver by Modulating Liver Function, Lipid Profile and Macrophage Polarization. Nutrients. 2021 Feb 11;13(2):599. https://pubmed.ncbi.nlm.nih.gov/33670347/, abgerufen am 08.08.2022.
Ebadi, M. et al. (2019): Sarcopenia in cirrhosis: from pathogenesis to interventions. J Gastroenterol. 2019 Oct;54(10):845-59. https://pubmed.ncbi.nlm.nih.gov/31392488/, abgerufen am 08.08.2022.
EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS). et al. (2018): Scientific opinion on the safety of green tea catechins. EFSA Journal. 2018 Apr;16(4):89. https://onlinelibrary.wiley.com/doi/10.1111/apt.12827, abgerufen am 08.08.2022.
Ein vermeidbares interdisziplinäres Krankheitsbild. https://www.slaek.de/media/dokumente/04presse/aerzteblatt/archiv/2011-2020/2016/09/0916_382.pdf, abgerufen am 06.04.2023.
Ermens, A.A.M. et al. (2003): Randomised clinical study: the effects of oral taurine 6g/day vs placebo on portal hypertension. Aliment Pharmacol Ther. 2018;47:86– 94. https://pubmed.ncbi.nlm.nih.gov/14636871/, abgerufen am 08.08.2022.
Escouto, G.S. et al. (2023): Probiotic Supplementation, Hepatic Fibrosis, and the Microbiota Profile in Patients with Nonalcoholic Steatohepatitis: A Randomized Controlled Trial. J Nutr. 153(7), 1984–1993. https://pubmed.ncbi.nlm.nih.gov/37225124/, abgerufen am 30.10.2023.
Eslam, M. et al. (2018): Genetics and epigenetics of NAFLD and NASH: Clinical impact. J Hepatol. 2018 Feb;68(2):268-79. https://pubmed.ncbi.nlm.nih.gov/29122391/, abgerufen am 08.08.2022.
European Food Safety Authority (EFSA) (2018): Scientific opinion on the safety of green tea catechins. EFSA Journal 2018 Apr;16(4):e05239. https://efsa.onlinelibrary.wiley.com/doi/full/10.2903/j.efsa.2018.5239, abgerufen am: 08.02.2018.
Ferlitsch, A. et al. (2005): Vasoconstrictor hyperactivity can be reversed by antioxidants in patients with advanced alcoholic cirrhosis of the liver and ascites. Crit Care Med 2005 Sep;33(9):2028-33. https://www.ncbi.nlm.nih.gov/pubmed/16148476, abgerufen am: 07.09.2018.
Fu, B.C. et al. (2020): Associations of plasma trimethylamine N-oxide, choline, carnitine, and betaine with inflammatory and cardiometabolic risk biomarkers and the fecal microbiome in the Multiethnic Cohort Adiposity Phenotype Study. Am J Clin Nutr. 2020 Jun 1;111(6):1226-34. https://pubmed.ncbi.nlm.nih.gov/32055828/, abgerufen am 08.08.2022.
Fukui, H. (2021): Leaky Gut and Gut-Liver Axis in Liver Cirrhosis: Clinical Studies Update. Gut Liver. 2021 Sep 15;15(5):666-676. https://pubmed.ncbi.nlm.nih.gov/33071239/, abgerufen am 06.04.2023.
Fukushima, K. et al. (2019): Association between dyslipidemia and plasma levels of branched-chain amino acids in the Japanese population without diabetes mellitus. J Clin Lipidol. Nov-Dec 2019;13(6):932-939.e2. https://pubmed.ncbi.nlm.nih.gov/31601483/, abgerufen am 08.08.2022.
Gaggini, M. et al. (2018): Altered amino acid concentrations in NAFLD: Impact of obesity and insulin resistance. Hepatology. 2018 Jan;67(1):145-58. https://pubmed.ncbi.nlm.nih.gov/28802074/, abgerufen am 08.08.2022.
Gao, X. et al. (2019): Low serum choline and high serum betaine levels are associated with favorable components of metabolic syndrome in Newfoundland population. J Diabetes Complications. 2019 Oct;33(10):107398. https://pubmed.ncbi.nlm.nih.gov/31320248/, abgerufen am 08.08.2022.
García-Álvarez, M. et al. (2018): Relationship of vitamin D status with advanced liver fibrosis and response to hepatitis C virus therapy: a meta-analysis. Hepathology 2014 Nov;60(5):1541-50. https://www.ncbi.nlm.nih.gov/pubmed/24975775, abgerufen am: 07.09.2018.
García-Ayllón, M.S. et al. (2008): Brain cholinergic impairment in liver failure. Brain. 2008 Nov;131(11):2946–56. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC2577805/, abgerufen am 08.08.2022.
Garrett-Laster, M. et al. (1984): Impairment of taste and olfaction in patients with cirrhosis: the role of vitamin A. Hum Nutr Clin Nutr 1984 May;38(3):203-14. https://www.ncbi.nlm.nih.gov/pubmed/6746322, abgerufen am: 07.09.2018.
Gentile, C.L. et al. (2011): Experimental evidence for therapeutic potential of taurine in the treatment of nonalcoholic fatty liver disease. Am J Physiol Regul Integr Comp Physiol. 2011 Dec;301(6):R1710-22. https://pubmed.ncbi.nlm.nih.gov/21957160/, abgerufen am 08.08.2022.
Gerbes, A.L. et al. (2018): Aktualisierung der S2k-Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) „Komplikationen der Leberzirrhose“. AWMF-Nr.: 021-017. https://www.awmf.org/uploads/tx_szleitlinien/021-017l_S2k_Komplikationen-der-Leberzirrhose_2019-04.pdf, abgerufen am 08.08.2022.
Gho, E.T. et al. (2018): L-ornithine L-aspartate for prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev 2018 May 15;5(5):CD012410. https://www.ncbi.nlm.nih.gov/pubmed/29762873, abgerufen am: 07.08.2018.
Gillessen, A. & Schmidt, H.H. (2020): Silymarin as Supportive Treatment in Liver Diseases: A Narrative Review. Adv Ther 2020 Apr;37(4):1279-1301. https://pubmed.ncbi.nlm.nih.gov/32065376/, abgerufen am: 23.06.2021.
Glöckler, T.M. et al. (2016): Die Wernicke Enzephalopathie. https://www.slaek.de/media/dokumente/04presse/aerzteblatt/archiv/2011-2020/2016/09/0916_382.pdf, abgerufen am 12.04.2023.
Gluud, L.L. et al. (2013): Oral branched-chain amino acids have a beneficial effect on manifestation of hepatic encephalopathy in a systematic review with meta-analyses of randomized controlled trials. J Nutr 2013 Aug;143(8):1263-8. https://www.ncbi.nlm.nih.gov/pubmed/23739310, abgerufen am: 07.09.2018.
Greenberg, J.A. et al. (2021): Eggs, dietary cholesterol, choline, betaine, and diabetes risk in the Women's Health Initiative: a prospective analysis. Am J Clin Nutr. 2021 Jul 1;114(1):368-77. https://pubmed.ncbi.nlm.nih.gov/33829251/, abgerufen am 08.08.2022.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2018): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 4. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Grüngreiff, K. et al. (2021): Albumin Substitution in Decompensated Liver Cirrhosis: Don't Forget Zinc. Nutrients. 2021 Nov 10;13(11):4011. https://pubmed.ncbi.nlm.nih.gov/34836265/, abgerufen am 08.08.2022.
Guan, R. et al. (1995): The effect of polyunsaturated phosphatidyl choline in the treatment of acute viral hepatitis. Aliment Pharmacol Ther. 1995 Dec;9(6):699-703. https://pubmed.ncbi.nlm.nih.gov/8824659/, abgerufen am 08.08.2022.
Guerrerio, A.L. et al. (2012): Choline intake in a large cohort of patients with nonalcoholic fatty liver disease. Am J Clin Nutr. 2012 Apr;95(4):892-900. https://pubmed.ncbi.nlm.nih.gov/22338037/, abgerufen am 08.08.2022.
Guerriero, E. et al. (2014): Assessment of the Selenoprotein M (SELM) over-expression on human hepatocellular carcinoma tissues by immunohistochemistry. Eur J Histochem 2014 Dec 1;58(4):2433. https://www.ncbi.nlm.nih.gov/pubmed/25578973, abgerufen am: 07.09.2018.
Gundermann, K.J. et al. (2016): Essential phospholipids in fatty liver: a scientific update. Clin Exp Gastroenterol. 2016;9:105–17. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4861608/, abgerufen am 08.08.2022.
Hamaya, R. et al. (2021): Association of Plasma Branched-Chain Amino Acid With Biomarkers of Inflammation and Lipid Metabolism in Women. Circ Genom Precis Med. 2021 Aug;14(4):e003330. https://pubmed.ncbi.nlm.nih.gov/34264743/, abgerufen am 08.08.2022.
Hambley, B.C. et al. (2016): Effect of vitamin K on coagulopathy in liver disease: a single center retrospective review. Blood 2016;128(22):2583. http://www.bloodjournal.org/content/128/22/2583?sso-checked=true, abgerufen am: 07.09.2018.
Hanai, T. et al. (2020): Usefulness of Carnitine Supplementation for the Complications of Liver Cirrhosis. Nutrients. 2020 Jun 29;12(7):1915. https://pubmed.ncbi.nlm.nih.gov/32610446/, abgerufen am 08.08.2022.
Harrison, S.A. et al. (2003): Vitamin E and vitamin C treatment improves fibrosis in patients with non-alcoholic steatohepatitis. Am J Gastroenterol 2003 Nov;98(11):2485-90. https://www.ncbi.nlm.nih.gov/pubmed/14638353, abgerufen am: 07.09.2018.
Hasegawa, T. et al. (2001): Plasma transforming growth factor-beta 1 level and efficacy of alpha-tocopherol in patients with non-alcoholic steatohepatitis: a pilot study. Aliment Pharmacol Ther 2001Oct;15(10):1667-72. https://www.ncbi.nlm.nih.gov/pubmed/11564008, abgerufen am: 07.08.2018.
Hassan, R. et al. (1991): Effect of thiamine on glucose utilization in hepatic cirrhosis. J Gastroenterol Hepatol 1991 Jan-Feb;6(1):59-60. https://www.ncbi.nlm.nih.gov/pubmed/1883979, abgerufen am: 07.09.2018.
Hayashi, M. et al. (2007): Evaluation of the effects of combination therapy with branched-chain amino acid and zinc supplements on nitrogen metabolism in liver cirrhosis. Hepatol Res. 2007 Aug;37(8):615-9. https://pubmed.ncbi.nlm.nih.gov/17517070/, abgerufen am 08.08.2022.
Hayward, K.L. et al. (2016): Can paracetamol (acetaminophen) be administered to patients with liver impairment? Br J Clin Pharmacol. 2016 Feb;81(2):210-22. https://pubmed.ncbi.nlm.nih.gov/26460177/, abgerufen am 08.08.2022.
He, M. et al. (2020): Gut microbiota-derived trimethylamine-N-oxide: A bridge between dietary fatty acid and cardiovascular disease? Food Res Int. 2020 Dec;138(Pt B):109812. https://pubmed.ncbi.nlm.nih.gov/33288187/, abgerufen am 08.08.2022.
He, Y. et al. (2021): Using Metabolomics in Diabetes Management with Traditional Chinese Medicine: A Review. Am J Chin Med. 2021;49(8):1813-1837. https://pubmed.ncbi.nlm.nih.gov/34961417/, abgerufen am 08.08.2022.
Hepatobiliary Pancreat Dis Int. 2014 Aug;13(4):354-60. https://pubmed.ncbi.nlm.nih.gov/25100119/, abgerufen am 06.04.2023.
Hernández-Guerra, M. et al. (2006): Ascorbic acid improves the intrahepatic dysfunction of patients with cirrhosis and portal hypertension. Hepatology 2006 Mar;43(3):485-91. https://www.ncbi.nlm.nih.gov/pubmed/16496307, abgerufen am: 07.09.2018.
Herold, G. (2017): Innere Medizin. Selbstverlag, Köln.
Ho, H.L. et al. (2019): Folic acid ameliorates homocysteine-induced angiogenesis and portosystemic collaterals in cirrhotic rats. Ann Hepatol 2019 Jul-Aug;18(4):633-639. https://pubmed.ncbi.nlm.nih.gov/31078441/, abgerufen am: 23.06.2021.
Hoan, N.X. et al. (2018): Vitamin D deficiency and hepatitis viruses-associated liver disease: A literature review. World J Gastroenterol 2018 Jan 28;24(4):445-60. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5787780/, abgerufen am: 07.09.2018.
Holecek, M. (2015): Ammonia and amino acid profiles in liver cirrhosis: Effects of variables leading to hepatic encephalopathy. Nutrition 2015 Jan;31(1):14-20. https://www.sciencedirect.com/science/article/abs/pii/S0899900714001506, abgerufen am 08.08.2022.
Holeček, M. (2017): Branched-chain amino acid supplementation in treatment of liver cirrhosis: Updated views on how to attenuate their harmful effects on cataplerosis and ammonia formation. Nutrition 2017 Sep;41:80-85. https://pubmed.ncbi.nlm.nih.gov/28760433/, abgerufen am: 23.06.2021.
HOLEČEK, M. (2021): The Role of Skeletal Muscle in The Pathogenesis of Altered Concentrations of Branched-Chain Amino Acids (Valine, Leucine, and Isoleucine) in Liver Cirrhosis, Diabetes, and Other Diseases. Physiol Res. 2021 Jun;70(3):293–305. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8820553/, abgerufen am 08.08.2022.
Honda, Y. et al. (2017): Efficacy of glutathione for the treatment of non-alcoholic fatty liver disease: an open-label, single-arm, multicenter, pilot study. BMC Gastroenterol. 2017;17:96. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5549431/, abgerufen am: 07.09.2018.
Hu, Y.H. et al. (2008): Dietary amino acid taurine ameliorates liver injury in chronic hepatitis patients. Amino Acids. 2008 Aug;35(2):469-73. https://pubmed.ncbi.nlm.nih.gov/17690950/, abgerufen am 08.08.2022.
Huang, L. et al. (2022): Alterations of gut microbiome and effects of probiotic therapy in patients with liver cirrhosis: A systematic review and meta-analysis. Medicine (Baltimore). 2022 Dec 23;101(51):e32335. https://pubmed.ncbi.nlm.nih.gov/36595801/, abgerufen am 06.04.2023.
Huber, R. et al. (2009): Artichoke leave extract for chronic hepatitis C - a pilot study. Phytomedicine 2009 Sep;16(9):801-4. https://pubmed.ncbi.nlm.nih.gov/19427774/, abgerufen am: 23.06.2021.
Hung, GD. et al. (2012): Green tea extract supplementation ameliorates CCl4-induced hepatic oxidative stress, fibrosis, and acute-phase protein expression in rat. J Formos Med Assoc. 2012 Oct;111(10):550-9. https://www.ncbi.nlm.nih.gov/pubmed/23089690, abgerufen am 06.02.2019.
Imajo, K. et al. (2012): Plasma free choline is a novel non-invasive biomarker for early-stage non-alcoholic steatohepatitis: A multi-center validation study. Hepatol Res. 2012 Aug;42(8):757-66. https://pubmed.ncbi.nlm.nih.gov/22780848/, abgerufen am 08.08.2022.
Imajo, K. et al. (2014): Oral choline tolerance test as a novel noninvasive method for predicting nonalcoholic steatohepatitis. J Gastroenterol. 2014 Feb;49(2):295-304. https://pubmed.ncbi.nlm.nih.gov/23503837/, abgerufen am 08.08.2022.
Internisten im Netz: Was ist eine Leberzirrhose. Herausgegeben vom Berufsverband Deutscher Internisten e.V. https://www.internisten-im-netz.de/krankheiten/leberzirrhose/was-ist-eine-leberzirrhose/, abgerufen am: 07.09.2018.
Ismaiel, A. et al. (2022): Effects of Branched-Chain Amino Acids on Parameters Evaluating Sarcopenia in Liver Cirrhosis: Systematic Review and Meta-Analysis. Front Nutr. 2022 Jan 27;9:749969. https://pubmed.ncbi.nlm.nih.gov/35155535/, abgerufen am 08.08.2022.
Jang, E.S. et al. (2021): Effectiveness of 4-Week Oral Taurine Treatment for Muscle Cramps in Patients with Liver Cirrhosis: A Single-Arm Pilot Study. Yonsei Med J. 2021 Jan;62(1):21-8. https://pubmed.ncbi.nlm.nih.gov/33381931/, abgerufen am 08.08.2022.
Janyajirawong, R. et al. (2021): Efficacy of Zinc Supplement in Minimal hepatic Encephalopathy: A prospective, Randomized Controlled Study (Zinc-MHE Trial). Asian Pac J Cancer Prev. 2021 Sep 1;22(9):2879-87. https://pubmed.ncbi.nlm.nih.gov/34582657/, abgerufen am 08.08.2022.
Jenkins, P.J. et al. (1982): Use of polyunsaturated phosphatidyl choline in HBsAg negative chronic active hepatitis: results of prospective double-blind controlled trial. Liver. 1982 Jun;2(2):77-81. https://pubmed.ncbi.nlm.nih.gov/6757621/, abgerufen am 08.08.2022.
Jeon, D. et al. (2021): Dynamics of Serum Retinol and Alpha-Tocopherol Levels According to Non-Alcoholic Fatty Liver Disease Status. Nutrients. 2021 May;13(5):1720. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8161312/, abgerufen am 08.08.2022.
Jha, A.K. et al. (2017): Effect of replenishment of vitamin D on survival in patients with decompensated liver cirrhosis: A prospective study. World J Gastrointest Pathophysiol 2017 Aug 15;8(3):133-41. https://www.ncbi.nlm.nih.gov/pubmed/28868183, abgerufen am: 07.09.2018.
Ji, Y. et al. (2019): Gut Microbiota-Derived Components and Metabolites in the Progression of Non-Alcoholic Fatty Liver Disease (NAFLD). Nutrients. 2019 Aug;11(8):1712. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC6724003/, abgerufen am 08.08.2022.
Jiang, W. et al. (2016): Hepatoprotective and antioxidant effects of lycopene on non-alcoholic fatty liver disease in rat. World J Gastroenterol. 2016 Dec 14;22(46):10180-8. https://pubmed.ncbi.nlm.nih.gov/28028366/, abgerufen am 08.08.2022.
Jindal, A. & Jagdish, R.K. (2019): Sarcopenia: Ammonia metabolism and hepatic encephalopathy. Clin Mol Hepatol. 2019 Sep;25(3):270-9. https://pubmed.ncbi.nlm.nih.gov/31006226/, abgerufen am 08.08.2022.
Kalopitas, G. et al. (2021): Impact of Silymarin in individuals with nonalcoholic fatty liver disease: A systematic review and meta-analysis. Nutrition 2021 Mar;83:111092. https://pubmed.ncbi.nlm.nih.gov/33418491/, abgerufen am: 23.06.2021.
Karwi, Q.G. & Lopaschuk, G.D. (2022): Branched-Chain Amino Acid Metabolism in the Failing Heart. Cardiovasc Drugs Ther. 2022 Feb 12. https://pubmed.ncbi.nlm.nih.gov/35150384/, abgerufen am 08.08.2022.
Katayama, K. (2020): Zinc and protein metabolism in chronic liver diseases. Nutr Res. 2020 Feb;74:1-9. https://pubmed.ncbi.nlm.nih.gov/31891865/, abgerufen am 08.08.2022.
Khan, A. et al. (2021): Understanding the Effects of Gut Microbiota Dysbiosis on Nonalcoholic Fatty Liver Disease and the Possible Probiotics Role: Recent Updates. Int J Biol Sci. 2021;17(3):818–33. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7975705/, abgerufen am 08.08.2022.
Kircheis, G. & Lüth, S. (2019): Pharmacokinetic and Pharmacodynamic Properties of L-Ornithine L-Aspartate (LOLA) in Hepatic Encephalopathy. Drugs. 2019 Feb;79(Suppl 1):23-9. https://pubmed.ncbi.nlm.nih.gov/30706424/, abgerufen am 08.08.2022.
Komolmit, P. et al. (2017): Vitamin D supplementation improves serum markers associated with hepatic fibrogenesis in chronic hepatitis C patients: A randomized, double-blind placebo-controlled study. Sci Rep. 2017;7:8905. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5566364/, abgerufen am: 07.09.2018.
Konstantinova, S.V. et al. (2008): Divergent associations of plasma choline and betaine with components of metabolic syndrome in middle age and elderly men and women. J Nutr. 2008 May;138(5):914-20. https://pubmed.ncbi.nlm.nih.gov/18424601/, abgerufen am 08.08.2022.
Koop, A.H. et al. (2018): An Argument for Vitamin D, A, and Zinc Monitoring in Cirrhosis. Ann Hepatol 2018 Oct 16;17(6):920-932. https://pubmed.ncbi.nlm.nih.gov/30600288/, abgerufen am: 23.06.2021.
Kornerup, L.S. et al. (2018): Update on the therapeutic management of hepatic encephalophaty. Curr Gastroenterol Rep 2018 Apr 11;20(5):21. https://www.ncbi.nlm.nih.gov/pubmed/29644492, abgerufen am: 07.09.2018.
Kreis, R. et al. (1991): Localized 1H NMR spectroscopy in patients with chronic hepatic encephalopathy. Analysis of changes in cerebral glutamine, choline and inositols. NMR Biomed. 1991 Apr;4(2):109-16. https://pubmed.ncbi.nlm.nih.gov/1650239/, abgerufen am 08.08.2022.
Krueger, E.S. et al. (2021): The Accumulation and Molecular Effects of Trimethylamine N-Oxide on Metabolic Tissues: It’s Not All Bad. Nutrients. 2021 Aug;13(8):2873. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8400152/, abgerufen am 08.08.2022.
Kubacka, J. et al. (2021): The Association between Branched-Chain Amino Acids (BCAAs) and Cardiometabolic Risk Factors in Middle-Aged Caucasian Women Stratified According to Glycemic Status. Nutrients. 2021 Sep 22;13(10):3307. https://pubmed.ncbi.nlm.nih.gov/34684308/, abgerufen am 08.08.2022.
Kujovich, J.L. (2015): Coagulation in liver disease: a balancing act. Hematology Am Soc Hematol Educ Program. 2015;2015:243-9. https://www.ncbi.nlm.nih.gov/pubmed/26637729, abgerufen am: 07.09.2018.
Lai, C.Y. et al. (2018): Possible synergistic effects of glutathione and C-reactive protein in the progression of liver cirrhosis. Nutrients 2018 Jun:10(6):678. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024608/, abgerufen am: 07.09.2018.
Lai, C.Y. et al. (2020): Impact of Glutathione and Vitamin B-6 in Cirrhosis Patients: A Randomized Controlled Trial and Follow-Up Study. Nutrients. 2020 Jul 3;12(7):1978. https://pubmed.ncbi.nlm.nih.gov/32635181/, abgerufen am 08.08.2022.
Lee, N.Y. & Suk, K.T. (2020): The Role of the Gut Microbiome in Liver Cirrhosis Treatment. Int J Mol Sci. 2020 Dec 28;22(1):199. https://pubmed.ncbi.nlm.nih.gov/33379148/, abgerufen am 06.04.2023.
León-Mimila, P. et al. (2021): Trimethylamine N-oxide levels are associated with NASH in obese subjects with type 2 diabetes. Diabetes Metab. 2021 Mar;47(2):101183. https://pubmed.ncbi.nlm.nih.gov/32791310/, abgerufen am 08.08.2022.
Li, C. et al. (2021): Study on the correlation between urinary retinol-binding protein and nonalcoholic fatty liver disease. J Med Biochem. 2021 Jan 26;40(1):86-91. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7857848, abgerufen am 08.08.2022.
Li, N. & Zhao, H. (2021): Role of Carnitine in Non-alcoholic Fatty Liver Disease and Other Related Diseases: An Update. Front Med (Lausanne). 2021 Aug 9;8:689042. https://pubmed.ncbi.nlm.nih.gov/34434943/, abgerufen am 08.08.2022.
Licata, A. et al. (2021): The Role of Vitamin Deficiency in Liver Disease: To Supplement or Not Supplement? Nutrients. 2021 Nov;13(11):4014. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8620546, abgerufen am 08.08.2022.
Lim, L.L. et al. (2020): Circulating branched-chain amino acids and incident heart failure in type 2 diabetes: The Hong Kong Diabetes Register. Diabetes Metab Res Rev. 2020 Mar;36(3):e3253. https://pubmed.ncbi.nlm.nih.gov/31957226/, abgerufen am 08.08.2022.
Liu, D. & Chen, P. (2023): Binary Bacillus subtilis protects the intestinal mucosa barrier and alleviates nonalcoholic steatohepatitis. Animal Model Exp Med. 10.1002/ame2.12337. https://pubmed.ncbi.nlm.nih.gov/37469297/, abgerufen am 30.10.2023.
Liu, J. et al. (2022): LC-MS-Based Lipidomic Analysis of Serum Samples from Patients with Type 2 Diabetes Mellitus (T2DM). Dis Markers. 2022;2022:5559470. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8858047/, abgerufen am 08.08.2022.
Liu, W. et al. (2015): Antioxidant Mechanisms in Nonalcoholic Fatty Liver Disease. Curr Drug Targets. 2015;16(12):1301-14. https://pubmed.ncbi.nlm.nih.gov/25915484/, abgerufen am 08.08.2022.
Llibre-Nieto, G.et al (2021): Micronutrient Deficiencies in Patients with Decompensated Liver Cirrhosis. Nutrients 2021 Apr 10;13(4):1249. https://pubmed.ncbi.nlm.nih.gov/33920134/, abgerufen am 23.06.2021.
Longo, M. et al. (2022): TM6SF2/PNPLA3/MBOAT7 Loss-of-Function Genetic Variants Impact on NAFLD Development and Progression Both in Patients and in In Vitro Models. Cell Mol Gastroenterol Hepatol. 2022;13(3):759-88. https://pubmed.ncbi.nlm.nih.gov/34823063/, abgerufen am 08.08.2022.
Lu, S.C. (2020): Dysregulation of glutathione synthesis in liver disease. Liver Research 2020;4(2):64-73. https://www.sciencedirect.com/science/article/pii/S2542568420300234, abgerufen am: 23.06.2021.
Lunia, M.K. et al. (2013): Probiotics prevent hepatic encephalopathy in patients with cirrhosis: a randomized controlled trial. Clin Gastroenterol Hepatol. 2014 Jun;12(6):1003-8.e1. https://pubmed.ncbi.nlm.nih.gov/24246768/, abgerufen am 06.04.2023.
Mahamid, M. et al. (2018): Folate and B12 levels correlate with histological severity in NASH patients. Nutrients. 2018;10(4):440. http://www.mdpi.com/2072-6643/10/4/440, abgerufen am: 07.09.2018.
Majzoub, A.M. et al. (2021): Systematic review with network meta-analysis: comparative efficacy of pharmacologic therapies for fibrosis improvement and resolution of NASH. Aliment Pharmacol Ther. 2021 Oct;54(7):880-9. https://pubmed.ncbi.nlm.nih.gov/34435378/, abgerufen am 08.08.2022.
Manne, V. & Saab, S. (2014): Impact of nutrition and obesity on chronic liver disease. Clin Liver Dis 2014 Feb;18(1):205-18. https://www.ncbi.nlm.nih.gov/pubmed/24274875, abgerufen am: 07.09.2018.
Mansour-Ghanaei, F. et al (2019): Efficacy of curcumin/turmeric on liver enzymes in patients with non-alcoholic fatty liver disease: A systematic review of randomized controlled trials. Integr Med Res 2019 Mar;8(1):57-61. https://pubmed.ncbi.nlm.nih.gov/30949432/, abgerufen am: 23.06.2021.
Mansour-Ghanaei, F. et al. (2020): The Efficacy of Vitamin D Supplementation against Nonalcoholic Fatty Liver Disease: A Meta-Analysis. J Diet Suppl. 2020;17(4):467-85. https://pubmed.ncbi.nlm.nih.gov/31256692/, abgerufen am 08.08.2022.
Martí-Carvajal, A.J. & Solà, I. (2015): Vitamin K for upper gastrointestinal bleeding in people with acute or chronic liver disease. Cochrane Database Syst Rev 2015 Jun 9;2015(6):CD004792. https://www.ncbi.nlm.nih.gov/pubmed/26058964, abgerufen am: 07.09.2018.
Martí-Carvajal, A.J. et al. (2019): Acetyl-L-carnitine for patients with hepatic encephalopathy. Cochrane Database Syst Rev. 2019 Jan 5;1(1):CD011451. https://pubmed.ncbi.nlm.nih.gov/30610762/, abgerufen am 08.08.2022.
Martínez-Arnau, F.M. et al. (2019): Beneficial Effects of Leucine Supplementation on Criteria for Sarcopenia: A Systematic Review. Nutrients. 2019 Oct 17;11(10):2504. https://pubmed.ncbi.nlm.nih.gov/31627427/, abgerufen am 08.08.2022.
Masterjohn, C. & Bruno, R.S. (2012): Therapeutic potential of green tea in nonalcoholic fatty liver disease. Nutr Rev 2012 Jan;70(1):41-56. https://www.ncbi.nlm.nih.gov/pubmed/22221215, abgerufen am: 06.02.2019.
Mayr, U. et al. (2020): Vitamin D Deficiency Is Highly Prevalent in Critically Ill Patients and a Risk Factor for Mortality: A Prospective Observational Study Comparing Noncirrhotic Patients and Patients With Cirrhosis. J Intensive Care Med. 2020 Oct;35(10):992-1001. https://pubmed.ncbi.nlm.nih.gov/30270710/, abgerufen am 08.08.2022.
Mazo, D.F. et al. (2019): Validation of PNPLA3 polymorphisms as risk factor for NAFLD and liver fibrosis in an admixed population. Ann Hepatol. May-Jun 2019;18(3):466-71. https://pubmed.ncbi.nlm.nih.gov/31054980/, abgerufen am 08.08.2022.
Mehedint, M.G. & Zeisel, S.H. (2013): Choline’s role in maintaining liver function: new evidence for epigenetic mechanisms. Curr Opin Clin Nutr Metab Care. 2013 May;16(3):339–45. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC3729018/, abgerufen am 08.08.2022.
Mei, Z. et al. (2021): Dietary factors, gut microbiota, and serum trimethylamine-N-oxide associated with cardiovascular disease in the Hispanic Community Health Study/Study of Latinos. Am J Clin Nutr. 2021 Jun 1;113(6):1503-14. https://pubmed.ncbi.nlm.nih.gov/33709132/, abgerufen am 08.08.2022.
Meroni, M. et al. (2021): Genetics Is of the Essence to Face NAFLD. Biomedicines. 2021 Oct;9(10):1359. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8533437/, abgerufen am 08.08.2022.
Mirhafez, S.R. et al. (2021): The Effect of Curcumin Phytosome on the Treatment of Patients with Non-alcoholic Fatty Liver Disease: A Double-Blind, Randomized, Placebo-Controlled Trial. Adv Exp Med Biol. 2021;1308:25-35. https://pubmed.ncbi.nlm.nih.gov/33861434/, abgerufen am 08.08.2022.
Mittal, V.V. et al. (2011): A randomized controlled trial comparing lactulose, probiotics, and L-ornithine L-aspartate in treatment of minimal hepatic encephalopathy. Eur J Gastroenterol Hepatol. 2011 Aug;23(8):725-32. https://pubmed.ncbi.nlm.nih.gov/21646910/, abgerufen am 06.04.2023.
Mondul, A. et al. (2015): PNPLA3 I148M Variant Influences Circulating Retinol in Adults with Nonalcoholic Fatty Liver Disease or Obesity. J Nutr. 2015 Aug;145(8):1687-91. https://pubmed.ncbi.nlm.nih.gov/26136587/, abgerufen am 08.08.2022.
Mousa, N. et al. (2016): The role of antioxidants and zinc in minimal hepatic encephalopathy: a randomized trial. Therap Adv Gastroenterol 2016 Sep;9(5):684-91. https://www.ncbi.nlm.nih.gov/pubmed/27582881, abgerufen am: 07.09.2018.
Muhammad, I. et al. (2018): Dual Role of Dietary Curcumin Through Attenuating AFB 1-Induced Oxidative Stress and Liver Injury via Modulating Liver Phase-I and Phase-II Enzymes Involved in AFB 1 Bioactivation and Detoxification. ront Pharmacol. 2018 May 25;9:554. https://pubmed.ncbi.nlm.nih.gov/29887802/, abgerufen am 08.08.2022.
Murakami, S. et al. (2018): Taurine attenuates the development of hepatic steatosis through the inhibition of oxidative stress in a model of nonalcoholic fatty liver disease in vivo and in vitro. Amino Acids. 2018 Sep;50(9):1279-88. https://pubmed.ncbi.nlm.nih.gov/29946793/, abgerufen am 08.08.2022.
Nagashimada, M. & Honda, M. (2021): Effect of Microbiome on Non-Alcoholic Fatty Liver Disease and the Role of Probiotics, Prebiotics, and Biogenics. Int J Mol Sci. 2021 Aug;22(15):8008. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8348401/, abgerufen am 08.08.2022.
Naito, Y. et al. (2020): Epigallocatechin-3-gallate (EGCG) attenuates non-alcoholic fatty liver disease via modulating the interaction between gut microbiota and bile acids. J Clin Biochem Nutr. 2020 Jul;67(1):2-9. https://pubmed.ncbi.nlm.nih.gov/32801462/, abgerufen am 08.08.2022.
Nakanashi, H. et al. (2015): L-carnitine reduces muscle cramps in patients with cirrhosis. Clin Gastroenterol Hepatol 2015 Aug 1;13(8):1540-43. https://www.cghjournal.org/article/S1542-3565(14)01741-8/fulltext, abgerufen am: 07.09.2018.
Nakanishi, H. et al. (2020): Impaired brain function improved by l-carnitine in patients with cirrhosis: evaluation using near-infrared spectroscopy. Scientific Reports 2020 Aug 11;10(13566):1-9. https://www.nature.com/articles/s41598-020-70585-y#citeas, abgerufen am: 23.06.2021.
Nakanishi, K. et al. (2019): Late-Evening Snack with Branched-Chain Amino Acid-Enriched Nutrients Does Not Always Inhibit Overt Diabetes in Patients with Cirrhosis: A Pilot Study. Nutrients. 2019 Sep 7;11(9):2140. https://pubmed.ncbi.nlm.nih.gov/31500257/, abgerufen am 08.08.2022.
Narita, K. & Amiya, E. (2021): Is branched-chain amino acid nutritional supplementation beneficial or detrimental in heart failure? World J Cardiol. 2021 Jun 26;13(6):163-9. https://pubmed.ncbi.nlm.nih.gov/34194634/, abgerufen am 08.08.2022.
National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda (MD) (2012): Vitamin A, in: LiverTox: Clinical and Research Information on Drug-Induced Liver Injury [Internet] 2020 Nov 4. https://pubmed.ncbi.nlm.nih.gov/31643494/, abgerufen am : 23.06.2021.
Niebergall, L.J. et al. (2011): Phosphatidylcholine protects against steatosis in mice but not non-alcoholic steatohepatitis. Biochim Biophys Acta. 2011 Dec;1811(12):1177-85. https://pubmed.ncbi.nlm.nih.gov/21745592/, abgerufen am 08.08.2022.
Niederau, C. et al. (1998): Polyunsaturated phosphatidyl-choline and interferon alpha for treatment of chronic hepatitis B and C: a multi-center, randomized, double-blind, placebo-controlled trial. Leich Study Group. Hepatogastroenterology . 1998 May-Jun;45(21):797-804. https://www.ncbi.nlm.nih.gov/pubmed/9684137, abgerufen am 08.08.2022.
Ning, Z. et al. (2021): How Perturbated Metabolites in Diabetes Mellitus Affect the Pathogenesis of Hypertension? Front Physiol. 2021;12:705588. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8416465/, abgerufen am 08.08.2022.
Noori, M. et al. (2017): Pomegranate juice prevents development of non-alcoholic fatty liver disease in rats by attenuating oxidative stress and inflammation. J Sci Food Agric. 2017 Jun;97(8):2327-32. https://pubmed.ncbi.nlm.nih.gov/27717115/, abgerufen am 08.08.2022.
Nouri-Vaskeh, M. et al. (2020): Curcumin ameliorates health-related quality of life in patients with liver cirrhosis: A randomized, double-blind placebo-controlled trial. Complement Ther Med. 2020 Mar;49:102351. https://pubmed.ncbi.nlm.nih.gov/32147077/, abgerufen am 08.08.2022.
Nouri-Vaskeh, M. et al. (2020): Effect of curcumin supplementation on disease severity in patients with liver cirrhosis: A randomized controlled trial. Phytother Res. 2020 Jun;34(6):1446-54. https://pubmed.ncbi.nlm.nih.gov/32017253/, abgerufen am 08.08.2022.
Okubo, T. et al. (2021): Effect of Vitamin D Supplementation on Skeletal Muscle Volume and Strength in Patients with Decompensated Liver Cirrhosis Undergoing Branched Chain Amino Acids Supplementation: A Prospective, Randomized, Controlled Pilot Trial. Nutrients. 2021 May 30;13(6):1874. https://pubmed.ncbi.nlm.nih.gov/34070910/, abgerufen am 08.08.2022.
Onaolapo, O.J. et al. (2017): l-Methionine and silymarin: A comparison of prophylactic protective capabilities in acetaminophen-induced injuries of the liver, kidney and cerebral cortex. Biomed Pharmacother. 2017 Jan;85:323-33. https://pubmed.ncbi.nlm.nih.gov/27889232/, abgerufen am 08.08.2022.
Owen, K.N. & Dewald, O. (2022): Vitamin E Toxicity. StatPearls Publishing; 2022 Jan. https://www.ncbi.nlm.nih.gov/books/NBK564373/, abgerufen am 08.08.2022.
Pan, X.F. et al. (2021): Associations of circulating choline and its related metabolites with cardiometabolic biomarkers: an international pooled analysis. Am J Clin Nutr. 2021 Sep 1;114(3):893-906. https://pubmed.ncbi.nlm.nih.gov/34020444/, abgerufen am 08.08.2022.
Panahi, Y. et al. (2018): Efficacy of artichoke leaf extract in non-alcoholic fatty liver disease: A pilot double-blind randomized controlled trial. Phytother Res 2018 Jul;32(7):1382-1387. https://pubmed.ncbi.nlm.nih.gov/29520889/, abgerufen am: 23.06.2021.
Pande, C. et al. (2012): Addition of probiotics to norfloxacin does not improve efficacy in the prevention of spontaneous bacterial peritonitis: a double-blind placebo-controlled randomized-controlled trial. Eur J Gastroenterol Hepatol. 2012 Jul;24(7):831-9. https://pubmed.ncbi.nlm.nih.gov/22522141/, abgerufen am 06.04.2023.
Papandreou, C. et al. (2019): Plasma metabolites predict both insulin resistance and incident type 2 diabetes: a metabolomics approach within the Prevención con Dieta Mediterránea (PREDIMED) study. Am J Clin Nutr. 2019 Mar;109(3):626–34. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7307433/, abgerufen am 08.08.2022.
Park, J.G. et al. (2017): Effects of branched-chain amino acids (BCAAs) on the progression of advanced liver disease. Medicine (Baltimore) 2017 Jan;96(24):e6580. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5478300/, abgerufen am: 07.09.2018.
Peralta, E.A. et al. (2009): Vitamin E increases biomarkers of estrogen stimulation when taken with tamoxifen. J Surg Res. 2009 May 1;153(1):143-7. https://pubmed.ncbi.nlm.nih.gov/18468636/, abgerufen am 08.08.2022.
Podszun, M. & Frank, J. (2014): Vitamin E-drug interactions: molecular basis and clinical relevance. Nutr Res Rev. 2014 Dec;27(2):215-31. https://pubmed.ncbi.nlm.nih.gov/25225959/, abgerufen am 08.08.2022.
Polyzos, S.A. et al. (2020): Selenium and selenoprotein P in nonalcoholic fatty liver disease. Hormones (Athens). 2020 Mar;19(1):61-72. https://pubmed.ncbi.nlm.nih.gov/31493247/, abgerufen am 08.08.2022.
Primignani, M. et al. (2015): Therapeutic and clinical aspects of portal vein thrombosis in patients with cirrhosis. World J Hepatol 2015 Dec 18;7(29):2906-12. https://www.ncbi.nlm.nih.gov/pubmed/26689354, abgerufen am: 07.09.2018.
Prince, M.I. et al. (2003): Oral antioxidant supplementation for fatigue associated with primary biliary cirrhosis: a result of a multicenter, randomied, placebo-controlled, cross-over tria. Aliment Pharmacol Ther 2003 Jan;17(1):137-43. https://www.ncbi.nlm.nih.gov/pubmed/12492743, abgerufen am: 07.09.2018.
Prystupa, A. et al. (2017): Association between serum selenium concentrations and levels of proinflammatory and profibrotic cytokines – interleukin-6 and growth differentiation factor-15, in patients with alcoholic liver disease. Int J Environ Res Public Health 2017 Apr;14(4):437. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5409638/, abgerufen am: 07.09.2018.
Razis, A.F.A. et al. (2018): Isothiocyanates and Xenobiotic Detoxification. Mol Nutr Food Res. 2018 Sep;62(18):e1700916. https://pubmed.ncbi.nlm.nih.gov/29288567/, abgerufen am 08.08.2022.
Regan, J.A. & Shah, S.H. (2020): Obesity Genomics and Metabolomics: a Nexus of Cardiometabolic Risk. Curr Cardiol Rep. 2020 Oct 10;22(12):174. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8133795/, abgerufen am 08.08.2022.
Renz-Polster, H. et al. Basislehrbuch Innere Medizin. 5. Aufl. Urban & Fischer München.
Rivosecchi, R.M. et al. (2017): The effectiveness of intravenous vitamin K in correcting cirrhosis-associated coagulopathy. Int J Pharm Pract 2017 Dec;25(6):463-65. https://www.ncbi.nlm.nih.gov/pubmed/28211589, abgerufen am: 07.09.2018.
Rodríguez-Sanabria, J.S. et al. (2022): An Update in Epigenetics in Metabolic-Associated Fatty Liver Disease. Front Med (Lausanne). 2022 Jan 11;8:770504. https://pubmed.ncbi.nlm.nih.gov/35087844/, abgerufen am 08.08.2022.
Roe, A.J. et al. (2017): Choline and its metabolites are differently associated with cardiometabolic risk factors, history of cardiovascular disease, and MRI-documented cerebrovascular disease in older adults. Am J Clin Nutr. 2017 Jun;105(6):1283-90. https://pubmed.ncbi.nlm.nih.gov/28356272/, abgerufen am 08.08.2022.
Rossi, R.E. et al. (2015): Diagnosis and treatment of nutritional deficiencies in alcoholic liver disease: Overview of available evidence and open issues. Dig Liver Dis 2015 Oct;47(10):819-25. https://www.ncbi.nlm.nih.gov/pubmed/26164399, abgerufen am: 07.09.2018.
Ruiz-Canela, M. et al. (2016): Plasma Branched-Chain Amino Acids and Incident Cardiovascular Disease in the PREDIMED Trial. Clin Chem. 2016 Apr;62(4):582-92. https://pubmed.ncbi.nlm.nih.gov/26888892/, abgerufen am 08.08.2022.
Ruiz-Margain A. et al. (2018): Effect of a high-protein, high-fiber diet plus supplementation with branched-chain amino acids on the nutritional status of patients with cirrhosis. Rev Gastroenterol Mex (Engl Ed). 2018 Jan-Mar;83(1):9-15. https://pubmed.ncbi.nlm.nih.gov/28408059/, abgerufen am 06.04.2023.
Saab, S. et al. (2016): Probiotics are helpful in hepatic encephalopathy: a meta-analysis of randomized trials. Liver Int. 2016 Jul;36(7):986-93. https://pubmed.ncbi.nlm.nih.gov/26561214/, abgerufen am 06.04.2023.
Saeed, A. et al. (2018): Disturbed Vitamin A Metabolism in Non-Alcoholic Fatty Liver Disease (NAFLD). Nutrients. 2018 Jan;10(1):29. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC5793257/, abgerufen am 08.08.2022.
Saeed, A. et al. (2021): Impaired Hepatic Vitamin A Metabolism in NAFLD Mice Leading to Vitamin A Accumulation in Hepatocytes. Cellular and Molecular Gastroenterology and Hepatology. 2021;11(1):309-25.e3. https://www.sciencedirect.com/science/article/pii/S2352345X20301120, abgerufen am 08.08.2022.
Safer, AM. et al. (2015): Effect of Green Tea Extract Encapsulated Into Chitosan Nanoparticles on Hepatic Fibrosis Collagen Fibers Assessed by Atomic Force Microscopy in Rat Hepatic Fibrosis Model. J Nanosci Nanotechnol. 2015 Sep;15(9):6452-9. https://www.ncbi.nlm.nih.gov/pubmed/26716199, abgerufen am 06.02.2019.
Saja, M.F. et al. (2013): The coagulopathy of liver disease: does vitamin K help? Blood Coagul Fibrinolysis 2013 Jan;24(1):10-7. https://www.ncbi.nlm.nih.gov/pubmed/23080365, abgerufen am: 07.09.2018.
Sakai, Y. et al. (2016): Effect of L-Carnitine in patients with liver cirrhosis on energy metabolism using indirect calorimetry: a pilot study. J Clin Med Res 2016 Dec;8(12):863-69. https://www.ncbi.nlm.nih.gov/pubmed/27829952, abgerufen am: 07.09.2018.
Salehi, E. et al. (2021): Curcumin Can be Acts as Effective agent for Prevent or Treatment of Alcohol-induced Toxicity in Hepatocytes: An Illustrated Mechanistic Review. Iran J Pharm Res. 2021 Winter;20(1):418-36. https://pubmed.ncbi.nlm.nih.gov/34400970/, abgerufen am 08.08.2022.
Santana, R.C. et al. (2016): Assessment of indicators of vitamin A status in non-cirrhotic chronic hepatitis C patients. Braz J Med Biol Res. 2016;49(1):e4785. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4678655/, abgerufen am: 07.09.2018.
Sanyal, A.J. et al. (2010): Pioglitazone, vitamin E, or placebo for non-alcoholic steatohepatitis. N Engl J Med 2010 May 6;362:1675-85. https://www.nejm.org/doi/full/10.1056/NEJMoa0907929, abgerufen am: 07.09.2018.
Savic, D. et al. (2020): The Importance of the Fatty Acid Transporter L-Carnitine in Non-Alcoholic Fatty Liver Disease (NAFLD). Nutrients. 2020 Jul 22;12(8):2178. https://pubmed.ncbi.nlm.nih.gov/32708036/, abgerufen am 08.08.2022.
Savic, Z. et al. (2018): Vitamin D supplementation in patients with alcoholic liver cirrhosis: a prospective study. Minerva Med 2018 Oct;109(5):352-7. https://www.ncbi.nlm.nih.gov/pubmed/29963831, abgerufen am: 07.09.2018.
Schwarzer, R. et al. (2018): Randomised clinical study: the effects of oral taurine 6g/day vs placebo on portal hypertension. Aliment Pharmacol Ther. 2018; 47: 86– 94. https://onlinelibrary.wiley.com/doi/10.1111/apt.14377, abgerufen am 08.08.2022.
Seifert, L.L. et al. (2021). Recurrence of Hepatic Encephalopathy after TIPS: Effective Prophylaxis with Combination of Lactulose and Rifaximin. J Clin Med. 10(20), 4763. https://pubmed.ncbi.nlm.nih.gov/34682886/, abgerufen am 30.10.2023.
Shen, Y.C. et al (2019): Zinc supplementation in patients with cirrhosis and hepatic encephalopathy: a systematic review and meta-analysis. Nutr J 2019 Jul 6;18(1):34. https://pubmed.ncbi.nlm.nih.gov/31279342/, abgerufen am: 23.06.2021.
Sherriff, J.L. et al. (2016): Choline, Its Potential Role in Nonalcoholic Fatty Liver Disease, and the Case for Human and Bacterial Genes. Adv Nutr. 2016 Jan 15;7(1):5-13. https://pubmed.ncbi.nlm.nih.gov/26773011/, abgerufen am 08.08.2022.
Sidhu, S.S. et al. (2018): L-ornithine L-aspartate in bouts of overt hepatic encephalopathy. Hepatology 2018 Feb;67(2):700-10. https://www.ncbi.nlm.nih.gov/pubmed/28749571, abgerufen am: 07.09.2018.
Singh, N.K. & Prasad, R.C. (1998): A pilot study of polyunsaturated phosphatidyl choline in fulminant and subacute hepatic failure. J Assoc Physicians India . 1998 Jun;46(6):530-2. https://www.ncbi.nlm.nih.gov/pubmed/11273253, abgerufen am 08.08.2022.
Siomkajło, M. & Daroszewski, J. (2019): Branched chain amino acids: Passive biomarkers or the key to the pathogenesis of cardiometabolic diseases? Adv Clin Exp Med. 2019 Sep;28(9):1263-9. https://pubmed.ncbi.nlm.nih.gov/31430068/, abgerufen am 08.08.2022.
Somi, M.H. et al. (2012): Effects of low dose zinc supplementation on biochemical markers in non-alcoholic cirrhosis: a randomized clinica trial. Arch Iran Med 2012 Aug;15(8):472-76. https://www.ncbi.nlm.nih.gov/pubmed/22827782, abgerufen: 07.09.2018.
Somi, M.H. et al. (2014): Data from randomized and controlled trial of LCarnithine prescription for the treatment for non-alcoholic fatty liver disease. Bioinformation 2014;10(9):575-79. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4209366/, abgerufen am: 07.09.2018.
Song, M. et al. (2021): Association of serum choline levels and all-cause mortality risk in adults with hypertension: a nested case-control study. Nutr Metab (Lond). 2021 Dec 20;18(1):108. https://pubmed.ncbi.nlm.nih.gov/34930356/, abgerufen am 08.08.2022.
Stauch, S. et al. (1998): Oral L-ornithine-L-aspartate therapy of chronic hepatic encephalopathy: results of a placebo-controlled double-blind study. J Hepatol. 1998 May;28(5):856-64. https://pubmed.ncbi.nlm.nih.gov/9625322/, abgerufen am 06.04.2023.
Stice, C.P. & Wang, X.D (2013): Carotenoids and alcoholic liver disease. Hepatobiliary Surg Nutr. 2013 Oct;2(5):244–7. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3924697/, abgerufen am 08.08.2022.
Stickel, F. et al. (2018): Genetic variants in PNPLA3 and TM6SF2 predispose to the development of hepatocellular carcinoma in individuals with alcohol-related cirrhosis. Am J Gastroenterol. 2018 Oct;113(10):1475-83. https://pubmed.ncbi.nlm.nih.gov/29535416/, abgerufen am 08.08.2022.
Sugihara, T. et al. (2017): Falsely Elevated Serum Vitamin B12 Levels Were Associated with the Severity and Prognosis of Chronic Viral Liver Disease. Yonago Acta Med. 2017 Mar;60(1):31–9. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC5355842/, abgerufen am 08.08.2022.
Świderska, M. et al. (2019): Oxidative stress biomarkers in the serum and plasma of patients with non-alcoholic fatty liver disease (NAFLD). Can plasma AGE be a marker of NAFLD? Oxidative stress biomarkers in NAFLD patients. Free Radic Res. 2019 Aug;53(8):841-50. https://pubmed.ncbi.nlm.nih.gov/31234658/, abgerufen am 08.08.2022.
Tan, H.K. et al. (2020): Effect of zinc treatment on clinical outcomes in patients with liver cirrhosis: A systematic review and meta-analysis. World J Hepatol. 2020;12(7):389-398. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7407915/, abgerufen am: 23.06.2021.
Tang, G. et al. (2021): Green Tea and Epigallocatechin Gallate (EGCG) for the Management of Nonalcoholic Fatty Liver Diseases (NAFLD): Insights into the Role of Oxidative Stress and Antioxidant Mechanism. Antioxidants (Basel). 2021 Jul 5;10(7):1076. https://pubmed.ncbi.nlm.nih.gov/34356308/, abgerufen am 08.08.2022.
Teriaky, A. et al. (2017): Prevalence of fat-soluble vitamin (A, D, and E) and zinc deficiency in patients with cirrhosis being assessed for liver transplantation. Acta Gastroenterol Belg 2017 Apr-Jun;80(2):237-41. https://www.ncbi.nlm.nih.gov/pubmed/29560688, abgerufen am: 07.09.2018.
Tobias, D.K. et al. (2018): Circulating Branched-Chain Amino Acids and Incident Cardiovascular Disease in a Prospective Cohort of US Women. Circ Genom Precis Med. 2018 Apr;11(4):e002157. https://pubmed.ncbi.nlm.nih.gov/29572205/, abgerufen am 08.08.2022.
Togo, S. et al. (2005): Usefulness of granular BCAA after hepatectomy for liver cancer complicated with liver cirrhosis. Nutrition. 2005 Apr;21(4):480-6.https://pubmed.ncbi.nlm.nih.gov/15811769/, abgerufen am 08.08.2022.
Uojima, H. et al. (2017): Effect of branched-chain amino acid supplementation on muscle strength and muscle mass in patients with liver cirrhosis. Eur J Gastroenterol Hepatol 2017 Dec 29;29(12):1402-7. https://www.ncbi.nlm.nih.gov/pubmed/28984678, abgerufen am: 07.09.2018.
Usman, M. & Bakhtawar, N. (2020): Vitamin E as an Adjuvant Treatment for Non-alcoholic Fatty Liver Disease in Adults: A Systematic Review of Randomized Controlled Trials. Cureus 2020 Jul 6;12(7):e9018. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7405968/, abgerufen am 23.06.2021.
Van de Casteele, M. et al. (2002): Blood antioxidant levels in patients with alcoholic liver disease correlate with the degree of liver impairment and are not specific to alcoholic liver injury itself. Aliment Pharmacol Ther 2002 Jan;16:985-92. https://onlinelibrary.wiley.com/doi/epdf/10.1046/j.1365-2036.2002.01255.x, abgerufen am: 07.09.2018.
Vidot, H. et al. (2014): Systematic review: the treatment of muscle cramps in patients with cirrhosis. Aliment Pharmacol Ther. 2014 Aug;40(3):221-32. https://pubmed.ncbi.nlm.nih.gov/24942957/, abgerufen am 08.08.2022.
Vidot, H. et al. (2018): Randomised clinical trial: oral taurine supplementation versus placebo reduces muscle cramps in patients with chronic liver disease. Aliment Pharmacol Ther. 2018 Oct;48(7):704-12. https://pubmed.ncbi.nlm.nih.gov/30136291/, abgerufen am 08.08.2022.
Vilar-Gomez, E. et al. (2021): Impact of the Association Between PNPLA3 Genetic Variation and Dietary Intake on the Risk of Significant Fibrosis in Patients With NAFLD. Am J Gastroenterol. 2021 May 1;116(5):994-1006. https://pubmed.ncbi.nlm.nih.gov/33306506/, abgerufen am 08.08.2022.
Walford, G.A. et al. (2013): Branched chain and aromatic amino acids change acutely following two medical therapies for type 2 diabetes mellitus. Metabolism. 2013 Dec;62(12):1772-8. https://pubmed.ncbi.nlm.nih.gov/23953891/, abgerufen am 08.08.2022.
Wang, X. et al. (2020): Circulating retinol-binding protein 4 is associated with the development and regression of non-alcoholic fatty liver disease. Diabetes Metab. 2020 Apr;46(2):119-28. https://pubmed.ncbi.nlm.nih.gov/31078721/, abgerufen am 08.08.2022.
Wang, X. et al. (2021): Serum selenium and non-alcoholic fatty liver disease (NAFLD) in U.S. adults: National Health and Nutrition Examination Survey (NHANES) 2011-2016. Environ Res. 2021 Jun;197:111190. https://pubmed.ncbi.nlm.nih.gov/33872646/, abgerufen am 08.08.2022.
Wang, Z. et al. (2014): Prognostic value of choline and betaine depends on intestinal microbiota-generated metabolite trimethylamine-N-oxide. Eur Heart J. 2014 Apr 7;35(14):904–10. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC3977137/, abgerufen am 08.08.2022.
Wigand, J. & Berg, T.(2013): Ätiologie, Diagnose und Prävention einer Leberzirrhose. Deutsches Ärzteblatt Studierende.de 2013;3:26-8. https://www.aerzteblatt.de/pdf.asp?id=139715, abgerufen am: 07.09.2018.
Wu, Z. et al. (2023): Alterations in the gut microbiota and the efficacy of adjuvant probiotic therapy in liver cirrhosis. Frontiers in cellular and infection microbiology, 13, 1218552. https://pubmed.ncbi.nlm.nih.gov/37483387/
Xiang, H. et al. (2022): The Role of the Intestinal Microbiota in Nonalcoholic Steatohepatitis. Front Endocrinol (Lausanne). 2022;13:812610. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8861316/, abgerufen am 08.08.2022.
Xu, J et al. (2014): Effects of probiotic therapy on hepatic encephalopathy in patients with liver cirrhosis: an updated meta-analysis of six randomized controlled trials.
Yang, F. et al. (2019): The value of severe vitamin D deficiency in predicting the mortality risk of patients with liver cirrhosis: A meta-analysis. Clin Res Hepatol Gastroenterol. 2019 Nov;43(6):722-9. https://pubmed.ncbi.nlm.nih.gov/30935905/, abgerufen am 08.08.2022.
Yang, J.J. et al. (2021): Circulating trimethylamine N-oxide in association with diet and cardiometabolic biomarkers: an international pooled analysis. Am J Clin Nutr. 2021 May 8;113(5):1145-56. https://pubmed.ncbi.nlm.nih.gov/33826706/, abgerufen am 08.08.2022.
Yang, Z. et al. (2016): Plasma selenium levels and nonalcoholic fatty liver disease in Chinese adults: a cross-sectional analysis. Sci Rep. 2016 Nov 17;6:37288. https://pubmed.ncbi.nlm.nih.gov/27853246/, abgerufen am 08.08.2022.
Yin, X. et al. (2015): The effect of green tea intake on risk of liver disease: a meta analysis. Int J Clin Exp Med. 2015 Jun 15;8(6):8339-46. https://www.ncbi.nlm.nih.gov/pubmed/26309486, abgerufen am: 06.02.2019.
Younis, N.S. et al. (2021): Taurine ameliorates thioacetamide induced liver fibrosis in rats via modulation of toll like receptor 4/nuclear factor kappa B signaling pathway. Sci Rep. 2021;11:12296. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8192756/, abgerufen am 08.08.2022.
Yu, B. & Wang, J. (2022): The efficacy of parenteral nutrition (PN) and enteral nutrition (EN) supports in cirrhosis: A systematic review and network meta-analysis. Medicine (Baltimore). 2022 Jan 21;101(3):e28618. https://pubmed.ncbi.nlm.nih.gov/35060537/, abgerufen am 06.04.2023.
Zanko, V.L. et al. (2020): Vitamin D for treatment of non-alcoholic fatty liver disease detected by transient elastography: A randomized, double-blind, placebo-controlled trial. Diabetes Obes Metab. 2020 Nov;22(11):2097-106. https://pubmed.ncbi.nlm.nih.gov/32613718/, abgerufen am 08.08.2022.
Zeybel, M. et al. (2021): Combined metabolic activators therapy ameliorates liver fat in nonalcoholic fatty liver disease patients. Mol Syst Biol. 2021 Oct;17(10):e10459. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8724764/, abgerufen am 08.08.2022.
Zhang, H. & Gao, J. (2022): Antibiotics and probiotics on hepatic venous pressure gradient in cirrhosis: A systematic review and a meta-analysis. PLoS One. 2022 Aug 30;17(8):e0273231. https://pubmed.ncbi.nlm.nih.gov/36040984/, abgerufen 06.04.2023.
Zhang, Y. et al. (2022): The gut microbiota-bile acid axis: A potential therapeutic target for liver fibrosis. Front Cell Infect Microbiol. 2022 Sep 15;12:945368. https://pubmed.ncbi.nlm.nih.gov/36189347/, abgerufen am 06.04.2023.
Zhang, Z. et al. (2017): Protective action of Se-supplementation against acute alcoholism is regulated by Selenoprotein P (SelP) in the liver. Biol Trace Elem Res 2017 Feb;175(2):375-87. https://www.ncbi.nlm.nih.gov/pubmed/27334433, abgerufen am: 07.09.2018.
Zhang, Z.H. et al. (2022): Serum Retinol-Binding Protein Levels Are Associated with Nonalcoholic Fatty Liver Disease in Chinese Patients with Type 2 Diabetes Mellitus: A Real-World Study. Diabetes Metab J. 2022 Jan;46(1):129-39. https://pubmed.ncbi.nlm.nih.gov/34372627/, abgerufen am 08.08.2022.
Zhao, J. et al. (2015): Novel Metabolic Markers for the Risk of Diabetes Development in American Indians. Diabetes Care. 2015 Feb;38(2):220–7. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4302260/, abgerufen am 08.08.2022.
Zöhrer, E. et al. (2017): Efficacy of docosahexaenoic acid-choline-vitamin E in pediatric NASH: a randomized controlled clinical trial. Appl Physiol Nutr Metab 2017 Sep;42(9):948-54. https://www.ncbi.nlm.nih.gov/pubmed/28511023, abgerufen am: 07.09.2018.