La cirrosi epatica è una patologia che comporta la cicatrizzazione del tessuto epatico, compromettendone progressivamente la funzionalità. Si tratta di una malattia incurabile, tuttavia è possibile rallentarne la progressione ed evitare gravi malattie conseguenti. Anche la medicina dei micronutrienti può contribuire in modo significativo. Leggete qui quali vitamine, minerali e aminoacidi sono particolarmente utili in caso di cirrosi epatica.
Cause e sintomi
Che cos’è la cirrosi epatica e quali sono le cause?
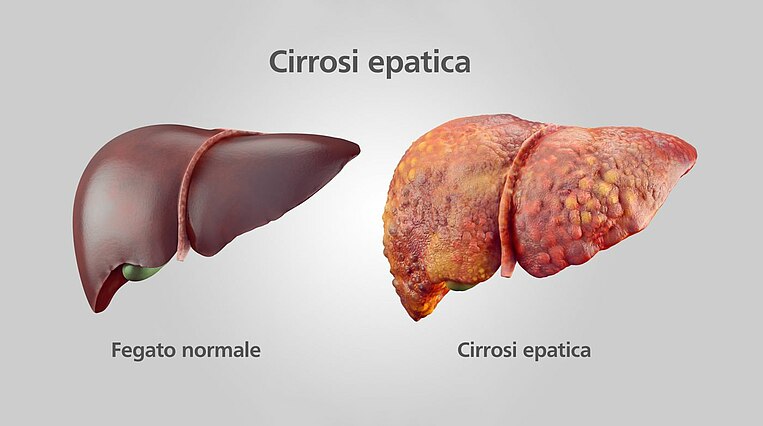
La cirrosi epatica è una patologia che danneggia il fegato, che si autoripara generando delle cicatrici che alla lunga portano a un progressivo restringimento dell’organo. Ecco perché la cirrosi epatica viene anche definita cirrosi atrofica del fegato. Questa patologia rappresenta spesso lo stadio finale di diverse epatopatie croniche.
In Italia, le cause più frequenti di cirrosi epatica sono la steatosi epatica alcolica e non alcolica. Mentre la steatosi alcolica, nota anche come "fegato grasso", è dovuta all’abuso di alcol, quella non alcolica colpisce soprattutto le persone gravemente in sovrappeso (obesità) o con diabete di tipo 2. Tra le altre cause principali di cirrosi epatica figurano le infezioni dovute a determinati virus dell’epatite, malattie metaboliche ereditarie, malattie autoimmuni e danni epatici dovuti a sostanze tossiche (epatiti tossiche).
Come si manifesta la cirrosi epatica?
La cirrosi epatica è accompagnata da diversi sintomi:
- Stanchezza, spossatezza
- Sensazione di pressione e di pesantezza nella parte superiore dell’addome
- Flatulenza, nausea
- Perdita di peso, denutrizione, calo nella percezione dei sapori
- Edemi (accumuli di liquidi), liquido nella cavità addominale (ascite)
- Ittero
- Insufficienza renale, blocco renale
Tra i sintomi tipici figurano anche alterazioni cutanee da epatopatia, ovvero alterazioni caratteristiche della pelle legate a questa patologia:
- Angiomi stellati sulla parte superiore del corpo, sul collo e sul viso (arteriole rosse con piccole diramazioni in rilievo dalla forma simile a una ragnatela)
- Palmi delle mani di colore rosso
- Labbra e lingua di colore rosso vivo (labbra lucide, lingua lucida)
- Prurito
- Colorazione bianca sulle unghie
- Pelle molto sottile, piena di rughe (atrofia cutanea) con vasi sanguigni molto visibili
Quali sono le malattie conseguenti di una cirrosi epatica?
Il fegato è fondamentale per la sua funzione disintossicante. In caso di cirrosi epatica, non è più in grado di svolgere correttamente questa funzione e, di conseguenza, l’ammoniaca nociva si accumula, finisce nel cervello e ne pregiudica il funzionamento (encefalopatia epatica). Questo causa disturbi neurologici come spasmi muscolari, deambulazione incerta, brividi e cedimento muscolare. Nello stadio finale della malattia, i soggetti sono sempre più confusi, non sono in grado di orientarsi e possono arrivare a perdere i sensi (coma epatico).
Inoltre, la cirrosi epatica è responsabile della maggior parte dei tumori che colpiscono il fegato (carcinoma epatocellulare).
Un’altra conseguenza da ricordare è la dilatazione delle vene dell’esofago (varici esofagee), dovuta a un malfunzionamento dei vasi, che comporta un aumento della pressione sanguigna all’interno della circolazione epatica (ipertensione portale). In molte persone, questo aumento della pressione causa la formazione di vene varicose nell’esofago e nello stomaco, con conseguente rischio di emorragie.
Obiettivi del trattamento
Qual è il trattamento classico della cirrosi epatica?
La cirrosi epatica è incurabile e i danni già manifesti non possono essere eliminati. Lo scopo del trattamento è evitare l’avanzamento della malattia e delle sue malattie conseguenti, eliminando innanzitutto le cause.
Se la malattia è dovuta all’eccessivo consumo di alcol, è indispensabile interromperne l’assunzione. In caso di infezione da epatite, è possibile assumere farmaci contro tali virus, mentre in caso di malattia autoimmune, i pazienti ricevono farmaci che bloccano il sistema immunitario.
In linea di massima occorre evitare le sostanze che possono danneggiare ulteriormente il fegato. Oltre all’alcol, tra esse si annoverano anche numerosi farmaci: le persone che soffrono di cirrosi epatica dovrebbero quindi chiedere al proprio medico curante quali farmaci possono o non possono assumere. Anche un’alimentazione sana con un apporto sufficiente di vitamine e nutrienti ha un effetto positivo sulla malattia.
Vengono trattati anche i sintomi, come ipertensione nel fegato, accumulo di liquidi nella cavità addominale o disfunzioni cerebrali dovute alla parziale incapacità del fegato di eliminare le sostanze tossiche come l’ammoniaca (encefalopatia epatica). Tra i sintomi della malattia ci sono un calo delle capacità cognitive e problemi di movimento. Nel peggiore dei casi, si deve ricorrere a un trapianto di fegato.
Informazioni
Proteine: amiche o nemiche? In passato le persone che soffrivano di cirrosi epatica dovevano seguire una dieta povera di proteine, poiché dosi troppo elevate potevano peggiorare l’encefalopatia epatica. Oggi questo non è più consigliato, perché un corretto apporto di proteine è importante per mantenere un buono stato di salute.
Tuttavia, quando si assumono amminoacidi e molte proteine è consigliabile sostenere la funzione intestinale per bloccare la produzione e l’assorbimento di ammoniaca, un prodotto liberato in modo naturale dal metabolismo delle proteine. È possibile ricorrere ad esempio ai probiotici, al lattulosio con effetto lassativo o all’antibiotico rifaximina. Inoltre, sarebbe consigliabile sottoporsi a regolari controlli del livello di ammoniaca.
Il lattulosio è uno zucchero con effetto lassativo e prebiotico, utilizzato anche nel trattamento della cirrosi epatica perché blocca la produzione e l’assorbimento dell’ammoniaca nociva da parte di intestino e sangue.
Gli obiettivi della medicina dei micronutrienti

Spesso le patologie del fegato sono accompagnate da malnutrizione, che causa un insufficiente apporto di calorie e, in particolare, una scarsa assunzione di vitamine B6, vitamine liposolubili e antiossidanti. Il fegato è fondamentale per la digestione e il metabolismo delle sostanze nutritive. A questo si aggiunge il fatto che gli alcolisti in particolare seguono una dieta limitata e, quindi, povera di nutrienti.
La medicina dei micronutrienti mira a evitare o compensare queste carenze. Inoltre, favorisce la disintossicazione dell’ammoniaca, rafforza lo sviluppo dei muscoli e contrasta i processi infiammatori:
- Le vitamine del gruppo B e le vitamine liposolubili A, D e K compensano le carenze dovute a disfunzioni epatiche.
- Le vitamine C ed E e i minerali selenio e zinco proteggono il fegato dai radicali liberi dell’ossigeno che favoriscono la cirrosi.
- Gli aminoacidi a catena ramificata sono importanti per la formazione dei muscoli e, insieme agli aminoacidi ornitina e arginina,favoriscono la disintossicazione dall’ammoniaca.
- La colina migliora la capacità rigenerativa del fegato e, insieme alla carnitina, migliora il metabolismo energetico e lipidico.
Come agisce la medicina dei micronutrienti
Rischio di carenza di vitamine del gruppo B: il fegato non è più in grado di accumularne e assorbirne quantità sufficienti
Meccanismo d’azione delle vitamine del gruppo B
Le vitamine del gruppo B partecipano al metabolismo energetico e degli zuccheri. Spesso l’apporto di queste vitamine con la dieta, il loro assorbimento nell’intestino e il deposito nel fegato risultano particolarmente difficoltosi, soprattutto in chi soffre di cirrosi epatica alcolica. In caso di epatopatie croniche, una carenza di vitamine del gruppo B (come la vitamina B12 e l’acido folico) è associata a valori epatici inferiori alla norma che comportano un rischio di gravi malattie conseguenti. Una carenza di vitamina B1 causa ad esempio danni ai nervi (sindrome di Wernicke-Korsakow/encefalopatia), mentre l’insufficienza di vitamina B12 porta all’anemia.
Inoltre, numerosi studi osservazionali confermano che una carenza di vitamina B6, vitamina B12 e acido folico provoca un aumento dei livelli di omocisteina che, in caso di cirrosi epatica, sono spesso associati ad un aggravamento del decorso della malattia.
I risultati dei primi studi dimostrano inoltre che l’assunzione di vitamina B1 migliora la glicemia nei pazienti con cirrosi epatica. Tuttavia, sono necessari ulteriori studi per approfondire l’effetto delle vitamine del gruppo B sulla progressione delle epatopatie croniche.
Dosaggio e consigli sull’assunzione delle vitamine del gruppo B
Si consiglia di assumere le vitamine del gruppo B sotto forma di preparati combinati, dove le dosi sono regolate al meglio per ogni singola vitamina. In caso di cirrosi epatica, i medici specializzati in micronutrienti consigliano di assumere ogni giorno da 50 a 100 milligrammi del complesso di vitamine B, e in particolare: circa 25 milligrammi di vitamina B1, B2, B6 e niacina; da 400 a 800 microgrammi di acido folico e 25 microgrammi di vitamina B12.
Consiglio
Acido folico sotto forma di acido 5-metiltetraidrofolico (5-MTHF): a causa di un difetto genetico, molte persone non sono in grado di attivare l’acido folico e, di conseguenza, dovrebbero assumerne la forma attiva 5-MTHF.
In caso di encefalopatia, è necessario somministrare dosi elevate di vitamina B1 (circa 100 milligrammi) direttamente per via endovenosa, seguite poi da 300 milligrammi al giorno per altri 30 giorni sotto forma di integratori alimentari.
Determinazione dei livelli di omocisteina in laboratorio
Chi soffre di cirrosi epatica dovrebbe sottoporsi a regolari esami per controllare i livelli di omocisteina. L’omocisteina viene misurata nel plasma, la parte liquida del sangue priva di cellule ematiche. I valori normali sono compresi tra 5 e 9 micromoli per litro.
Da considerare in caso di gravidanza, allattamento, nefropatie e assunzione di farmaci
Le vitamine del gruppo B possono essere assunte ad alte dosi durante la gravidanza e l’allattamento solo in caso di carenza accertata e previa consultazione con il ginecologo curante.
I pazienti nefropatici e i diabetici con danni renali dovrebbero assumere la vitamina B12 sotto forma di metilcobalamina e non di cianocobalamina, poiché quest’ultima a dosaggi elevati probabilmente è dannosa per i pazienti con problemi ai reni.
A dosi elevate (oltre 5 milligrammi al giorno), la vitamina B6 può ridurre l’effetto degli antiepilettici (come il fenobarbital [Luminal®] e la fenitoina [Aurantin®]) e dei farmaci contro la malattia di Parkinson (come la levodopa/L-dopa, ad es. Duodopa®, Madopar®), pertanto deve esserne evitata l’assunzione contemporanea.
I pazienti con problemi al fegato soffrono spesso di una carenza di vitamine liposolubili
Meccanismo d’azione delle vitamine liposolubili D, K e A
Chi soffre di epatopatie croniche spesso assume pochi grassi e, quindi, anche poche vitamine liposolubili come le vitamine D, K e A. Nei soggetti sani il fegato è responsabile della produzione dell’acido biliare, necessario per la sintesi dei grassi, e svolge anche la funzione di deposito per le vitamine liposolubili. In caso di cirrosi epatica, però, questa funzione si riduce, causando spesso una carenza.
Vitamina D: i risultati dei primi studi dimostrano che la vitamina D influisce positivamente sulla cirrosi epatica e ne rallenta la progressione. Inoltre, sembra che prolunghi la sopravvivenza nello stadio finale della malattia. Sono tuttavia necessari ulteriori studi clinici che confermino l’effetto positivo della vitamina D.
Vitamina K: la vitamina K è responsabile della coagulazione del sangue, quindi una sua carenza può portare a una maggiore propensione alle emorragie. Esistono singole evidenze che confermano che la vitamina K migliora la coagulazione in pazienti con cirrosi epatica, ma la letteratura a disposizione non è ancora sufficiente.
Vitamina A: è possibile che la vitamina A migliori il senso del gusto nei pazienti con cirrosi epatica. Un calo nella percezione degli odori e dei sapori può favorire la malnutrizione nelle persone con cirrosi epatica.
Dosaggio e consigli sull’assunzione delle vitamine D, K e A
In caso di cirrosi epatica, la medicina dei micronutrienti consiglia di assumere ogni giorno da 400 a 800 microgrammi di vitamina A e tra 60 e 400 microgrammi di vitamina K.
Per quanto riguarda invece la vitamina D, si dovrebbero assumere da 1.000 a 3.000 unità internazionali. Tuttavia, per stabilire la dose corretta sarebbe meglio consultare il proprio medico, il quale determinerà il livello individuale di vitamina D. In caso di grave carenza di vitamina D, può essere necessario aumentare la dose per un determinato periodo di tempo. Per maggiori informazioni sul corretto dosaggio della vitamina D leggere qui.
Poiché le vitamine D, K e A sono liposolubili, si consiglia di assumerle durante o subito dopo un pasto ricco di grassi, così da migliorarne l’assorbimento da parte dell’intestino.
Determinazione dei livelli di vitamina D in laboratorio
Per accertare una carenza di vitamina D se ne misura la forma di trasporto nel sangue, la cosiddetta vitamina D 25(OH) (calcidiolo). Il valore ottimale della vitamina D dovrebbe essere compreso tra 40 e 60 nanogrammi per millilitro.
A volte i valori di vitamina D sono indicati dai laboratori in unità di misura diverse: per convertire i valori indicati in nanogrammi per millilitro in nanomoli per litro (nmol/l) si moltiplica il valore ottenuto per 2,5.
Da considerare in caso di gravidanza, assunzione di farmaci e malattie renali
Un sovradosaggio di vitamina A durante la gravidanza può causare problemi di crescita e malformazioni del feto, pertanto le donne incinte non dovrebbero assumerla mediante integratori.
La vitamina A è sconsigliata per chi soffre di insufficienza renale poiché i reni indeboliti non sono in grado di eliminarla correttamente e potrebbe quindi accumularsi in eccesso nell’organismo. In caso di malattie epatiche, la vitamina D andrebbe assunta solo previo accordo del medico poiché aumenta l’assorbimento del calcio nell’intestino e i reni indeboliti non sono poi in grado di eliminarlo correttamente.
Chi assume i seguenti farmaci dovrebbe discutere con il proprio medico se è opportuno o meno continuare a prendere anche integratori vitaminici, perché potrebbero esserci delle interazioni.
- L’assunzione concomitante di vitamina D e diuretici del gruppo dei tiazidici (come l’idroclorotiazide [ad esempio Esidrex®] e l’indapamide [ad esempio Ipamix®]) potrebbe aumentare oltre la norma i livelli di calcio.
- L’assunzione concomitante di vitamina K e anticoagulanti della classe dei cumarinici contenenti i principi attivi fenprocumone (ad esempio Marcumar®) o warfarin (Coumadin®) può peggiorarne l’efficacia.
La vitamina E, la vitamina C e altri antiossidanti possono proteggere da ulteriori danni epatici
Meccanismo d’azione degli antiossidanti
Un consumo eccessivo di alcol o danni alle cellule epatiche e infiammazioni già in essere espongono l’organismo ad un elevato stress ossidativo, che viene contrastato esaurendo le riserve naturali di antiossidanti. Il problema può essere risolto assumendo vitamina E, vitamina C e altri antiossidanti come il glutatione e le catechine del tè verde.
Vitamina E: i vantaggi della vitamina E dipendono dal tipo di danni epatici. Secondo uno studio clinico, ad esempio, i pazienti con steatosi non alcolica presentavano un significativo miglioramento dei valori epatici, un calo dei valori infiammatori e una riduzione della steatosi e del processo cirrotico, mentre i pazienti con cirrosi epatica alcolica in stadio avanzato non presentavano alcun miglioramento.
Vitamina C: i primi studi dimostrano che la vitamina C è in grado di migliorare il funzionamento dei vasi e, in molti soggetti colpiti, di ridurre la pressione alta nella circolazione epatica. La vitamina C è necessaria anche per rigenerare la vitamina E. Uno studio clinico l’assunzione di vitamina E e C in soggetti con steatosi non alcolica ha migliorato i valori epatici.
Glutatione: bassi livelli di glutatione in pazienti con problemi epatici sono associati a un peggioramento delle condizioni del fegato. Sono disponibili prime evidenze che dimostrano come l’assunzione di glutatione da parte di pazienti con steatosi non alcolica migliori i valori epatici.
Catechine del tè verde: le catechine, flavonoidi estratti dal tè verde, hanno un effetto antiossidante e antinfiammatorio e possono quindi proteggere le cellule epatiche, come dimostrano esperimenti sugli animali. I ricercatori hanno analizzato 15 studi osservazionali diversi e hanno concluso che il rischio di contrarre malattie del fegato come la cirrosi epatica era inferiore tra i soggetti che bevevano tè. L’assunzione di estratto di tè verde ha avuto un effetto positivo sui soggetti con steatosi non alcolica e ha ridotto i valori epatici superiori alla norma. Tuttavia, sono necessari ulteriori studi clinici per verificare se il tè verde o l’estratto di tè verde migliorino altre epatopatie già conclamate.
In linea generale, alcuni studi dimostrano che diversi antiossidanti influiscono positivamente sulla cirrosi epatica, sebbene tali vantaggi non siano ancora confermati in modo univoco in tutti i pazienti con malattie epatiche. Allo stato attuale delle nostre conoscenze, però, non sussiste alcun rischio per la sicurezza.
Dosaggio e consigli sull’assunzione di antiossidanti
In caso di cirrosi epatica, i medici specializzati in micronutrienti consigliano di assumere ogni giorno da 300 a 670 milligrammi di vitamina E. Va ricordato che negli integratori combinati, in cui la dose delle singole vitamine è armonizzata in modo ottimale, spesso la quantità di vitamina E è di gran lunga inferiore.
Informazioni
Si consiglia di consultare un medico specializzato in micronutrienti se si vuole seguire una terapia a base di dosi più elevate di vitamina E (superiori a 50 milligrammi). I fumatori non dovrebbero assumere più di 50 milligrammi di vitamina E al giorno poiché sono soggetti al rischio di emorragia cerebrale e possibilmente a un rischio di tumore ai polmoni lievemente superiore.
Si dovrebbero assumere ogni giorno da 1.000 a 2.000 milligrammi di vitamina C e circa 300 milligrammi di glutatione. In caso di steatosi non alcolica, alcuni medici specializzati in micronutrienti propongono una dose giornaliera di 200 milligrammi di catechine del tè verde (EGCG).
Il momento migliore per assumere la vitamina E è insieme o subito dopo i pasti, poiché i grassi contenuti nei cibi ne agevolano l’assorbimento. Inoltre, essa dovrebbe essere combinata con la vitamina C, che la integra e rigenera dopo che ha attaccato i radicali liberi. Pertanto, anche il fabbisogno di vitamina C aumenta. Il glutatione andrebbe assunto almeno una o due ore prima dei pasti perché gli altri elementi nutrizionali ne riducono l’assorbimento, mentre le catechine del tè verde vanno prese insieme ai pasti.
Da considerare in caso di malattie e assunzione di farmaci
In rari casi l’estratto di tè verde può causare danni al fegato. Le persone che soffrono di epatopatie dovrebbe sempre consultare il proprio medico prima dell’assunzione, soprattutto se per lunghi periodi. L’assunzione dell’estratto andrebbe interrotta in caso di aumento dei valori epatici.
Dosi elevate di vitamina E possono causare interazioni con determinati anticoagulanti, pertanto chi li assume dovrebbe consultare il proprio medico. A causa dell’elevato rischio di emorragia, i pazienti dovrebbero interrompere l’assunzione di dosi elevate di vitamina E 14 giorni prima di un intervento chirurgico. Il rischio di emorragia aumenta anche in caso di grave carenza di vitamina K, nel qual caso si consiglia di assumere la vitamina E solo dopo aver compensato anche la carenza di vitamina K.
Non si può escludere che dosi superiori a 1.000 milligrammi di vitamina C causino interazioni con anticoagulanti come il warfarin (Coumadin®). Per sicurezza, chi assume questi farmaci deve concordare con il proprio medico un eventuale trattamento a base di vitamina C.
La vitamina C può favorire la formazione di calcoli renali, pertanto chi già ne soffre non dovrebbe assumerne dosi giornaliere superiori a 1.000 milligrammi. In caso di insufficienza renale, si sconsiglia di assumere dosi elevate di vitamina C (superiori a 500 milligrammi al giorno) poiché i reni malati non sono in grado di eliminare correttamente la vitamina in eccesso.
Poiché la vitamina C migliora l’assorbimento del ferro, chi soffre di emacromatosi dovrebbe assumere dosi più elevate solo previo controllo medico.
Lo zinco e il selenio rallentano la progressione della malattia
Meccanismo d’azione dello zinco e del selenio
Lo zinco e il selenio sono coinvolti in numerose vie metaboliche nel fegato. Chi soffre di cirrosi epatica presenta spesso una situazione di carenza che ha ripercussioni negative sul decorso della malattia. Si sospetta addirittura che una carenza di zinco, correlata a un aumento dei livelli di rame, possa favorire l’insorgenza del tumore al fegato. Si presume che le proprietà difensive dello zinco e del selenio siano basate sulle loro proprietà antiossidanti e sembra anche che il selenio contrasti il processo di cirrosi epatica.
Zinco: le prime evidenze di uno studio clinico hanno rivelato che l’assunzione di 50 milligrammi di zinco può arrestare la progressione della malattia e bloccare l’accumulo eccessivo di rame. In un altro studio clinico, i pazienti con una disfunzione cerebrale di natura patologica (dovuta a encefalopatia epatica) hanno ricevuto zinco combinato con le vitamine C, A ed E e il lattulosio. Questo trattamento ha ridotto il livello di ammoniaca nel sangue e ha migliorato sensibilmente i sintomi neurologici rispetto al trattamento con solo lattulosio. Inoltre, sono stati osservati miglioramenti dei valori epatici e del grado di gravità della cirrosi epatica.
Selenio: un esperimento condotto sui topi ha dimostrato l’effetto positivo del selenio, che ha attenuato i danni al fegato causati dall’alcol e ha arrestato la morte delle cellule epatiche. Un primo esperimento preliminare sull’uomo ha dimostrato come il selenio abbia probabilmente un’efficacia migliore sotto forma di selenato di sodio anziché di selenometionina.
Dosaggio e consigli sull’assunzione di zinco e selenio
I medici specializzati in micronutrienti consigliano di assumere da 10 a 30 milligrammi di zinco al giorno. In caso di cirrosi epatica, una dose compresa tra 100 e 300 microgrammi di selenio potrebbe avere effetti positivi. Si consiglia di sottoporsi a controlli regolari dei livelli di selenio nel sangue in modo da poter poi scegliere un trattamento più mirato.
Il momento migliore per assumere preparati a base di zinco e selenio è durante i pasti, poiché se assunti a stomaco vuoto potrebbero causare problemi di stomaco. Inoltre, lo zinco viene assorbito meglio insieme ad altri alimenti, in particolare di origine animale.
Consiglio
Dosi elevate di vitamina C trasformano il selenito in una forma che l’organismo non è in grado di assorbire. Si consiglia quindi di rispettare un intervallo di una o due ore tra le due assunzioni. Se si sceglie un integratore combinato con vitamina C, assicurarsi che contenga selenato di sodio.
Determinazione dei livelli di selenio in laboratorio
In caso di cirrosi epatica, si consiglia di sottoporsi a un controllo dei livelli di selenio. I risultati dei primi studi indicano che i livelli di selenio aumentano proporzionalmente all’aggravarsi della malattia, pertanto è necessario evitarne dosi eccessive.
I livelli di selenio possono essere misurati nel siero (parte del sangue priva di cellule ematiche) o nel sangue intero. i valori ottenuti nell’analisi sul sangue intero sono più significativi poiché riflettono l’apporto a lungo termine, mentre i valori ottenuti dall’analisi del siero sono soggetti ad oscillazioni maggiori. I valori nel sangue intero dovrebbero essere compresi tra 120 e 150 microgrammi per litro.
Da considerare in caso di assunzione di farmaci e malattie renali
Lo zinco può legarsi a determinati farmaci, neutralizzandone l’efficacia. Tra questi figurano gli antibiotici (inibitori della DNA girasi come la ciprofloxacina [ad es. Basemar®] e tetracicline come la tetraciclina [ad es. Ambramicina®]) e i farmaci contro l’osteoporosi contenenti bifosfonati come l’acido alendronico (ad es. Fosamax®). Si consiglia quindi di osservare un intervallo di almeno due ore tra l’assunzione di tali medicinali e quella di preparati a base di zinco.
L’assunzione supplementare di zinco con preparati a base di minerali dovrebbe essere evitata in caso di insufficienza renale cronica o di altre nefropatie. I reni indeboliti, infatti, non sono in grado di eliminare correttamente lo zinco e il selenio in eccesso.
Gli aminoacidi a catena ramificata sostengono l’alimentazione e hanno un effetto disintossicante
Meccanismo d’azione degli aminoacidi a catena ramificata

In caso di cirrosi epatica il fegato non è più in grado di svolgere correttamente la sua funzione disintossicante, consentendo all’ammoniaca nociva di raggiungere livelli pericolosi nel sangue e di danneggiare il cervello e il metabolismo. Gli aminoacidi a catena ramificata come la leucina, l’isoleucina o la valina contribuiscono a neutralizzare l’ammoniaca, ma la loro concentrazione nel sangue spesso si riduce, soprattutto in chi soffre di cirrosi epatica.
Uno studio panoramico in corso mostra che l’apporto di aminoacidi a catena ramificata può ridurre sensibilmente il rischio di danni al cervello causati dall’ammoniaca, come l’encefalopatia epatica. Inoltre, favorisce lo sviluppo dei muscoli, migliora la forza muscolare e alleggerisce lo svolgimento delle attività quotidiane nelle persone colpite da cirrosi. I dati dei primi studi mostrano come gli aminoacidi a catena ramificata (se assunti ad una dose pari a 12.450 milligrammi al giorno) abbiano un effetto positivo sul decorso e sulla gravità della malattia.
Dosaggio e consigli sull’assunzione di aminoacidi a catena ramificata
I medici specializzati in micronutrienti consigliano una dose giornaliera compresa tra 250 e 300 milligrammi di aminoacidi a catena ramificata per chilogrammo di peso corporeo come terapia di supporto in caso di cirrosi epatica. Un uomo che pesa 60 chilogrammi, ad esempio, dovrebbe assumerne 15.000 milligrammi (15 grammi).
La colina supporta la rigenerazione del fegato e il metabolismo dei grassi
Meccanismo d’azione della colina
La colina, sotto forma di fosfatidilcolina, si concentra nella membrana cellulare delle cellule epatiche ed è in grado di migliorarne la capacità di rigenerazione. Inoltre, possiede proprietà antiossidanti e antinfiammatorie e combatte la cirrosi epatica. Svolge anche un ruolo importante nel metabolismo dei grassi, pertanto un’eventuale carenza può causare steatosi.
Esistono evidenze che una carenza di colina e del suo precursore, l’aminoacido metionina, favorisce l’insorgenza del tumore al fegato. I dati di un primo studio mostrano come la colina abbrevi il tempo di guarigione in caso di neuropatie (come l’encefalopatia epatica) e riduca il rischio di decesso associato.
I vantaggi di un trattamento con colina in caso di steatosi o epatite sono stati dimostrati da alcuni studi, alcuni dei quali clinici, in cui i soggetti colpiti da steatosi hanno presentato un miglioramento dei valori epatici e del metabolismo degli zuccheri. Inoltre, la colina ha alleviato i disturbi legati alla malattia e i sintomi infiammatori, nonché ridotto la formazione di tessuto cicatriziale (processo cirrotico). I pazienti con epatite che hanno assunto colina dopo una terapia antivirale hanno fatto registrare un tasso di ricaduta inferiore. Grazie alla colina, i pazienti che non rispondevano in modo sufficiente alla terapia antivirale hanno ottenuto un miglioramento dei sintomi della malattia.
Dosaggio e consigli sull’assunzione di colina
Gli esperti in micronutrienti consigliano una dose giornaliera da 500 a 2.000 milligrammi di fosfatidilcolina come trattamento di supporto contro le steatosi e i danni epatici. La fosfatidilcolina è la fonte di colina che l’organismo è in grado di assorbire. Se ne consiglia l’assunzione insieme ai pasti.
Da considerare in caso di gravidanza/allattamento e malattie
Poiché non esistono studi sufficienti sull’uso della fosfatidilcolina durante la gravidanza e l’allattamento, per precauzione essa non andrebbe assunta oppure dovrebbe essere assunta solo previo accordo con il medico. In base ai dati dei primi studi, però, è sicura.
Si consiglia di fare attenzione anche in caso di pressione bassa, poiché un apporto costante di colina in quantità elevate potrebbe causare un ipotensione o un suo peggioramento.
L’ornitina e l’acido aspartico disintossicano l’organismo dall’ammoniaca
Meccanismo d’azione dell’ornitina e dell’acido aspartico
Gli amminoacidi ornitina e acido aspartico (L-ornitina-L-aspartato, LOLA) riducono il livello dell’ammoniaca nociva e possono così influenzare positivamente il decorso di un disturbo cerebrale di origine epatica (encefalopatia epatica).
Uno studio clinico ha dimostrato recentemente che l’assunzione di LOLA per via endovenosa può ridurre il tempo di guarigione dall’encefalopatia epatica. Inoltre, secondo uno studio panoramico, essa può influire positivamente sulle complicanze gravi e sul rischio di decesso. La letteratura a disposizione non è però ancora sufficiente. Sono necessarie ulteriori ricerche per valutare se l’effetto è riscontrabile in tutti i pazienti con disturbi epatici.
Dosaggio e consigli sull’assunzione di acido aspartico e ornitina
In caso di disturbi cerebrali di origine epatica, i medici specializzati in micronutrienti consigliano di assumere da 20.000 a 40.000 milligrammi di LOLA direttamente in vena.
L’assunzione tramite integratori aiuta a disintossicare l’organismo e, quindi, a prevenire disturbi cerebrali. Si consiglia di assumere una dose pari a 3.000 milligrammi tre volte al giorno. Dosi maggiori (superiori a 6.000 milligrammi) possono causare isolati episodi di diarrea, pertanto si consiglia di assumere tali dosi distribuite nell’arco della giornata.
La carnitina aiuta a disintossicare l’organismo e favorisce il metabolismo energetico
Meccanismo d’azione della carnitina
La carnitina è un aminoacido che svolge un ruolo importante nel metabolismo energetico perché favorisce il trasporto degli acidi grassi all’interno dei mitocondri (le centrali energetiche delle cellule), responsabili della produzione di energia per tutte le nostre cellule, prevenendo la formazione di legami nocivi. Inoltre, la carnitina ha proprietà antiossidanti, migliora la stabilità della membrana cellulare e protegge i neuroni.
In alcuni studi condotti su un numero ridotto di soggetti, 1.000 milligrammi di carnitina hanno migliorato i valori epatici e ridotto il grado di gravità della cirrosi epatica. I soggetti che l’hanno assunta hanno inoltre mostrato miglioramenti nel metabolismo energetico e hanno sofferto più raramente di crampi muscolari. Nei pazienti con disturbi cerebrali di origine epatica, la carnitina è stata in grado di ridurre il livello di ammoniaca e di migliorare le funzioni cerebrali. Tuttavia, sono necessarie ulteriori e approfondite ricerche sui benefici della carnitina in pazienti con cirrosi epatica.
Dosaggio e consigli sull’assunzione della carnitina
Gli esperti in micronutrienti consigliano di assumere ogni giorno 1.000 milligrammi di carnitina, anche direttamente per via endovenosa.
Se si sceglie invece di assumere un integratore, la dose dovrebbe essere distribuita nel corso della giornata, preferibilmente prima o durante i pasti.
Da considerare in caso di malattie e assunzione di farmaci
Nei diabetici la L-carnitina migliora l’indice glicemico. Se si assume L-carnitina contemporaneamente a farmaci ipoglicemizzanti, c’è il rischio di ipoglicemia. Tra questi farmaci figurano la metformina (Metforal®, Metfonorm® e Glucophage®) e le sulfoniluree (Euglucon®, Bi-Euglucon® o Maninil®). Potrebbe eventualmente essere necessario adeguare la dose dei farmaci. Si consiglia di controllare regolarmente l’indice glicemico e di consultare il proprio medico.
In casi molto rari la L-carnitina può rafforzare l’effetto degli anticoagulanti di tipo cumarinico (antagonisti della vitamina K), tra cui l’etil biscoumacetato (Tromexan®), il fenprocumone (Marcuphen®, Falithrom®, Marcoumar®) e il warfarin (Coumadin®). Se si prendono già questi farmaci, l’assunzione di L-carnitina andrebbe discussa con il medico, che controllerà il fattore di coagulazione (valore INR).
Chi soffre di insufficienza renale cronica dovrebbe discutere con il proprio medico l’eventuale assunzione di preparati a base di dosi elevate di L-carnitina (oltre 1.000 milligrammi). Sebbene questi pazienti presentino spesso una carenza di L-carnitina, la sua assunzione a lungo termine da parte di pazienti nefropatici non è supportata da studi sufficienti.
Anche chi ha un tumore dovrebbe discuterne l’assunzione con il proprio medico.
Dosaggi in breve
Dosi giornaliere consigliate in caso di cirrosi epatica ed encefalopatia epatica | |
|---|---|
Vitamine | |
Vitamina B1 | in caso di cirrosi epatica: 25 milligrammi (mg)
in caso di encefalopatia epatica: 100 milligrammi per via endovenosa e 300 milligrammi tramite integratori per 30 giorni |
Vitamina B2 | 25 milligrammi |
Vitamina B6 | 25 milligrammi |
Vitamina B12 | 25 microgrammi (µg) |
Acido folico | da 400 a 800 microgrammi |
Niacina | 25 milligrammi |
Vitamina A | da 400 a 800 microgrammi |
Vitamina D | da 1.000 a 3.000 unità internazionali (UI) |
Vitamina K | da 60 a 400 microgrammi |
Vitamina E | da 300 a 670 milligrammi |
Vitamina C | da 1.000 a 2.000 milligrammi |
Minerali | |
Selenio | da 100 a 300 microgrammi |
Zinco | da 10 a 50 milligrammi |
Altri | |
Colina | da 500 a 2.000 milligrammi (sotto forma di fosfatidilcolina) |
Glutatione | 500 milligrammi |
Catechine del tè verde (EGCG) | 200 milligrammi |
Aminoacidi a catena ramificata | da 250 a 300 milligrammi per chilogrammo di peso corporeo (mg/kg) |
Acido aspartico e ornitina | in caso di cirrosi epatica: 9.000 milligrammi
in caso di encefalopatia epatica: da 20.000 a 40.000 milligrammi per via endovenosa |
Carnitina | 1.000 milligrammi |
Esami di laboratorio consigliati in breve
Esami del sangue consigliati in caso di cirrosi epatica | |
|---|---|
Valori normali | |
Omocisteina | da 5 a 9 micromoli per litro (µmol/l) |
Vitamina D | da 40 a 60 nanogrammi per millilitro (ng/ml) |
Selenio | da 120 a 150 microgrammi per litro (µg/l) nel sangue intero |
Riepilogo
La medicina dei micronutrienti è in grado di alleviare in modo efficace la cirrosi epatica e le sue malattie conseguenti. Le vitamine del gruppo B e le vitamine liposolubili A, D e K possono compensare eventuali carenze e contrastare la cicatrizzazione del fegato. Le vitamine C ed E, il glutatione, le catechine del tè verde e altri antiossidanti, tra cui i minerali zinco e selenio, disintossicano i radicali liberi dell’ossigeno che possono migliorare la cirrosi epatica.
Gli aminoacidi a catena ramificata supportano lo sviluppo dei muscoli e contribuiscono alla disintossicazione dell’organismo. Anche l’ornitina e l’acido aspartico favoriscono la disintossicazione dall’ammoniaca nociva che può causare danni al cervello (encefalopatia epatica) associati alle condizioni del fegato. La colina e la carnitina migliorano il metabolismo energetico e dei grassi.
Indice degli studi e delle fonti
Bae, M. et al. (2018): Food components with antifibrotic activity and implications in prevention of liver disease. J Nutr Biochem.2018;55:1-11. https://www.ncbi.nlm.nih.gov/pubmed/29268106, consultato il: 07.08.2018.
Bémeur, C. et al. (2014): Nutrition in the management of cirrhosis and its neurological complications. J Clin Exp Hepatol. 2014;4(2):141-50. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4116712/, consultato il: 07.09.2018.
Bhanji, R.A. et al. (2016): Hyperhomocysteinemia is associated with severity of cirrhosis and negative impact after liver transplantation. Liver Int. 2016;36(5):696-704. https://www.ncbi.nlm.nih.gov/pubmed/26473801, consultato il: 07.09.2018.
Biesalski, H. K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H. K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Bjelakovic, G. et al. (2010): Meta-Analysis: antioxidant supplements for liver disease – the Cochrane Hepato-Biliary Group. Aliment Pharmacol Ther. 2010;32(3):356-67. https://www.ncbi.nlm.nih.gov/pubmed/20497142, consultato il: 07.09.2018.
Bjelakovic, G. et al. (2011): Antioxidant supplements for liver disease. Cochrane Database Syst Rev. 2011;3:CD007749. https://www.ncbi.nlm.nih.gov/pubmed/21412909, consultato il: 07.09.2018.
Bjelakovic, G. et al. (2017): Vitamin D supplementation for chronic liver diseases in adults. Cochrane Database Syst Rev. 2017;11:CD011564. https://www.ncbi.nlm.nih.gov/pubmed/29099543, consultato il: 07.09.2018.
Burgerstein, L. et al. (2012): Handbuch Nährstoffe – Vorbeugen und heilen durch ausgewogene Ernährung: Alles über Spurenelemente, Vitamine und Mineralstoffe. 12. Aufl. Trias.
Burk, R.F. et al. (2015): Selenium deficiency occurs in some patients with moderate-to-severe cirrhosis and can be corrected by administration of selenite but not selenoethionine: a randomized controlled trial. Am J Clin Nutr. 2015;102(5):1126-1133. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4625587/, consultato il: 07.08.2018.
Chalasani, N. et al. (2012): The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology. 2012 Jun;55(6):2005-23. https://www.ncbi.nlm.nih.gov/pubmed/22488764, consultato il: 06.02.2019.
Charlton, M. (2006): Branched-chain amino acid enriched supplementation as therapy for liver disease. J Nutr. 2006;136(1 Suppl):295S-8S. https://www.ncbi.nlm.nih.gov/pubmed/16365102, consultato il: 07.09.2018.
Colpo, E. et al. (2015): Effect of antioxidant potential on severity of cirrhosis in humans. Nutr Hosp. 2015;32(5):2294-300. https://www.ncbi.nlm.nih.gov/pubmed/26545691, consultato il: 07.08.2018.
Davenport, C. et al. (2015): Choline intakes exceeding recommendations during human lactation improve breast milk choline content by increasing PEMT pathway metabolites. https://www.ncbi.nlm.nih.gov/pubmed/26025328, consultato il: 07.09.2018.
de la Maza, M.P. et al. (1995): Effects of long-term vitamin E supplementation in alcoholic cirrhosis. J Am Coll Nutr. 1995;14(2):192-6. https://www.ncbi.nlm.nih.gov/pubmed/7790695, consultato il: 07.09.2018.
Del Ben, M. et al. (2017): The role of nutraceuticals for the treatment of non-alcoholic fatty liver disease. Br J Clin Pharmacol. 2017;83(1):88-95. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5338137/#bcp12899-bib-0017, consultato il: 07.09.2018.
EFSA: Scientific opinion on the safety of green tea catechins. EFSA Journal 2018; 16,4. https://efsa.onlinelibrary.wiley.com/doi/full/10.2903/j.efsa.2018.5239, consultato il: 8.2.2018.
Ferlitsch, A. et al. (2005): Vasoconstrictor hyperactivity can be reversed by antioxidants in patients with advanced alcoholic cirrhosis of the liver and ascites. Crit Care Med. 2005;33(9):2028-33. https://www.ncbi.nlm.nih.gov/pubmed/16148476, consultato il: 07.09.2018.
García-Álvarez, M. et al. (2018): Relationship of vitamin D status with advanced liver fibrosis and response to hepatitis C virus therapy: a meta-analysis. Hepathology. 2014;60(5):1541-20. https://www.ncbi.nlm.nih.gov/pubmed/24975775, consultato il: 07.09.2018.
Garrett-Laster, M. et al. (1984): Impairment of taste and olfaction in patients with cirrhosis: the role of vitamin A. Hum Nutr Clin Nutr. 1984;38(3):203-14. https://www.ncbi.nlm.nih.gov/pubmed/6746322, consultato il: 07.09.2018.
Gho, E.T. et al. (2018): L-ornithine L-aspartate for prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev. 2018;5:CD012410. https://www.ncbi.nlm.nih.gov/pubmed/29762873, consultato il: 07.08.2018.
Gluud, L.L. et al. (2013): Oral branched-chain amino acids have a beneficial effect on manifestation of hepatic encephalopathy in a systematic review with meta-analyses of randomized controlled trials. J Nutr. 2013;143(8):1263-8. https://www.ncbi.nlm.nih.gov/pubmed/23739310, consultato il: 07.09.2018.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2018): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 4. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Guerriero, A.L. et al. (2012): Choline intake in a large cohort of patients with non-alcoholic fatty liver disease. Am J Clin Nutr. 2012;95(4):892-900. https://www.ncbi.nlm.nih.gov/pubmed/22338037, consultato il: 07.09.2018.
Guerriero, E. et al. (2014): Assessment of the Selenoprotein M (SELM) over-expression on human hepatocellular carcinoma tissues by immunohistochemistry. Eur J Histochem. 2014;58(4):2433. https://www.ncbi.nlm.nih.gov/pubmed/25578973, consultato il: 07.09.2018.
Gundermann, K.J. et al. (2016): Essential phospholipids in fatty liver: a scientific update. Clin Exp Gastroenterol. 2016;9:105-17. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4861608/, consultato il: 07.09.2018
Hambley, B.C. et al. (2016): Effect of vitamin K on coagulopathy in liver disease: a single center retrospective review. Blood. 2016;128:2583. http://www.bloodjournal.org/content/128/22/2583?sso-checked=true, consultato il: 07.09.2018.
Harrison, S.A. et al. (2003): Vitamin E and vitamin C treatment improves fibrosis in patients with non-alcoholic steatohepatitis. Am J Gastroenterol. 2003;98(11):2485-90. https://www.ncbi.nlm.nih.gov/pubmed/14638353, consultato il: 07.09.2018.
Hasegawa, T. et al. (2001): Plasma transforming growth factor-beta 1 level and efficacy of alpha-tocopherol in patients with non-alcoholic steatohepatitis: a pilot study. Aliment Pharmacol Ther. 2001;15(10):1667-72. https://www.ncbi.nlm.nih.gov/pubmed/11564008, consultato il: 07.08.2018.
Hassan, R. et al. (1991): Effect of thiamine on glucose utilization in hepatic cirrhosis. J Gastroenterol Hepatol. 1991;6(1):59-60. https://www.ncbi.nlm.nih.gov/pubmed/1883979, consultato il: 07.09.2018.
Hernández-Guerra, M. et al. (2006): Ascorbic acid improves the intrahepatic dysfunction of patients with cirrhosis and portal hypertension. Hepatology. 2006;43(3):485-91. https://www.ncbi.nlm.nih.gov/pubmed/16496307, consultato il: 07.09.2018.
Herold, G. (2017): Innere Medizin. Selbstverlag, Köln.
Hoan, N.X. et al. (2018): Vitamin D deficiency and hepatitis viruses-associated liver disease: A literature review. World J Gastroenterol. 2018;24(4):445-460. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5787780/, consultato il: 07.09.2018.
Honda, Y. et al. (2017): Efficacy of glutathione for the treatment of non-alcoholic fatty liver disease: an open-label, single-arm, multicenter, pilot study. BMC Gastroenterol. 2017;17:96. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5549431/, consultato il: 07.09.2018.
Hung, GD. et al. (2012): Green tea extract supplementation ameliorates CCl4-induced hepatic oxidative stress, fibrosis, and acute-phase protein expression in rat. J Formos Med Assoc. 2012 Oct;111(10):550-9. https://www.ncbi.nlm.nih.gov/pubmed/23089690, consultato il: 06.02.2019.
Internisten im Netz: Was ist eine Leberzirrhose. Herausgegeben vom Berufsverband Deutscher Internisten e.V. https://www.internisten-im-netz.de/krankheiten/leberzirrhose/was-ist-eine-leberzirrhose/, consultato il: 07.09.2018.
Jha, A.K. et al. (2017): Effect of replenishment of vitamin D on survival in patients with decompensated liver cirrhosis: A prospective study. World J Gastrointest Pathophysiol. 2017;8(3):133-41. https://www.ncbi.nlm.nih.gov/pubmed/28868183, consultato il: 07.09.2018.
Kornerup, L.S. et al. (2018): Update on the therapeutic management of hepatic encephalophaty. Curr Gastroenterol Rep. 2018;20(5):21. https://www.ncbi.nlm.nih.gov/pubmed/29644492, consultato il: 07.09.2018.
Komolmit, P. et al. (2017): Vitamin D supplementation improves serum markers associated with hepatic fibrogenesis in chronic hepatitis C patients: A randomized, double-blind placebo-controlled study. Sci Rep. 2017;7:8905. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5566364/, consultato il: 07.09.2018.
Kujovich, J.L. (2015): Coagulation in liver disease: a balancing act. Hematology Am Soc Hematol Educ Program. 2015;2015:243-9. https://www.ncbi.nlm.nih.gov/pubmed/26637729, consultato il: 07.09.2018.
Lai, C.Y. et al. (2018): Possible synergistic effects of glutathione and C-reactive protein in the progression of liver cirrhosis. Nutrients. 2018:10(6):678. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024608/, consultato il: 07.09.2018.
Mahamid, M. et al. (2018): Folate and B12 levels correlate with histological severity in NASH patients. Nutrients. 2018;10(4):440. http://www.mdpi.com/2072-6643/10/4/440, consultato il: 07.09.2018.
Martí-Carvajal, A.J. et al. (2015): Vitamin K for upper gastrointestinal bleeding in people with acute or chronic liver disease. Cochrane Database Syst Rev. 2015;6:CD004792. https://www.ncbi.nlm.nih.gov/pubmed/26058964, consultato il: 07.09.2018.
Masterjohn, C. & Bruno, R.S. (2012): Therapeutic potential of green tea in nonalcoholic fatty liver disease. Nutr Rev. 2012 Jan;70(1):41-56. https://www.ncbi.nlm.nih.gov/pubmed/22221215, consultato il: 06.02.2019.
Masterjohn, C. Bruno, RS. (2012): Therapeutic potential of green tea in nonalcoholic fatty liver disease. Nutr Rev. 2012 Jan;70(1):41-56. https://www.ncbi.nlm.nih.gov/pubmed/22221215, consultato il: 06.02.2019.
Mehedint, M.G. et al. (2013): Choline’s role in maintaining liver function: a new evidence for epigenetic mechanisms. Curr Opin Clin Nutr Metab Care. 2013;16(3):339-345. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3729018/, consultato il: 07.09.2018.
Mousa, N. et al. (2016): The role of antioxidants and zinc in minimal hepatic encephalopathy: a randomized trial. Therap Adv Gastroenterol. 2016;9(5):684-91. https://www.ncbi.nlm.nih.gov/pubmed/27582881, consultato il: 07.09.2018.
Nakanashi, H. et al. (2015): L-carnitine reduces muscle cramps in patients with cirrhosis. Clin Gastroenterol Hepatol. 2015;13(8):1540-43. https://www.cghjournal.org/article/S1542-3565(14)01741-8/fulltext, consultato il: 07.09.2018.
Niederau, C. et al. (1998): Polyunsaturated phosphatidyl-choline and interferon alpha for treatment of chronic hepatitis B and C: a multi-center randomized, double-blind, placebo-controlled trial. Leich Study Group. Hepatogastroenterolgy. 1998;45(21):797-804. https://www.ncbi.nlm.nih.gov/pubmed/9684137, consultato il: 07.09.2018.
Park, J.G. et al. (2017): Effects of branched-chain amino acids (BCAAs) on the progression of advanced liver disease. Medicine (Baltimore). 2017;96(24):e6580. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5478300/, consultato il: 07.09.2018.
Primignani, M. et al. (2015): Therapeutic and clinical aspects of portal vein thrombosis in patients with cirrhosis. World J Hepatol. 2015;7(29):2906-12. https://www.ncbi.nlm.nih.gov/pubmed/26689354, consultato il: 07.09.2018.
Prince, M.I. et al. (2003): Oral antioxidant supplementation for fatigue associataed with primary biliary cirrhosis: a result of a multicenter, randomied, placebo-controlled, cross-over tria. Aliment Pharmacol Ther. 2003;17(1):137-43. https://www.ncbi.nlm.nih.gov/pubmed/12492743, consultato il: 07.09.2018.
Prystupa, A. et al. (2017): Association between serum selenium concentrations and levels of proinflammatory and profibrotic cytokines – interleukin-6 and growth differentiation factor-15, in patients with alcoholic liver disease. Int J Environ Res Public Health. 2017;14(4):437. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5409638/, consultato il: 07.09.2018.
Renz-Polster, H. et al. Basislehrbuch Innere Medizin. 5. Aufl. Urban & Fischer München.
Rivosecchi, R.M. et al. (2017): The effectiveness of intravenous vitamin K in correcting cirrhosis-associated coagulopathy. Int J Pharm Pract. 2017;25(6):463-65. https://www.ncbi.nlm.nih.gov/pubmed/28211589, consultato il: 07.09.2018.
Rossi, R.E. et al. (2015): Diagnosis and treatment of nutritional deficiencies in alcoholic liver disease: Overview of available evidence and open issues. Dig Liver Dis. 2015;47(10):819-25. https://www.ncbi.nlm.nih.gov/pubmed/26164399, consultato il: 07.09.2018.
Safer, AM. et al. (2015): Effect of Green Tea Extract Encapsulated Into Chitosan Nanoparticles on Hepatic Fibrosis Collagen Fibers Assessed by Atomic Force Microscopy in Rat Hepatic Fibrosis Model. J Nanosci Nanotechnol. 2015 Sep;15(9):6452-9. https://www.ncbi.nlm.nih.gov/pubmed/26716199, consultato il: 06.02.2019.
Saja, M.F. et al. (2013): The coagulopathy of liver disease: does vitamin K help? Blood Coagul Fibrinolysis. 2013;24(1):10-7. https://www.ncbi.nlm.nih.gov/pubmed/23080365, consultato il: 07.09.2018.
Sakai, Y. et al. (2016): Effect of L-Carnitine in patients with liver cirrhosis on energy metabolism using indirect calorimetry: a pilot study. J Clin Med Res. 2016;8(12):863-69. https://www.ncbi.nlm.nih.gov/pubmed/27829952, consultato il: 07.09.2018.
Santana, R.C. et al. (2016): Assessment of indicators of vitamin A status in non-cirrhotic chronic hepatitis C patients. Braz J Med Biol Res. 2016;49(1):e4785. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4678655/, consultato il: 07.09.2018.
Sanyal, A.J. et al. (2010): Pioglitazone, vitamin E, or placebo for non-alcoholic steatohepatitis. N Engl J Med. 2010;362:1675-85. https://www.nejm.org/doi/full/10.1056/NEJMoa0907929, consultato il: 07.09.2018.
Savic, Z. et al. (2018): Vitamin D supplementation in patients with alcoholic liver cirrhosis: a prospective study. Minerva Med. 2018;doi: 10.23736/S0026-4806.18.05723-3. https://www.ncbi.nlm.nih.gov/pubmed/29963831, consultato il: 07.09.2018.
Sheriff, J.L. et al. (2016): Choline, its potential role in non-alcoholic fatty liver disease, and the case for human and bacterial genes. Adv Nutr. 2016;7(1):5-13. https://www.ncbi.nlm.nih.gov/pubmed/26773011, consultato il: 07.08.2018.
Sidhu, S.S. et al. (2017): L-ornithine L-aspartate in bouts of overt hepatic encephalopathy. Hepatology. 2017;doi: 10.1002/hep.29410. https://www.ncbi.nlm.nih.gov/pubmed/28749571, consultato il: 07.09.2018.
Somi, M.H. et al. (2012): Effects of low dose zinc supplementation on biochemical markers in non-alcoholic cirrhosis: a randomized clinica trial. Arch Iran Med. 2012;15(8):472-76. https://www.ncbi.nlm.nih.gov/pubmed/22827782, consultato il: 07.09.2018.
Somi, M.H. et al. (2014): Data from randomized and controlled trial of LCarnithine prescription for the treatment for non-alcoholic fatty liver disease. Bioinformation. 2014;10(9):575-79. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4209366/, consultato il: 07.09.2018.
Teriaky, A. et al. (2017): Prevalence of fat-soluble vitamin (A, D, and E) and zinc deficiency in patients with cirrhosis being assessed for liver transplantation. Acta Gastroenterol Belg. 2017;80(2):237-241. https://www.ncbi.nlm.nih.gov/pubmed/29560688, consultato il: 07.09.2018.
Uojima, H. et al. (2017): Effect of branched-chain amino acid supplementation on muscle strength and muscle mass in patients with liver cirrhosis. Eur J Gastroenterol Hepatol. 2017;29(12):1402-07. https://www.ncbi.nlm.nih.gov/pubmed/28984678, consultato il: 07.09.2018.
van de Casteele, M. et al. (2002): Blood antioxidant levels in patients with alcoholic liver disease correlate with the degree of liver impairment and are not specific to alcoholic liver injury itself. Aliment Pharmacol Ther. 2002;16:985-92. https://onlinelibrary.wiley.com/doi/epdf/10.1046/j.1365-2036.2002.01255.x, consultato il: 07.09.2018.
Vignan Manne, M.D. et al. (2014): Impact of nutrition and obesity on chronic liver disease. Clin Liver Dis. 2014;18(1):205-18. https://www.ncbi.nlm.nih.gov/pubmed/24274875, consultato il: 07.09.2018.
Wigand, J. et al. (2013): Ätiologie, Diagnose und Prävention einer Leberzirrhose. Deutsches Ärzteblatt. 2013;3:26-28. https://www.aerzteblatt.de/pdf.asp?id=139715, consultato il: 07.09.2018.
Yin, X. et al. (2015): The effect of green tea intake on risk of liver disease: a meta analysis. Int J Clin Exp Med. 2015 Jun 15;8(6):8339-46. https://www.ncbi.nlm.nih.gov/pubmed/26309486, consultato il: 06.02.2019.
Yin, X. et al. (2015): The effect of green tea intake on risk of liver disease: a meta analysis. Int J Clin Exp Med. 2015 Jun 15;8(6):8339-46. eCollection 2015. https://www.ncbi.nlm.nih.gov/pubmed/26309486, consultato il: 06.02.2019.
Zhang, Z. et al. (2017): Protective action of Se-supplementation against acute alcoholism is regulated by Selenoprotein P (SelP) in the liver. Biol Trace Elem Res. 2017;175(2):375-87. https://www.ncbi.nlm.nih.gov/pubmed/27334433, consultato il: 07.09.2018.
Zöhrer, E. et al. (2017): Efficacy of docosahexaenoic acid-choline-vitamin E in pediatric NASH: a randomized controlled clinical trial. Appl Physiol Nutr Metab. 2017;42(9):948-54. https://www.ncbi.nlm.nih.gov/pubmed/28511023, consultato il: 07.09.2018.