Molte persone vengono a contatto ogni giorno con i metalli pesanti, tra cui arsenico, piombo, cadmio e mercurio, quelli più tossici in assoluto. Diverse vitamine, minerali, aminoacidi e flavonoidi aiutano a proteggersi dagli effetti nocivi di questi metalli e a favorirne l’eliminazione da parte dell’organismo. Leggete qui le soluzioni offerte dai micronutrienti per far fronte a un’intossicazione da metalli pesanti.

Cause e sintomi
Da cosa è causata l’intossicazione da metalli pesanti?
I metalli pesanti sono presenti ovunque in natura, e l’uomo li mette in circolo attraverso le attività industriali. Quelli pericolosi sono i metalli pesanti tossici, tra cui rientrano:
- arsenico
- piombo
- cadmio
- mercurio
La presenza di metalli pesanti negli alimenti è in costante aumento. L’industria mineraria, le aziende e i rifiuti permettono a questi metalli di finire nell’ambiente, raggiungendo poi le verdure attraverso la polvere e le precipitazioni. Questi metalli sono però contenuti anche nei gas di scarico o nei fertilizzanti. Possono arricchire terreni e acque freatiche ed essere assorbiti dalle piante. I metalli pesanti entrano in contatto con l’organismo anche attraverso gli alimenti, l’aria che respiriamo, le sigarette o le otturazioni con amalgama (mercurio). Sono soprattutto i dentisti e i loro assistenti che corrono il rischio di un’intossicazione da mercurio a causa delle otturazioni dentali.
Conseguenze e sintomi delle intossicazioni da metalli pesanti
I metalli pesanti danneggiano le strutture vitali dell’organismo come il DNA o le proteine all’interno delle cellule. Sono dannosi anche per gli acidi grassi importanti per la membrana cellulare. Una volta all’interno dell’organismo, i metalli pesanti raggiungono diversi organi e possono contribuire all’insorgenza di vari tumori. Qui di seguito sono indicati i sintomi associati ai diversi metalli pesanti:
- Arsenico: colorazione grigiastra della pelle (melanosi), maggiore formazione di calli sui palmi di mani e sulle piante dei piedi accompagnati da tagli dolorosi, nausea, vomito e diarrea. Chi assume arsenico per un periodo prolungato presenta un aumento anomalo dei corpuscoli rossi del sangue (poliglobulia), che rendono il sangue più denso e portano alla formazione di coaguli che occludono i vasi (trombosi). Anche il tumore è una complicanza cronica che colpisce soprattutto polmoni, pelle, vescica e reni.
- Piombo: crampi allo stomaco e all’intestino (coliche), stipsi, stanchezza diffusa, pelle pallida (colorito da piombo), disturbi renali e anemia. L’assunzione prolungata (cronica) di piombo può danneggiare gravemente i nervi e portare a paralisi. Tra le complicanze successive ci sono anche il Parkinson e il cancro.
- Cadmio: corrosione della mucosa gastrica, vomito, danni renali fino a insufficienza renale, irritazione delle vie respiratorie superiori, bronchite e infiammazione polmonare (a seguito di inalazione di vapori contenenti cadmio). L’intossicazione cronica da cadmio si manifesta soprattutto sotto forma di osteomalacia e fratture ossee, a cui si aggiungono mal di schiena e mal di gambe, danni epatici e renali e anemia.
- Mercurio: dolori agli arti, mal di testa, emicrania, stanchezza e brividi. L’assunzione a lungo termine di mercurio danneggia soprattutto il sistema nervoso centrale e può portare a paralisi e morte.
Obiettivi del trattamento
Qual è il trattamento classico dell’intossicazione da metalli pesanti?
I pazienti con intossicazione da metalli pesanti dovrebbero evitare di esporsi ulteriormente al contatto. Il trattamento varia poi a seconda del metallo pesante:
In caso di assunzione di piombo per via orale è necessario eliminarlo provocando il vomito o sottoponendosi a una lavanda gastrica. Si consiglia di assumere contemporaneamente anche del carbone attivo, che trasforma il piombo in solfato di piombo difficilmente solubile, che si lega ai carboni attivi e può essere così eliminato.
Se il piombo è già entrato in circolo, i pazienti devono assumere dei farmaci (agenti complessanti) che legano il piombo per poi eliminarlo. Tra gli agenti complessanti usati in caso di avvelenamento da piombo ci sono ad esempio:
- acido dimercaptosuccinico (DMSA come Succicaptal®)
- acido dimercapto-propanosulfonico (DMPS come Dimaval®)
- penicillamina (come ad esempio Metalcaptase®)
Anche un’intossicazione acuta da arsenico o mercurio è trattata con agenti complessanti, più precisamente DMSA o DMPS per l’arsenico e DMPS per il mercurio.
In caso di intossicazione cronica da piombo o mercurio asintomatica, invece, non si ricorre agli agenti complessanti, ma è vietato entrare nuovamente in contatto con il metallo pesante. Non si utilizzano agenti complessanti neppure in caso di intossicazione da cadmio cronica, per la quale non si conoscono trattamenti legati alle cause.
Gli obiettivi della medicina dei micronutrienti
Il trattamento delle intossicazioni da metalli pesanti può essere integrato con la medicina dei micronutrienti, che aiuta soprattutto ad eliminare tali metalli. Alcune vitamine, minerali, aminoacidi e flavonoidi possono legarsi ai metalli pesanti, trasformandoli in una forma atossica, e possono anche favorirne l’eliminazione tramite le feci o l’urina.
Alcuni micronutrienti hanno anche proprietà antiossidanti, il che significa che possono bloccare o attenuare i danni causati dai metalli pesanti.
I principali micronutrienti utili sono:
- Vitamina C ed E, zinco e selenio, che proteggono dallo stress ossidativo causato dai metalli pesanti.
- Vitamine B1 e B6, che favoriscono l’eliminazione dei metalli pesanti.
- Spirulina e clorella, che si legano ai metalli pesanti e ne favoriscono l’eliminazione attraverso l’urina.
- Acido alfa-lipoico, che rigenera le vitamine E e C e contribuisce a proteggere le cellule.
- N-acetilcisteina e glutatione, che legano i metalli pesanti e hanno un effetto antiossidante.
- Quercetina e rutina, che agiscono da antiossidanti e agenti complessanti.
- Zeolite e bentonite, che si legano ai metalli pesanti a livello intestinale.
Trattamento con i micronutrienti
Le vitamine antiossidanti bloccano gli attacchi dei metalli pesanti
Meccanismo d’azione delle vitamine C ed E
I metalli pesanti producono radicali liberi e stress ossidativo, che danneggiano l’organismo. In caso di intossicazione da metalli pesanti si ricorre agli antiossidanti come le vitamine C ed E, che prevengono i danni ossidativi che colpiscono le strutture cellulari. Catturano i radicali liberi e li neutralizzano. Si presume che la vitamina C sia in grado di formare addirittura dei chelati con piombo, cadmio e mercurio, riducendone così la quantità nell’organismo e favorendone l’eliminazione.
In uno studio clinico, la vitamina C ha ridotto il contenuto di piombo nel sangue dei soggetti. Nei 75 fumatori arruolati per lo studio che avevano ricevuto ogni giorno 1.000 milligrammi di vitamina C si è osservato un calo della concentrazione di piombo da 1,8 a 0,4 micromoli per litro di sangue. Altri studi non hanno però confermato questo effetto. Sono pertanto necessari ulteriori esperimenti per giungere ad una conclusione affidabile.
Le vitamine C ed E hanno anche un effetto protettivo. In base a uno studio di un anno su persone che entravano quotidianamente in contatto con il piombo, una dose quotidiana di 1.000 milligrammi di vitamina C e di 268 milligrammi di vitamina E ha ridotto sensibilmente i danni cellulari ossidativi causati dal piombo. Inoltre, esperimenti condotti sugli animali hanno mostrato che la vitamina E impedisce l’accumulo di piombo nel fegato.
Gli stessi esperimenti dimostrano, inoltre, che sia la vitamina C sia la vitamina E proteggono dall’avvelenamento da arsenico (se assunte in aggiunta ad agenti complessanti come il DMSA).
Dosaggio e consigli sull’assunzione delle vitamine C ed E
In caso di intossicazione da metalli pesanti, si consigliano da 500 a 1.000 milligrammi di vitamina C al giorno. Questa dose si è dimostrata efficace nel ridurre l’intossicazione da piombo nel sangue e contrastarne gli effetti nocivi sulla salute.
La vitamina E, invece, è efficace alla dose di 270 milligrammi. Poiché si tratta di una dose elevata, occorre assolutamente consultare un medico specializzato in micronutrienti prima di assumerla. In assenza di consulto medico, si consiglia di assumere un massimo di 50 milligrammi di vitamina E al giorno.
Si raccomanda di assumere la vitamina C in combinazione con la vitamina E, perché quest’ultima la rigenera e aumenta la protezione antiossidante.
Determinazione dello stato antiossidante in laboratorio
Per confermare il successo della terapia, il medico dovrebbe controllare regolarmente lo stato antiossidante nel sangue. I valori normali sono compresi tra 1,13 e 1,57 millimoli per litro. Occorre ricordare che i valori e le unità possono variare sensibilmente a seconda del laboratorio e del metodo utilizzato.
Vitamine C ed E: da considerare in caso di malattie e assunzione farmaci
Vitamina C: in caso di insufficienza renale, si sconsiglia di assumere dosi elevate di vitamina C (superiori a 500 milligrammi al giorno), poiché c’è il rischio che si formino calcoli e depositi di ossalato nei tessuti. Chi soffre di emocromatosi dovrebbe assumerne dosi più elevate di vitamina C solo previo controllo medico.
Vitamina E: dosi elevate di vitamina E possono causare interazioni con alcuni farmaci. Chi segue una terapia con anticoagulanti dovrebbe chiedere consiglio al proprio medico, in particolare se assume:
- anticoagulanti del gruppo degli antagonisti della vitamina K (ad esempio fenprocumone come Falithrom® e Marcumar® o warfarin come Coumadin® e Marevan®)
- inibitori dell’aggregazione piastrinica (ad esempio l’acido acetilsalicilico come Aspirina, ASA)
- nuovi anticoagulanti orali come dabigatran (Pradaxa®) e rivaroxaban (Xarelto®) o edoxaban (Lixiana®)
Nei fumatori il rischio di emorragia cerebrale può aumentare se si assumono dosi elevate (superiori a 50 milligrammi) di vitamina E sotto forma di alfa-tocoferolo. Questi soggetti dovrebbero quindi interromperne l’assunzione, soprattutto se combinata con più di 15 milligrammi di beta-carotene.
I minerali rafforzano le difese antiossidanti
Meccanismo d’azione dello zinco e del selenio
Zinco e selenio possono proteggere dalle intossicazioni da metalli pesanti attraverso vari meccanismi: rafforzano il potere difensivo antiossidante dell’organismo e favoriscono la formazione di proteine che catturano i metalli (metallotioneine). Lo zinco blocca la proliferazione di cadmio e piombo all’interno dell’organismo perché occupa i recettori a cui si legano. Il selenio forma complessi insolubili con vari metalli pesanti come arsenico, mercurio o piombo, che vengono poi eliminati.
Zinco: diversi studi condotti su uomini e animali hanno evidenziato che un ridotto apporto di zinco o una sua carenza incrementano l’intossicazione da metalli pesanti e portano a un aumento dell’assorbimento di cadmio e piombo a livello intestinale. Gli scienziati ritengono quindi che lo zinco protegga dall’avvelenamento da cadmio o piombo.
Selenio: durante uno studio osservazionale condotto su 8.092 partecipanti i ricercatori hanno scoperto che un livello ridotto di selenio nel sangue è correlato a un rischio maggiore di tumore alla pelle causato dall’arsenico. I ricercatori hanno dedotto che assumere quantità sufficienti di selenio con l’alimentazione riduce il rischio di tumore da arsenico. Sono stati conclusi anche i primi studi sulla correlazione tra selenio e intossicazione da mercurio causata dalle otturazioni in amalgama. Chi soffriva di sintomi di un’intossicazione da mercurio aveva anche livelli di selenio nel sangue notevolmente al di sotto dei valori normali. Il selenio potrebbe aumentare la quantità di mercurio eliminato, evitando così un’intossicazione causata dall’amalgama.
Molti esperimenti su uomini e animali hanno confermato l’efficacia di zinco e selenio contro l’intossicazione da metalli pesanti. Ora è necessario eseguire esami mirati su persone intossicate per determinare la dose e la durata di somministrazione necessarie.
Dosaggio e consigli sull’assunzione di zinco e selenio
Per contrastare le intossicazioni da metalli pesanti, i medici specializzati in micronutrienti consigliano fino a 30 milligrammi di zinco al giorno, preferibilmente combinato con la vitamina C (1.000 milligrammi). In caso di assunzione continuata, si consigliano da 10 a 15 milligrammi al giorno. La dose di selenio è compresa tra 100 e 300 microgrammi al giorno. Entrambi andrebbero assunti insieme ai pasti perché sono più tollerabili a livello gastrico. In caso di rimozione di otturazioni con amalgama si dovrebbe in ogni caso assumere il selenio un’ora prima dell’estrazione per evitare accumuli di mercurio nell’organismo.
Importante: non bisogna assumere agenti complessanti come il DMSA e il DMPS insieme a zinco o selenio perché potrebbero reagire nell’intestino, neutralizzandone l’efficacia. Si consiglia quindi di rispettare un intervallo temporale sufficiente.
Consiglio
Selenio sotto forma di selenato di sodio: poiché la vitamina C blocca l’assorbimento del selenio (contenuto nel selenato di sodio), si consiglia di rispettare un intervallo di una-due ore tra le due assunzioni. Chi opta per integratori combinati con selenato di sodio dovrebbe fare attenzione perché l’effetto inibente di questo legame non è stato ancora dimostrato.
Determinazione dei livelli di selenio in laboratorio
Si consiglia di sottoporsi a esami del sangue per determinare il livello di selenio onde evitare possibili sovradosaggi. Il contenuto di selenio nel sangue intero riflette il suo apporto nel lungo termine ed è più affidabile di quello misurato nel plasma. Se il valore del selenio nel sangue intero è inferiore a 100 microgrammi per litro, il soggetto presenta una carenza.
Zinco e selenio: da considerare in caso di assunzione di farmaci e malattie
Lo zinco riduce l’efficacia di determinati antibiotici del gruppo degli inibitori della DNA girasi (Ciprobay®, Ciloxan®) e delle tetracicline (Efracea®, Ligosan®), così come dei farmaci contro l’osteoporosi, i cosiddetti bifosfonati (Andronat®, Alendros®). Si consiglia di rispettare un intervallo di almeno due ore tra l’assunzione di integratori di zinco e antibiotici o farmaci contro l’osteoporosi.
In caso di insufficienza renale cronica o di altre nefropatie, si sconsiglia di assumere integratori minerali contenenti zinco e selenio poiché i reni indeboliti non sono in grado di eliminarli completamente,con conseguente eccessivo aumento dei loro livelli nel sangue.
Le vitamine B1 e B6 riducono la quantità di piombo nell’organismo
Meccanismo d’azione delle vitamine B1 e B6
La vitamina B1 si lega ai complessi di piombo e consente di eliminarli rapidamente. È stato dimostrato che anche la vitamina B6 riduce l’accumulo di piombo nei tessuti dell’organismo. I ricercatori partono dal presupposto che la vitamina si leghi al piombo prima che venga assorbito.
In primo studio condotto su 24 soggetti, una dose giornaliera di 75 milligrammi di vitamina B1 ha ridotto la concentrazione di piombo nel sangue di chi presentava valori superiori alla norma.
I primi studi hanno dimostrato anche che la presenza di piombo nell’organismo è associata ad un livello di vitamina B1 estremamente ridotto. Viceversa, una carenza di vitamina B1 o B6 aumenta le possibilità di avvelenamento da piombo o cadmio.
Combinazione di vitamine del gruppo B e antiossidanti: si consiglia di combinare i due gruppi vitaminici. Un esperimento condotto sugli animali ha mostrato che la combinazione di vitamina B1 e C favorisce l’eliminazione del piombo attraverso l’urina e riduce l’intossicazione da piombo di fegato e reni, nonché i danni da piombo.
Dosaggio e consigli sull’assunzione delle vitamine B1 e B6
Per ridurre il livello di piombo nel sangue si dovrebbero assumere 75 milligrammi di vitamina B1, mentre per quanto riguarda la vitamina B6, al momento non sono disponibili risultati sufficienti per determinare la dose efficace. Nella maggior parte dei casi i medici specializzati in micronutrienti consigliano un integratore combinato che contenga tutte le vitamine del gruppo B, Le vitamine del gruppo B collaborano tra loro nell’ambito del metabolismo.
La spirulina e la clorella eliminano i metalli pesanti
Meccanismo d’azione della spirulina e della clorella
Le alghe spirulina (Spirulina platensis) e clorella (Chlorella vulgaris) sono in grado di legarsi ai metalli pesanti. Esami di laboratorio confermano che le pareti cellulari dell’alga spirulina assorbono cadmio, nichel o cromo. Per quanto riguarda la clorella, esami di laboratorio hanno evidenziato che è in grado di eliminare piombo e cadmio grazie all’attività delle pareti cellulari o della clorofilla, che si legano ai metalli pesanti.
Il parere degli esperti
I ricercatori ritengono che la clorella riduca soprattutto le intossicazioni da metalli pesanti a livello intestinale. Esami condotti sugli animali dimostrano che la combinazione di clorella e cadmio consente all’organismo di assorbire dosi minori di questo metallo pesante. Se non si assume più cadmio, anche la clorella non fornisce più alcun vantaggio.
I primi studi sull’uomo dimostrano un effetto positivo sull’eliminazione dei metalli pesanti come l’arsenico. In uno studio clinico di dimensioni ridotte, 250 milligrammi di estratto di spirulina e 2 milligrammi di zinco hanno aumentato la quantità di arsenico eliminato tramite l’urina in pazienti intossicati con questo metallo rispetto a chi aveva ricevuto un placebo. Inoltre, la combinazione zinco-spirulina ha ridotto di circa la metà il contenuto di arsenico nei capelli, e questo è considerato un sintomo evidente di una riduzione dell’intossicazione da arsenico.
Entrambe le alghe hanno anche proprietà antiossidanti: 3.600 milligrammi di estratto di clorella hanno ridotto i danni da stress ossidativo sui grassi dell’organismo e migliorato lo stato antiossidante nei soggetti fumatori. Gli esperimenti condotti sugli animali confermano inoltre che la spirulina riduce i danni ossidativi causati da piombo, mercurio e arsenico.
In futuro sarà necessario condurre ulteriori studi clinici per determinare in che misura la clorella e la spirulina favoriscono l’eliminazione di altri metalli pesanti e attenuano le conseguenze.
Dosaggio e consigli sull’assunzione della spirulina e della clorella
Per disintossicarsi dai metalli pesanti si consiglia di assumere ogni giorno da 2.400 a 3.000 milligrammi di estratto di alghe clorella o spirulina oppure, in alternativa, da 2.000 a 4.000 milligrammi di alghe essiccate, preferibilmente durante un pasto e con sufficiente acqua.
Informazioni
I valori del ferro nel sangue diminuiscono se si assumono 2.000 milligrammi di spirulina per tre mesi. Pertanto, è consigliabile consultare il proprio medico in caso di uso prolungato e sottoporsi a un monitoraggio dei parametri del ferro.
La qualità conta! La spirulina e la clorella si legano ai metalli pesanti e ai veleni ambientali presenti non solo nell’organismo, ma anche nell’acqua. Bisogna quindi optare per integratori provenienti solo da produttori controllati (ad esempio da agricoltura biologica) e acquistarli solo da produttori che analizzano le alghe per rilevare eventuali veleni ambientali e impurità.
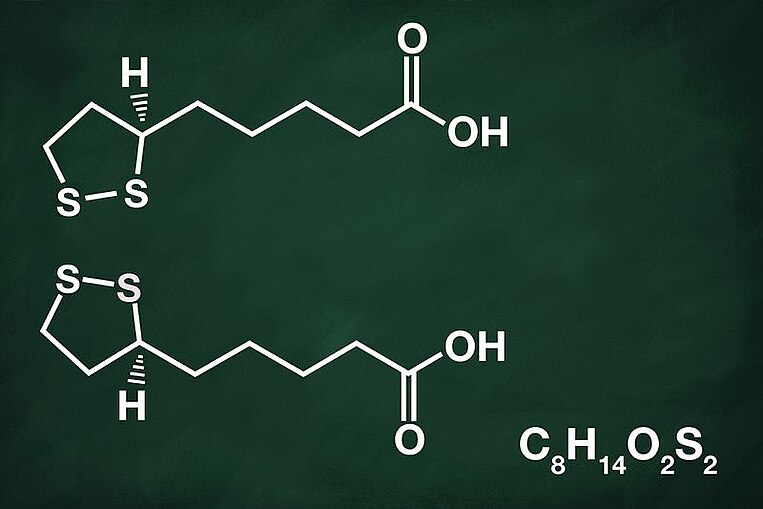
L’acido alfa-lipoico si lega ai metalli pesanti
Meccanismo d’azione dell’acido alfa-lipoico
L’acido alfa-lipoico è in grado di legarsi ai metalli pesanti nocivi, che vengono così neutralizzati ed eliminati dall’organismo. Dai risultati ottenuti da esperimenti sugli animali e in laboratorio si evince che l’acido alfa-lipoico si lega con i seguenti metalli pesanti: cadmio, piombo, mercurio, manganese, zinco, cobalto, rame, platino e ferro.
Inoltre, ha proprietà antiossidanti e protegge dai radicali liberi e dallo stress ossidativo causato dai metalli pesanti. Uno studio condotto sugli animai ha mostrato come l’acido alfa-lipoico riduca l’ossidazione dei grassi nel cervello e nel tessuto connettivo. L’acido alfa-lipoico è in grado di prevenire i danni ossidativi causati da mercurio e piombo, che attraversano facilmente la barriera emato-encefalica e si accumulano nel tessuto cerebrale. L’acido alfa-lipoico, infatti, è uno dei pochi antiossidanti in grado di attraversare la barriera emato-encefalica. Sono necessari studi clinici sull’uomo per confermare l’effetto positivo dell’acido lipoico in caso di intossicazione da metalli pesanti.
Il parere degli esperti
Teoricamente l’acido alfa-lipoico, grazie alle sue proprietà complessanti, può legarsi ad altri minerali presenti nell’organismo (calcio, magnesio, zinco, ferro), ma finora si hanno a disposizione solo i risultati di esperimenti condotti sugli animali. Non esistono evidenze sull’uomo che l’acido alfa-lipoico causi una carenza di minerali.
Inoltre, l’acido alfa-lipoico aumenta la concentrazione di altri antiossidanti, come il glutatione, dentro e fuori le cellule e può rigenerare antiossidanti come il coenzima Q10 e le vitamine C ed E dopo che hanno neutralizzato i radicali.
Dosaggio e consigli sull’assunzione dell’acido alfa-lipoico
I medici specializzati in micronutrienti prescrivono da 600 a 1.200 milligrammi di acido alfa-lipoico per quattro settimane a pazienti intossicati con metalli pesanti. Spesso l’acido alfa lipoico viene inizialmente somministrato tramite infusione diretta in vena (due infusioni da 600 milligrammi alla settimana per due settimane) anziché per via orale.
L’eliminazione dei metalli pesanti dovrebbe sempre essere supervisionata da un medico, perché l’acido alfa-lipoico potrebbe mobilitare i metalli pesanti accumulati, che potrebbero poi diffondersi nuovamente all’interno dell’organismo. In questo caso il medico potrebbe affiancare alla terapia altri agenti complessanti.
L’acido alfa-lipoico andrebbe assunto a stomaco vuoto, ad esempio un’ora prima dei pasti, perché i minerali contenuti negli alimenti ne bloccano l’assorbimento a livello intestinale.
Acido alfa-lipoico: da considerare in caso di gravidanza, allattamento e diabete
Le donne incinte e che allattano al seno dovrebbero assumere l’acido alfa-lipoico solo previo accordo con il proprio medico. I primi studi mostrano però che 600 milligrammi al giorno di acido alfa-lipoico non hanno alcun effetto negativo su mamma e bambino.
L’acido alfa-lipoico può intensificare l’effetto dell’insulina e di altri farmaci antidiabetici sulla riduzione della glicemia e favorire quindi l’ipoglicemia. Per questo motivo, è necessario sottoporsi a un controllo molto accurato dell’indice glicemico prima dell’avvio della terapia. Tra i principi attivi interessati ci sono ad esempio la glibenclamide, la glimepiride e la metformina.
N-acetilcisteina: lo zolfo si lega ai metalli pesanti
Meccanismo d’azione dell’N-acetilcisteina
I gruppi di zolfo contenuti nell’N-acetilcisteina le consentono di legarsi ai metalli pesanti, pertanto questa sostanza è consigliata in caso di intossicazioni. In uno studio clinico condotto su lavoratori a contatto con il piombo, tre gruppi di soggetti hanno ricevuto diverse dosi di N-acetilcisteina (1 × 200, 2 × 200 o 2 × 400 milligrammi) per tre mesi. Al termine dello studio è risultato che il contenuto di piombo nel sangue dei soggetti nei tre gruppi che avevano ricevuto l’N-acetilcisteina era sensibilmente inferiore rispetto a quelli del gruppo di controllo. Gli scienziati hanno concluso che in futuro l’N-acetilcisteina potrebbe diventare un’opzione terapeutica in caso di intossicazioni da piombo.
Inoltre, in un primo studio condotto su persone regolarmente a contatto con il piombo, i soggetti che avevano preso N-acetilcisteina presentavano un miglioramento delle difese antiossidanti rispetto al gruppo di controllo. L’organismo utilizza l’N-acetilcisteina per produrre il glutatione, la molecola antiossidante per eccellenza.
Dosaggio e consigli sull’assunzione dell’N-acetilcisteina
In caso di intossicazioni da metalli pesanti, i medici specializzati in micronutrienti consigliano da 200 a 800 milligrammi di N-acetilcisteina al giorno, possibilmente suddivisi in più dosi nell’arco della giornata, di preferenza insieme ai pasti.
N-acetilcisteina: da considerare in caso di gravidanza, allattamento, malattie e assunzione di farmaci
Non sono disponibili studi a sufficienza per consigliare l’assunzione dell’N-acetilcisteina durante la gravidanza e la allattamento. Pertanto, spetta al ginecologo prendere una decisione in merito.
Dovrebbe consultare il proprio medico anche chi soffre delle seguenti patologie:
- Costrizione delle vie respiratorie e disfunzioni respiratorie come asma, che possono causare ostruzioni dei bronchi
- Propensione alle emorragie gastrointestinali (ad esempio in caso di ulcera gastrica o esofagea)
- Malattie epatiche o renali
- Intolleranza all’istamina: l’N-acetilcisteina può bloccare la degradazione dell’istamina
Dato che l’N-acetilcisteina ha un effetto espettorante, non andrebbe assunta in concomitanza con farmaci antitussivi poiché si corre il rischio che le secrezioni non vengano espulse. Tra i farmaci di questo tipo si annoverano Monapax® o Codyl®.
L’assunzione combinata di N-acetilcisteina e nitroglicerina, un principio attivo vasodilatatore, può causare un calo della pressione. In caso di terapia antibiotica, si raccomanda di attendere almeno due ore prima di assumere l’N-acetilcisteina.
Il glutatione aiuta le naturali difese contro i radicali liberi
Meccanismo d’azione del glutatione
Il glutatione è una delle più importanti molecole disintossicanti e assicura un’efficace protezione cellulare. Viene utilizzato anche in caso di intossicazione da metalli pesanti, soprattutto contro mercurio o cadmio, due metalli che producono radicali altamente nocivi all’interno delle cellule dell’organismo. Il glutatione è in grado di contrastarli, svuotando le riserve. Una sua carenza può causare danni neurologici. Un primo studio di alto livello condotto su 54 soggetti ha dimostrato che l’assunzione di glutatione consente di aumentarne il livello nel sangue.
I primi studi condotti dimostrano, inoltre, che è in grado di legarsi al mercurio, favorendone l’eliminazione: la somministrazione di glutatione per via endovenosa (insieme a vitamina C e agli agenti complessanti DMPS e DMSA) ha ridotto di circa il 70 percento la quantità di mercurio presente nell’urina.
Dosaggio e consigli sull’assunzione del glutatione
Sulla base delle loro esperienze pratiche, i medici specializzati in micronutrienti consigliano di somministrare per via endovenosa 600 milligrammi di glutatione da due a tre volte la settimana per un totale di sei settimane.
Sono consigliate anche le capsule: in questo modo il glutatione raggiunge l’organismo attraverso l’intestino.
La quercetina e la rutina hanno un effetto antiossidante e si legano ai complessi di metalli pesanti
Meccanismo d’azione della quercetina e della rutina
Il flavonoide quercetina è in grado di neutralizzare i radicali liberi e di legarsi ai metalli pesanti, rafforzando le difese antiossidanti e proteggendo le cellule dallo stress ossidativo causato dall’intossicazione. La rutina è molto simile alla quercetina. Viene degradata dai batteri intestinali, producendo quercetina.
Esperimenti sui topi hanno dimostrato che la quercetina potenzia il trattamento contro l’intossicazione da arsenico: la combinazione di monoisoamil-DMSA è risultata più efficace della somministrazione delle sostanze da sole. In un esperimento sugli animali la quercetina ha dimostrato di avere un effetto protettivo anche contro i danni renali causati dal cadmio. Anche la rutina ha avuto un effetto protettivo contro i danni renali se combinata con il selenio e ha neutralizzato gli effetti nocivi dell’argento sul sistema nervoso. Si suppone che contribuisca anche a lenire i danni epatici causati dal nichel.
È tuttavia necessario condurre altri studi sull’uomo per poter confermare questi risultati.
Dosaggio e consigli sull’assunzione della quercetina e della rutina
In caso di intossicazione da metalli pesanti, gli esperti in micronutrienti consigliano di seguire un’alimentazione ricca di antiossidanti, tra cui vitamine, minerali e flavonoidi come la quercetina e la rutina.
Fino ad oggi non sono stati condotti studi affidabili per poter stabilire la dose consigliata di quercetina e rutina in caso di intossicazioni da metalli pesanti. I primi studi indicano, tuttavia, che è possibile consigliare dosi minime di questi flavonoidi (ad esempio 300 milligrammi di quercetina e rutina combinate). Si consiglia di non assumere dosi elevate per lunghi periodi di tempo, perché, come dimostrato da alcuni studi sugli animali, ciò potrebbe danneggiare le cellule in caso di intossicazione da metalli pesanti con un effetto pro-ossidante.
La quercetina e la rutina andrebbero assunte insieme ai pasti.
Controllo dello stato antiossidante in laboratorio
Il medico dovrebbe controllare regolarmente lo stato antiossidante nel sangue per monitorare il successo del trattamento.
Quercetina e rutina: da considerare in caso di gravidanza, allattamento, malattie e assunzione di farmaci
Vista la carenza di studi sufficienti sulla sicurezza della quercetina e della rutina, se ne sconsiglia l’uso durante la gravidanza e allattamento. In caso di dubbi è bene chiedere al proprio medico curante.
La quercetina blocca l’enzima CYP3A4 responsabile della degradazione dei farmaci, pertanto influisce anche sulla loro efficacia. Se si assumono farmaci, occorre consultare il proprio medico o farmacista.
In caso di insufficienza renale, spetta al medico decidere se consigliare o meno l’assunzione di rutina o quercetina, perché i reni malati potrebbero non essere in grado di eliminarle correttamente. Si sconsiglia l’uso della rutina anche in caso di accumuli di liquidi a seguito di cardiopatie.
La zeolite e la bentonite favoriscono l’eliminazione dei metalli pesanti
Meccanismo d’azione della zeolite e della bentonite
La zeolite è un minerale estratto dalla pietra vulcanica che si è dimostrato in grado di legarsi a metalli pesanti come il mercurio, il piombo o il cadmio. La forma utilizzata con maggior frequenza in medicina è la clinoptilolite. La bentonite è una miscela composta da diversi minerali argillosi. È molto dilatabile e, come la zeolite, si lega ai metalli pesanti. Spesso viene utilizzata sotto forma di montmorillonite. Questi minerali sono sicuri per la salute e non finiscono nel sangue, ma vengono eliminati con le feci insieme ai metalli pesanti a cui si legano.
Ora è necessario condurre studi sull’uomo per verificare la potenziale efficacia della clinoptilolite-zeolite e della montmorillonite-bentonite in caso di intossicazione da metalli pesanti.
Dosaggio e consigli sull’assunzione della zeolite e della bentonite
Nella maggior parte dei casi si prescrive una cura di due mesi basta su una miscela composta da 500-1.000 milligrammi di clinoptilolite-zeolite e 500-1.000 milligrammi di montmorillonite-bentonite. Questi minerali sono particolarmente consigliati se si vuole ridurre l’intossicazione da metalli pesanti con l’alimentazione. Le capsule o la polvere vanno assunte insieme ai pasti in più dosi distribuite nell’arco della giornata.
In rari casi possono causare stipsi. Per evitare tale effetto, si consiglia di bere sufficienti liquidi (da 2 a 3 litri al giorno), preferibilmente acqua. Si consiglia di evitare bevande alcoliche, acide e che contengono caffeina, come il succo di pompelmo, di arancia, di limone o di ananas.
Zeolite e bentonite: da considerare in caso di gravidanza, allattamento, malattie e assunzione di farmaci
Le donne incinte e che allattano al seno, così come i bambini, non devono assumere la zeolite e la bentonite senza il previo consenso del medico.
Si sconsiglia di assumerle insieme ai farmaci e si raccomanda di rispettare un intervallo di almeno due ore.
Dosaggi in breve
Dosi giornaliere consigliate in caso di intossicazioni da metalli pesanti | |
|---|---|
Vitamine | |
Vitamina C | da 500 a 1.000 milligrammi (mg) |
Vitamina E | 270 milligrammi |
Vitamina B1 | 75 milligrammi |
Minerali | |
Zinco | da 10 a 15 milligrammi |
Selenio | da 100 a 300 microgrammi (µg) |
Flavonoidi | |
Clorella e spirulina | da 2.000 a 4.000 milligrammi se alghe o da 2.400 a 3000 milligrammi se estratto |
Quercetina e rutina | assunte insieme, fino a 300 milligrammi |
Altre sostanze | |
Acido alfa-lipoico | da 600 a 1.200 milligrammi |
N-acetilcisteina | da 200 a 800 milligrammi |
Glutatione | 600 milligrammi |
Clinoptilolite-zeolite e montmorillonite-bentonite | da 500 a 1.000 milligrammi |
Esami di laboratorio consigliati in breve
Esami del sangue consigliati in caso di intossicazioni da metalli pesanti | |
|---|---|
Valori normali | |
Stato antiossidante complessivo (siero) | da 1,13 a 1,57 millimoli per litro* (mmol/l) |
Selenio | da 120 a 150 microgrammi per litro (µg/l) nel sangue intero |
*I valori possono oscillare a seconda del laboratorio che esegue gli esami
Riepilogo
I metalli pesanti possono attaccare le cellule o il patrimonio genetico attraverso la formazione di radicali liberi, che a loro volta contribuiscono all’insorgenza di neuropatie e tumori. Attraverso la somministrazione di vitamine, minerali, aminoacidi o flavonoidi, la medicina dei micronutrienti favorisce la disintossicazione dell’organismo e l’eliminazione dei metalli pesanti e protegge dai danni:
Le vitamine C ed E limitano i danni alle strutture cellulari o al patrimonio genetico (DNA) causati da piombo o cadmio. Anche lo zinco e il selenio proteggono l’organismo dagli effetti nocivi dei vari metalli pesanti perché aumentano la concentrazione degli enzimi antiossidanti e rafforzano il sistema difensivo antiossidante. Svolgono un’azione simile anche l’acido alfa-lipoico, l’N-acetilcisteina, il glutatione, la quercetina e la rutina.
Le alghe spirulina e clorella, la pietra vulcanica zeolite e il minerale argilloso bentonite sono in grado di legarsi ai metalli pesanti favorendone l’eliminazione. Anche le vitamine B1 e B6 formano complessi con il piombo consentendo all’organismo di espellerlo immediatamente.
Indice degli studi e delle fonti
Abarikwu, S.O. et al. (2016): Selenium and rutin alone or in combination do not have stronger protective effects than their separate effects against cadmium-induced renal damage. Pharm Biol. 2016;54(5):896-904, https://www.ncbi.nlm.nih.gov/pubmed/26455473, consultato il: 19.09.2018.
Agency for Toxic Substances and Disease Registry (2010): Arsenic Toxicity How Should Patients Overexposed to Arsenic Be Treated and Managed?, https://www.atsdr.cdc.gov/csem/csem.asp?csem=1&po=13, consultato il: 19.09.2018.
Al-Homaidan, A. A. et al. (2015): Adsorptive removal of cadmium ions by Spirulina platensis dry biomass. Saudi Journal of Biological Sciences, 22(6), 795–800.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4625374/, consultato il: 19.09.2018.
Bai, Y. et al. (2004): Characterization of the rutin-metal complex by electrospray ionization tandem mass spectrometry. Anal Sci. 2004 Aug;20(8):1147-51. https://www.ncbi.nlm.nih.gov/pubmed/15352502, consultato il: 19.09.2018.
Bargagli, R. (2000): Trace metals in Antarctica related to climate change and increasing human impact. Rev Environ Contam Toxicol. 2000;166:129–173. https://www.ncbi.nlm.nih.gov/pubmed/10868078, consultato il: 19.09.2018.
Bashandy, S.A. et al. (2016): Antioxidant Potential of Spirulina platensis Mitigates Oxidative Stress and Reprotoxicity Induced by Sodium Arsenite in Male Rats. Oxid Med Cell Longev. 2016;2016:7174351. https://www.ncbi.nlm.nih.gov/pubmed/26881036, consultato il: 19.09.2018.
Biesalski, H.K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H.K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Calabrese, E.J. et al. (1987): The effects of vitamin C supplementation on blood and hair levels of cadmium, lead, and mercury. Ann N Y Acad Sci. 1987;498:347-53. https://www.ncbi.nlm.nih.gov/pubmed/3476002, consultato il: 19.09.2018.
Chen, Y. et al. (2007): A Prospective Study of Blood Selenium Levels and the Risk of Arsenic-related Premalignant Skin Lesions. Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, 16(2), 207–213. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1924921/, consultato il: 19.09.2018.
Colpo, E. et al. (2008): A single high dose of ascorbic acid and iron is not correlated with oxidative stress in healthy volunteers. Ann Nutr Metab. 2008;53(2):79-85. https://www.ncbi.nlm.nih.gov/pubmed/18852484, consultato il: 19.09.2018.
Dawson, E.B. et al. (1999): The effect of ascorbic acid supplementation on the blood lead levels of smokers. J. Am. Coll. Nutr. 1999;18:166–170, https://www.ncbi.nlm.nih.gov/pubmed/10204833, consultato il: 19.09.2018.
Deutsche Forschungsgemeinschaft (2006): DFG legt MAK- und BAT-Werte-Liste 2006 vor (Memento vom 10. Februar 2009 im Internet Archive) (Pressemitteilung Nr. 34, 5. Juli 2006), http://www.dfg.de/aktuelles_presse/pressemitteilungen/2006/presse_2006_34.html, consultato il: 19.09.2018.
DGAUM e.V. (Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e.V.) (2010): Arbeit unter Einwirkung von Blei und seinen Verbindungen (2010), AWMF-Registernummer: 002/001: https://www.awmf.org/uploads/tx_szleitlinien/002-001l_S1_Arbeit_unter_Einwirkung_von_Blei_2010-abgelaufen.pdf, consultato il: 19.09.2018.
DGAUM e.V. (Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e.V.) unter Beteiligung der Gesellschaft für Toxikologie (2014): Arbeitsmedizinische Leitlinie Arbeiten unter Einwirkung von Cadmium und seinen Verbindungen, AWMF-Registernummer: 002/002, https://www.awmf.org/uploads/tx_szleitlinien/002-002l_S1_Arbeit_Cadmium_Verbindungen_2014-07.pdf, consultato il: 19.09.2018.
DGAUM e.V. (Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e.V.) unter Beteiligung der Gesellschaft für Toxikologie (2014): Arbeitsmedizinische Leitlinie Arbeiten unter Einwirkung von Quecksilber und seinen Verbindungen, AWMF-Registernummer: 002/003, https://www.awmf.org/uploads/tx_szleitlinien/002-003l_S1_Arbeiten_Quecksilber_Verbindungen_2015-06.pdf, consultato il: 19.09.2018.
Dhawan M. et al. (1989): Preventive and therapeutic role of vitamin E in chronic plumbism. 1989 Dec;2(4):335-40. https://www.ncbi.nlm.nih.gov/pubmed/2604901/, consultato il: 14.11.2018.
Drugs and Lactation Database (LactMed) [Internet]. Bethesda (MD): National Library of Medicine (US); 2006-. Spirulina. [Updated 2017 Apr 11]. https://www.ncbi.nlm.nih.gov/books/NBK501849/, consultato il: 19.09.2018.
Elangovan, P. & Pari, L. (2013): Ameliorating effects of troxerutin on nickel-induced oxidative stress in rats. Redox Rep. 2013;18(6):224-32. https://www.ncbi.nlm.nih.gov/pubmed/24112957, consultato il: 19.09.2018.
Federico, A. et al. (2015): A pilot study on the ability of clinoptilolite to absorb ethanol in vivo in healthy drinkers: effect of gender. J Physiol Pharmacol. 2015 Jun;66(3):441-7. https://www.ncbi.nlm.nih.gov/pubmed/26084226, consultato il: 19.09.2018.
Flora, S.J. (2009): Structural, chemical and biological aspects of antioxidants for strategies against metal and metalloid exposure. Oxidative Medicine and Cellular Longevity, 2(4), 191–206. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2763257/#R1, consultato il: 19.09.2018.
Feillet-Coudray, C. et al. (2006): Effect of zinc supplementation on in vitro copper-induced oxidation of low-density lipoproteins in healthy French subjects aged 55-70 years: the Zenith Study. Br J Nutr. 2006
Jun;95(6):1134-42. https://www.ncbi.nlm.nih.gov/pubmed/16768836, consultato il: 19.09.2018.
Gao, Z.et al. (2002): Effects of rutin supplementation on antioxidant status and iron, copper, and zinc contents in mouse liver and brain. Biol Trace Elem Res. 2002 Sep;88(3):271-9. https://www.ncbi.nlm.nih.gov/pubmed/12350136, consultato il: 19.09.2018.
George, C.M. et al. (2013): A Cross-sectional Study of the Impact of Blood Selenium on Blood and Urinary Arsenic Concentrations in Bangladesh. Environmental Health, 12, 52, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3724573/, consultato il: 19.09.2018.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2018): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 4. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Han, D. et al. (1997): L. Lipoic acid increases de novo synthesis of cellular glutathione by improving cystine utilization. Biofactors. 1997;6(3):321-38. https://www.ncbi.nlm.nih.gov/pubmed/9288403, consultato il: 19.09.2018.
Hsu, P.-C. & Guo, Y.L. (2002): Antioxidant nutrients and lead toxicity. Toxicology. 2002;180:33–44. http://www.ncbi.nlm.nih.gov/pubmed/12324198, consultato il: 19.09.2018.
Jan, A.T. et al. (2015): Heavy Metals and Human Health: Mechanistic Insight into Toxicity and Counter Defense System of Antioxidants. International Journal of Molecular Sciences, 16(12), 29592–29630. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4691126/#B213-ijms-16-26183, consultato il: 19.09.2018.
Kalafati, M. et al. (2010): Ergogenic and antioxidant effects of spirulina supplementation in humans. Med Sci Sports Exerc. 2010 Jan;42(1):142-51. https://www.ncbi.nlm.nih.gov/pubmed/20010119, consultato il: 19.09.2018.
Kalia, K. & Flora, S.J. (2005): Strategies for safe and effective therapeutic measures for chronic arsenic and lead poisoning. J Occup Health. 2005 Jan;47(1):1-21. https://www.ncbi.nlm.nih.gov/pubmed/15703449, consultato il: 19.09.2018.
Kasperczyk, S. et al. (2014): Effect of treatment with N-acetylcysteine on non-enzymatic antioxidant reserves and lipid peroxidation in workers exposed to lead. Ann Agric Environ Med. 2014;21(2):272-7. https://www.ncbi.nlm.nih.gov/pubmed/24959775, consultato il: 19.09.2018.
Kasperczyk, S. et al. (2016): Effect of N-acetylcysteine administration on homocysteine level, oxidative damage to proteins, and levels of iron (Fe) and Fe-related proteins in lead-exposed workers. Toxicol Ind Health. 2016 Sep;32(9):1607-18. https://www.ncbi.nlm.nih.gov/pubmed/25731901?report=docsum&format=text, consultato il: 19.09.2018.
Kim, G.N. & Jang, H.D. (2009): Protective mechanism of quercetin and rutin using glutathione metabolism on HO-induced oxidative stress in HepG2 cells. Ann N Y Acad Sci. 2009 Aug;1171:530-7. https://www.ncbi.nlm.nih.gov/pubmed/19723100, consultato il: 19.09.2018.
Khalil, S.R. et al. (2018): Spirulina platensis attenuates the associated neurobehavioral and inflammatory response impairments in rats exposed to lead acetate. Ecotoxicol Environ Saf. 2018 Aug 15;157:255-265. https://www.ncbi.nlm.nih.gov/pubmed/29625400, consultato il: 19.09.2018.
Kumar, R.M. et al. (2013): Accumulation of heavy metals (Cu, Cr, Pb and Cd) in freshwater micro algae (Chlorella sp.). J Environ Sci Eng. 2013 Jul;55(3):371-6. https://www.ncbi.nlm.nih.gov/pubmed/25509955, consultato il: 19.09.2018.
Lachili, B. et al. (2001): Increased lipid peroxidation in pregnant women after iron and vitamin C supplementation. Biol Trace Elem Res. 2001 Nov;83(2):103-10, https://www.ncbi.nlm.nih.gov/pubmed/11762527, consultato il: 19.09.2018.
Lamidi, Y.I. & Akefe, I.O. (2017): Mitigate Effects of Antioxidants in Lead Toxicity. Res Rep Toxi. Vol.1 No.1:3, http://www.imedpub.com/articles/mitigative-effects-of-antioxidants-in-lead-toxicity.pdf, consultato il: 19.09.2018.
Liu, Y. & Guo, M.: Studies on transition metal-quercetin complexes using electrospray ionization tandem mass spectrometry. Molecules. 2015 May 13;20(5):8583-94. https://www.ncbi.nlm.nih.gov/pubmed/25985359, consultato il: 19.09.2018.
Macáková, K. et al. (2012): Iron reduction potentiates hydroxyl radical formation only in flavonols. Food Chem. 2012 Dec 15;135(4):2584-92. https://www.ncbi.nlm.nih.gov/pubmed/22980846, consultato il: 19.09.2018.
Martins Rde, P. et al. (20009): Synergistic neurotoxicity induced by methylmercury and quercetin in mice. Food Chem Toxicol. 2009 Mar;47(3):645-9. https://www.ncbi.nlm.nih.gov/pubmed/19141311, consultato il: 19.09.2018.
Misbahuddin, M. et al. (2006): Efficacy of spirulina extract plus zinc in patients of chronic arsenic poisoning: a randomized placebo-controlled study. Clin Toxicol (Phila). 2006;44(2):135-41, https://www.ncbi.nlm.nih.gov/pubmed/16615668, consultato il: 19.09.2018.
Mishra, D. & Flora, S.J. (2008): Quercetin administration during chelation therapy protects arsenic-induced oxidative stress in mice. Biol Trace Elem Res. 2008 May;122(2):137-47. https://www.ncbi.nlm.nih.gov/pubmed/18183357, consultato il: 19.09.2018.
Muran, P.J. (2006): Mercury elimination with oral DMPS, DMSA, vitamin C, and glutathione: an observational clinical review. Altern Ther Health Med. 2006 May-Jun;12(3):70-5. https://www.ncbi.nlm.nih.gov/pubmed/16708769, consultato il: 19.09.2018.
Nau, H. et al. (2002): Lebensmitteltoxikologie: Rückstände und Kontaminanten: Risiken und Verbraucherschutz. Georg Thieme Verlag Stuttgart New York.
Nickander, K.K. et al. (1996): Alpha-lipoic acid: antioxidant potency against lipid peroxidation of neural tissues in vitro and implications for diabetic neuropathy. Free Radic Biol Med. 1996;21(5):631-9, https://www.ncbi.nlm.nih.gov/pubmed/8891666, consultato il: 19.09.2018.
Panahi, Y. et al. (2013): Investigation of the effects of Chlorella vulgaris supplementation on the modulation of oxidative stress in apparently healthy smokers. Clin Lab. 2013;59(5-6):579-87. https://www.ncbi.nlm.nih.gov/pubmed/23865357, consultato il: 19.09.2018.
Patrick, L. (2003): Toxic metals and antioxidants: Part II. The role of antioxidants in arsenic and cadmium toxicity. Altern Med Rev. 2003 May;8(2):106-28, https://www.ncbi.nlm.nih.gov/pubmed/12777158, consultato il: 19.09.2018.
Rana, M.N.et al. (2018): Toxicodynamics of Lead, Cadmium, Mercury and Arsenic- induced kidney toxicity and treatment strategy: A mini review. Toxicology Reports, 5, 704–713. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6035907/, consultato il: 19.09.2018.
Reichl, F.-X. (2017): Moderne Umweltmedizin: Umweltbelastungen – Diagnostik – Therapie, Lehmanns Media, 1. Auflage.
Renugadevi, J. & Prabu, S.M.: Quercetin protects against oxidative stress-related renal dysfunction by cadmium in rats. Exp Toxicol Pathol. 2010 Sep;62(5):471-81, https://www.ncbi.nlm.nih.gov/pubmed/19615871, consultato il: 19.09.2018.
Richie, J.P. et al. (2015): Randomized controlled trial of oral glutathione supplementation on body stores of glutathione. Eur J Nutr. 2015 Mar;54(2):251-63, https://www.ncbi.nlm.nih.gov/pubmed/24791752, consultato il: 19.09.2018.
Romay, C. et al. (2003): C-phycocyanin: a biliprotein with antioxidant, anti-inflammatory and neuroprotective effects. Curr Protein Pept Sci. 2003 Jun;4(3):207-16. https://www.ncbi.nlm.nih.gov/pubmed/12769719, consultato il: 19.09.2018.
Sarezky, D. et al. (2016): Tolerability in the elderly population of high-dose alpha lipoic acid: a potential antioxidant therapy for the eye. Clinical Ophthalmology (Auckland, N.Z.), 10, 1899–1903, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5047711/, consultato il: 19.09.2018.
Suliburska, J.et al. (2016): Effect of Spirulina maxima Supplementation on Calcium, Magnesium, Iron, and Zinc Status in Obese Patients with Treated Hypertension. Biol Trace Elem Res. 2016 Sep;173(1):1-6. https://www.ncbi.nlm.nih.gov/pubmed/26779620, consultato il: 19.09.2018.
Sohler, A. et al. (1977): Blood lead levels in psychiatric outpatients reduced by zinc and vitamin C. Journal of Orthomolecular Psychiatry, 6(3), 272-276. http://orthomolecular.org/library/jom/1977/pdf/1977-v06n03-p272.pdf, consultato il: 19.09.2018.
Tandon, S.K. et al. (2001): Lead poisoning in Indian silver refiners. Sci Total Environ. 2001 Dec 17;281(1-3):177-82, https://www.ncbi.nlm.nih.gov/pubmed/11778950, consultato il: 19.09.2018.
Trueba, G.P. et al. (2004): Oxygen free radical and antioxidant defense mechanism in cancer. Front. Biosci. 2004;9:2029–2044. https://www.ncbi.nlm.nih.gov/pubmed/15353268, consultato il: 19.09.2018.
Zhai, Q. et al. (2015): Dietary Strategies for the Treatment of Cadmium and Lead Toxicity. Nutrients, 7(1), 552–571. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4303853/, consultato il: 19.09.2018.




