Schwermetalle sind in der Umwelt allgegenwärtig. Arsen, Blei, Cadmium und Quecksilber gehören zu den giftigsten Schwermetallen. Sie erhöhen das Risiko für zahlreiche chronische und entzündliche Krankheiten. Verschiedene Vitamine, Mineralstoffe, Aminosäuren und Pflanzenstoffe können helfen, vor den schädlichen Wirkungen von Schwermetallen zu schützen und deren Ausscheidung aus dem Körper zu fördern. Lesen Sie hier, welche Möglichkeiten die Mikronährstoffmedizin bietet, um die Entgiftung bei einer Schwermetallbelastung zu unterstützen.

Ursachen und Symptome
Wodurch kommt es zur Schwermetallbelastung?
Schwermetalle kommen überall in der Natur vor. Der Mensch bringt sie über industrielle Aktivitäten in Umlauf. Zunehmend findet man Schwermetallbelastungen deshalb in Lebensmitteln. Beispielsweise gelangen sie durch Bergbau, Industrie und Müll in die Umwelt. Niederschläge und Staub transportieren sie anschließend auf die Felder und das Gemüse. Aber auch Abgase oder Düngemittel enthalten Schwermetalle. Sie können sich im Boden und Grundwasser anreichern und von Pflanzen aufgenommen werden. In den Körper gelangen Schwermetalle letztendlich durch Lebensmittel oder bei deren Zubereitung sowie durch die Atemluft und Zigaretten.
Problematisch sind die giftigen Schwermetalle. Dazu zählen:
- Arsen
- Aluminium
- Blei
- Cadmium
- Quecksilber
Eine Quecksilbervergiftung ist ein weltweites Problem. Quecksilber kommt vermehrt in Fisch, Meeresfrüchten und Wildpilzen vor. Auch Zahnfüllungen aus Amalgam enthalten es, sodass sogar der Zahnarzt oder die Zahnarzthelfer betroffen sein können. Blei wird in immer mehr Alltagsgegenständen verboten, wie Farben, Benzin oder Wasserleitungen. Ein Problem ist jedoch noch das Blei, das durch die Munition der Jäger in der Umwelt gelangt. Arsen reichert sich in Reis und Getreide an. Cadmium wird häufig in Wildpilzen, Getreide, Blattgemüse, Leinsamen und Zigaretten nachgewiesen. Mit Aluminium sind viele Kräuter und Gewürze belastet. Auch einige Medikamente und bestimmte Deos (Antitranspirantien) enthalten Aluminium.
Info
Bei Personen, die sich glutenfrei ernährten, wurden höhere Blutwerte an Quecksilber, Blei und Cadmium sowie erhöhte Urinspiegel an Arsen beobachtet. Forscher vermuten, dass bei einer glutenfreien Ernährung mehr auf Lebensmittel zurückgegriffen wird, die häufig mit Schwermetallen belastet sind – zum Beispiel auf Reis (Arsen).
Folgen und Symptome von Schwermetallbelastungen
Reichern sich Schwermetalle im Körper an, beeinträchtigen sie antioxidative Schutzsysteme und verursachen oxidativen Stress. Dadurch schädigen sie lebensnotwendige Körperstrukturen wie unser Erbgut (DNA) oder Eiweiße in den Zellen. Auch die Fettsäuren in der Zellhülle (Membran) können verändert werden. So greifen Schwermetalle verschiedene Organe an. Daneben verändern sie die Aktivität der Gene, was über viele Jahre zu Krebs führen kann. Auch die Entwicklung eines ungeborenen Kindes in der Schwangerschaft kann gestört werden. Folgende Symptome sind möglich:
- Arsen: Grauschwarze Verfärbungen der Haut (Arsenmelanose), vermehrte Hornhautbildung an Hand- und Fußsohlen mit Hauteinrissen sowie Übelkeit, Erbrechen und Durchfall deuten auf eine Arsenvergiftung hin. Ist die Arsenaufnahme chronisch, erhöht sich der Gehalt des roten Blutfarbstoffs im Blut (Polyglobulie). Dadurch können die Gefäße durch Gerinnsel verstopfen (Thrombose). Auch Krebs ist eine Folge. Er befällt vor allem die Lunge, Haut, Harnblase und Nieren.
- Aluminium: Eine Aluminiumvergiftung kann unter anderem zu Stoffwechselstörungen, Unfruchtbarkeit, Blutarmut, Gewebeveränderungen (Nekrose) und entzündlichen Erkrankungen führen. Auch sind eine Thrombose sowie ein Herzinfarkt und Schlaganfall möglich. Diskutiert wird ebenfalls, dass Aluminium zur Entwicklung von Alzheimer, Autismus und Krebs beiträgt.
- Blei: Es kommt zu Magen- und Darmkrämpfen mit starken Schmerzen, Verstopfung, Abgeschlagenheit, blasser Haut, Störungen der Nierenfunktion und Blutarmut. Bei chronischer Bleiaufnahme können Nerven so stark geschädigt werden, dass es zu Lähmungen kommt. Spätfolgen können außerdem Parkinson und Krebs sein.
- Cadmium: Typische Anzeichen sind Verätzungen der Magenschleimhaut, Erbrechen, Nierenschäden bis hin zu Nierenversagen sowie beim Einatmen Reizungen der oberen Atemwege, Bronchitis und Lungenentzündung. Bei einer chronischen Cadmiumbelastung treten vor allem Knochenerweichungen mit Knochenbrüchen auf, außerdem Rücken- und Beinschmerzen sowie Blutarmut.
- Quecksilber: Glieder- und Kopfschmerzen, Migräne, Müdigkeit sowie Zittern können durch Quecksilber ausgelöst werden. Bei langfristiger Quecksilberaufnahme wird das Zentralnervensystem geschädigt: Es kommt zu Hirnschäden und Lähmungen bis hin zum Tod.
Expertenwissen
Fehldiagnose Rheuma bei Quecksilbervergiftung: Quecksilber stört viele Körperfunktionen, darunter auch das Nervensystem und den Bewegungsapparat. Zum Teil ähneln die Beschwerden einer rheumatischen oder infektiösen Erkrankung. Fehldiagnosen sind möglich. Eine verzögerte Diagnose und damit spätere Behandlung können schwerwiegende Folgen haben. Bei ungeklärten Gliederschmerzen sollte daher auch eine Quecksilbervergiftung in Betracht gezogen werden.
Ziele der Behandlung
Wie wird eine Schwermetallvergiftung klassisch behandelt?
Bei einer Schwermetallvergiftung sollte nach der Ursache gefahndet und jeder weitere Kontakt mit dem Schwermetall vermieden werden. Die Behandlungsweise unterscheidet sich je nach Schwermetall:
Wurde akut eine größere Menge Blei geschluckt, sollte es durch Erbrechen oder eine Magenspülung aus dem Verdauungstrakt entfernt werden. Gleichzeitig ist die Einnahme von Aktivkohle anzuraten. Sie wandelt Blei in schwerlösliches Bleisulfat um, das an Aktivkohle gebunden und ausgeschieden wird.
Ist Blei schon im Körperkreislauf, geben Ärzte Medikamente (Komplexbildner oder auch Chelatbildner genannt). Sie binden Blei, damit es anschließend ausgeschieden wird. Zu den Komplexbildnern bei Bleivergiftungen gehören zum Beispiel:
- Dimercaptobernsteinsäure (DMSA wie Succicaptal®)
- Dimercaptopropansulfonsäure (DMPS wie Dimaval®)
- Penicillamin (wie zum Beispiel Metalcaptase®)
- Ethylendiamintetraacetat (EDTA wie Titriplex® ll oder Idranal® II)
Eine akute Vergiftung mit Arsen beziehungsweise Quecksilber wird ebenfalls mit Komplexbildnern behandelt. Dabei werden DMSA oder DMPS angewendet.
Bei chronischen Vergiftungen mit Blei, Quecksilber oder Cadmium ohne Symptome werden keine Komplexbildner eingesetzt. In jedem Fall gilt aber ein Kontaktverbot mit dem Schwermetall. Auch bei einer chronischen Cadmiumvergiftung werden keine Komplexbildner angewendet; eine ursachenbezogene Behandlung ist bei Cadmium nicht bekannt.
Expertenwissen
Parallel zur Chelattherapie werden Antioxidantien empfohlen, um die Schäden durch Mobilisierung der Schwermetalle zu dämpfen. Der Körper braucht außerdem Mineralstoffe, da sie durch die Schwermetalle aus ihren Positionen in zum Beispiel Enzymen verdrängt wurden. Sind die Positionen durch Mineralstoffe besetzt, werden Schwermetalle zudem nicht erneut eingelagert. Chelate entfernen vermutlich auch Mineralstoffe, die der Körper braucht – vor allem Zink und Kupfer. Antioxidantien und Mineralstoffe sollten daher als Basisabsicherung parallel ergänzt werden.
Ziele der Mikronährstoffmedizin
Die Behandlung von Schwermetallbelastungen lässt sich durch die Mikronährstoffmedizin ergänzen – insbesondere dann, wenn Komplexbildner in der klassischen Therapie nicht erfolgreich sind. Im Vordergrund steht, die Ausscheidung von Schwermetallen zu unterstützen. Einige Vitamine, Mineralstoffe, Aminosäuren und Pflanzenstoffe können Schwermetalle binden und sie so in eine ungiftige Form umwandeln. Auch können sie deren Ausleitung über den Stuhl oder Urin fördern. Zudem wirken einige Mikronährstoffe antioxidativ. Das bedeutet, sie können Schäden durch Schwermetalle abschwächen.
Zu den wichtigsten Mikronährstoffen gehören:
- Vitamin C und E sowie Zink und Selen schützen vor oxidativem Stress, der durch Schwermetalle ausgelöst wird.
- Vitamin B1 und B6 fördern die Schwermetallausscheidung.
- Spirulina und Chlorella binden Schwermetalle und fördern die Ausscheidung über den Urin.
- Alpha-Liponsäure regeneriert Vitamin E und C und trägt zum Zellschutz bei.
- N-Acetylcystein und Glutathion binden Schwermetalle und wirken antioxidativ.
- Quercetin und Rutin wirken als Antioxidans und Komplexbildner.
- Zeolith und Bentonit leiten Schwermetalle im Darm aus.
- Probiotika stärken eine geschädigte Darmbarriere.
Behandlung mit Mikronährstoffen
Antioxidative Vitamine fangen Schwermetallangriffe ab
Wirkweise von Vitamin C und E
Schwermetalle erzeugen oxidativen Stress, der den Körper belastet. Um die Folgen zu verringern, werden bei einer Schwermetallbelastung Antioxidantien eingesetzt: Sie hemmen oxidative Schäden an Zellstrukturen. Zum Beispiel verhinderten Antioxidantien wie Vitamin C und Curcumin laut Tierstudien Gefäßschäden als Folge einer Cadmiumvergiftung. Vitamin E mit Selen reduzierte dagegen bei Ratten eine Beeinträchtigung des Immunsystems durch Aluminium.
Auch bei Menschen wurden Schutzeffekte nachgewiesen: Die tägliche Einnahme von 1.000 Milligramm Vitamin C und 270 Milligramm Vitamin E minderten in einer einjährigen Studie durch Blei ausgelöste oxidative Zellschäden. In einer anderen hochwertigen Studie senkte es den Bleigehalt im Blut.
Tierversuche zeigten außerdem eine bessere Ausscheidung von Blei und Arsen mit Vitamin C und E. Außerdem wurde die Entgiftung von Arsen, Aluminium und Blei unterstützt (zum Teil in Kombination mit Selen oder Komplexbildnern). Auch wenn nicht alle Studien diesen Effekt bestätigen, schlussfolgern Forscher in einer Übersichtsarbeit insgesamt, dass Vitamin C und E vermutlich zur Vorbeugung und zur Reduzierung einer Bleibelastung vorteilhaft sind.
Es liegen zahlreiche Hinweise vor, dass antioxidative Vitamine bei Schwermetallbelastung helfen könnten. Größere Studien müssen noch mehr Daten mit Menschen liefern. Dennoch sollte man bei Schwermetallbelastung auf Antioxidantien achten.
Dosierung und Einnahmeempfehlung von Vitamin C und E
Bei Schwermetallbelastung werden zwischen 500 und 1.000 Milligramm Vitamin C pro Tag empfohlen. Diese Dosierung war wirksam, um die Bleibelastung im Blut zu reduzieren und dessen gesundheitsschädliche Effekte abzufangen.
Vitamin E war in einer Dosis von 270 Milligramm wirksam. Diese hohe Dosierung sollte zuvor mit einem Mikronährstoff-Experten abgesprochen werden. Ohne Rücksprache sind bis zu 50 Milligramm Vitamin E pro Tag sinnvoll. Bei Rauchern steigt möglicherweise das Risiko für Hirnblutungen und Lungenkrebs, wenn sie über 50 Milligramm Vitamin E als Alpha-Tocopherol einnehmen. Deshalb sollten sie darauf verzichten – vor allem in Verbindung mit hoch dosiertem Beta-Carotin.
Es ist empfehlenswert, die beiden Vitamine zusammen einzunehmen, da Vitamin C das Vitamin E regeneriert und dadurch der antioxidative Schutz erhöht wird. Außerdem ist die Einnahme zu einer Mahlzeit wichtig, um das fettlösliche Vitamin E gut aufnehmen zu können.
Antioxidativen Status im Labor bestimmen lassen
Um den Behandlungserfolg zu überwachen, sollte ein Arzt regelmäßig den antioxidativen Status im Blut überprüfen. Normalwerte liegen im Bereich zwischen 1,13 bis 1,57 Millimol pro Liter. Zu beachten ist, dass Werte und Einheiten je nach Labor und Methode sehr unterschiedlich sein können.
Vitamin C und E: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
In der Schwangerschaft und Stillzeit wird eine Vitamin-C-Zufuhr von rund 110 Milligramm beziehungsweise 150 Milligramm empfohlen. Höhere Mengen sollte man zur Sicherheit mit dem Arzt absprechen. Mengen bis 1.800 Milligramm pro Tag sind aber wahrscheinlich sicher. Auch die Einnahme von Vitamin E muss mit dem Arzt abgesprochen werden.
Bei Nierenschwäche sollten nicht mehr als 500 Milligramm Vitamin C pro Tag eingenommen werden, da die Gefahr für Harnsteine und Oxalat-Ablagerungen im Gewebe steigt. Menschen mit krankhafter Eisenüberladung (Hämochromatose) sollten Vitamin C nur unter ärztlicher Kontrolle einnehmen: Es steigert die Eisenaufnahme.
Bei einer schweren Verdauungsschwäche (Malabsorption) kann ein Vitamin-K-Mangel vorliegen. Die Blutungsgefahr steigt, sodass erst der Vitamin-K-Mangel ausgeglichen werden muss, bevor man Vitamin E einnimmt. Dabei sollten die Gerinnungswerte kontrolliert werden.
Vitamin C könnte die Wirkung von Krebsmedikamenten hemmen, wie die des Blutkrebs-Wirkstoffs Bortezomib (wie Velcade®) sowie von Doxorubicin (wie Adriblastin®, Ribodoxo®), Methotrexat (wie Bendatrexat®, Lantarel®) und Cisplatin (wie Cis-GRY®). Nehmen Sie Vitamin C deshalb bei Krebs nur nach Absprache mit dem Arzt ein.
Mineralstoffe stärken die antioxidative Abwehr
Wirkweise von Mineralstoffen
Schwermetalle verursachen nicht nur oxidativen Stress. Sie unterdrücken auch die Funktion von Mineralstoffen und beeinflussen den Mineralstoffhaushalt. Vor allem Zink und Selen stärken die antioxidative Abwehr. Sie sind wichtig für die Bildung von Eiweißen, welche Metalle abfangen (Metallothionein). Zudem verdrängt Zink Cadmium und Blei im Körper, da es seine Bindungsstellen besetzt. Selen kann mit Arsen, Quecksilber oder Blei Komplexe bilden, die so ausgeschieden werden.
Studien zeigen, dass eine niedrigere Zinkzufuhr oder ein Mangel die Schwermetallbelastung verstärkt und zu einer gesteigerten Aufnahme von Cadmium und Blei im Darm führt. Forscher vermuten, dass die Einnahme von Zink vor einer Cadmium- beziehungsweise Bleivergiftung schützt. Darauf deuten auch Übersichtsarbeiten bei einer Arsen- oder Quecksilberbelastung hin.
Selen könnte zur Arsen- und Quecksilberentgiftung geeignet sein. Bei Menschen erhöhte eine mit Selen angereicherte Mahlzeit in einer hochwertigen Studie die Arsenausscheidung über den Urin. Auch könnte Selen die Quecksilberausscheidung steigern. Laut einer großen Beobachtungsstudie gehen niedrige Selenwerte im Blut mit einem erhöhten Risiko einher, an Hautkrebs durch Arsen zu erkranken. Auch steht ein guter Selenstatus in Zusammenhang mit einer geringeren Schädigung der Nieren durch Schwermetalle.
Eine ausreichende Versorgung mit Magnesium und Calcium ist ebenfalls wichtig: In Tierversuchen halfen die Mineralstoffe beim Schutz vor Blei, Aluminium und Cadmium. Daneben senkte Silicium bei Tieren die Aufnahme von Aluminium. So hilft Silicium möglicherweise, eine Aluminium-Anreicherung im Gehirn einzudämmen.
Die Wirkung von Mineralstoffen bei einer Schwermetallbelastung ist in vielen Tierversuchen belegt. Weitere hochwertige Studien müssen die Wirkung künftig auch bei Menschen zeigen.
Dosierung und Einnahmeempfehlung von Mineralstoffen
Bei einer Schwermetallbelastung empfehlen Mikronährstoff-Experten 5 bis 15 Milligramm Zink sowie 70 bis 100 Mikrogramm Selen pro Tag. Für Magnesium ist eine tägliche Dosierung von 200 bis 400 Milligramm sinnvoll sowie für Calcium 400 bis 800 Milligramm. Speziell bei einer Aluminiumvergiftung könnten 100 bis 200 Milligramm Silicium helfen, die Aufnahme im Darm zu senken. Mineralstoffpräparate sollten für eine gute Aufnahme und Verträglichkeit zum Essen eingenommen werden.
Manchmal empfehlen Mikronährstoff-Experten während einer Ausleitungstherapie unter ärztlicher Kontrolle höhere Dosierungen – zum Beispiel 30 bis 60 Milligramm Zink und 100 bis 300 Mikrogramm Selen. Bei Entfernung von Amalgamfüllungen sollte Selen in jedem Fall eine Stunde vor dem Termin eingenommen werden, um zu verhindern, dass sich Quecksilber im Körper anreichert.
Wichtig: Nehmen Sie Komplexbildner wie DMSA, DMPS und Penicillamin nicht zeitgleich mit Mineralstoffen ein. Sie reagieren im Darm miteinander und verlieren dann ihre Wirkung. Halten Sie einen Einnahmeabstand ein.
Tipp
Selen als Natriumselenat: Da Vitamin C die Aufnahme von Selen (aus Natriumselenit) hemmt, sollte ein Einnahmeabstand von ein bis zwei Stunden zwischen Vitamin C und Selen liegen. Achten Sie bei Kombinationspräparaten auf Natriumselenat; für diese Verbindung wurde der hemmende Effekt nicht nachgewiesen.
Selen und Magnesium im Labor bestimmen lassen
Da Selen auf Dauer überdosiert werden kann, empfiehlt sich die Kontrolle der Blutwerte. Die Messung im Vollblut spiegelt die Langzeitversorgung wider. Normalwerte liegen zwischen 120 und 150 Mikrogramm pro Liter Selen im Vollblut.
Auch ab einer regelmäßigen Dosierung über 250 Milligramm Magnesium pro Tag empfiehlt es sich, die Werte im Blut zu kontrollieren. Magnesium wird im Vollblut gemessen, da es überwiegend in den roten Blutzellen vorliegt. Normal sind Spiegel von 1,38 bis 1,50 Millimol pro Liter.
Mineralstoffe: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sollten die empfohlenen Dosierungen nur in Rücksprache mit dem Frauenarzt eingenommen werden.
Calcium darf bei zu hohen Calciumwerten nicht ergänzt werden. Das kommt zum Beispiel vor bei einer Überfunktion der Nebenschilddrüse, Sarkoidose, Knochenmetastasen und Knochenmarkkrebs. Bei Pankreatitis sollte ein Arzt festlegen, ob und wie viel Calcium genommen werden kann.
Bei Nierenerkrankungen muss vorher mit dem Arzt besprochen werden, ob Mineralstoffe eingenommen werden dürfen. Geschwächte Nieren könnten sie nicht richtig ausscheiden; die Blutspiegel könnten zu stark steigen. Bei Blutwäsche (Dialyse) darf kein Silicium ergänzt werden. Eine Rücksprache gilt auch bei Nierensteinen und hoher Calciumausscheidung für Silicium und Calcium. Erhöhte Magnesiumwerte können zudem bei Nebenniereninsuffizienz (Morbus Addison) und Schilddrüsenunterfunktion vorkommen. Dann sollte Magnesium nicht ohne Laborkontrolle eingenommen werden.
Selen könnte das Risiko für Diabetes beeinflussen. Zu hohe und zu niedrige Blutwerte sind ungünstig. Ohne Blutkontrolle sollten Menschen mit Diabetes und hoher Diabetes-Gefahr kein Selen einnehmen. Daneben ist eine Rücksprache mit dem Arzt bei Krebs und einer Krebstherapie notwendig. Denn in den meisten Fällen sollte bei Krebs sowohl ein Mangel als auch eine Überversorgung vermieden werden.
Zink, Calcium und Magnesium vermindern die Wirkung von Antibiotika, etwa aus der Gruppe der Gyrasehemmer (Ciprobay®, Ciloxan®) und Tetracycline (Doxybene®, Doxycyclin®) sowie von Schilddrüsenhormonen (L-Thyroxin Aventis®, Berlthyrox®) und Osteoporose-Medikamenten, sogenannten Bisphosphonaten (Fosamax®, Bondronat®). Es empfiehlt sich ein Einnahmeabstand von mindestens zwei Stunden.
Blutdruck- und Entwässerungsmedikamente aus der Klasse der Thiaziddiuretika (wie Disalunil® oder Esidrix®) verringern die Ausscheidung von Calcium, ebenso das Psychopharmakon Lithium (Quilonum®, Hypnorex®). Die Einnahme von Calcium sollte daher mit dem Arzt besprochen werden.
B-Vitamine senken den Schwermetallgehalt im Körper
Wirkweise von B-Vitaminen
B-Vitamine helfen bei der Entgiftung und Ausscheidung von Schwermetallen:
- Vitamin B1 bildet vermutlich mit Blei Komplexe, die schnell ausgeschieden werden.
- Für Vitamin B6 gibt es Anhaltspunkte, dass es die Speicherung von Blei im Gewebe vermindert. Vermutlich bindet Vitamin B6 Blei, bevor es vom Körper aufgenommen wird.
- Folsäure könnte die Aluminiumanreicherung hemmen, insbesondere in den Knochen, den Nieren und im Gehirn.
- Vitamin B12 ist zusammen mit Folsäure für die Umwandlung (Methylierung) und Entgiftung von Arsen verantwortlich.
Schwermetalle verursachen Vitaminverluste: Beobachtungsstudien zeigen, dass eine Vergiftung mit Blei und Cadmium mit niedrigeren Vitamin-B12- und Folsäurewerten verbunden ist. In der Folge hatten die Menschen hohe Homocysteinwerte. Homocystein ist ein Stoffwechselprodukt, das in hohen Mengen als Zellgift gilt und ohne B-Vitamine nicht entgiftet werden kann. Außerdem wurde beobachtet, dass Blei einen Mangel an Vitamin B1 verursachen kann, was möglicherweise Nervenschädigungen verstärkt.
Die Einnahme von Folsäure verbesserte laut einer Übersichtsarbeit die Entgiftung und Ausscheidung von Arsen über den Urin. Vitamin B1 senkte zudem in einer ersten Studie erhöhte Bleiwerte.
Tipp
Kombination von B-Vitaminen und Antioxidantien: Die beiden Vitamingruppen lassen sich auch sinnvoll kombinieren. In einem Tierexperiment förderte die gemeinsame Einnahme von Vitamin B1 und Vitamin C die Ausscheidung von Blei über den Urin und reduzierte die Bleibelastung von Leber und Nieren sowie die Bleischäden.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Um den Bleigehalt im Blut zu senken, wurden in einer ersten Studie 75 Milligramm Vitamin B1 eingesetzt. Vitamin B6 könnte in einer Dosierung von 50 Milligramm pro Tag hilfreich sein. Da es sich dabei um hohe Mengen handelt, muss ein Arzt oder Mikronährstoff-Experte die Therapie kontrollieren. Folsäure war in einer Dosierung von 400 Mikrogramm wirksam.
Meist empfehlen Mikronährstoff-Experten ein Kombinationspräparat, das alle B-Vitamine enthält und den täglichen Bedarf deckt. B-Vitamine arbeiten im Stoffwechsel zusammen. Ein entsprechendes Präparat ist daher oft niedriger dosiert. B-Vitamine nimmt man am besten zum Essen ein.
B-Vitamine: im Labor bestimmen
Hohe Homocysteinwerte können ein Anzeichen dafür sein, dass die Schwermetalle die Reserven an B-Vitaminen aufbrauchen. Der Spiegel an Homocystein gibt somit indirekt die Versorgung mit B-Vitaminen an. Normalwerte liegen zwischen 5 und 9 Mikromol pro Liter Blutplasma.
Vitamin B6 und Folsäure: zu beachten in der Schwangerschaft und Stillzeit sowie bei Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sollte hoch dosiertes Vitamin B6 nur bei einem nachgewiesenen Mangel und nach Absprache mit dem Frauenarzt eingenommen werden.
Vitamin B6 kann ab einer Dosis von 5 Milligramm die Wirkung von Medikamenten gegen Parkinson und Epilepsie abschwächen. Deshalb sollte es nicht hoch dosiert mit diesen Medikamenten eingenommen werden. Dazu zählen beispielsweise Phenobarbital (Luminal®) und Phenytoin (Phenhydan®, Zentropil®) oder der Wirkstoff L-Dopa (Madopar®, Stalevo®).
Gegen Infektionskrankheiten werden Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®) eingesetzt. Folsäure vermindert die Wirkung dieser Medikamente.
Spirulina und Chlorella eliminieren Schwermetalle
Wirkweise von Spirulina und Chlorella
Die Algen Spirulina und Chlorella können Schwermetalle binden. Laborversuche bestätigen, dass die Zellwände der Spirulina-Alge Cadmium, Nickel und Chrom aufnehmen. Chlorella kann laut Laborversuchen dagegen Blei und Cadmium entfernen. Verantwortlich dafür sind die Zellwände oder das Chlorophyll: Beide binden die Schwermetalle.
Expertenwissen
Forscher gehen davon aus, dass Chlorella vor allem die Schwermetallbelastung im Darm senkt. Die gleichzeitige Einnahme von Chlorella und Cadmium führte bei Tieren dazu, dass ihr Körper weniger Cadmium aufnahm. Wurde die Cadmiumzufuhr gestoppt, hatte die Chlorella-Gabe jedoch keinen Nutzen.
Laut Tierversuchen könnte Chlorella vor einer Bleivergiftung schützen. Auch zur Wirkung von Spirulina gegen Schwermetalle wie Arsen, Cadmium, Quecksilber und Blei gibt es Labor- und Tierversuche. Erste Studien an Menschen belegen bereits einen Nutzen bei der Ausleitung von Arsen: In einer kleinen hochwertigen Studie führte die Einnahme von 250 Milligramm Spirulina-Extrakt plus 2 Milligramm Zink zu einer vermehrten Ausscheidung von Arsen über den Urin. Außerdem reduzierte die Spirulina-Zink-Kombination den Arsengehalt im Haar um etwa die Hälfte.
Darüber hinaus wirken beide Algen antioxidativ: Bei Rauchern senkte Chlorella-Extrakt oxidative Schäden und verbesserte den antioxidativen Status. Tierversuche belegen außerdem, dass Spirulina durch Blei, Quecksilber und Arsen ausgelöste oxidative Schäden verringert.
Wie gut Chlorella und Spirulina die Ausleitung von anderen Schwermetallen fördern und die Folgen dämpfen, müssen weitere hochwertige Studien zeigen.
Dosierung und Einnahmeempfehlung von Spirulina und Chlorella
Zur Entgiftung von Schwermetallen werden täglich 250 bis 400 Milligramm Chlorella- oder Spirulina-Extrakt empfohlen. Alternativ können 2.000 bis 4.000 Milligramm der getrockneten Algen als Pulver eingenommen werden. Sinnvoll ist die Einnahme zur Mahlzeit. Dazu sollten Sie ausreichend trinken.
Info
Eine Einnahme von 2.000 Milligramm Spirulina-Pulver für drei Monate verringerte die Eisenwerte im Blut. Daher sollte der Arzt bei dauerhafter Einnahme eine Überwachung der Eisen-Parameter durchführen.
Auf die Qualität kommt es an! Spirulina und Chlorella binden nicht nur Schwermetalle und Umweltgifte im Körper, sondern auch im Gewässer. Achten Sie deshalb auf Präparate aus kontrollierter Produktion (zum Beispiel biologischem Anbau) und kaufen Sie nur von Herstellern, die ihre Algen auf Umweltgifte und Verunreinigungen untersuchen.
Spirulina und Chlorella: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sollte eine Einnahme von Spirulina und Chlorella mit dem Arzt abgesprochen werden. Bisher gibt es keine Anzeichen für negative Auswirkungen, die Daten reichen jedoch nicht aus, um die Sicherheit abschließend zu bewerten.
Wenn bei Nierenerkrankungen die tägliche Eiweißmenge vom Arzt begrenzt wurde, sollte der Eiweißgehalt von Spirulina und Chlorella berücksichtigt werden. Da die Algen viele Eiweiße und damit Aminosäuren enthalten, wird Personen mit Phenylketonurie von einer Ergänzung abgeraten. Dies ist eine Störung des Aminosäurestoffwechsels (Phenylalanin). Spirulina ist zudem purinreich. Gichtpatienten müssen auf Purine achten. Getrocknete Spirulina enthält pro 1.000 Milligramm 40 bis 60 Milligramm Purin.
Bei Autoimmunerkrankungen, Muskel- oder Leberschäden wird eine Ergänzung nicht oder nur in Rücksprache mit dem Arzt empfohlen. Es ist noch nicht klar, welchen Einfluss Spirulina hat.
Chlorella enthält viel Vitamin K. Vitamin K hemmt die Wirkung bestimmter Blutgerinnungshemmer (Vitamin-K-Antagonisten). Dazu gehören Phenprocoumon (zum Beispiel Marcumar® und Marcuphen®) und Warfarin (wie Coumadin®). Daher sollte die kombinierte Einnahme mit einem Arzt abgesprochen werden. Zwar ist dies grundsätzlich möglich, es kann jedoch sein, dass die Medikamentendosis angepasst werden muss.
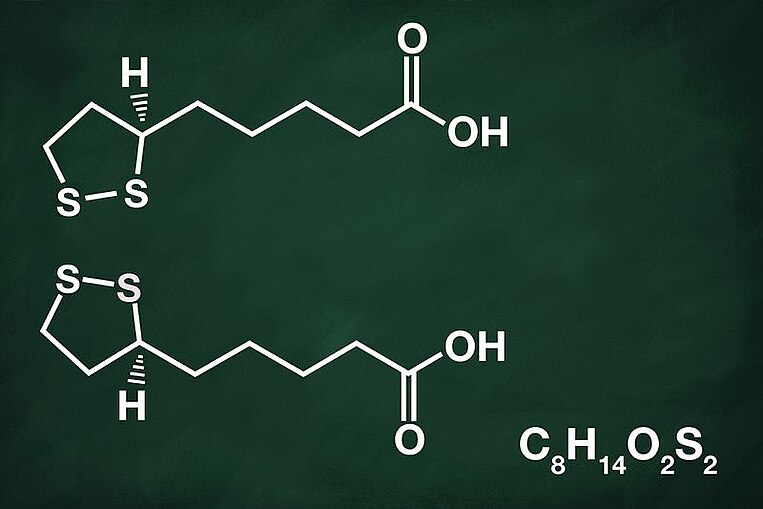
Alpha-Liponsäure bindet Schwermetalle
Wirkweise von Alpha-Liponsäure
Alpha-Liponsäure kann schädliche Schwermetalle binden. Diese können dann in gebundener und unschädlicher Form aus dem Körper ausgeschieden werden. Aus Tier- und Laborversuchen ist bekannt, dass Alpha-Liponsäure mit folgenden Schwermetallen Komplexe eingeht: Cadmium, Blei, Quecksilber, Mangan, Zink, Cobalt, Kupfer, Platin und Eisen.
Zudem schützt Alpha-Liponsäure durch ihre antioxidativen Eigenschaften vor oxidativem Stress, der durch Schwermetalle verursacht wird. Auch steigert sie die Konzentration anderer Antioxidantien wie Glutathion und kann Coenzym Q10, Vitamin E und C regenerieren. Das könnte insgesamt die negativen Folgen einer Schwermetallvergiftung verringern.
In Tierversuchen reduzierte Alpha-Liponsäure eine Beeinträchtigung der Blutbildung, Nerven- sowie Durchblutungsstörungen, eine Immunschwächung und Unfruchtbarkeit durch Cadmium oder Blei. Auch verminderte Alpha-Liponsäure in weiteren Tierstudien oxidative Schäden im Gehirn und Nervengewebe. Sie kann als eine der wenigen Antioxidantien die Blut-Hirn-Schranke passieren. Somit wirkt Alpha-Liponsäure wahrscheinlich den Schäden von Schwermetallen wie Quecksilber und Blei im Gehirn entgegen. Hochwertige Studien müssen allerdings noch zeigen, wie gut Alpha-Liponsäure auch Menschen bei Schwermetallbelastungen helfen kann.
Dosierung und Einnahmeempfehlung von Alpha-Liponsäure
Mikronährstoff-Experten verwenden zur Entgiftung von Schwermetallen vier Wochen lang 600 bis 1.200 Milligramm Alpha-Liponsäure täglich. Häufig geben sie Alpha-Liponsäure am Anfang statt der oralen Einnahme auch als Infusion direkt in die Vene (zwei Infusionen pro Woche mit 600 Milligramm Alpha-Liponsäure für zwei Wochen).
Die Ausleitung von Schwermetallen sollte immer von einem Arzt begleitet werden. Alpha-Liponsäure könnte gespeicherte Schwermetalle mobilisieren, die sich dann im Körper neu verteilen. Der Arzt kann die Therapie deshalb mit weiteren Komplexbildnern wie DSMA unterstützen.
Alpha-Liponsäure sollte auf nüchternen Magen eingenommen werden – zum Beispiel eine Stunde vor dem Essen. Mineralstoffe aus der Nahrung hemmen die Aufnahme im Darm.
Info
Alpha-Liponsäure kann aufgrund der komplexbildenden Eigenschaften theoretisch Mineralstoffe im Körper binden. Allerdings gibt es dazu bisher nur Tierversuche. Bei Menschen wurde nur eine Senkung des Eisens im Blut durch Alpha-Liponsäure nachgewiesen. Dabei wurden zwölf Wochen lang 600 Milligramm Alpha-Liponsäure gegeben. Bei längerer Einnahme sollte man deshalb die Eisenwerte prüfen lassen.
Zudem ist bei Einnahme über einen langen Zeitraum die Ergänzung von Biotin wichtig: Alpha-Liponsäure hemmt die Wirkung von Biotin. Gute Präparate enthalten bereits Biotin.
Alpha-Liponsäure: zu beachten in der Schwangerschaft und Stillzeit sowie bei Medikamenteneinnahme
Schwangere und Stillende sollten Alpha-Liponsäure nur nach Rücksprache mit einem Arzt einnehmen. Erste Untersuchungen zeigen jedoch, dass die Einnahme von 600 Milligramm Alpha-Liponsäure pro Tag keine negativen Auswirkungen auf Mutter und Kind hatte.
Personen, die Schilddrüsenhormone (wie L-Thyroxin Winthrop®, L-Thyroxin beta®) einnehmen, sollten die Einnahme von Alpha-Liponsäure mit dem Arzt absprechen. Die Wirkung des Medikaments könnte gebremst werden.
Auch eine Krebstherapie mit Cisplatin könnte durch Alpha-Liponsäure beeinträchtigt werden. Gleichzeitig liegen aber auch Hinweise vor, dass Alpha-Liponsäure einige schädigende Nebenwirkungen des Wirkstoffs für die Ohren verringert. In jedem Fall sollte Alpha-Liponsäure bei Krebs nur in Rücksprache mit dem Arzt eingenommen werden.
Alpha-Liponsäure kann die blutzuckersenkende Wirkung von Insulin und anderen Diabetes-Medikamenten (Antidiabetika) verstärken und so eine Unterzuckerung begünstigen. Daher ist am Anfang der Therapie eine engmaschige Blutzuckermessung sinnvoll. Zu den Medikamentenwirkstoffen gehören zum Beispiel Glibenclamid (wie Euglucon® und Maninil®), Glimepirid (wie Amaryl® und Glimmegama®) und Metformin (wie Competact® und Diabesin®).
N-Acetylcystein: Schwefel bindet Schwermetalle
Wirkweise von N-Acetylcystein
Durch die enthaltenen Schwefelgruppen ist N-Acetylcystein in der Lage, Schwermetalle zu binden. Deshalb ist der Einsatz bei Schwermetallvergiftungen sinnvoll. Bei Tieren verringerte N-Acetylcystein die Bleimenge im Blut und Gehirn sowie durch Blei verursachte Schäden. Auch wirkte es gegen durch Arsen ausgelöste Leberschäden bei Ratten.
Tierversuche und einige Vorstudien mit Menschen zeigen, dass N-Acetylcystein Metalle bindet. So konnten bei Menschen Quecksilber, Blei, Gold und Arsen entfernt werden. In einer hochwertigen Studie wiesen Blei-Arbeiter nach der dreimonatigen Einnahme von N-Acetylcystein einen deutlich niedrigeren Bleigehalt im Blut auf als die Kontrollgruppe ohne Behandlung. N-Acetylcystein könnte eine zusätzliche Therapieoption bei Bleivergiftungen sein, das schlussfolgerten die Wissenschaftler.
Bei Personen mit regelmäßigem Bleikontakt konnte N-Acetylcystein im Vergleich zur Kontrollgruppe zudem die antioxidative Abwehr verbessern. Dies zeigt eine erste Studie. Aus N-Acetylcystein stellt der Körper Glutathion her, das oxidativen Stress reduziert.
Dosierung und Einnahmeempfehlung von N-Acetylcystein
Mikronährstoff-Experten empfehlen, bei Schwermetallvergiftungen täglich 200 bis 800 Milligramm N-Acetylcystein einzunehmen – möglichst in mehreren kleinen Dosen über den Tag verteilt. N-Acetylcystein sollte dabei nach den Mahlzeiten eingenommen werden.
N-Acetylcystein: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Für die Einnahme von N-Acetylcystein in der Schwangerschaft oder Stillzeit gibt es keine ausreichenden Studien. Über die Anwendung sollte daher ein Frauenarzt entscheiden.
Bei folgenden Krankheiten sollten Sie die Einnahme von N-Acetylcystein mit Ihrem Arzt besprechen:
- Verengungen der Atemwege und bei gestörter Atemfunktion wie Asthma, da es zu einem Krampf der Bronchien kommen kann
- Neigung zu Magen-Darm-Blutungen (zum Beispiel bei Speiseröhren- oder Magengeschwür)
- Histaminunverträglichkeit: N-Acetylcystein kann den Histaminabbau hemmen.
- schwacher Leberfunktion: NAC wird langsamer abgebaut.
Da N-Acetylcystein schleimlösend wirkt, sollte es nicht gleichzeitig mit Arzneimitteln eingenommen werden, die den Hustenreflex einschränken (Antitussiva): Es besteht die Gefahr, dass die Sekrete nicht ausgehustet werden. Dazu gehören Hustenstiller wie Codein (Codicaps®), Noscapin (Capval®) und Dextromethorphan (Dextro Bolder®, Silomat®).
Die gleichzeitige Gabe von N-Acetylcystein und des gefäßerweiternden Wirkstoffs Nitroglycerin (Corangin®, Nitrangin®) kann zudem zu einem niedrigen Blutdruck führen. Kombinieren Sie die Präparate daher nur nach Rücksprache mit Ihrem Arzt.
Falls Sie Antibiotika nehmen müssen, sollte die Einnahme zu N-Acetylcystein mindestens in einem zweistündigen Abstand erfolgen. Die zeitgleiche Einnahme kann die Wirkung verringern. Betroffen sind zum Beispiel Tetracyclin (Tetracyclin Wolff®), Streptomycin (Strepto-Fatol®) oder Penicillin (Penicillin Sandoz®).
Glutathion unterstützt die natürliche Radikalabwehr
Wirkweise von Glutathion
Glutathion ist eines der wichtigsten Entgiftungsmoleküle und sorgt für einen wirksamen Zellschutz. Auch bei der Entgiftung von Schwermetallen spielt es eine wichtige Rolle, insbesondere bei Belastungen mit Quecksilber oder Cadmium. Die beiden Schwermetalle bilden hochgiftige Radikale in Körperzellen. Für deren Entgiftung wird Glutathion verbraucht, wodurch sich die Speicher leeren. Ein Mangel kann zu Nervenschäden führen. Durch die Einnahme von Glutathion lässt sich der Glutathionspiegel im Blut steigern. Dies zeigt eine erste hochwertige Studie mit 54 Probanden.
Erste Studien belegen, dass Glutathion zudem Quecksilber bindet und seine Ausscheidung fördert: Die Gabe von Glutathion als Infusion über die Venen (zusammen mit Vitamin C sowie den Komplexbildnern DMPS und DMSA) senkte den Gehalt von Quecksilber im Urin um circa 70 Prozent.
Dosierung und Einnahmeempfehlung von Glutathion
Mikronährstoff-Experten empfehlen auf Basis ihrer Anwendungserfahrung eine Infusion mit 600 Milligramm Glutathion in die Vene. Diese sollte zwei- bis dreimal wöchentlich für insgesamt sechs Wochen durchgeführt werden.
Sinnvoll kann auch die Einnahme von Kapseln sein: So kann Glutathion ebenfalls die Zellen schützen. Bei Präparaten zum Einnehmen liegt die tägliche Dosierung meist zwischen 100 und 300 Milligramm. Wahlweise können auch die einzelnen Bausteine ergänzt werden wie Glutamin, Cystein und Glycin.
Quercetin und Rutin wirken antioxidativ und bilden Schwermetallkomplexe
Wirkweise von Quercetin und Rutin
Der Pflanzenstoff Quercetin kann freie Radikale unschädlich machen und Schwermetalle binden. Dadurch stärkt er die antioxidative Abwehr und schützt vor oxidativem Stress und Entzündungen durch Schwermetallbelastung. Rutin ist Quercetin sehr ähnlich: Im Darm wird Rutin von den Darmbakterien abgebaut. Dabei entsteht Quercetin.
Bei Mäusen verstärkte Quercetin die Behandlung einer Arsenbelastung: Die gemeinsame Gabe mit dem Komplexbildner Monoisoamyl-DMSA war wirksamer als die alleinige Ergänzung. Quercetin schützte Tiere zudem vor Nierenschäden durch Cadmium. Gleiches gilt für Rutin, wenn es mit Selen kombiniert wurde. Eine Wirkung auf die Leberschädigung durch Nickel wird ebenfalls angenommen. Darüber hinaus neutralisierte Rutin die schädlichen Wirkungen von Silber auf das Nervensystem.
Beim Menschen untersuchten Forscher in einer ersten hochwertigen Studie Quercetin bei einer Eisenüberladung. Normalerweise ist Eisen ein wichtiger Mineralstoff. Reichert er sich jedoch an, schädigt er ebenfalls Zellen. Nach zwölf Wochen wurden niedrigere Eisenwerte durch Quercetin festgestellt. Weitere Studien mit Menschen müssen folgen, um die Wirkung bei anderen Schwermetallen zu untersuchen.
Info
Es gibt im Übrigen sehr viele theoretische Untersuchungen, die zeigen, dass viele Pflanzenextrakte vor Schäden durch Schwermetalle schützen. Neben der quercetinreichen Zwiebel sind es zum Beispiel Inhaltsstoffe aus Knoblauch, Trauben und Tomaten. Besonders wichtig sind die Polyphenole aus Ingwer, Grüntee, Beerenfrüchten, Oliven und Rosmarin.
Dosierung und Einnahmeempfehlung von Quercetin und Rutin
Mikronährstoff-Experten empfehlen bei einer Schwermetallbelastung eine Ernährung, die reich ist an Antioxidantien. Dazu zählen neben Vitaminen und Mineralstoffen auch Pflanzenstoffe wie Quercetin und Rutin.
Bisher sind keine verlässlichen Studien verfügbar, um eine Aussage über die Dosierung von Quercetin und Rutin bei Schwermetallvergiftungen zu treffen. Erste Studien liefern aber Hinweise, dass niedrige Dosierungen sinnvoll sein können (zum Beispiel 300 Milligramm Quercetin und Rutin als kombinierte Gabe). Eine langfristige hohe Dosierung sollte allerdings vermieden werden: Es gibt Hinweise aus Tierstudien, dass sie bei Schwermetallbelastung zellschädigend (prooxidativ) wirken könnten.
Quercetin und Rutin sollten zu den Mahlzeiten eingenommen werden.
Quercetin und Rutin: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Schwangere und Stillende sollten auf eine Einnahme von Quercetin verzichten. Es fehlen Untersuchungen zur Unbedenklichkeit. Die Einnahme von Rutin sollte mit dem Arzt abgesprochen werden.
Quercetin blockiert ein Enzym (CYP3A4), das Medikamente abbaut. Dadurch wird auch ihre Wirkung beeinflusst. Wenn Sie Medikamente einnehmen, sprechen Sie mit Ihrem Arzt oder Apotheker. Es sollte zum Beispiel nicht eingenommen werden mit Benzodiazepinen (wie Faustan®, Valocordin® oder Diazepam®), Calciumkanalblockern (Norvasc®, Amlovasc®), Immunsuppressiva (Azafalk®, Azaimun®), Statinen (Zocor®, SimvaHEXAL®) sowie Antibiotika zum Beispiel aus der Wirkstoffgruppe der Gyrasehemmer (wie Ciloxan®, Norfluxx® oder Supracyclin®) oder Makrolidantibiotika (wie Claromycin®, Biaxin®). Denkbar ist auch eine verstärkende Wirkung von Blutgerinnungshemmern (zum Beispiel Marcumar®).
Da Quercetin und Rutin antioxidativ wirken, könnten sie in hoher Dosierung die Wirkung von Krebsmedikamenten beeinflussen. Sprechen Sie eine Einnahme daher mit dem Arzt ab.
Bei eingeschränkter Nierenfunktion sollten Quercetin oder Rutin nicht eingenommen werden. Kranke Nieren könnten die Stoffe nicht richtig ausscheiden. Auch bei Lebererkrankungen oder Wassereinlagerungen infolge von Herzerkrankungen ist die Einnahme von Rutin nicht geeignet.
Zeolith und Bentonit fördern die Ausscheidung von Schwermetallen
Wirkweise von Zeolith und Bentonit
Zeolith ist ein Mineral, das aus Vulkangestein gewonnen wird. Es bindet nachweislich Schwermetalle wie Quecksilber, Blei oder Cadmium. Die in der Medizin am häufigsten eingesetzte Form ist Klinoptilolith. Bentonit ist eine Mischung aus verschiedenen Tonmineralen. Es ist sehr quellfähig und bindet wie Zeolith Schwermetalle. Häufig wird es in der Form von Montmorillonit verwendet. Diese Minerale gelangen nicht ins Blut, sondern werden zusammen mit den im Darm gebundenen Schwermetallen über den Stuhl wieder ausgeschieden.
Eine erste hochwertige Studie zeigt bei Menschen, dass Zeolith-Klinoptilolith die Bleiaufnahme verringerte, wodurch die Bleispiegel im Blut und Urin abnahmen. Weitere hochwertige Studien sind nun notwendig, um das Wirkungspotenzial von Klinoptilolith-Zeolith und Montmorillonit-Bentonit bei einer Bleivergiftung und anderen Schwermetallbelastungen zu belegen.
Dosierung und Einnahmeempfehlung von Zeolith und Bentonit
Meist wird eine Mischung aus 500 bis 1.000 Milligramm Klinoptilolith-Zeolith und 500 bis 1.000 Milligramm Montmorillonit-Bentonit eingesetzt – als Kur für ein bis zwei Monate. Diese Mineralien sind besonders sinnvoll, wenn die Schwermetallbelastung über die Nahrung reduziert werden soll. Kapseln oder Pulver werden über den Tag verteilt zur Mahlzeit eingenommen.
Selten können Verstopfungen auftreten. Um ihnen vorzubeugen, sollten Sie ausreichend trinken (2 bis 3 Liter pro Tag) – idealerweise Wasser. Meiden Sie alkoholische, koffeinhaltige und säurehaltige Getränke wie Grapefruit-, Orangen-, Zitronen- oder Ananassaft.
Tipp
Achten Sie auf die Reinheit der Produkte. Vulkanmineralien können natürlicherweise selbst verschiedene Schwermetalle enthalten, da sie sie auch in der Natur binden. Kaufen Sie deshalb nur bei Herstellern, die ihre Produkte auf Umweltgifte und Verunreinigungen untersuchen.
Zeolith und Bentonit: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Von einer Anwendung von Zeolith und Bentonit bei schwangeren und stillenden Frauen sowie bei Kindern wird abgeraten. Es liegen nicht genug Daten zur Sicherheit vor.
Bentonit und Zeolith enthalten Silicium und Aluminium, die in geringen Mengen freigesetzt werden. Der Körper muss sie über die Nieren ausscheiden. Um die Nieren nicht weiter zu belasten, sollten Personen mit Nierenproblemen eine Einnahme mit ihrem Arzt absprechen. Bei einer Blutwäsche (Dialyse) wird von der Einnahme abgeraten. Auch bei Nierensteinen sind Zeolith und Bentonit möglicherweise ungeeignet, da Silicium die Steinbildung begünstigen könnte.
Bentonit sollte vorerst nicht bei viralen/bakteriellen Magen-Darm-Erkrankungen (Gastroenteritis) eingesetzt werden. Bentonit bindet vermutlich Viren; er könnte aber auch dazu beitragen, dass Viren infektiöser werden. Daneben könnte Bentonit bewirken, dass Gene zwischen Bakterienarten leichter weitergegeben werden und Resistenzen gegen Antibiotika weiterverbreitet werden.
Zeolith und Bentonit sollten nicht gleichzeitig mit Medikamenten eingenommen werden. Halten Sie einen Einnahmeabstand von mindestens zwei Stunden ein. Eine bindende Wirkung wurde zum Beispiel für die Schilddrüsenhormone Thyroxin (wie L-Thyroxin® und Berlthyrox®) und Triiodthyronin (wie Thybon® und Novothyral®) nachgewiesen.
Probiotika stärken eine geschädigte Darmbarriere
Wirkweise von Probiotika
Schwermetalle stören die Bakterienzusammensetzung im Darm (Darmflora). Eine gesunde Darmflora könnte jedoch helfen, die Folgen einer Schwermetallvergiftung abzuschwächen: Nützliche Darmbakterien (probiotische Bakterien) binden und entgiften Schwermetalle, um sich selbst zu schützen. Dadurch könnten die Bakterien verhindern, dass neue Schwermetalle ins Blut gelangen, denn sie werden zusammen mit den Schwermetallen ausgeschieden.
In einer Vorstudie verhinderte ein mit dem Bakterium Lactobacillus rhamnosus angereicherter Joghurt, dass die Schwermetallgehalte im Blut weiter anstiegen. Untersucht wurden Frauen und Kinder, die zuvor stark belastet waren. Gesundheitsförderliche Bakterien standen in einer Vorstudie außerdem mit einer höheren antioxidativen Kapazität in Zusammenhang. Das könnte bedeuten, dass sie oxidative Schäden durch Schwermetallbelastungen besser abfangen.
Weitere und hochwertige Studien müssen folgen, um den Effekt nützlicher Darmbakterien zu bestätigen. Probiotika sind jedoch eine vielversprechende Möglichkeit, um die Ausleitung von Schwermetallen zu begleiten und die Darmflora zu stärken.
Dosierung und Einnahmeempfehlung von Probiotika
Zur Stärkung der Darmflora empfehlen Mikronährstoff-Experten täglich 1 bis 20 Milliarden (1 bis 20 x 109) gesundheitsförderliche Bakterien (koloniebildende Einheiten (KBE)). Dazu gehören insbesondere Bifidobakterien und Laktobazillen. Das Präparat sollte eine breite Mischung verschiedener Bakterien enthalten. So ist die Überlebenswahrscheinlichkeit im Darm am größten.
Die Einnahme von Probiotika ist als Kur möglich. Setzt man sie jedoch ab, werden sie nach etwa 14 Tagen wieder ausgeschieden. Für einen langfristigen Effekt sollten Probiotika dauerhaft eingenommen werden.
Tipp
Es empfiehlt sich, Probiotika mit Ballaststoffen zu kombinieren. Ballaststoffe dienen den Bakterien als Nahrung und regulieren so ebenfalls die Darmflora. Darüber hinaus regen sie die Darmtätigkeit an, sodass die Schwermetalle im Stuhl schneller ausgeschieden werden. Es gibt spezielle Kombinationspräparate auf dem Markt – zum Beispiel mit resistenten Dextrinen oder resistenter Stärke.
Probiotika: zu beachten bei Erkrankungen sowie Medikamenteneinnahme
Einige probiotische Bakterien bilden Histamin. Sie könnten bei einer Histaminintoleranz Beschwerden hervorrufen. Dazu zählen wahrscheinlich: Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis und Enterococcus faecium.
Sehr geschwächte Personen oder Personen mit unterdrücktem Immunsystem sollten nur in Rücksprache mit dem Arzt Probiotika einnehmen. Patienten mit zentralen Venenzugängen (zum Beispiel bei Chemotherapie), Herzklappenerkrankungen und Kurzdarmsyndrom sollten keine Probiotika bekommen.
Probiotika sollten mit einem Abstand von mindestens zwei Stunden zu Antibiotika eingenommen werden. Ansonsten tötet das Antibiotikum die probiotischen Bakterien ab.
Dosierungen auf einen Blick
Empfehlung pro Tag bei Schwermetallbelastungen | |
|---|---|
Vitamine | |
Vitamin C | 500 bis 1.000 Milligramm (mg) |
Vitamin E | 270 Milligramm |
Vitamin B1 | 75 Milligramm |
Vitamin B6 | 50 Milligramm |
| Folsäure | 400 Mikrogramm (µg) |
Mineralstoffe | |
Zink | 5 bis 15 Milligramm |
Selen | 70 bis 100 Mikrogramm |
Magnesium | 200 bis 400 Milligramm |
Calcium | 400 bis 800 Milligramm |
Silicium | 100 bis 200 Milligramm |
Pflanzenstoffe | |
Chlorella oder Spirulina | jeweils 2.000 bis 4.000 Milligramm Pulver oder 250 bis 400 Milligramm Extrakt |
Quercetin und Rutin | beide zusammen bis zu 300 Milligramm |
Sonstige | |
Alpha-Liponsäure | 600 bis 1.200 Milligramm |
N-Acetylcystein | 200 bis 800 Milligramm |
Glutathion | 100 bis 300 Milligramm |
Klinoptilolith-Zeolith und Montmorillonit-Bentonit | je 500 bis 1.000 Milligramm |
Probiotika | 1 bis 20 Milliarden (1 bis 20 x 109) koloniebildende Einheiten (KBE) |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei Schwermetallbelastungen | |
|---|---|
Normalwerte | |
Gesamt-Antioxidantienstatus (Serum) | 1,13 bis 1,57 Millimol pro Liter (mmol/l) oder je nach Labor |
Selen (Vollblut) | 120 bis 150 Mikrogramm pro Liter (µg/l) |
Magnesium (Vollblut) | 1,38 bis 1,50 Millimol pro Liter |
Homocystein (Plasma) | unter 10 Mikromol pro Liter (µmol/l) |
Zusammenfassung
Schwermetalle können durch die Bildung freier Radikale Zellen oder das Erbgut angreifen. Auf diese Weise tragen sie zur Entstehung anderer Krankheiten wie Nerven- und Krebserkrankungen bei. Die Mikronährstoffmedizin fördert mit Vitaminen, Mineralstoffen, Aminosäuren oder Pflanzenstoffen die Entgiftung und die Ausscheidung von Schwermetallen und schützt vor deren Folgen.
Vitamin C und E verhindern Schäden an Zellstrukturen oder der Erbinformation (DNA), die durch Schwermetalle wie Blei oder Cadmium verursacht werden. Auch Zink, Selen, Calcium und Magnesium wehren Schadwirkungen von verschiedenen Schwermetallen ab, indem sie unter anderem das antioxidative Abwehrsystem stärken und Schwermetalle verdrängen. Silicium verringert vermutlich insbesondere die Aluminiumaufnahme. Eine schützende Funktion könnten auch Alpha-Liponsäure, N-Acetylcystein, Glutathion, Quercetin sowie Rutin haben.
Daneben sind die Algen Spirulina und Chlorella, das Vulkangestein Zeolith und das Tonmineral Bentonit sowie Probiotika wahrscheinlich in der Lage, Schwermetalle zu binden. Sie fördern vermutlich die Ausleitung oder verhindern, dass neue Schwermetalle in das Blut gelangen. Auch die Vitamine B1, B6 und Folsäure sind für die Ausleitung von Schwermetallen wichtig.
Verzeichnis der Studien und Quellen
Almenara, C.C.P. et al. (2020): The Role of Antioxidants in the Prevention of Cadmium-Induced Endothelial Dysfunction. Curr Pharm Des. 2020;26(30):3667-3675. https://pubmed.ncbi.nlm.nih.gov/32294029/, abgerufen am 20.09.2022.
Aaseth, J. et al. (2021): The Aging Kidney-As Influenced by Heavy Metal Exposure and Selenium Supplementation. Biomolecules. 2021 Jul 22;11(8):1078. https://pubmed.ncbi.nlm.nih.gov/34439746/, abgerufen am 20.09.2022.
Abarikwu, S.O. et al. (2016): Selenium and rutin alone or in combination do not have stronger protective effects than their separate effects against cadmium-induced renal damage. Pharm Biol 2016;54(5):896-904, https://www.ncbi.nlm.nih.gov/pubmed/26455473, abgerufen am 19.09.2018.
Abdrabou, M.I. et al. (2019): Ameliorative effects of Spirulina maxima and Allium sativum on lead acetate-induced testicular injury in male albino rats with respect to caspase-3 gene expression. Acta Histochem. 2019 Feb;121(2):198-206. https://pubmed.ncbi.nlm.nih.gov/30587387/, abgerufen am 20.09.2022.
Abuawad, A. et al. (2021): Nutrition, one-carbon metabolism and arsenic methylation. Toxicology. 2021 Jun 15;457:152803. https://pubmed.ncbi.nlm.nih.gov/33905762/, abgerufen am 20.09.2022.
Agency for Toxic Substances and Disease Registry (2010): Arsenic Toxicity How Should Patients Overexposed to Arsenic Be Treated and Managed?, https://www.atsdr.cdc.gov/csem/csem.asp?csem=1&po=13 und www.atsdr.cdc.gov/csem/arsenic/docs/arsenic.pdf, abgerufen am 19.09.2018.
Albtoosh, A. et al. (2022): Potential Protective Effect of Spirulina Platensis on Sodium Arsenite Induced Cardiotoxicity in Male Rats. Tissue Barriers. 2022 Apr 3;10(2):1983330. https://pubmed.ncbi.nlm.nih.gov/34615441/, abgerufen am 20.09.2022.
Al-Homaidan, A. A. et al. (2015): Adsorptive removal of cadmium ions by Spirulina platensis dry biomass. Saudi J Biol Sci, 2015 Nov;22(6):795–800.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4625374/, abgerufen am 19.09.2018.
American College of Medical Toxicology (Hrsg.) (2010): American College of Medical Toxicology Position Statement on Post-Chelator Challenge Urinary Metal Testing. https://www.acmt.net/wp-content/uploads/2022/06/PRS_090601_Post-Chelator-Challenge-Urinary-Metal-Testing.pdf, abgerufen am 20.09.2022.
Andres, S. et al. (2018): Safety Aspects of the Use of Quercetin as a Dietary Supplement. Mol Nutr Food Res 2018;62(1):10.1002/mnfr.201700447. https://pubmed.ncbi.nlm.nih.gov/29127724/, abgerufen am 01.02.2023.
Argos, M. et al. (2010): Dietary B vitamin intakes and urinary total arsenic concentration in the Health Effects of Arsenic Longitudinal Study (HEALS) cohort, Bangladesh. Eur J Nutr. 2010 Dec;49(8):473–81. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3904864/, abgerufen am 20.09.2022.
Arndt, T. (2012): Problematik, Klinik und Beispiele der Spurenelementvergiftung – Cadmium. Toxichem Krimtech 2012;79(3):127. https://www.gtfch.org/cms/images/stories/media/tk/tk79_3/Arndt1.pdf, abgerufen am 20.09.2022.
Arun, K. B. et al. (2021): Probiotics and gut microbiome − Prospects and challenges in remediating heavy metal toxicity. Journal of Hazardous Materials 2021. 420:126676. https://www.sciencedirect.com/science/article/abs/pii/S0304389421016411?via%3Dihub, abgerufen am: 01.02.2023.
Ayuob, N.N. (2013): Can vitamin E and selenium alleviate the immunologic impact of aluminium on pregnant rats' spleens? Cell Immunol. 2013 Jul-Aug;284(1-2):104-10. https://pubmed.ncbi.nlm.nih.gov/23973873/, abgerufen am 20.09.2022.
Azeem, M. et al. (2023): An insight into anticancer, antioxidant, antimicrobial, antidiabetic and anti-inflammatory effects of quercetin: a review. Polym Bull (Berl) 2023;80(1):241-62. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8800825/, abgerufen am 01.02.2023.
Bae, S. et al. (2021): Provision of folic acid for reducing arsenic toxicity in arsenic-exposed children and adults. Cochrane Database Syst Rev. 2021 Oct 18;10(10):CD012649. https://pubmed.ncbi.nlm.nih.gov/34661903/, abgerufen am 20.09.2022.
Bai, Y. et al. (2004): Characterization of the rutin-metal complex by electrospray ionization tandem mass spectrometry. Anal Sci 2004 Aug;20(8):1147-51. https://www.ncbi.nlm.nih.gov/pubmed/15352502, abgerufen am 19.09.2018.
Balali-Mood, M. et al. (2021): Toxic Mechanisms of Five Heavy Metals: Mercury, Lead, Chromium, Cadmium, and Arsenic. Front. Pharmacol., 13 April 2021. https://www.frontiersin.org/articles/10.3389/fphar.2021.643972/full, abgerufen am 20.09.2022.
Bardestani, A. et al. (2021): Quercetin attenuates neurotoxicity induced by iron oxide nanoparticles. J Nanobiotechnology. 2021 Oct 18;19(1):327. https://pubmed.ncbi.nlm.nih.gov/34663344/, abgerufen am 20.09.2022.
Bargagli, R. (2000): Trace metals in Antarctica related to climate change and increasing human impact. Rev Environ Contam Toxicol 2000;166:129-73. https://www.ncbi.nlm.nih.gov/pubmed/10868078, abgerufen am 19.09.2018.
Bashandy, S.A.E. et al. (2016): Antioxidant Potential of Spirulina platensis Mitigates Oxidative Stress and Reprotoxicity Induced by Sodium Arsenite in Male Rats. Oxid Med Cell Longev. 2016;2016:7174351. https://www.ncbi.nlm.nih.gov/pubmed/26881036, abgerufen am 19.09.2018.
Batiha, G.E. et al. (2020): The Pharmacological Activity, Biochemical Properties, and Pharmacokinetics of the Major Natural Polyphenolic Flavonoid: Quercetin. Foods 2020 Mar 23;9(3):374. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7143931/, abgerufen am 01.02.2023.
Baydar, T. et al. (2005): Effect of folic acid supplementation on aluminum accumulation in rats. Nutrition. 2005 Mar;21(3):406-10. https://pubmed.ncbi.nlm.nih.gov/15797685/, abgerufen am 20.09.2022.
Bernardo, J.F. (2021): Aluminum Toxicity Clinical Presentation. https://emedicine.medscape.com/article/165315-clinical, abgerufen am 20.09.2022.
Bhattacharya, S. (2020): The Role of Spirulina (Arthrospira) in the Mitigation of Heavy-Metal Toxicity: An Appraisal. J Environ Pathol Toxicol Oncol. 2020;39(2):149-57. https://pubmed.ncbi.nlm.nih.gov/32749124/, abgerufen am 02.06.2021.
Biesalski, H.K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H.K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Bisanz, J. E. et al. (2014): Randomized open-label pilot study of the influence of probiotics and the gut microbiome on toxic metal levels in Tanzanian pregnant women and school children. mBio. 2014 Oct 7;5(5):e01580-14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4196227/, abgerufen am 01.02.2023.
Bist, P. & Choudhary, S. (2022): Impact of Heavy Metal Toxicity on the Gut Microbiota and Its Relationship with Metabolites and Future Probiotics Strategy: a Review. Biol Trace Elem Res 2022;200:5328–50. https://link.springer.com/article/10.1007/s12011-021-03092-4#citeas, abgerufen am 01.02.2023.
Bjørklund, G. (2015): Selenium as an antidote in the treatment of mercury intoxication. Biometals. 2015 Aug;28(4):605-14. https://pubmed.ncbi.nlm.nih.gov/25947386/, abgerufen am 20.09.2022.
Bjørklund, G. et al. (2017): Metal chelators and neurotoxicity: lead, mercury, and arsenic. Arch Toxicol. 2017 Dec;91(12):3787-97. https://pubmed.ncbi.nlm.nih.gov/29063135/, abgerufen am 20.09.2022.
Bjørklund, G. et al. (2019): A Review on Coordination Properties of Thiol-Containing Chelating Agents Towards Mercury, Cadmium, and Lead. Molecules. 2019 Sep;24(18):3247. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6767255/, abgerufen am 20.09.2022.
Bjørklund, G. et al. (2019): Insights on alpha lipoic and dihydrolipoic acids as promising scavengers of oxidative stress and possible chelators in mercury toxicology. J Inorg Biochem. 2019 Jun;195:111-9. https://pubmed.ncbi.nlm.nih.gov/30939378/, abgerufen am 20.09.2022.
Boyina, H.K. (2020): In Silico and In Vivo Studies on Quercetin as Potential Anti-Parkinson Agent. Adv Exp Med Biol. 2020;1195:1-11. https://pubmed.ncbi.nlm.nih.gov/32468451/, abgerufen am 02.06.2021.
Bozack, A.K. et al. (2019): Folic acid supplementation enhances arsenic methylation: results from a folic acid and creatine supplementation randomized controlled trial in Bangladesh. Am J Clin Nutr. 2019 Feb 1;109(2):380-91. https://pubmed.ncbi.nlm.nih.gov/30590411/, abgerufen am 20.09.2022.
Buha, A. et al. (2012): Effects of oral and intraperitoneal magnesium treatment against cadmium-induced oxidative stress in plasma of rats. Arh Hig Rada Toksikol. 2012 Sep;63(3):247-54. https://pubmed.ncbi.nlm.nih.gov/23152374/, abgerufen am 20.09.2022.
Bulat, Z. et al. (2021): Effect of Magnesium Supplementation on the Distribution Patterns of Zinc, Copper, and Magnesium in Rabbits Exposed to Prolonged Cadmium Intoxication. The Scientific World Journal. 2012:572514. https://www.hindawi.com/journals/tswj/2012/572514/, abgerufen am 20.09.2022.
Bundesinstitut für Risikobewertung (BfR) (2014): Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. Stellungnahme Nr. 007/2014. https://www.bfr.bund.de/cm/343/aluminiumhaltige-antitranspirantien-tragen-zur-aufnahme-von-aluminium-bei.pdf, abgerufen am 20.09.2022.
Bundesinstitut für Risikobewertung (BfR) (2014): Freisetzung von Blei aus Kaffee- und Espressomaschinen. Stellungnahme Nr. 003/2014. https://bfr.bund.de/cm/343/freisetzung-von-blei-aus-kaffee-und-espressomaschinen.pdf, abgerufen am 21.09.2022.
Bundesministerium für Umwelt (hrsg.) (2020): Quecksilberemissionen aus industriellen Quellen – Status Quo und Perspektiven. https://www.umweltbundesamt.de/sites/default/files/medien/5750/publikationen/2021-04-26_texte_67-2021_quecksilberemissionen_0.pdf, abgerufen am 20.09.2022.
Burgerstein Handbuch Nährstoffe, Dr. Lothar Burgerstein, TRIAS Verlag in Georg Thieme Verlag KG, 13. Auflage 2018
Büyükşekerci, M. et al. (2015): Evaluation of folate and vitamin B12 levels in lead exposed workers. Cilt. 2015;42(3):294-8. https://dergipark.org.tr/tr/download/article-file/54588, abgerufen am 20.09.2022.
Calabrese, E.J. et al. (1987): The effects of vitamin C supplementation on blood and hair levels of cadmium, lead, and mercury. Ann N Y Acad Sci 1987;498:347-53. https://www.ncbi.nlm.nih.gov/pubmed/3476002, abgerufen am 19.09.2018.
Camiolo, G. et al. (2019): α-Lipoic Acid Reduces Iron-induced Toxicity and Oxidative Stress in a Model of Iron Overload. Int J Mol Sci. 2019 Jan 31;20(3):609. https://pubmed.ncbi.nlm.nih.gov/30708965/, abgerufen am 20.09.2022.
Cao, Y. et al. (2015): Chelation therapy in intoxications with mercury, lead and copper. J Trace Elem Med Biol. 2015;31:188-92. https://pubmed.ncbi.nlm.nih.gov/24894443/, abgerufen am 20.09.2022.
Chen, W. et al. (2012): Characterizing N-acetylcysteine (NAC) and N-acetylcysteine amide (NACA) binding for lead poisoning treatment. J Colloid Interface Sci. 2012 Apr 1;371(1):144-9. https://pubmed.ncbi.nlm.nih.gov/22284448/, abgerufen am 20.09.2022.
Chen, X. et al. (2014): Effects of lead and cadmium co-exposure on bone mineral density in a Chinese population. Bone. 2014 Jun;63:76-80. https://pubmed.ncbi.nlm.nih.gov/24607944/, abgerufen am 20.09.2022.
Chen, Y. et al. (2007): A Prospective Study of Blood Selenium Levels and the Risk of Arsenic-related Premalignant Skin Lesions. Cancer Epidemiol Biomarkers Prev 2007 Feb;16(2),207-213. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1924921/, abgerufen am 19.09.2018.
Chowdhury, U.K. et al. (2000): Groundwater arsenic contamination in Bangladesh and West Bengal, India. Environ Health Perspect. 2000 May;108(5):393-7. https://pubmed.ncbi.nlm.nih.gov/10811564/, abgerufen am 20.09.2022.
Colpo, E. et al. (2008): A single high dose of ascorbic acid and iron is not correlated with oxidative stress in healthy volunteers. Ann Nutr Metab 2008;53(2):79-85. https://www.ncbi.nlm.nih.gov/pubmed/18852484, abgerufen am 19.09.2018.
Dawson, E.B. et al. (1999): The effect of ascorbic acid supplementation on the blood lead levels of smokers. J Am Coll Nutr 1999;18(2):166-70. https://www.ncbi.nlm.nih.gov/pubmed/10204833, abgerufen am 19.09.2018.
de Paula Fonseca Arrifano, G. et al. (2018): Role for apolipoprotein E in neurodegeneration and mercury intoxication. Front Biosci (Elite Ed). 2018 Jan 1;10(2):229-41. https://pubmed.ncbi.nlm.nih.gov/28930615/, abgerufen am 20.09.2022.
Demmler, M. (2009): Schießsport und innere Bleibelastung. http://edoc.ub.uni-muenchen.de/9920/1/Demmeler_Matthias.pdf, abgerufen am 20.09.2022.
Deore, M.S. et al. (2021): Alpha-Lipoic Acid Protects Co-Exposure to Lead and Zinc Oxide Nanoparticles Induced Neuro, Immuno and Male Reproductive Toxicity in Rats. Front Pharmacol. 2021 Jul 8;12:626238. https://pubmed.ncbi.nlm.nih.gov/34305580/, abgerufen am 20.09.2022.
Deutsche Forschungsgemeinschaft (2006): DFG legt MAK- und BAT-Werte-Liste 2006 vor (Memento vom 10. Februar 2009 im Internet Archive) (Pressemitteilung Nr. 34, 5. Juli 2006), https://www.dfg.de/service/presse/pressemitteilungen/2006/pressemitteilung_nr_34/, abgerufen am 19.09.2018.
Devarapogu, R. & Asupatri, U.R. (2023): Effects of zinc supplementation in mitigating the harmful effects of chronic cadmium exposure in a zebrafish model. Environ Toxicol Pharmacol. 2023 Jun;100:104158. https://pubmed.ncbi.nlm.nih.gov/37236493/, abgerufen 30.10.2023.
DGAUM e.V. (Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e.V.) (2010): Arbeit unter Einwirkung von Blei und seinen Verbindungen (2010), AWMF-Registernummer: 002/001: https://www.awmf.org/uploads/tx_szleitlinien/002-001l_S1_Praevention-Frueherkennung-arbeitsbedingter-Gesundheitsgefaehrdungen_Blei_2020-05.pdf, abgerufen am 19.09.2018.
DGAUM e.V. (Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e.V.) unter Beteiligung der Gesellschaft für Toxikologie (2014): Arbeitsmedizinische Leitlinie Arbeiten unter Einwirkung von Cadmium und seinen Verbindungen, AWMF-Registernummer: 002/002, https://www.awmf.org/uploads/tx_szleitlinien/002-002l_S1_Arbeit_Cadmium_Verbindungen_2014-07-abgelaufen.pdf, abgerufen am 19.09.2018.
DGAUM e.V. (Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e.V.) unter Beteiligung der Gesellschaft für Toxikologie (2014): Arbeitsmedizinische Leitlinie Arbeiten unter Einwirkung von Quecksilber und seinen Verbindungen, AWMF-Registernummer: 002/003, https://www.awmf.org/uploads/tx_szleitlinien/002-003l_S1_Arbeiten_Quecksilber_Verbindungen_2015-06-abgelaufen.pdf, abgerufen am 19.09.2018.
Dhawan M. et al. (1989): Preventive and therapeutic role of vitamin E in chronic plumbism. Biomed Environ Sci 1989 Dec;2(4):335-40. https://www.ncbi.nlm.nih.gov/pubmed/2604901/, abgerufen am 14.11.2018.
Djukić-Cosić, D. et al. (2006): Effect of supplemental magnesium on the kidney levels of cadmium, zinc, and copper of mice exposed to toxic levels of cadmium. Biol Trace Elem Res. 2006 Winter;114(1-3):281-91. https://pubmed.ncbi.nlm.nih.gov/17206009/, abgerufen am 20.09.2022.
Domingo, J.L. et al. (2011): Oral silicon supplementation: an effective therapy for preventing oral aluminum absorption and retention in mammals. Nutr Rev. 2011 Jan;69(1):41-51. https://pubmed.ncbi.nlm.nih.gov/21198634/, abgerufen am 20.09.2022.
Dorrigiv, M. et al. (2021): Onion ( Allium cepa) and its Main Constituents as Antidotes or Protective Agents against Natural or Chemical Toxicities: A Comprehensive Review. Iran J Pharm Res. 2021 Winter;20(1):3-26. https://pubmed.ncbi.nlm.nih.gov/34400937/, abgerufen am 20.09.2022.
Drugs and Lactation Database (LactMed) [Internet]. Bethesda (MD): National Library of Medicine (US) (2006): Spirulina. https://www.ncbi.nlm.nih.gov/books/NBK501849/, abgerufen am 19.09.2018.
Duan, H. (2020): Gut microbiota: A target for heavy metal toxicity and a probiotic protective strategy. Sci Total Environ 2020;742:140429. https://pubmed.ncbi.nlm.nih.gov/32629250/, abgerufen am 01.02.2023.
Elangovan, P. & Pari, L. (2013): Ameliorating effects of troxerutin on nickel-induced oxidative stress in rats. Redox Rep 2013;18(6):224-32. https://www.ncbi.nlm.nih.gov/pubmed/24112957, abgerufen am 19.09.2018.
Federico, A. et al. (2015): A pilot study on the ability of clinoptilolite to absorb ethanol in vivo in healthy drinkers: effect of gender. J Physiol Pharmacol 2015 Jun;66(3):441-7. https://www.ncbi.nlm.nih.gov/pubmed/26084226, abgerufen am 19.09.2018.
Feillet-Coudray, C. et al. (2006): Effect of zinc supplementation on in vitro copper-induced oxidation of low-density lipoproteins in healthy French subjects aged 55-70 years: the Zenith Study. Br J Nutr 2006 Jun;95(6):1134-42. https://www.ncbi.nlm.nih.gov/pubmed/16768836, abgerufen am 19.09.2018.
Feng, P. et al. (2022): Human supplementation with Pediococcus acidilactici GR-1 decreases heavy metals levels through modifying the gut microbiota and metabolome. npj Biofilms Microbiomes 2022;8(63). https://www.nature.com/articles/s41522-022-00326-8, abgerufen am 01.02.2023.
Flora, S.J. (2009): Structural, chemical and biological aspects of antioxidants for strategies against metal and metalloid exposure. Oxid Med Cell Longev 2009 Sep-Oct;2(4):191–206. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2763257/, abgerufen am 19.09.2018.
Galal, M.K. et al. (2019): Modulation of caspase-3 gene expression and protective effects of garlic and spirulina against CNS neurotoxicity induced by lead exposure in male rats. Neurotoxicology . 2019 May;72:15-28. https://pubmed.ncbi.nlm.nih.gov/30703413/, abgerufen am 20.09.2022.
Gamble, M.V. et al. (2007): Folic acid supplementation lowers blood arsenic. Am J Clin Nutr. 2007 Oct;86(4):1202-9. https://pubmed.ncbi.nlm.nih.gov/17921403/, abgerufen am 20.09.2022.
Gao, Z.et al. (2002): Effects of rutin supplementation on antioxidant status and iron, copper, and zinc contents in mouse liver and brain. Biol Trace Elem Res 2002 Sep;88(3):271-9. https://www.ncbi.nlm.nih.gov/pubmed/12350136, abgerufen am 19.09.2018.
Gargoui, M. et al. (2019): Potential protective effects of the edible alga Arthrospira platensis against lead-induced oxidative stress, anemia, kidney injury, and histopathological changes in adult rats. Appl Physiol Nutr Metab. 2019 Mar;44(3):271-81. https://pubmed.ncbi.nlm.nih.gov/30138569/, abgerufen am 20.09.2022.
George, C.M. et al. (2013): A Cross-sectional Study of the Impact of Blood Selenium on Blood and Urinary Arsenic Concentrations in Bangladesh. Environmental Health 2013;12:52. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3724573/, abgerufen am 19.09.2018.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2018): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 4. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Grosicki, A. et al. (2015): Magnesium supplements affect selected cadmium toxic actions and uptake of repeated doses of cadmium. Journal of Veterinary Research. 2015;59(4):541-6. https://sciendo.com/it/article/10.1515/bvip-2015-0081, abgerufen am 20.09.2022.
Guyonnet, S. et al. (2007): The potential influence of silica present in drinking water on Alzheimer's disease and associated disorders. J Nutr Health Aging. 2007 Mar-Apr;11(2):119-24. https://pubmed.ncbi.nlm.nih.gov/17435954/, abgerufen am 20.09.2022.
Hamed, M. et al. (2019): Ameliorative effect of Spirulina platensis against lead nitrate-induced cytotoxicity and genotoxicity in catfish Clarias gariepinus. Environ Sci Pollut Res Int. 2019 Jul;26(20):20610-8. https://pubmed.ncbi.nlm.nih.gov/31104244/, abgerufen am 20.09.2022.
Han, D. et al. (1997): L. Lipoic acid increases de novo synthesis of cellular glutathione by improving cystine utilization. Biofactors 1997;6(3):321-38. https://www.ncbi.nlm.nih.gov/pubmed/9288403, abgerufen am 19.09.2018.
Hemalatha, P. et al. (2013): Evaluation of protective effect of N-acetyl cysteine on arsenic-induced hepatotoxicity. J Nat Sci Biol Med. 2013 Jul;4(2):393-5. https://pubmed.ncbi.nlm.nih.gov/24082739/, abgerufen am 20.09.2022.
Hsu, P.-C. & Guo, Y.L. (2002): Antioxidant nutrients and lead toxicity. Toxicology 2002 Oct 30;180(1):33-44. http://www.ncbi.nlm.nih.gov/pubmed/12324198, abgerufen am 19.09.2018.
Hsueh, Y.M. et al. (2021): Plasma Vitamin B12 and Folate Alter the Association of Blood Lead and Cadmium and Total Urinary Arsenic Levels with Chronic Kidney Disease in a Taiwanese Population. Nutrients 2021;13(11):3841. https://www.mdpi.com/2072-6643/13/11/3841/htm, abgerufen am 20.09.2022.
Ibrahim, F. et al. (2020): Manganese-induced neurotoxicity and the potential protective effects of lipoic acid and Spirulina platensis. Toxicol Mech Methods. 2020 Sep;30(7):497-507. https://pubmed.ncbi.nlm.nih.gov/32441205/, abgerufen am 20.09.2022.
Igbokwe, I.O. et al. (2019): Aluminium toxicosis: a review of toxic actions and effects. Interdiscip Toxicol. 2019 Oct; 12(2): 45–70. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7071840/, abgerufen am 20.09.2022.
Jan, A.T. et al. (2015): Heavy Metals and Human Health: Mechanistic Insight into Toxicity and Counter Defense System of Antioxidants. Int J Mol Sci 2015 De;16(12):29592-630. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4691126/, abgerufen am 19.09.2018.
Jones, K. et al. (2017): Urinary Excretion of Aluminium and Silicon in Secondary Progressive Multiple Sclerosis. EBioMedicine. 2017 Dec;26:60-7. https://pubmed.ncbi.nlm.nih.gov/29128442/, abgerufen am 20.09.2022.
Kalafati, M. et al. (2010): Ergogenic and antioxidant effects of spirulina supplementation in humans. Med Sci Sports Exerc 2010 Jan;42(1):142-51. https://www.ncbi.nlm.nih.gov/pubmed/20010119, abgerufen am 19.09.2018.
Kalia, K. & Flora, S.J.S. (2005): Strategies for Safe and Effective Therapeutic Measures for ChronicArsenic and Lead Poisoning. J Occup Health 2005;47:1–21. https://onlinelibrary.wiley.com/doi/epdf/10.1539/joh.47.1, abgerufen am 20.09.2022.
Kasperczyk, S. et al. (2014): Effect of treatment with N-acetylcysteine on non-enzymatic antioxidant reserves and lipid peroxidation in workers exposed to lead. Ann Agric Environ Med 2014;21(2):272-7. https://www.ncbi.nlm.nih.gov/pubmed/24959775, abgerufen am 19.09.2018.
Kasperczyk, S. et al. (2016): Effect of N-acetylcysteine administration on homocysteine level, oxidative damage to proteins, and levels of iron (Fe) and Fe-related proteins in lead-exposed workers. Toxicol Ind Health 2016 Sep;32(9):1607-18. https://www.ncbi.nlm.nih.gov/pubmed/25731901?report=docsum&format=text, abgerufen am 19.09.2018.
Khalil, S.R. et al. (2018): Spirulina platensis attenuates the associated neurobehavioral and inflammatory response impairments in rats exposed to lead acetate. Ecotoxicol Environ Saf 2018 Aug 15;157:255-65. https://www.ncbi.nlm.nih.gov/pubmed/29625400, abgerufen am 19.09.2018.
Kim, G.N. & Jang, H.D. (2009): Protective mechanism of quercetin and rutin using glutathione metabolism on HO-induced oxidative stress in HepG2 cells. Ann N Y Acad Sci 2009 Aug;1171:530-7. https://www.ncbi.nlm.nih.gov/pubmed/19723100, abgerufen am 19.09.2018.
Kısaarslan, A.P. et al. (2019): Elemental mercury intoxication in 7 patients admitted to a pediatric rheumatology clinic. Turk J Pediatr. 2019;61(5):786-90. https://pubmed.ncbi.nlm.nih.gov/32105014/, abgerufen am 20.09.2022.
klotz, K. et al. (2017): The Health Effects of Aluminum Exposure. Dtsch Arztebl Int. 2017 Sep 29;114(39):653-9. https://pubmed.ncbi.nlm.nih.gov/29034866/, abgerufen am 20.09.2022.
Kosnett, M.J. (2013): The role of chelation in the treatment of arsenic and mercury poisoning. J Med Toxicol. 2013 Dec;9(4):347-54. https://pubmed.ncbi.nlm.nih.gov/24178900/, abgerufen am 20.09.2022.
Krumenacker, T. (2020): Wird bleihaltige Jagdmunition endlich verboten? https://www.spektrum.de/news/naturschutz-wird-bleihaltige-jagdmunition-endlich-verboten/1744688, abgerufen am 20.09.2022.
Kumar, R.M. et al. (2013): Accumulation of heavy metals (Cu, Cr, Pb and Cd) in freshwater micro algae (Chlorella sp.). J Environ Sci Eng 2013 Jul;55(3):371-6. https://www.ncbi.nlm.nih.gov/pubmed/25509955, abgerufen am 19.09.2018.
Lachili, B. et al. (2001): Increased lipid peroxidation in pregnant women after iron and vitamin C supplementation. Biol Trace Elem Res 2001 Nov;83(2):103-10. https://www.ncbi.nlm.nih.gov/pubmed/11762527, abgerufen am 19.09.2018.
Lamidi, Y.I. & Akefe, I.O. (2017): Mitigate Effects of Antioxidants in Lead Toxicity. Res Rep Toxi 2017;1(1):3. http://www.imedpub.com/articles/mitigative-effects-of-antioxidants-in-lead-toxicity.pdf, abgerufen am 19.09.2018.
Ledda, C. et al. (2020): Exposure to Toxic Heavy Metals Can Influence Homocysteine Metabolism? Antioxidants (Basel). 2020 Jan; 9(1): 30. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7022705/, abgerufen am 20.09.2022.
Lesjak M. et al. (2019): Quercetin inhibits intestinal non-haem iron absorption by regulating iron metabolism genes in the tissues. Eur J Nutr. 2019 Mar;58(2):743-753. https://pubmed.ncbi.nlm.nih.gov/29594477/, abgerufen am 02.06.2021.
Li, S. et al. (2022): Effects of Sub-chronic Lead Exposure on Essential Element Levels in Mice. Biol Trace Elem Res. 2022 Feb 8. https://pubmed.ncbi.nlm.nih.gov/35133610/, abgerufen am 20.09.2022.
Ling, H.T. et al. (2016): Long-term effect of environmental cadmium exposure on human body's mineral metabolic balance. Zhonghua Yu Fang Yi Xue Za Zhi. 2016 Apr;50(4):316-21. https://pubmed.ncbi.nlm.nih.gov/27029362/, abgerufen am 20.09.2022.
Liu, Y. & Guo, M.: Studies on transition metal-quercetin complexes using electrospray ionization tandem mass spectrometry. Molecules 2015 May 13;20(5):8583-94. https://www.ncbi.nlm.nih.gov/pubmed/25985359, abgerufen am 19.09.2018.
Luo, Q. et al. (2022): The Effects of Lead and Cadmium Co-exposure on Serum Ions in Residents Living Near a Mining and Smelting Area in Northwest China Biol Trace Elem Res. 2022 Sep;200(9):3932-40. https://pubmed.ncbi.nlm.nih.gov/34713392/, abgerufen am 20.09.2022.
Macáková, K. et al. (2012): Iron reduction potentiates hydroxyl radical formation only in flavonols. Food Chem 2012 Dec 15;135(4):2584-92. https://www.ncbi.nlm.nih.gov/pubmed/22980846, abgerufen am 19.09.2018.
Martínez-Galero, E. et al. (2016): Preclinical antitoxic properties of Spirulina (Arthrospira). Pharm Biol. 2016 Aug;54(8):1345-53. https://pubmed.ncbi.nlm.nih.gov/26439611/, abgerufen am 20.09.2022.
Martins R.D.P. et al. (2009): Synergistic neurotoxicity induced by methylmercury and quercetin in mice. Food Chem Toxicol 2009 Mar;47(3):645-9. https://www.ncbi.nlm.nih.gov/pubmed/19141311, abgerufen am 19.09.2018.
Matović, V. et al. (2010): Antagonism between cadmium and magnesium: a possible role of magnesium in therapy of cadmium intoxication. Magnes Res. 2010 Mar;23(1):19-26. https://pubmed.ncbi.nlm.nih.gov/20228012/, abgerufen am 20.09.2022.
Matović, V. et al. (2011): Cadmium toxicity revisited: focus on oxidative stress induction and interactions with zinc and magnesium. Arh Hig Rada Toksikol. 2011 Mar;62(1):65-76. https://pubmed.ncbi.nlm.nih.gov/21421535/, abgerufen am 20.09.2022.
Matović, V. et al. (2012): Route-dependent effects of cadmium/cadmium and magnesium acute treatment on parameters of oxidative stress in rat liver. Food Chem Toxicol. 2012 Mar;50(3-4):552-7. https://pubmed.ncbi.nlm.nih.gov/22240416/, abgerufen am 20.09.2022.
Mehrpour, O. et al. (2020): Comparison of Vitamin B12, Vitamin D, and Folic Acid Blood Levels in Plumbism Patients and Controls in Eastern Iran. Biological Trace Element Research. 2020 Mar;199:9–17. https://doi.org/10.1007/s12011-020-02119-6, abgerufen am 20.09.2022.
Mehrpour, O. et al. (2021): Comparison of Vitamin B12, Vitamin D, and Folic Acid Blood Levels in Plumbism Patients and Controls in Eastern Iran. Biol Trace Elem Res. 2021 Jan;199(1):9-17. https://pubmed.ncbi.nlm.nih.gov/32207029/, abgerufen am 20.09.2022.
Mehrpour, O. et al. (2021): Correction to: Comparison of Vitamin B12, Vitamin D, and Folic Acid Blood Levels in Plumbism Patients and Controls in Eastern Iran. Biological Trace Element Research 2021;199:813. https://link.springer.com/article/10.1007/s12011-020-02189-6, abgerufen am 20.09.2022.
Mendes P.R. et al. (2014): Effect of alpha lipoic acid on the blood cell count and iron kinetics in hypertensive patients. Nutr Hosp 2014 Nov 3;31(2):883-9. https://pubmed.ncbi.nlm.nih.gov/25617577/, abgerufen am 02.06.2021.
Metsla, K. et al. (2022): α-Lipoic Acid Has the Potential to Normalize Copper Metabolism, Which Is Dysregulated in Alzheimer's Disease. J Alzheimers Dis. 2022;85(2):715-28. https://pubmed.ncbi.nlm.nih.gov/34864665/, abgerufen am 20.09.2022.
Mężyńska M. & Brzóska, M.M. (2019): Review of polyphenol-rich products as potential protective and therapeutic factors against cadmium hepatotoxicity. J Appl Toxicol 2019 Jan;39(1):117-145. https://pubmed.ncbi.nlm.nih.gov/30216481/, abgerufen am 02.06.2021.
Mirkov, I. et al. (2020): Plant Extracts and Isolated Compounds Reduce Parameters of Oxidative Stress Induced by Heavy Metals: An up-to-Date Review on Animal Studies. Curr Pharm Des. 2020;26(16):1799-1815. https://pubmed.ncbi.nlm.nih.gov/32264808/, abgerufen am 02.06.2021.
Misbahuddin, M. et al. (2006): Efficacy of spirulina extract plus zinc in patients of chronic arsenic poisoning: a randomized placebo-controlled study. Clin Toxicol (Phila) 2006;44(2):135-41, https://www.ncbi.nlm.nih.gov/pubmed/16615668, abgerufen am 19.09.2018.
Mishra, D. & Flora, S.J. (2008): Quercetin administration during chelation therapy protects arsenic-induced oxidative stress in mice. Biol Trace Elem Res 2008 May;122(2):137-47. https://www.ncbi.nlm.nih.gov/pubmed/18183357, abgerufen am 19.09.2018.
Mitani, K. (1992): Relationship between neurological diseases due to aluminium load, especially amyotrophic lateral sclerosis, and magnesium status. Magnes Res. 1992 Sep;5(3):203-13. https://pubmed.ncbi.nlm.nih.gov/1467159/, abgerufen am 20.09.2022.
Modgil, S. et al. (2019): Alpha lipoic acid attenuates the long-term effects of lead exposure in retinal ischemic injury mouse model. Environ Sci Pollut Res Int. 2019 May;26(15):15548-58. https://pubmed.ncbi.nlm.nih.gov/30945075/, abgerufen am 20.09.2022.
Mold, M. et al. (2018): Aluminium in brain tissue in autism. J Trace Elem Med Biol. 2018 Mar;46:76-82. https://pubmed.ncbi.nlm.nih.gov/29413113/, abgerufen am 20.09.2022.
Mumtaz, S. et al. (2020): Therapeutic role of garlic and vitamins C and E against toxicity induced by lead on various organs. Environ Sci Pollut Res Int. 2020 Mar;27(9):8953-64. https://pubmed.ncbi.nlm.nih.gov/32036533/, abgerufen am 20.09.2022.
Muran, P.J. (2006): Mercury elimination with oral DMPS, DMSA, vitamin C, and glutathione: an observational clinical review. Altern Ther Health Med 2006 May-Jun;12(3):70-5. https://www.ncbi.nlm.nih.gov/pubmed/16708769, abgerufen am 19.09.2018.
Nau, H. et al. (2002): Lebensmitteltoxikologie: Rückstände und Kontaminanten: Risiken und Verbraucherschutz. Georg Thieme Verlag Stuttgart New York.
Nickander, K.K. et al. (1996): Alpha-lipoic acid: antioxidant potency against lipid peroxidation of neural tissues in vitro and implications for diabetic neuropathy. Free Radic Biol Med 1996;21(5):631-9, https://www.ncbi.nlm.nih.gov/pubmed/8891666, abgerufen am 19.09.2018.
Nikolić, R. et al. (2015): Monitoring the toxic effects of Pb, Cd and Cu on hematological parameters of Wistar rats and potential protective role of lipoic acid and glutathione. Toxicol Ind Health. 2015 Mar;31(3):239-46. https://pubmed.ncbi.nlm.nih.gov/23293128/, abgerufen am 20.09.2022.
Norgerg et al. (2015). Schwermetalle sind Kummulationsgifte. Handbook of the toxicology of metals I+II. 4. Auflage. Elsevier Verlag Amsterdam.
Nutmakul, T. (2022): A review on benefits of quercetin in hyperuricemia and gouty arthritis. Saudi Pharm J 2022 Jul;30(7):918-26. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9315272/, abgerufen am 01.02.2023.
Panahi, Y. et al. (2013): Investigation of the effects of Chlorella vulgaris supplementation on the modulation of oxidative stress in apparently healthy smokers. Clin Lab 2013;59(5-6):579-87. https://www.ncbi.nlm.nih.gov/pubmed/23865357, abgerufen am 19.09.2018.
Patrick, L. (2003): Toxic metals and antioxidants: Part II. The role of antioxidants in arsenic and cadmium toxicity. Altern Med Rev 2003 May;8(2):106-28. https://www.ncbi.nlm.nih.gov/pubmed/12777158, abgerufen am 19.09.2018.
Pedroso, T.F. et al. (2017): Effects of Zinc and N-Acetylcysteine in Damage Caused by Lead Exposure in Young Rats. Biol Trace Elem Res. 2017 Dec;180(2):275-84. https://pubmed.ncbi.nlm.nih.gov/28389902/, abgerufen am 20.09.2022.
Queiroz, M.L.S. et al. (2008): Chlorella vulgaris up-modulation of myelossupression induced by lead: the role of stromal cells. Food Chem Toxicol. 2008 Sep;46(9):3147-54. https://pubmed.ncbi.nlm.nih.gov/18684395/, abgerufen am 20.09.2022.
Raehsler, S.L. et al. (2018): Accumulation of Heavy Metals in People on a Gluten-Free Diet. Clin Gastroenterol Hepatol. 2018 Feb;16(2):244-51. https://pubmed.ncbi.nlm.nih.gov/28223206/, abgerufen am 20.09.2022.
Rahman, M. et al. (2019): Selenium and zinc protections against metal-(loids)-induced toxicity and disease manifestations: A review. Ecotoxicol Environ Saf. 2019 Jan 30;168:146-63. https://pubmed.ncbi.nlm.nih.gov/30384162/, abgerufen am 20.09.2022.
Rana, M.N.et al. (2018): Toxicodynamics of Lead, Cadmium, Mercury and Arsenic- induced kidney toxicity and treatment strategy: A mini review. Toxicology Reports 2018;5:704–13. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6035907/, abgerufen am 19.09.2018.
Reichl, F.-X. (2017): Moderne Umweltmedizin: Umweltbelastungen – Diagnostik – Therapie, Lehmanns Media, 1. Auflage.
Renugadevi, J. & Prabu, S.M.: Quercetin protects against oxidative stress-related renal dysfunction by cadmium in rats. Exp Toxicol Pathol. 2010 Sep;62(5):471-81. https://www.ncbi.nlm.nih.gov/pubmed/19615871, abgerufen am 19.09.2018.
Richie Jr, J.P. et al. (2015): Randomized controlled trial of oral glutathione supplementation on body stores of glutathione. Eur J Nutr. 2015 Mar;54(2):251-63. https://pubmed.ncbi.nlm.nih.gov/24791752/, abgerufen am 20.09.2022.
Romay, C. et al. (2003): C-phycocyanin: a biliprotein with antioxidant, anti-inflammatory and neuroprotective effects. Curr Protein Pept Sci 2003 Jun;4(3):207-16. https://www.ncbi.nlm.nih.gov/pubmed/12769719, abgerufen am 19.09.2018.
Rubio, C. et al. (2021): Dietary exposure to trace elements (B, Ba, Li, Ni, Sr, and V) and toxic metals (Al, Cd, and Pb) from the consumption of commercial preparations of Spirulina platensis. Environ Sci Pollut Res Int. 2021 May;28(17):22146-55. https://pubmed.ncbi.nlm.nih.gov/33420686/, abgerufen am 20.09.2022.
Sajadi Hezaveh, Z. et al. (2019): The effect of quercetin on iron overload and inflammation in β-thalassemia major patients: A double-blind randomized clinical trial. Complement Ther Med. 2019 Oct;46:24-28. https://pubmed.ncbi.nlm.nih.gov/31519283/, abgerufen am 02.06.2021.
Samekova, K. et al. (2021): Concomitant oral intake of purified clinoptilolite tuff (G-PUR) reduces enteral lead uptake in healthy humans. Sci Rep. 2021 Jul 20;11(1):14796. https://pubmed.ncbi.nlm.nih.gov/34285282/, abgerufen am 20.09.2022.
Sarezky, D. et al. (2016): Tolerability in the elderly population of high-dose alpha lipoic acid: a potential antioxidant therapy for the eye. Clin Ophthalmol 2016 Sep 29;10:1899-903. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5047711/, abgerufen am 19.09.2018.
Sayed, A.H. et al. (2019): Cytotoxic and genotoxic effects of arsenic on erythrocytes of Oryzias latipes: Bioremediation using Spirulina platensis. J Trace Elem Med Biol. 2019 Sep;55:82-8. https://pubmed.ncbi.nlm.nih.gov/31345371/, abgerufen am 20.09.2022.
Schmundt, H. (2020): Warum Jäger die Umwelt vergiften. https://www.spiegel.de/wissenschaft/natur/bleimunition-vergiftet-pro-jahr-eine-million-voegel-die-regierung-blockiert-ein-verbot-a-0c00f7ae-0de1-41fe-a9bb-8a7bff463638, abgerufen am 20.09.2022.
Schwalfenberg, G.K. (2021): N-Acetylcysteine: A Review of Clinical Usefulness (an Old Drug with New Tricks). J Nutr Metab. 2021 Jun 9;2021:9949453. https://pubmed.ncbi.nlm.nih.gov/34221501/, abgerufen am 20.09.2022.
Sharma, S. et al. (2020): Neuroprotective Effect of Quercetin in Combination with Piperine Against Rotenone- and Iron Supplement-Induced Parkinson's Disease in Experimental Rats. Neurotox Res. 2020 Jan;37(1):198-209. https://pubmed.ncbi.nlm.nih.gov/31654381/, abgerufen am 02.06.2021.
Shaw, C.J. & Tomljenovic, L. (2013): Aluminum in the central nervous system (CNS): toxicity in humans and animals, vaccine adjuvants, and autoimmunity. Immunol Res. 2013 Jul;56(2-3):304-16. https://pubmed.ncbi.nlm.nih.gov/23609067/, abgerufen am 20.09.2022.
Sherif, A.H. et al. (2020): Immune status of Oreochromis niloticus subjected to long-term lead nitrate exposure and a Arthrospira platensis treatment trial. Environ Toxicol Pharmacol. 2020 May;76:103352. https://pubmed.ncbi.nlm.nih.gov/32045721/, abgerufen am 20.09.2022.
Sijko, M. & Kozłowska, L. (2021): Influence of Dietary Compounds on Arsenic Metabolism and Toxicity. Part I-Animal Model Studies. Toxics. 2021 Oct 11;9(10):258. https://pubmed.ncbi.nlm.nih.gov/34678954/, abgerufen am 20.09.2022.
Sitek, A. & Kozłowska, L. (2022): The role of well-known antioxidant vitamins in the prevention of cadmium-induced toxicity. Int J Occup Med Environ Health. 2022 Aug 1;35(4):367-392. https://pubmed.ncbi.nlm.nih.gov/35818760/, abgerufen 30.10.2023.
Smits, J.E. et al. (2019): Food as medicine: Selenium enriched lentils offer relief against chronic arsenic poisoning in Bangladesh. Environ Res. 2019 Sep;176:108561. https://pubmed.ncbi.nlm.nih.gov/31299617/, abgerufen am 20.09.2022.
Sohler, A. et al. (1977): Blood lead levels in psychiatric outpatients reduced by zinc and vitamin C. Journal of Orthomolecular Psychiatry 1977;6(3):272-6. http://orthomolecular.org/library/jom/1977/pdf/1977-v06n03-p272.pdf, abgerufen am 19.09.2018.
Spiegel (Hrsg.) (2015): Zwei deutsche Ehepaare auf Sri Lanka vergiftet. https://www.spiegel.de/gesundheit/ernaehrung/ayurveda-zwei-deutsche-ehepaare-auf-sri-lanka-vergiftet-a-1054771.html, abgerufen am 20.09.2022.
Suliburska, J.et al. (2016): Effect of Spirulina maxima Supplementation on Calcium, Magnesium, Iron, and Zinc Status in Obese Patients with Treated Hypertension. Biol Trace Elem Res 2016 Sep;173(1):1-6. https://www.ncbi.nlm.nih.gov/pubmed/26779620, abgerufen am 19.09.2018.
Szlacheta, Z. et al. (2020): Potential Antioxidant Activity of Calcium and Selected Oxidative Stress Markers in Lead- and Cadmium-Exposed Workers. Oxid Med Cell Longev. 2020 Oct 5;2020:8035631. https://pubmed.ncbi.nlm.nih.gov/33082913/, abgerufen am 20.09.2022.
Tandon, S.K. et al. (2001): Lead poisoning in Indian silver refiners. Sci Total Environ 2001 Dec;17;281(1-3):177-82. https://www.ncbi.nlm.nih.gov/pubmed/11778950, abgerufen am 19.09.2018.
Trueba, G.P. et al. (2004): Oxygen free radical and antioxidant defense mechanism in cancer. Front Biosci 2004 Sep 1;9:2029-44. https://www.ncbi.nlm.nih.gov/pubmed/15353268, abgerufen am 19.09.2018.
Umweltbundesamt (Hrsg.) (2021): Arsen im Feinstaub. https://www.umweltbundesamt.de/themen/luft/luftschadstoffe-im-ueberblick/metalle-im-feinstaub/arsen-im-feinstaub#emittenten, abgerufen am 20.09.2022.
Wani, A.W. et al. (2021): Lead and zinc interactions - An influence of zinc over lead related toxic manifestations. J Trace Elem Med Biol. 2021 Mar;64:126702. https://pubmed.ncbi.nlm.nih.gov/33285442/, abgerufen am 20.09.2022.
Wieloch, M. et al. (2012): Do toxic heavy metals affect antioxidant defense mechanisms in humans?. Ecotoxicol Environ Saf 2012;78:195-205. https://pubmed.ncbi.nlm.nih.gov/22169892/, abgerufen am 01.02.2023.
Wyparło-Wszelaki, M. et al. (2021): Blood Magnesium Level and Selected Oxidative Stress Indices in Lead-Exposed Workers. Biol Trace Elem Res. 2021 Feb;199(2):465-72. https://pubmed.ncbi.nlm.nih.gov/32372126/, abgerufen am 20.09.2022.
Yildiz, M. et al. (2020): Mercury intoxication resembling pediatric rheumatic diseases: case series and literature review. Rheumatol Int. 2020 Aug;40(8):1333-42. https://pubmed.ncbi.nlm.nih.gov/32342181/, abgerufen am 20.09.2022.
Younes, M. et al. (2018): Re-evaluation of calcium silicate (E 552), magnesium silicate (E 553a(i)), magnesium trisilicate (E 553a(ii)) and talc (E 553b) as food additives. EFSA J. 2018 Aug 2;16(8):e05375. https://pubmed.ncbi.nlm.nih.gov/32626019/, abgerufen am 20.09.2022.
Yuan, Y. et al. (2021): Alpha-Lipoic Acid Attenuates Cadmium- and Lead-Induced Neurotoxicity by Inhibiting Both Endoplasmic-Reticulum Stress and Activation of Fas/FasL and Mitochondrial Apoptotic Pathways in Rat Cerebral Cortex. Neurotox Res. 2021 Aug;39(4):1103-15. https://pubmed.ncbi.nlm.nih.gov/33689146/, abgerufen am 20.09.2022.
Zhai, Q. et al. (2015): Dietary Strategies for the Treatment of Cadmium and Lead Toxicity. Nutrients 2015 Jan;7(1):552-71. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4303853/, abgerufen am 19.09.2018.
Zwolak, I. (2020): The Role of Selenium in Arsenic and Cadmium Toxicity: an Updated Review of Scientific Literature. Biol Trace Elem Res. 2020; 193(1): 44–63. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6914719/, abgerufen am 20.09.2022.






