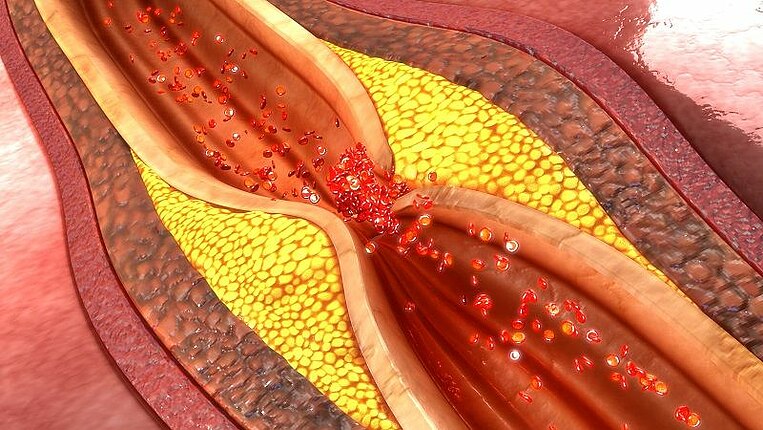
Nelle persone che soffrono di iperomocisteinemia il livello di questa sostanza nel sangue supera i valori normali. L’omocisteina è un veleno cellulare che danneggia le pareti dei vasi. Se raggiunge livelli troppo elevati, si trasforma in un fattore di rischio critico per trombosi, embolie, arteriosclerosi, infarto cardiaco e ictus. Determinati micronutrienti sono necessari per eliminarla dall’organismo e contribuire così a ridurre il rischio di numerose malattie conseguenti.
Cause e sintomi
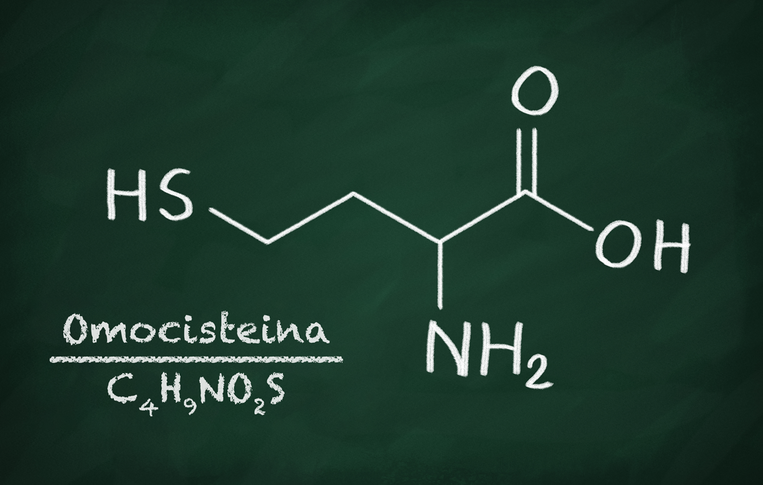
Che cos'è l'omocisteina?
L’omocisteina è un prodotto intermedio nocivo che si forma naturalmente durante il metabolismo e che deve essere costantemente neutralizzato. Per trasformare questa sostanza in legami innocui, sono necessarie diverse vitamine che scindono l’omocisteina in sostanze non pericolose, ovvero nei due aminoacidi metionina e cisteina.
Informazioni
In medicina, un aumento dei livelli di omocisteina nel sangue viene definito iperomocisteinemia, o, in breve, omocisteinemia.
Iperomocisteinemia: cause
Normalmente l’organismo è in grado di mantenere nella norma il livello di omocisteina ed evitare così che danneggi i vasi. Tuttavia, diversi fattori possono causare un aumento di questa sostanza nel sangue. Tra questi ricordiamo:
- Carenza vitaminica: nella maggior parte dei casi, l’iperomocisteinemia è causata da una carenza di vitamine B6, B12 e acido folico. Con l’avanzare dell’età, ma anche in presenza di uno stile di vita non salutare, l’apporto di questi micronutrienti si riduce. Una carenza vitaminica si manifesta con maggiore frequenza anche nelle persone che soffrono di malattie gastrointestinali, quali gastrite cronica (infiammazione cronica della mucosa intestinale) e malattie infiammatorie croniche intestinali (MICI), o che seguono una dieta rigida a causa della celiachia (intolleranza al glutine).
- Difetto genetico: a causa di difetti genetici ereditari, i livelli di omocisteina possono aumentare, perché gli enzimi del metabolismo di questa sostanza non funzionano correttamente o per nulla, causando un aumento estremo dei livelli ematici di omocisteina, che viene escreta attraverso l’urina (omocistinuria). Questa forma grave è però molto rara: secondo le stime colpisce circa 300.000 persone in tutto il mondo. Le malattie cardiovascolari possono colpire già bambini e adolescenti, anche se più spesso la causa del malfunzionamento degli enzimi è da ricondursi a un altro difetto genetico, la mutazione omozigote del gene MTHFR, che può ridurre di circa il 70 percento l’attività enzimatica. Questa forma più lieve interessa circa il 16 percento della popolazione, ossia una persona su sei.
- Insufficienza renale cronica: i pazienti con insufficienza renale cronica presentano un metabolismo renale limitato, che non è più in grado di eliminare l’omocisteina in modo sufficiente.
- Uso di farmaci: i farmaci per la riduzione dei livelli di colesterolo e di grassi nel sangue (come il fenofibrato) o per il trattamento del Parkinson (L-dopa) possono causare un aumento dell’omocisteina. Anche l’assunzione prolungata di antiepilettici come la fenitoina, la carbamazepina e l’acido valproico favoriscono l’iperomocisteinemia.; Lo stesso vale per i farmaci che bloccano la formazione degli acidi gastrici (inibitori della pompa protonica), che riducono l’assorbimento della vitamina B12, la quale svolge un ruolo importante nell’eliminazione dell’omocisteina.
- Consumo di alcol: l’alcol influisce sugli enzimi chiave del metabolismo dell’omocisteina. Basta un consumo moderato di alcol per alzare il livello di omocisteina.
- Alimentazione ricca di proteine: un apporto elevato di proteine animali può aumentare il livello di omocisteina se il metabolismo non funziona perfettamente.
- Disturbi metabolici: diversi disturbi metabolici, come l’ipotiroidismo o il diabete, sono legati anche a un aumento dei livelli di omocisteina.
Iperomocisteinemia: sintomi indicativi di livelli elevati
Se il livello dell’omocisteina supera i valori normali non compare alcun sintomo. Ci si accorge della presenza di livelli elevati di omocisteina solo quando insorgono malattie conseguenti.
I medici ritengono che un aumento del livello di omocisteina modifichi il funzionamento delle cellule dei vasi, favorendo alterazioni trombotiche e arteriosclerotiche. Studi osservazionali mostrano che l’iperomocisteinemia è un fattore di rischio per molte altre patologie:
- Arteriosclerosi
- Demenza, come l’Alzheimer
- Osteoporosi
- Complicanze cardiovascolari associate a nefropatie (insufficienza renale)
- Complicanze legate al diabete
- Alterazioni del tono dell'umore o depressione
- Degenerazione maculare senile (DMS)
- Complicanze da gravidanza come la preeclampsia
In caso di difetto genetico, sintomi come miopia, disabilità intellettiva, scoliosi oppure osteoporosi possono manifestarsi già in età infantile. Nei primi anni dell’età adulta il rischio di complicanze come infarto cardiaco, ictus, trombosi ed embolie aumenta.
Obiettivi del trattamento
Come viene trattato in modo classico un aumento del livello di omocisteina?
Un livello elevato di omocisteina può avere origine genetica o essere dovuto allo stile di vita. L’omocistinuria, un disturbo metabolico genetico, è riconosciuta come malattia in base alla Classificazione internazionale delle malattie (ICD), al contrario dell’omocisteinemia acquisita. In entrambi i casi il trattamento tradizionale mira a ridurre i livelli elevati di omocisteina, ricorrendo a una terapia basata sui micronutrienti che prevede, per prima cosa, la somministrazione di acido folico, vitamina B6 (piridossina), vitamina B12 (cobalamina) e betaina.
I livelli di omocisteina possono essere influenzati in certa misura anche mediante la dieta: poiché l'omocisteina si forma a partire dall'aminoacido metionina, come raccomandato ai pazienti con omocistinuria geneticamente determinata, il suo apporto dovrebbe essere limitato. Poiché tutte le fonti proteiche contengono metionina, è necessario utilizzare miscele artificiali che non la contengano.
Per prevenire il rischio di embolie trombotiche, spesso i pazienti sono trattati anche con anticoagulanti come l’acido acetilsalicilico (ASA).
Gli obiettivi della medicina dei micronutrienti
Come la medicina classica, anche quella dei micronutrienti tratta l’eccesso di omocisteina ricorrendo alle vitamine, perché spesso un aumento dei suoi valori è dovuto a una carenza vitaminica. Si sono dimostrate efficaci le seguenti sostanze:
- Le vitamine del gruppo B aiutano a disintossicare l'organismo dall'omocisteina.
- La colina e la betaina supportano l'efficacia delle vitamine del gruppo B
- Gli acidi grassi omega-3 rafforzano l'azione sui livelli di omocisteina e hanno un effetto antinfiammatorio.
- L'N-acetilcisteina riduce il livello di omocisteina e migliora la funzione vascolare.
Trattamento con i micronutrienti
Ridurre l'omocisteina con l'acido folico e le vitamine B2, B6 e B12
Meccanismo d’azione delle vitamine del gruppo B
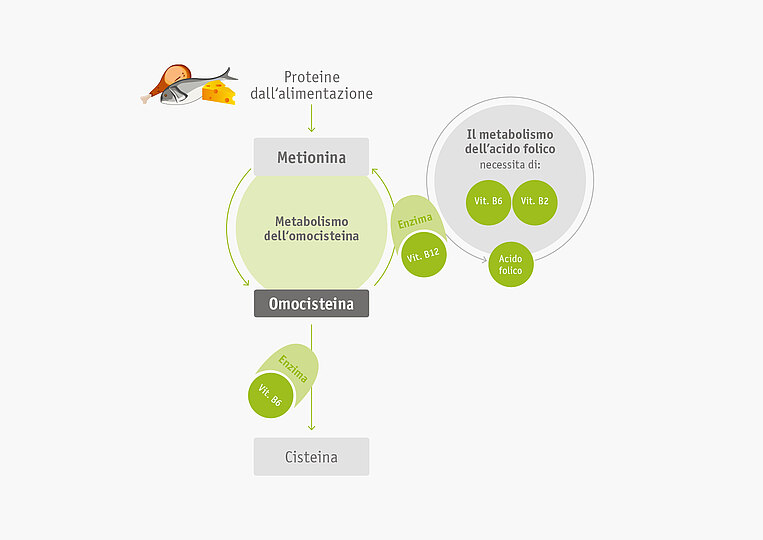
L’organismo necessita di diversi tipi di vitamina B per neutralizzare l’omocisteina. Un’eventuale carenza porta all’iperomocisteinemia. Questo fenomeno si manifesta soprattutto con l’avanzare dell’età.
Vitamina B12: la vitamina B12 (cobalamina) garantisce che l’omocisteina sia nuovamente trasformata in metionina.
Vitamina B6: grazie alla vitamina B6 (piridossina), l’organismo trasforma l’omocisteina in cisteina.
Acido folico: l’acido folico è necessario per garantire la produzione di nuovi enzimi che scindono l’omocisteina. Anche le vitamine B6 e B2 sono indispensabili per questo processo di rigenerazione.
L’efficacia delle vitamine del gruppo B sui livelli di omocisteina è stata testata in numerosi studi, che hanno confermato che questo gruppo vitaminico contribuisce ad abbassare i livelli troppo elevati.
Tuttavia, le conseguenze positive sulla salute sono ancora oggetto di discussione e non è altresì possibile stimare con esattezza se e in che misura le vitamine del gruppo B siano in grado di evitare infarti cardiaci, ictus e trombosi. Alcune evidenze dimostrano però che l’assunzione a lungo termine di acido folico è in grado di ridurre del 18 percento il rischio di ictus. Un effetto ancora più significativo è stato ottenuto, tra gli altri, in studi condotti per un periodo di 36 mesi, in cui si è registrato un calo dei livelli di omocisteina superiore al 20 percento.
Per concludere, le vitamine del gruppo B sono una terapia relativamente poco costosa che riduce probabilmente il rischio di insorgenza di malattie cardiovascolari dovute all’età.
Metabolismo dell’omocisteina
Dosaggio e consigli sull’assunzione delle vitamine del gruppo B
Le vitamine del gruppo B dovrebbero essere combinate e utilizzate per un periodo di tempo prolungato, poiché i livelli di omocisteina aumentano nuovamente quando si interrompe l’assunzione.
Si consigliano le seguenti dosi:
- Vitamina B2: da 1 a 5 milligrammi al giorno
- Vitamina B6: da 5 a 15 milligrammi al giorno
- Vitamina B12: fino a 500 microgrammi (sotto forma di metilcobalamina)
- Acido folico: da 200 a 500 microgrammi al giorno (sotto forma di acido 5-metiltetraidrofolico, la forma attiva utilizzabile direttamente)
Consiglio
Affinché risulti più efficace, l’acido folico (o folato) deve prima essere attivato nell’organismo. Questa forma bioattiva è chiamata anche acido 5-metiltetraidrofolico (5-MTHF). Circa la metà della popolazione presenta un difetto genetico che ne rallenta l’attivazione. Nel dieci percento dei casi il processo rallenta addirittura di circa il 70 percento. Si consiglia quindi di non assumere l’acido folico (o il folato), bensì direttamente l’acido 5-metiltetraidrofolico.
Determinazione dei valori dell'omocisteina in laboratorio
È importante sottoporsi a esami di controllo durante la terapia per monitorare i livelli di omocisteina. In particolare, è consigliabile per i pazienti a rischio che soffrono già di vasculopatie, diabete mellito, livelli troppo alti di lipidi nel sangue o sovrappeso patologico (obesità), nonché per le persone anziane.
L’omocisteina viene misurata nel plasma, la componente liquida del sangue priva di cellule ematiche. I valori normali sono compresi tra 5 e 9 micromoli per litro.
Informazioni
Se i valori sono compresi tra 10 e 25 micromoli per litro, si parla di una forma lieve di iperomocisteinemia; valori da 25 a 50 micromoli per litro indicano una moderata iperomocisteinemia e concentrazioni tra 50 e 500 micromoli per litro indicano una forma grave, che solitamente si accompagna anche a omocistinuria, cioè a un difetto enzimatico genetico.
Vitamine del gruppo B: da considerare in caso di gravidanza, allattamento, malattie e assunzione di farmaci
In caso di gravidanza e allattamento, si dovrebbero assumere dosi elevate di vitamine B2, B6 e B12 solo in caso di carenza conclamata e previo consenso del ginecologo curante.
I diabetici che presentano danni ai reni e i pazienti con problemi renali devono prestare particolare attenzione, assumendo la vitamina B12 sotto forma non di cianocobalamina, bensì di metilcobalamina. La cianocobalamina, infatti, è probabilmente nociva a dosaggi elevati per i soggetti nefropatici. A oggi non è stato chiaramente dimostrato se la riduzione dei livelli di omocisteina rechi beneficio ai pazienti con problemi renali, che devono tuttavia prestare attenzione all’apporto di vitamine del gruppo B, poiché l’acido folico e le vitamine B2 e B6 si perdono durante la dialisi.
L’assunzione di vitamine del gruppo B dopo l’impianto di stent e dopo un infarto non è stata ancora studiata a sufficienza. Poiché è probabile che esse abbiano in tali casi un effetto negativo, occorre evitare alte dosi di vitamina B6 (da 40 a 50 milligrammi al giorno), vitamina B12 (a partire da 60 microgrammi al giorno) e acido folico (a partire da 800 microgrammi al giorno).
A dosi elevate (oltre 5 milligrammi al giorno), la vitamina B6 può ridurre l’effetto degli antiepilettici (come il fenobarbital [Luminal®] e la fenitoina [Aurantin®, Dintoina®]) e dei farmaci contro la malattia di Parkinson (come la levodopa [Duodopa®]). Pertanto, questi principi attivi non devono essere assunti insieme alla vitamina B6.
L’acido folico riduce l'effetto degli antibiotici utilizzati nel trattamento delle infezioni con i principi attivi trimetoprim (Bactrim®), proguanile (Malarone®) e pirimetamina (Metakelfin®).
La colina e la betaina supportano l’efficacia delle vitamine del gruppo B
Meccanismo d’azione della betaina
Betaina appartiene in senso lato al gruppo degli aminoacidi. Inizialmente veniva estratta dalla barbabietola rossa, da cui prende il nome. L’organismo è in grado di sintetizzare autonomamente la betaina anche dalla colina presente nel fegato e contenuta, ad esempio, nella carne o nelle uova.
La colina e la betaina forniscono componenti (gruppi metilici) necessarie all’organismo per neutralizzare l’omocisteina e trasformarla in metionina. Studi osservazionali hanno mostrato che un maggiore apporto di colina e betaina tramite l'alimentazione è associato a livelli più bassi di omocisteina, soprattutto nei soggetti che presentano contemporaneamente bassi livelli di acido folico e vitamina B12.
Sono disponibili dati anche in merito all'assunzione delle sostanze:
- Colina: In un primo studio, 2.600 milligrammi di fosfatidilcolina (un composto speciale di colina) al giorno hanno ridotto livelli leggermente elevati di omocisteina:
- Betaina: dall’analisi di 5 studi clinici è risultato che i livelli di omocisteina scendevano in media di 1,23 micromoli per litro se si assumevano ogni giorno 4.000 milligrammi per almeno 6 settimane.
La betaina può essere utile soprattutto se i livelli di omocisteina non sono correlati alle vitamine del gruppo B. Uno studio ha dimostrato che la combinazione di acido folico e betaina assunta per 4 settimane è in grado di ridurre i valori dell’omocisteina, mentre non si sono osservati effetti significativi per le vitamine B6 e B12. In tale studio le vitamine del gruppo B e la betaina sono state assunte insieme al vino, che si ritiene possa anch’esso ridurre i livelli di omocisteina.
Dosaggio e consigli sull’assunzione di colina e betaina
In alcuni studi sono stati impiegati fino a 2.600 milligrammi di fosfatidilcolina per abbassare i livelli elevati di omocisteina. In media, 100 milligrammi di fosfatidilcolina forniscono 13 milligrammi di colina. Il dosaggio raccomandato nella medicina dei micronutrienti viene quindi convertito in 200-300 milligrammi di colina al giorno.
Gli esperti in micronutrienti consigliano di assumere betaina soprattutto quando non è possibile ottenere un miglioramento con le vitamine del gruppo B. Secondo gli studi, sono necessari tra 500 e 4.000 milligrammi al giorno. Il calo dei valori dipende dalla dose: maggiore è la quantità assunta, maggiore sarà anche la riduzione. Per dosi superiori a 400 milligrammi di betaina, è necessario consultare l'esperto di micronutrienti. A partire da 3.000 milligrammi al giorno, la betaina potrebbe aumentare i livelli di colesterolo nei pazienti a rischio. Pertanto, la terapia con betaina dovrebbe essere accompagnata da un opportuno monitoraggio, soprattutto nei primi sei mesi.
La colina e la betaina andrebbero assunte insieme ai pasti nel corso della giornata.
Colina e betaina: da considerare in caso di gravidanza, allattamento e malattie
Durante la gravidanza e l'allattamento la colina e la betaina non devono essere assunte senza prima consultare un medico. Non sono stati eseguiti studi sulla sicurezza al dosaggio raccomandato.
Chi soffre di malattie cardiovascolari conclamate dovrebbe assumere colina ad alto dosaggio solo d'accordo con l'esperto in micronutrienti. Alcuni prodotti di degradazione della colina (trimetilammina-N-ossido) potrebbero infatti aggravare la patologia, soprattutto se la flora intestinale è alterata, perché è in tali condizioni che si formano i suddetti prodotti di degradazione.
I prodotti di degradazione della colina potrebbero anche aggravare il diabete nei soggetti che ne soffrono. Questi ultimi dovrebbero quindi discutere dell'uso di questo nutriente con il loro medico.
Nei pazienti con problemi renali, la funzione dei reni potrebbe non essere più sufficiente a espellere i prodotti di degradazione della fosfatidilcolina. Pertanto, in via precauzionale, le persone affette da malattie renali dovrebbero evitare di assumere preparati di micronutrienti contenenti fosfatidilcolina o colina.
Anche i pazienti oncologici dovrebbero astenersi dall'assumere colina ad alto dosaggio a titolo precauzionale, poiché il metabolismo della colina è alterato in alcune cellule tumorali.
Gli acidi grassi omega-3 hanno un effetto antinfiammatorio
Meccanismo d’azione degli acidi grassi omega-3

Gli acidi grassi omega-3 come l’EPA (acido eicosapentaenoico) e il DHA (acido docosaesaenoico) hanno un effetto antinfiammatorio, proteggono i vasi, riducono i livelli di grasso nel sangue quando superano i valori normali e, grazie al loro effetto vasodilatatore, agiscono anche come antipertensivi. Inoltre, sono in grado di abbassare livelli troppo elevati di omocisteina, come confermato non solo dai test condotti sugli animali ma anche dai primi piccoli studi condotti sull’uomo. Questo effetto positivo è stato riscontrato in particolare nei seguenti gruppi:
- diabetici con alterazioni del metabolismo dei lipidi (dislipidemia),
- pazienti che hanno sofferto di un infarto cardiaco acuto
- uomini con livelli di grassi nel sangue (colesterolo e trigliceridi) superiori alla norma.
I ricercatori ritengono che gli acidi grassi omega-3 potrebbero influenzare il metabolismo della metionina.
Informazioni
Si sospetta che l'omocisteina sia associata alla depressione. Gli acidi grassi omega-3 hanno un provato effetto antidepressivo, che costituisce una delle molte ragioni per cui questi nutrienti dovrebbero essere assunti in presenza di livelli elevati di omocisteina.
Dosaggio e consigli sull’assunzione degli acidi grassi omega-3
Sono stati condotti test di successo che prevedevano una somministrazione giornaliera di 1.500-2.000 milligrammi di acidi grassi omega-3. Questi nutrienti dovrebbero essere assunti insieme ai pasti, perché i grassi presenti negli alimenti ne favoriscono il passaggio al sangue dall’intestino.
Nella scelta dei preparati, occorre prestare attenzione all’alta qualità e purezza per garantire che le proprietà dei preziosi acidi grassi siano sfruttate appieno.
Determinazione dell’indice omega-3 in laboratorio
L’indice omega-3 è dato dalla percentuale dei due acidi grassi omega-3 EPA e DHA presenti nel sangue e, poiché questi ultimi si trovano nei globuli rossi, è sufficiente un normale esame del sangue.
Un controllo di questo tipo è particolarmente necessario in pazienti con arteriosclerosi e malattie cardiovascolari. In condizioni ottimali, l’indice omega-3 dovrebbe essere compreso tra l’otto e l’undici percento.
Acidi grassi omega-3: cosa considerare in caso di assunzione di anticoagulanti.
Nonostante siano generalmente ben tollerati, dosi elevate di acidi grassi omega-3 (superiori a 1.000 milligrammi al giorno) possono aumentare il rischio di emorragia. I pazienti che assumono contemporaneamente dosi elevate di farmaci anticoagulanti e gli omega-3 dovrebbero sottoporsi regolarmente a controlli del tempo di protrombina (INR). In alcuni casi, inoltre, potrebbe essere necessario regolare la dose degli anticoagulanti.
L’N-acetilcisteina migliora la funzionalità dei vasi
Meccanismo d’azione dell’N-acetilcisteina
L’N-acetilcisteina (NAC) è in grado di ridurre il livello di omocisteina nel sangue. Uno studio clinico ha mostrato come la NAC e l'acido folico abbiano lo stesso effetto positivo. Una dose da 600 milligrammi assunta per otto settimane è risultata efficace. La NAC ha inoltre migliorato la funzionalità vascolare.
Gli studi condotti hanno mostrato che l’efficacia della NAC sui livelli di omocisteina dipende dalla dose somministrata, ossia maggiore è la dose, maggiore è la riduzione dei livelli di omocisteina nel sangue.
Inoltre, la NAC è il precursore naturale della cisteina, un aminoacido di cui l’organismo ha bisogno per sintetizzare il glutatione, un principio attivo dalle elevate proprietà antiossidanti che protegge i vasi. La NAC potenzia la sintesi del glutatione e svolge a sua volta un'azione antiossidante.
Dose e consigli sull’assunzione di N-acetilcisteina
In caso di aumento dei livelli di omocisteina, gli esperti in micronutrienti raccomandano di solito da 500 a 1.500 milligrammi al giorno, preferibilmente suddivisi in tre dosi, ad esempio da 500 a 600 milligrammi, per garantire una migliore tollerabilità.
La NAC andrebbe inoltre assunta dopo i pasti.
N-acetilcisteina: da considerare in caso di gravidanza, allattamento e assunzione di farmaci
Poiché non sono disponibili dati empirici sufficienti sull'uso dell'N-acetilcisteina nelle donne in gravidanza e allattamento, la sua assunzione dovrebbe essere soppesata in modo critico dal medico.
La NAC può indebolire l’efficacia di alcuni antibiotici come le tetracicline, gli aminoglicosidici e le penicilline. Pertanto, i pazienti che assumono entrambi dovrebbero rispettare un intervallo di almeno due ore.
La NAC agisce anche da espettorante, quindi non dovrebbe essere assunta in concomitanza con gli antitussivi, poiché la riduzione del riflesso della tosse potrebbe portare a un accumulo delle secrezioni.
Dosaggi in breve
Dosi giornaliere di micronutrienti consigliate in caso di livelli elevati di omocisteina | |
|---|---|
Vitamina B2 | da 1 a 5 milligrammi (mg) |
Vitamina B6 | da 5 a 15 milligrammi (in caso di omocistinuria: da 200 a 1.200 milligrammi) |
Acido folico | da 200 a 600 microgrammi (µg) sotto forma di acido 5-metiltetraidrofolico |
Vitamina B12 | da 10 a 500 microgrammi (sotto forma di metilcobalamina) |
Betaina | da 500 a 4.000 milligrammi |
Colina | da 200 a 300 milligrammi |
Acidi grassi omega-3 | da 1.500 a 2.000 milligrammi con una percentuale il più elevata possibile di EPA |
N-acetilcisteina | da 500 a 1.500 milligrammi |
Esami di laboratorio consigliati in caso di livelli elevati di omocisteina
Esami di laboratorio consigliati in caso di livelli elevati di omocisteina
Valori ottimali | |
|---|---|
Indice omega-3 (siero) | dall’8 all’11 percento |
Omocisteina | < 10 micromoli per litro (µmol/l) |
Riepilogo
Nelle persone che soffrono di iperomocisteinemia il livello di questa sostanza nel sangue supera i valori normali, danneggiando le pareti dei vasi. L'omocisteina aumenta il rischio di trombosi, embolie, arteriosclerosi, infarto cardiaco, ictus e altre patologie. Determinati micronutrienti degradano l’omocisteina presente nell’organismo e possono così ridurre il rischio di insorgenza di numerose patologie.
Le vitamine del gruppo B, come le vitamina B2, B6 e B12 e l’acido folico, in particolare, combattono l’aumento dei livelli di omocisteina e sono consigliate come trattamento in caso di iperomocisteinemia. Anche la colina e la betaina sono consigliate, poiché aiutano l’organismo a eliminare l’omocisteina.
Gli acidi grassi omega-3 come il DHA e l’EPA sono in grado di ridurre leggermente i livelli di omocisteina e rafforzano in modo significativo l’efficacia delle vitamine del gruppo B. Inoltre, hanno un effetto antinfiammatorio, proteggono i vasi, riducono i livelli di grasso nel sangue quando superano i valori normali e, grazie al loro effetto vasodilatatore, agiscono anche come antipertensivi.
Anche l’N-acetilcisteina riduce il livello di omocisteina e migliora la funzione vascolare. Non da ultimo, questo aminoacido ha un effetto antiossidante e protegge l’organismo dai danni cellulari.
Indice degli studi e delle fonti
Ao, M. et al. (2017): High prevalence of vitamin B-12 insufficiency in patients with Crohn's disease. Asia Pac J Clin Nutr. 2017;26(6):1076-1081. https://www.ncbi.nlm.nih.gov/pubmed/28917233, consultato il: 10.04.2018.
Biesalski, H. K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H. K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Borchard-Tuch, C. (2007): Homocystein. Vitamin-B-Prophylaxe in der Diskussion, in: Pharmazeutische Zeitung. Ausgabe 35/2007. https://www.pharmazeutische-zeitung.de/index.php?id=3591, consultato il: 13.02.2018.
Cianciolo, G. et al. (2017): Folic Acid and Homocysteine in Chronic Kidney Disease and Cardiovascular Disease Progression: Which Comes First? Cardiorenal Med. 2017 Oct;7(4):255-266. https://www.ncbi.nlm.nih.gov/pubmed/29118764, consultato il: 13.03.2018.
Clarke, R. et al. (2010): Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals. Arch Intern Med. 2010 Oct 11;170(18):1622-31. https://www.ncbi.nlm.nih.gov/pubmed/20937919, consultato il: 12.02.2018.
Dawson, S. L. et al. (2016): A combination of omega-3 fatty acids, folic acid and B-group vitamins is superior at lowering homocysteine than omega-3 alone: A meta-analysis. Nutr Res. 2016 Jun;36(6):499-508. https://www.ncbi.nlm.nih.gov/pubmed/27188895, consultato il: 14.02.2018.
Dean, L. et al. (2016): Medical Genetics Summaries [Internet]. Bethesda (MD): National Center for Biotechnology Information (US); 2012-2012 Mar 8 [updated 2016 Oct 27]. https://www.ncbi.nlm.nih.gov/pubmed/28520345, consultato il: 07.02.2018.
Deris, I. (2001): Hyperhomocysteinämie: Vitaminsubstitution wird empfohlen. Dtsch Arztebl 2001; 98(45): A-2981. https://www.aerzteblatt.de/archiv/29412/Hyperhomocysteinaemie-Vitaminsubstitution-wird-empfohlen, consultato il: 14.02.2018.
Dinckal, M. H. et al. (2003): Effect of homocysteine-lowering therapy on vascular endothelial function and exercise performance in coronary patients with hyperhomocysteinaemia. Acta Cardiol. 2003;58:389–396. https://www.ncbi.nlm.nih.gov/pubmed/14609303, consultato il: 13.02.2018.
Earnest, C. P. (2012): Complementary effects of multivitamin and omega-3 fatty acid supplementation on indices of cardiovascular health in individuals with elevated homocysteine. Int J Vitam Nutr Res. 2012 Feb;82(1):41-52. https://www.ncbi.nlm.nih.gov/pubmed/22811376, consultato il: 14.02.2018.
European Food Safety Authority (2017): Safety of betaine as a novel food pursuant to Regulation(EC) No 258/97. EFSA Journal 2017;15(11):5057. https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2017.5057, consultato il: 13.08.2018.
Gariballa, S. (2011): Testing homocysteine-induced neurotransmitter deficiency, and depression of mood hypothesis in clinical practice. Age Ageing. 2011 Nov;40(6):702-5. https://www.ncbi.nlm.nih.gov/pubmed/21771745, consultato il: 13.02.2018.
Gariballa, S. (2012): Effects of mixed dietary supplements on total plasma homocysteine concentrations (tHcy): a randomized, double-blind, placebo-controlled trial. Int J Vitam Nutr Res. 2012 Aug;82(4):260-6. https://www.ncbi.nlm.nih.gov/pubmed/23591663, consultato il: 13.02.2018.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2018): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 4. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Hildebrandt, W. et al. (2015): Oral N-acetylcysteine reduces plasma homocysteine concentrations regardless of lipid or smoking status. The American Journal of Clinical Nutrition.2015 Nov;102(5):1014-1024. https://academic.oup.com/ajcn/article/102/5/1014/4564368, consultato il: 23.03.2018.
Homocysteine Lowering Trialists’ Collaboration (2005): Dose-dependent effects of folic acid on blood concentrations of homocysteine: a meta-analysis of the randomized trials. Am J Clin Nutr. 2005 Oct;82(4):806-12. https://www.ncbi.nlm.nih.gov/pubmed/?term=Homocysteine%20Lowering%20Trialists%27%20Collaboration%5BCorporate%20Author%5D, consultato il: 12.02.2018.
House, A.A. et al. (2010): Effect of B-vitamin therapy on progression of diabetic nephropathy: a randomized controlled trial. JAMA. 2010 Apr 28;303(16):1603-9. https://www.ncbi.nlm.nih.gov/pubmed/20424250, consultato il: 12.03.2018.
Huang, P. et al. (2015): Homocysteine and the risk of age-related macular degeneration: a systematic review and meta-analysis. Sci Rep. 2015 Jul 21;5:10585. https://www.ncbi.nlm.nih.gov/pubmed/26194346, consultato il: 13.02.2018.
Huang, T. et al. (2015): Effect of vitamin B-12 and n-3 polyunsaturated fatty acids on plasma homocysteine, ferritin, C-reaction protein, and other cardiovascular risk factors: a randomized controlled trial. Asia Pac J Clin Nutr. 2015;24(3):403-11. https://www.ncbi.nlm.nih.gov/pubmed/26420180, consultato il: 14.02.2018.
Kasperczyk, S. et al. (2016): Effect of N-acetylcysteine administration on homocysteine level, oxidative damage to proteins, and levels of iron (Fe) and Fe-related proteins in lead-exposed workers. Toxicol Ind Health. 2016 Sep;32(9):1607-18. https://www.ncbi.nlm.nih.gov/pubmed/25731901, consultato il: 13.03.2018.
Koyama, K. et al. (2010): Randomized controlled trial of the effect of short-term coadministration of methylcobalamin and folate on serum ADMA concentration in patients receiving long-term hemodialysis. Am J Kidney Dis. 2010 Jun;55(6):1069-78. https://www.ncbi.nlm.nih.gov/pubmed/20430500, consultato il: 09.04.2018.
Kosmadakis, G. et al. (2013): Vitamins in dialysis: who, when and how much? Renal Failure. 2014 Feb;36(4): 638-650. https://www.tandfonline.com/doi/full/10.3109/0886022X.2014.882714?scroll=top&needAccess=true, consultato il: 23.03.2018.
Kumar, A. et al. (2017): The metabolism and significance of homocysteine in nutrition and health. Nutr Metab (Lond). 2017; 14: 78. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5741875/, consultato il: 07.02.2018
Lange, H. et al. (2004): Folate therapy and in-stent restenosis after coronary stenting. N Engl J Med. 2004 Jun 24;350(26):2673-81. https://www.ncbi.nlm.nih.gov/pubmed/15215483, consultato il: 13.03.2018.
Leclerc, D. (2000-2013): Molecular Biology of Methylenetetrahydrofolate Reductase (MTHFR) and Overview of Mutations/Polymorphisms. In: Madame Curie Bioscience Database [Internet]. Austin (TX): Landes Bioscience; 2000-2013. https://www.ncbi.nlm.nih.gov/books/NBK6561, consultato il: 07.02.2018.
Lonn, E. et al. (2006): Homocysteine lowering with folic acid and B vitamins in vascular disease. N Engl J Med. 2006 Apr 13;354(15):1567-77. https://www.ncbi.nlm.nih.gov/pubmed/16531613, consultato il: 13.02.2018.
McAuley, E. et al. (2016): Riboflavin status, MTHFR genotype and blood pressure: current evidence and implications for personalised nutrition. Proc Nutr Soc. 2016 Aug;75(3):405-14. https://www.ncbi.nlm.nih.gov/pubmed/27170501, consultato il: 14.02.2018.
McRae, M.P. (2013): Betaine supplementation decreases plasma homocysteine in healthy adult participants: a meta-analysis. J Chiropr Med. 2013 Mar;12(1):20-5. https://www.ncbi.nlm.nih.gov/pubmed/23997720, consultato il: 13.08.2018.
No authors listed (2003): Betaine. Alternative Medicine Review 2003:8(2). http://archive.foundationalmedicinereview.com/publications/8/2/193.pdf, consultato il: 13.08.2018.
Orphanet Report Series, Rare Diseases Collection (2018): Nummer 2, Januar 2018. http://www.orpha.net/orphacom/cahiers/docs/DE/Pravalenzen_seltener_Krankheiten_absteigender_Pravalenz_oder_Falle.pdf, consultato il: 13.02.2018.
Oussalah, A. et al. (2011): Meta-analysis: hyperhomocysteinaemia in inflammatory bowel diseases. Aliment Pharmacol Ther. 2011 Nov;34(10):1173-84. https://www.ncbi.nlm.nih.gov/pubmed/21967576, consultato il: 12.02.2018.
Pietrzik, K. (2010): Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin Pharmacokinet. 2010 Aug;49(8):535-48. https://www.ncbi.nlm.nih.gov/pubmed/20608755, consultato il: 14.02.2018.
Prinz-Langenohl, R. et al. (2009): [6S]-5-methyltetrahydrofolate increases plasma folate more effectively than folic acid in women with the homozygous or wild-type 677C-->T polymorphism of methylenetetrahydrofolate reductase. Br J Pharmacol. 2009 Dec;158(8):2014-21. https://www.ncbi.nlm.nih.gov/pubmed/19917061, consultato il: 14.02.2018.
Rajdl, D. et al. (2016): Effect of Folic Acid, Betaine, Vitamin B6, and Vitamin B12 on Homocysteine and Dimethylglycine Levels in Middle-Aged Men Drinking White Wine. Nutrients. 2016 Jan 12;8(1). https://www.ncbi.nlm.nih.gov/pubmed/26771632, consultato il: 13.08.2018.
Reulecke, B. und Denecke, J. (2009): Diagnostik und Therapie der Homocystinurie. Kinder- und Jugendmedizin. 2009 (Vol. 9): Heft 5, pp. 289-293. https://silo.tips/download/keywords-homocystinuria-methionine-metabolism-homocysteine, consultato il: 09.03.2018.
Saposnik, G. (2011): The Role of Vitamin B in Stroke Prevention: A Journey From Observational Studies to Clinical Trials and Critique of the Vitamins To Prevent Stroke. Stroke. 2011 Jan;42:838-842. http://stroke.ahajournals.org/content/42/3/838, consultato il: 23.03.2018.
Scaglione, F. und Panzavolta, G. (2014): Folate, folic acid and 5-methyltetrahydrofolate are not the same thing. Xenobiotica. 2014 May;44(5):480-8. https://www.ncbi.nlm.nih.gov/pubmed/24494987, consultato il: 14.02.2018.
Schwab, U. et al. (2006): Orally administered betaine has an acute and dose-dependent effect on serum betaine and plasma homocysteine concentrations in healthy humans. J Nutr. 2006 Jan;136(1):34-8. https://www.ncbi.nlm.nih.gov/pubmed/16365055, consultato il: 13.08.2018
Spence, J.D. (2013): B vitamin therapy for homocysteine: renal function and vitamin B12 determine cardiovascular outcomes. Clin Chem Lab Med. 2013 Mar;51(3):633-7. https://www.ncbi.nlm.nih.gov/pubmed/23449527, consultato il: 23.03.2018.
Spence, J.D. et al. (2017): B vitamins in stroke prevention: time to reconsider. The Lancet Neurology. 2017 Sep;16(9):750 - 760. https://www.ncbi.nlm.nih.gov/pubmed/28816120, consultato il: 23.03.2018.
Strain, J.J. et al. (2004): B-vitamins, homocysteine metabolism and CVD. Proc Nutr Soc. 2004 Nov;63(4):597-603. https://www.ncbi.nlm.nih.gov/pubmed/15831132, consultato il: 12.02.2018.
Sun, F. et al: (2017): Correlation of Maternal Serum Homocysteine in the First Trimester with the Development of Gestational Hypertension and Preeclampsia. Med Sci Monit. 2017; 23: 5396–5401. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5699171/, consultato il: 12.02.2018.
Troesch, B. et al. (2016): Potential Links between Impaired One-Carbon Metabolism Due to Polymorphisms, Inadequate B-Vitamin Status, and the Development of Alzheimer's Disease. Nutrients. 2016 Dec 10;8(12). pii: E803. https://www.ncbi.nlm.nih.gov/pubmed/27973419, consultato il: 12.02.2018.
Vacek, T.P. et al. (2013): The role of homocysteine in bone remodeling. Clin Chem Lab Med. 2013;51:579–590. https://www.ncbi.nlm.nih.gov/pubmed/23449525, consultato il: 13.02.2018.
Valente, F.X. et al. (2015): B vitamins related to homocysteine metabolism in adults celiac disease patients: a cross-sectional study. Nutr J. 2015 Oct 20;14:110. https://www.ncbi.nlm.nih.gov/pubmed/26487487, consultato il: 12.02.2018.
Van Hattum, E.S. et al. (2007): Does folate therapy reduce the risk of coronary restenosis? Neth Heart J. 2007 Jan;15(1):12-5. https://www.ncbi.nlm.nih.gov/pubmed/17612702, consultato il: 23.03.2018.
Wang, X. et al. (2007): Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007 Jun 2;369(9576):1876-82. https://www.ncbi.nlm.nih.gov/pubmed/17544768, consultato il: 13.02.2018.
Wolters, M. et al. (2005): Effect of multivitamin supplementation on the homocysteine and methylmalonic acid blood concentrations in women over the age of 60 years. Eur J Nutr. 2005 Mar;44(3):183-92. https://www.ncbi.nlm.nih.gov/pubmed/15309436, consultato il: 14.02.2018.
Xiao, Y. et al. (2013): Dietary protein and plasma total homocysteine, cysteine concentrations in coronary angiographic subjects. Nutr J. 2013; 12: 144. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4176105/, consultato il: 07.02.2018.
Yilmaz, H. et al. (2007): Effects of folic acid and N-acetylcysteine on plasma homocysteine levels and endothelial function in patients with coronary artery disease. Acta Cardiol. 2007 Dec;62(6):579-85. https://www.ncbi.nlm.nih.gov/pubmed/18214123, consultato il: 13.03.2018.
Yılmaz, N. & Eren, E. (2009): Homocysteine oxidative stress and relation to bone mineral density in post-menopausal osteoporosis. Aging Clin Exp Res. 2009;21:353–357. https://www.ncbi.nlm.nih.gov/pubmed/19959926, consultato il: 13.02.2018.
Zheng, S. et al. (2017): Association of ulcerative colitis with transcobalamin II gene polymorphisms and serum homocysteine, vitamin B12, and folate levels in Chinese patients. Immunogenetics. 2017 Jul;69(7):421-428. https://www.ncbi.nlm.nih.gov/pubmed/28526947, consultato il: 10.04.2018.
Zhou, Y. et al. (2014): Association between plasma homocysteine status and hypothyroidism: a meta-analysis. Int J Clin Exp Med. 2014;7:4544. https://www.ncbi.nlm.nih.gov/pubmed/19959926, consultato il: 13.02.2018.