La BPCO è una malattia caratterizzata dal restringimento delle vie aeree che porta a disturbi come tosse, espettorazione e difficoltà respiratorie. I micronutrienti possono influenzare positivamente il decorso della BPCO, rallentarne la progressione e alleviarne i sintomi. Qui troverete maggiori informazioni.

Cause e sintomi
Sintomi della BPCO
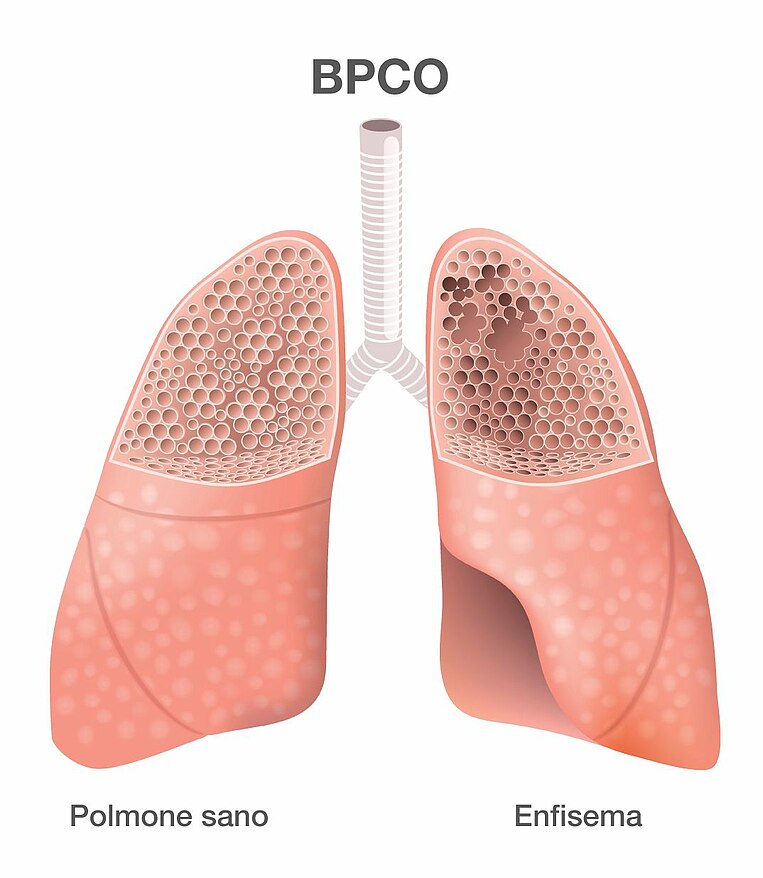
La broncopneumopatia cronica ostruttiva (BPCO) è caratterizzata da un restringimento delle vie respiratorie che impedisce il passaggio dell'aria, soprattutto nella fase di espirazione. I sintomi tipici che permettono di identificarla sono difficoltà respiratorie, tosse ed espettorazione di muco. Le difficoltà respiratorie (dispnea) si manifesta quasi solo in occasione di sforzi fisici nella fase iniziale della malattia, per poi diventare un sintomo costante anche in stato di riposo con l'avanzare della patologia. Altri segni di una BPCO sono stanchezza e calo delle prestazioni.
In alcuni soggetti la progressione si ferma al restringimento delle vie respiratorie, in particolare dei bronchi, mentre in alcuni casi interessa anche gli alveoli, dove avviene lo scambio di ossigeno e anidride carbonica. Questa forma di BPCO provoca la rottura degli alveoli, in un processo noto anche come enfisema o, più precisamente, enfisema polmonare, in cui il volume polmonare diminuisce assieme all’apporto di ossigeno al sangue.
Informazioni
Il termine BPCO designa entrambe le malattie polmonari, ovvero la broncopneumopatia cronica ostruttiva e la broncopneumopatia cronica ostruttiva con enfisema polmonare.
La BPCO è caratterizzata da recidive, le cosiddette esacerbazioni, che ne determinano il progressivo peggioramento.
Cause della BPCO
La BPCO, al pari della bronchite classica che la precede, è provocata dal fumo e dal contatto costante negli anni con inquinanti atmosferici. Non mancano tuttavia i fattori genetici, come il deficit di alfa-1-antitripsina, una malattia congenita che favorisce la comparsa della BPCO.
Informazioni
Differenza tra tosse persistente (bronchite cronica) e BPCO: La tosse persistente con espettorato è quasi sempre provocata da una “semplice” bronchite cronica, in cui i sintomi vengono scatenati da un’infiammazione dei bronchi. In presenza di una BPCO i bronchi sono invece costantemente ristretti e il tessuto polmonare è danneggiato. Nella stragrande maggioranza dei casi, la BPCO è una conseguenza della bronchite cronica.
Diagnosi della BPCO: classificazione in base al grado di gravità
Il grado di gravità della BPCO viene definito in base alle linee guide della Global Initiative for Chronic Obstructive Lung Disease (GOLD) in considerazione di due criteri:
1. Il valore della funzione polmonare, che indica il grado della sua compromissione e viene determinato misurando il volume d'aria che il paziente riesce ad espirare in un secondo. In ambito medico si parla di volume espiratorio massimo nel 1º secondo, abbreviato in FEV1 (Forced Expiratory Volume in 1 second). I valori nominali del FEV1 vengono calcolati su base individuale e dipendono da statura, età e sesso. Il grado di gravità della BPCO è indicato dalla percentuale del valore nominale raggiunta:
- GOLD 1: FEV1 pari ad almeno l'80 percento del valore nominale
- GOLD 2: FEV1 dal 50 all’80 percento del valore nominale
- GOLD 3: FEV1 dal 30 al 50 percento del valore nominale
- GOLD 4: FEV1 inferiore al 30 percento del valore nominale
2. La classificazione GOLD è completata da uno schema di ripartizione ABCD, che tiene conto del numero di recidive acute nell’anno trascorso e del grado di sofferenza. L'assegnazione al gruppo A presuppone l'assenza pressoché totale di peggioramento e sintomi, al contrario del gruppo D, dove gli episodi sono numerosi.
Obiettivi del trattamento
Qual è il trattamento classico della BPCO?
La BPCO è una malattia incurabile. Il tessuto polmonare distrutto non può essere ripristinato. I farmaci impiegati nella terapia della BPCO hanno pertanto la funzione di alleviare i disturbi e contribuire ad evitare peggioramenti (esacerbazioni) e complicazioni:
- I broncodilatatori con principi attivi come i beta-2-simpaticomimetici (Ventolin®, Serevent®) o gli anticolinergici (Duovent®, Bretaris®) dilatano i bronchi, facilitando la respirazione. La teofillina (Theodur®, Aminomal®) viene oggi utilizzata molto più di rado.
- Gli antinfiammatori inibiscono l’irritazione infiammatoria e il gonfiore ai bronchi. Tuttavia, a causa dei loro possibili effetti collaterali, in caso di BPCO non dovrebbero essere impiegati per periodi prolungati. I farmaci comunemente usati includono i cortisonici inalatori (Clenilexx®, Pulmaxan®), i cosiddetti glucocorticoidi, e gli inibitori della fosfodiesterasi 4 (roflumilast come Daxas®).
Altri farmaci vengono utilizzati in caso di necessità: gli antibiotici possono ridurre la pressione batterica a carico dei polmoni e diminuire il pericolo di peggioramenti dovuti ad infezioni. Il medico prescrive a volte anche mucolitici e antitussivi.
Allenamento fisico, ginnastica ed esercizi respiratori possono migliorare la resistenza delle persone con BPCO e alleviarne i sintomi, e anche l’ossigenoterapia con respiratore può rivelarsi utile.
Un ruolo importante è svolto poi dall’alimentazione, che nella BPCO è spesso errata o carente. Sovrappeso e sottopeso possono a loro volta peggiorare il decorso della malattia. I pazienti con un peso corporeo al di sopra della norma dovrebbero pertanto ponderare la possibilità di un dimagramento.
Per scongiurare un ulteriore peggioramento della funzione polmonare, i soggetti con BPCO dovrebbero smettere di fumare ed evitare tutte le possibili sollecitazioni a carico dei polmoni sul luogo di lavoro. Vaccinazioni preventive, ad esempio contro influenza o pneumococchi, possono impedire la comparsa di infezioni concomitanti e polmoniti.
Anche il trapianto di polmone può essere preso in considerazione una volta esaurite tutte le opzioni terapeutiche.
Gli obiettivi della medicina dei micronutrienti
I micronutrienti influenzano positivamente il decorso della BPCO:
- Gli antinfiammatori e i nutrienti antiossidanti come gli acidi grassi omega-3 o le vitamine A, C ed E contengono i processi infiammatori delle vie respiratorie e proteggono dallo stress ossidativo.
- I nutrienti dall'effetto mucolitico, decongestionante o rilassante come l’N-acetilcisteina o il magnesio alleviano le difficoltà respiratorie.
- L'azione rinforzante della vitamina D sul sistema immunitario riduce il rischio di infezioni.
- Gli aminoacidi o le proteine sono consigliabili in caso di carenze alimentari e conseguente perdita di massa muscolare.
Trattamento con i micronutrienti
N-acetilcisteina: mucolitica, battericida e antiossidante
Meccanismo d'azione dell'N-acetilcisteina in caso di BPCO
Nella BPCO l’N-acetilcisteina (NAC) svolge una triplice azione, liberando le vie respiratorie, combattendo i batteri e proteggendo dallo stress ossidativo.
Azione mucolitica: l’N-acetilcisteina scioglie il muco presente nelle vie respiratorie, favorendone l’espettorazione con la tosse. La ricerca mostra che l’N-acetilcisteina allevia i disturbi della BPCO, che raramente peggiora. Un altro studio documenta come l’N-acetilcisteina, abbinata a regolare attività fisica, migliori la qualità di vita delle persone interessate da una BPCO stabile. Questi effetti positivi si riscontrano con l'assunzione per un periodo superiore ai sei mesi.
Azione antibatterica: le infezioni possono peggiorare il quadro clinico della BPCO. Alcuni batteri si proteggono creando un biofilm che ostacola il trattamento antibiotico. L’N-acetilcisteina è in grado di distruggere questa protezione, rendendo vulnerabili gli agenti patogeni.
Stress ossidativo: l’N-acetilcisteina svolge un’azione antiossidante contro lo stress ossidativo, che compare spesso in concomitanza con la BPCO e danneggia il tessuto polmonare. L’N-acetilcisteina concorre alla rigenerazione degli antiossidanti prodotti dall’organismo (come il glutatione.
L'assunzione prolungata di N-acetilcisteina può mitigare le recidive acute. In base alle meta-analisi condotte sugli studi disponibili, il suo impiego non ha tuttavia un effetto sulla qualità di vita di tutti i pazienti, che non sempre sviluppano una maggiore resistenza fisica nelle attività quotidiane.
N-acetilcisteina: dosaggio e consigli sull’assunzione
Per evitare un peggioramento acuto della BPCO si consiglia l'assunzione giornaliera di 1.200 milligrammi di N-acetilcisteina. Questa dose è adeguata anche per i pazienti affetti da bronchite cronica che presentano segni di restringimento delle vie respiratorie. Gli studi mostrano che l’N-acetilcisteina deve essere assunta per periodi prolungati (6 mesi) affinché possa apportare un qualche effetto.
Da considerare in caso gravidanza e assunzione di farmaci
L’impiego dell’N-acetilcisteina durante la gravidanza e l'allattamento non è ancora documentato a sufficienza e per questo dovrebbe essere deciso da un medico.
La combinazione di N-acetilcisteina con antitussivi (Bisolvon®, Monapax®) non è indicata poiché il contenimento del riflesso della tosse può portare ad un pericoloso accumulo di secreto.
L’N-acetilcisteina può inoltre indebolire l'efficacia di alcuni antibiotici come le tetracicline, gli aminoglicosidici e le penicilline, che devono pertanto essere assunti a una distanza di almeno due ore.
La vitamina D migliora la funzione polmonare
Meccanismo d'azione della vitamina D in caso di BPCO
La vitamina D svolge un ruolo importante per la BPCO perché rinforza il sistema immunitario e aiuta sia a respingere i patogeni sia a terminare i processi infiammatori. Una carenza di vitamina D rappresenta un fattore di rischio per le malattie delle vie respiratorie. Le persone con un deficit di vitamina D corrono un rischio maggiore di sviluppare una BPCO o una sua forma più grave.
Uno studio ha mostrato il diradarsi delle recidive acute nei soggetti trattati con preparati a base di vitamina D per un periodo superiore ai sei mesi. Gli effetti positivi sono ancora più evidenti in presenza di un grave deficit di vitamina D.
Uno studio di alto livello ha inoltre evidenziato come la vitamina D migliorasse la funzione polmonare in alcune persone. I test sono stati condotti su pazienti affetti da asma, BPCO e fumatori, cui sono stati somministrati la vitamina D o un placebo.
Un buon apporto di vitamina D aiuta inoltre a prevenire malattie che spesso si accompagnano alla BPCO, come l'osteoporosi e la debolezza muscolare. La vitamina D è infatti responsabile dell’assorbimento del calcio necessario alle ossa dall’intestino.
Vitamina D: dosaggio e consigli sull'assunzione in caso di BPCO
In presenza di BPCO è consigliata l'assunzione regolare di vitamina D, con dosi indicative comprese tra 1.000 e 4.000 unità internazionali. L’obiettivo è essenzialmente quello di compensare un’eventuale carenza e raggiungere il livello ottimale di 40-60 nanogrammi per millilitro di sangue.
Il dosaggio esatto viene calcolato dal medico sulla base dei valori ematici. La regola generale per aumentare in modo lento e costante la quantità di vitamina D prevede la somministrazione di 1.000 unità internazionali al giorno, che in aggiunta alle 4.500 unità internazionali prodotte dall’organismo determina un incremento di 10 nanogrammi per millilitro.
Determinazione dei livelli di vitamina D in laboratorio
I livelli di vitamina D nella sua forma di trasporto vitamina D 25(OH) (calcidiolo) vengono rilevati nel siero ematico. Un valore compreso tra 40 e 60 nanogrami per millilitro di sangue è considerato ottimale.
Indicazioni in caso di insufficienza renale
La vitamina D aumenta i livelli di calcio nel sangue. Gli anziani e i soggetti affetti da BPCO possono presentare un indebolimento della funzione renale e livelli eccessivi di calcio, da monitorare in caso di assunzione di vitamina D. Sono considerati normali valori nel sangue intero compresi tra 1,45 e 1,55 millimoli per litro.
Gli acidi grassi omega-3 arrestano le infiammazioni
Meccanismo d'azione degli acidi grassi omega-3 in caso di BPCO
La BPCO è spesso caratterizzata da infiammazioni alle vie respiratorie. Gli acidi grassi omega-3 (DHA ed EPA) contengono i processi infiammatori poiché l’organismo li impiega per la produzione di sostanze in grado di eliminare attivamente l’infiammazione. L'azione degli acidi grassi omega-3 su varie malattie infiammatorie a carico di articolazioni e intestino trova crescente conferma e potrebbe anche alleviare i sintomi della BPCO.
Le prime indicazioni in questo senso si basano su esami del sangue: nelle persone con valori ematici più elevati di acidi grassi omega-3 la malattia ha un decorso nettamente meno grave.
Anche i primi studi clinici condotti sugli integratori di acidi grassi omega-3 ne lasciano supporre un effetto positivo: uno studio della Clinica universitaria di Taiwan mostra una maggiore resistenza delle persone trattate, che a piedi riuscivano a coprire una distanza più lunga nell’unità di tempo. Gli autori riportano inoltre un peggioramento più lento della funzione polmonare nonché un miglioramento della qualità di vita dei soggetti interessati.
Sono tuttavia necessarie ulteriori ricerche, perché, ad esempio, non tutti gli studi hanno dimostrato un calo dei valori di infiammazione nel sangue.
Acidi grassi omega-3: dosaggio e consigli sull'assunzione in caso di BPCO
A supporto del trattamento della BPCO i medici esperti in micronutrienti consigliano fino a 2.000 milligrammi di acidi grassi omega-3 con la massima percentuale possibile di EPA (1.000 milligrammi), che ha un forte effetto antinfiammatorio. L'assorbimento degli acidi grassi omega-3 da parte dell’organismo è ottimale se questi vengono assunti insieme ai pasti.
I preparati a base di olio di pesce presentano notevoli differenze sul piano della qualità: quelli migliori vengono purificati e non contengono sostanze nocive. L’olio di krill è di ottima qualità per natura, poiché è essenzialmente più povero di elementi dannosi.
Acidi grassi omega-3: cautela in caso di disturbi della coagulazione del sangue e malattie renali o epatiche
Gli acidi grassi omega-3 fluidificano il sangue e, a partire dai 1.000 milligrammi al giorno, possono potenziare l'efficacia dei farmaci anticoagulanti (Falithrom®, Marcumar®). Pertanto, prima di assumere contemporaneamente acidi grassi omega-3, e persone che fanno uso di questi farmaci dovrebbero sempre consultare il proprio medico, che può monitorare il tempo di coagulazione espresso dal valore di Quick e adeguare di conseguenza la dose dei medicinali.
Gli integratori di acidi grassi omega-3 rallentano la coagulazione del sangue e per questo dovrebbero essere sospesi prima di un intervento chirurgico, attenendosi al parere del medico. Le persone affette da coagulopatie dovrebbero rinunciare del tutto all’assunzione di acidi grassi omega-3.
La BPCO può portare alla comparsa di malattie epatiche o renali, in presenza delle quali l'assunzione di acidi grassi omega-3 è sconsigliata.
Il magnesio facilita la respirazione?
Meccanismo d'azione del magnesio in caso di BPCO
Il magnesio rilassa la muscolatura dei bronchi e dilata le vie respiratorie. Per questo potrebbe agevolare la respirazione ai pazienti con BPCO.
Le ricerche evidenziano che le persone con BPCO assumono una quantità di magnesio nettamente inferiore rispetto alle persone sane. Il calo del livello di magnesio in presenza di BPCO provoca irritabilità delle vie respiratorie con la progressiva compromissione della funzione polmonare. Nel corso di un’esacerbazione, il livello di magnesio è inferiore rispetto a quello di un soggetto con BPCO stabile. Sono pertanto molte le indicazioni indirette che lasciano supporre un effetto benefico del magnesio sull'asma.
Dosaggio e consigli sull’assunzione
Chi soffre di BPCO dovrebbe assicurarsi un apporto sufficiente di magnesio, ad esempio fino a 250 milligrammi al giorno sotto forma di integratori di minerali.
In caso di carenza di magnesio, i medici esperti in micronutrienti consigliano anche da 300 a 600 milligrammi per un determinato periodo.
Determinazione dei livelli di magnesio in laboratorio
Un’eventuale carenza di magnesio si determina misurandone i livelli nel sangue intero. I valori normali sono compresi tra 1,38 e 1,50 millimoli di magnesio per litro di sangue intero.
Da considerare in caso di malattie renali e assunzione di farmaci per l’osteoporosi o antibiotici
Le persone affette da malattie renali non dovrebbero assumere magnesio con integratori alimentari perché i reni debilitati non riescono a smaltire la quantità di minerale in eccesso, con il pericolo di un suo accumulo nel sangue.
Il magnesio riduce l’efficacia degli antibiotici del gruppo degli inibitori della DNA girasi (Ciflox®, Ciperus®) e delle tetracicline (Efracea®, Ligosan®), nonché dei farmaci per l’osteoporosi, i cosiddetti bisfosfonati (Fosamax®, Bondronat®). Se ne consiglia pertanto di assumerli a due ore di distanza.
Gli antiossidanti riducono lo stress ossidativo
Meccanismo d'azione degli antiossidanti in caso di BPCO
I pazienti con BPCO sono maggiormente colpiti dallo stress ossidativo rispetto alle persone sane. Questo significa che i radicali liberi danneggiano le cellule dell’organismo, provocando un inasprimento dei processi infiammatori polmonari. Gli antiossidanti normalmente catturano i radicali liberi e li rendono innocui. Alcuni studi evidenziano una presenza insufficiente di antiossidanti nel sangue dei soggetti con BPCO.
Agli antiossidanti appartengono ad esempio le vitamine A, C ed E nonché gli oligoelementi zinco e selenio:
- Vitamina A: l’assunzione di una grande quantità di vitamina A con l’alimentazione dimezza il rischio di ammalarsi di BPCO.
- Vitamina C e vitamina E: le persone affette da BPCO soffrono più spesso di rumori respiratori, espettorazione e difficoltà respiratorie in presenza di bassi livelli ematici di vitamina E e vitamina C. Durante gli attacchi alla base di un peggioramento acuto il valore di queste vitamine è inferiore rispetto alle fasi stabili della malattia. Una quantità più elevata viene invece associata a un miglioramento della funzione polmonare. Anche il tasso di mortalità è inferiore nelle persone affette da BPCO trattate con integratori di vitamina E.
- Zinco e selenio: i livelli degli oligoelementi zinco e selenio sono ridotti nelle persone con BPCO, soprattutto nei malati gravi. L’integrazione di zinco e selenio nell’ambito di uno studio ha permesso di ridurre i periodi di ventilazione artificiale.
Attualmente si suppone che un buon apporto di antiossidanti possa migliorare lo stato nutrizionale dei soggetti con BPCO, riducendo il rischio di complicazioni (ad esempio infezioni). Gli antiossidanti non sono tuttavia riusciti ad eliminare le conseguenze dannose del fumo.
Antiossidanti: dosaggio e consigli sull’assunzione
In generale gli studi attualmente disponibili indicano come il modo migliore di assumere gli antiossidanti sia nella loro composizione naturale attraverso l’alimentazione: le vitamine ad alto dosaggio in forma isolata da sole, ad esempio la vitamina E esclusivamente sotto forma di alfa-tocoferolo o il precursore della vitamina A beta-carotene, non sono in grado di migliorare i sintomi della BPCO. Alcuni dati sembrano addirittura indicare la loro potenziale pericolosità per i fumatori.
Più adatti sono i preparati con miscele di antiossidanti di composizione naturale, che per dosaggio e contenuto vitaminico devono essere simili agli alimenti. Le dosi giornaliere consigliate sono pari a fino a 800 microgrammi di vitamina A, da 100 a 150 milligrammi di vitamina C, 40 milligrammi di complesso della vitamina E, da 50 a 100 microgrammi di selenio e 15 milligrammi di zinco. I fumatori non dovrebbero superare la dose di 15 milligrammi di beta-carotene.
Le compresse vanno assunte insieme ai pasti perché l’organismo può assorbire le vitamine A ed E solo in presenza di grassi.
Il selenio sotto forma di selenito di sodio trasforma la vitamina C in un una forma che non viene assorbita dall’organismo e per questo le due sostanze non devono essere assunte assieme, bensì a distanza di una-due ore.
Consiglio
Se si desidera combinare la vitamina C e il selenio, occorre assicurarsi che il preparato contenga selenato e non selenito di sodio. La vitamina C non pregiudica l'assorbimento del selenato di sodio.
Determinazione dello stress ossidativo in laboratorio
Una verifica del fabbisogno di antiossidanti è opportuna soprattutto in caso di assunzione di preparati ad alto dosaggio.
La malondialdeide, che indica l'entità dei danni provocati agli acidi grassi insaturi attraverso i radicali liberi, è uno dei marcatori utili a tal fine. I livelli di malondialdeide possono essere determinati sia nel siero ematico sia nell’urina. I valori normali sono compresi tra 0,36 e 1,4 micromoli per litro di sangue o tra 0,2 e 1,45 micromoli per millimole di creatina nell’urina.
Attenzione: i laboratori utilizzano test ematici differenti per determinare lo stress ossidativo.
Inoltre, il medico può far rilevare le vitamine e i minerali presenti nel sangue, ad esempio il selenio, i cui livelli normali nel sangue intero dovrebbero oscillare tra 120 e 150 microgrammi per litro. Il selenio non dovrebbe essere integrato in presenza di valori superiori a 150 microgrammi per litro.
Da considerare in caso di malattie renali e gravidanza
Le persone affette da insufficienza renale non dovrebbero assumere più di 500 milligrammi di vitamina C al giorno. I reni debilitati non sono inoltre in gradi di smaltire correttamente lo zinco e il selenio. Il controllo dei valori ematici è necessario per evitare sovradosaggi.
I preparati a base di vitamina A sono sconsigliati in caso di insufficienza renale a causa della compromissione dello smaltimento della sostanza. Anche le donne incinte non dovrebbero integrare la vitamina A, che in dosi eccessive può essere dannosa per il nascituro.
Le vitamine del gruppo B riducono il rischio di trombosi nella BPCO
Meccanismo d'azione delle vitamine del gruppo B in caso di BPCO
L’omocisteina è una sostanza prodotta in misura ridotta dall’organismo. In quantità maggiori può avere effetti nocivi, ad esempio sul sistema cardiovascolare (arteriosclerosi). L’omocisteina viene eliminata se il corpo dispone di sufficienti vitamine del gruppo B, soprattutto di vitamina B6, B12 e acido folico.
Le ricerche evidenziano che le persone con BPCO hanno bassi livelli di vitamina B accompagnati da un eccesso di omocisteina, con conseguente rischio maggiore di sviluppare pericolosi coaguli di sangue e occlusioni vascolari (trombosi), nonché malattie cardiocircolatorie. Si presume che bassi livelli di omocisteina contengano anche l’insorgenza di malattie conseguenti in presenza di BPCO.
Vitamine del gruppo B: dosaggio e consigli sull'assunzione in caso di BPCO
Per abbassare un livello di omocisteina oltre la norma nel quadro clinico di una BPCO si impiegano da 5 a 15 milligrammi di vitamina B6, da 400 a 600 microgrammi di acido folico e 500 microgrammi di vitamina B12.
Determinazione dei livelli di omocisteina in laboratorio
I livelli di omocisteina vengono misurati nel plasma e rientrano nelle norma fino a 10 micromoli per litro. A partire da 15 micromoli di omocisteina per litro si parla di iperomocisteinemia, ovvero di un eccesso di questa sostanza.
Gli aminoacidi prevengono la perdita di massa muscolare
Meccanismo d'azione degli aminoacidi in caso di BPCO
Circa un terzo delle persone affette da una forma da media a grave di BPCO presenta segni di perdita di massa muscolare, in un processo che in medicina viene definito sarcopenia. La resistenza agli sforzi ulteriormente compromessa dalla perdita di massa muscolare porta spesso i pazienti ad evitare l'attività fisica e peggiorare così la malattia.
Gli aminoacidi forniscono energia ai muscoli, ne impediscono l’indebolimento e favoriscono la costruzione di massa muscolare. Diversi studi mostrano che è soprattutto l’assunzione di aminoacidi essenziali e aminoacidi a catena ramificata (Branched Chained Amino Acids, BCAA) per più mesi da parte di persone affette da BPCO grave a ripercuotersi positivamente sul bilancio energetico dei muscoli, sulle funzioni psichiche e sullo stato di salute percepito. I pazienti affetti da BPCO con poca massa muscolare hanno spesso bassi livelli di questi aminoacidi.
Informazioni
Il termina “essenziale” significa “indispensabile per la vita”: l’organismo non può produrre questi aminoacidi autonomamente, pertanto occorre assumerli con l’alimentazione. Gli aminoacidi a catena ramificata sono un particolare sottogruppo di aminoacidi essenziali, di cui fanno parte la valina, la leucina e l'isoleucina.
Dosaggio e consigli sull’assunzione
Per compensare la perdita di massa muscolare in caso di BPCO si consigliano da 4.000 a 8.000 milligrammi di amminoacidi essenziali, di cui, nell’opzione ottimale, 1.200 milligrammi di leucina e 600 milligrammi rispettivamente di valina e isoleucina.
Consiglio
Accanto agli integratori di aminoacidi esistono anche frullati proteici contenenti tutti gli aminoacidi (essenziali) necessari all’organismo.
Prudenza in caso di malattie renali
Le persone con funzione renale ridotta non dovrebbero assumere più di 600-800 milligrammi di proteine più aminoacidi per chilogrammo di peso corporeo al giorno, perché in questi casi i reni riescono ad espellere solo una parte dei prodotti metabolici che ne risultano. Per una persona di 60 chili il consumo complessivo giornaliero di proteine dovrebbe pertanto limitarsi a 36.000-48.000 milligrammi. Le quantità non dovrebbero neppure essere inferiori per evitare la malnutrizione.
La quantità ideale di proteine per un paziente nefropatico dovrebbe essere definita da un medico.
Dosaggi in breve
Dosi giornaliere di micronutrienti consigliate in caso di BPCO | |
|---|---|
Vitamine | |
Vitamina A | 800 microgrammi (µg) |
Vitamina B6 | da 5 a 15 milligrammi (mg) |
Acido folico | da 400 a 600 microgrammi |
Vitamina B12 | 500 microgrammi |
Vitamina C | da 100 a 150 milligrammi |
Vitamina D | da 1.000 a 4.000 unità internazionali (UI) |
Complesso della vitamina E | 40 milligrammi |
Oligoelementi | |
Selenio | da 50 a 100 microgrammi |
Zinco | 15 milligrammi |
Magnesio | 250 milligrammi |
Altre sostanze | |
N-acetilcisteina | 1.200 milligrammi |
Acidi grassi omega-3 | fino a 2.000 milligrammi, con la massima percentuale possibile di EPA (1.000 milligrammi) |
Aminoacidi essenziali | 4.000 milligrammi, di cui 1.200 milligrammi di leucina e 600 milligrammi rispettivamente di valina e isoleucina |
Esami di laboratorio in breve
Esami di laboratorio consigliati in caso di BPCO | |
|---|---|
Vitamina D (siero) | da 40 a 60 nanogrammi per millilitro (ng/ml) |
Selenio (sangue intero) | da 120 a 150 microgrammi per litro (µg/l) |
Malondialdeide Siero ematico Urina |
da 0,36 a 1,4 micromoli per litro (µmol/l) da 0,2 a 1,45 micromoli per millimole di creatinina (µmol/mmol) |
Magnesio (sangue intero) | da 1,38 a 1,50 millimoli per litro (mmol/l) |
Omocisteina (plasma ematico) | fino a 10 micromoli per litro (µmol/l) |
Sostegno ai farmaci tramite i micronutrienti
La vitamina B6 riduce gli effetti collaterali della teofillina
La teofillina è una sostanza broncodilatatrice prescritta nel trattamento della BPCO. Le persone che la assumono hanno spesso livelli ridotti di vitamina B6. Uno studio mostra come l'assunzione di preparati a base di vitamina B6 allevi gli effetti collaterali della teofillina a carico del sistema nervoso.
Per compensare una possibile carenza di vitamina B6 dovuta all’impiego della teofillina, si consiglia di assumere da 20 a 50 milligrammi di vitamina B6 al giorno.
I probiotici combattono la diarrea provocata dagli antibiotici
Circa la metà di tutte le recidive acute (esacerbazioni) della BPCO è dovuta alla presenza di batteri nell’organismo, che vengono combattuti con gli antibiotici. Questi ultimi, però, attaccano anche i batteri “buoni” dell’intestino, che a loro volta tengono a bada altri agenti patogeni, come quelli che provocano la diarrea.
L'assunzione di probiotici con lattobacilli e il lievito Saccharomyces boulardii riduce i casi di diarrea dovuti al trattamento antibiotico nonché la loro intensità e durata.
Consiglio
Se invece la causa dei problemi conseguenti alla somministrazione di antibiotici è il batterio Clostridium difficile, il trattamento con il Lactobacillus casei è quello che promette il maggior sollievo.
La dose dovrebbe essere compresa tra 10 e 20 miliardi di batteri.
I probiotici devono essere assunti a distanza di due o tre ore dagli antibiotici per non esporli al loro attacco. Solo il lievito può essere ingerito contemporaneamente perché non è sensibile agli antibiotici.
Dosaggi in breve
Micronutrienti in caso di assunzione di teofillina | |
|---|---|
Vitamina B6 | da 20 a 50 milligrammi (mg) |
Micronutrienti in caso di assunzione di antibiotici | |
Probiotici con lattobacilli e lievito | da 10 a 20 miliardi di batteri |
Riepilogo
La BPCO è una malattia caratterizzata dal restringimento delle vie respiratorie i cui sintomi tipici sono difficoltà respiratorie, tosse ed espettorazione.
L’impiego dei micronutrienti ha un effetto positivo sul decorso della malattia. Al gruppo appartengono sostanze antinfiammatorie come gli acidi grassi omega-3. Inoltre l’N-acetilcisteina scioglie il muco e riduce il pericolo di recidive acute. I medici esperti in micronutrienti affrontano lo stress ossidativo che accompagna le malattie polmonari con miscele di antiossidanti contenenti le vitamine A, C ed E nonché gli oligoelementi zinco e selenio.
In presenza di BPCO si riscontra spesso anche una carenza di vitamina D, che deve essere compensata. Contro il sintomo della costrizione delle vie respiratorie la terapia a base di micronutrienti impiega il magnesio per via del suo effetto miorilassante. Se la perdita di massa muscolare diventa un problema, si può ricorrere agli aminoacidi. L’aumento dei valori ematici di omocisteina nei pazienti affetti da BPCO può essere contrastato con le vitamine del gruppo B.
I probiotici aiutano l’intestino qualora un’infezione richieda l’impiego di antibiotici. Le persone affette da BPCO e trattate con teofillina hanno spesso una carenza di vitamina B6, che deve essere integrata con un preparato.
Indice degli studi e delle fonti
Ahmadi, A. et al. (2012): Nutritional evaluation in chronic obstructive pulmonary disease patients. Pak J Biol Sci 15(10): 501–505. https://www.ncbi.nlm.nih.gov/pubmed/24187906, consultato il: 23.02.2018.
Atlantis, E. & Cochrane, B. (2016): The association of dietary intake and supplementation of specific polyunsaturated fatty acids with inflammation and functional capacity in chronic obstructive pulmonary disease: a systematic review. Int J Evid Based Healthc. 2016 Jun;14(2): 53–63. https://www.ncbi.nlm.nih.gov/pubmed/26134547, consultato il: 23.02.2018.
Aziz, H.S. (2005): Serum magnesium levels and acute exacerbations of chronic obstructive pulmonary disease: a retrospective study. Ann Clin Lab Sci 35(4): 423–427. https://www.ncbi.nlm.nih.gov/pubmed/16254259, consultato il: 23.02.2018.
Bartel, P.R. et al. (1994): Vitamin B-6 supplementation and theophylline-related effects in humans. Am J Clin Nutr. 1994 Jul;60(1): 93–99. https://www.ncbi.nlm.nih.gov/pubmed/8017343, consultato il: 23.02.2018.
Beyer,G. et al. (2021): S3-Leitlinie Pankreatitis. AWMF Registernummer 021 - 003. https://register.awmf.org/assets/guidelines/021-003l_S3_Pankreatitis_2022-04_01.pdf, consultato il: 09.03.2022.
Blasi, F. et al. (2016): The effect of N-acetylcysteine on biofilms: Implications for the treatment of respiratory tract infections. Respir Med. 2016 Aug;117: 190–197. https://www.ncbi.nlm.nih.gov/pubmed/27492531, consultato il: 23.02.2018.
Burgerstein, L. et al. (2012): Handbuch Nährstoffe – Vorbeugen und heilen durch ausgewogene Ernährung: Alles über Spurenelemente, Vitamine und Mineralstoffe. 12. Aufl.; Trias.
Cazzola, M. et al. (2015): Influence of N-acetylcysteine on chronic bronchitis or COPD exacerbations: a meta-analysis. Eur Respir Rev. 2015 Sep;24(137):451–61. https://www.ncbi.nlm.nih.gov/pubmed/26324807, consultato il: 23.02.2018.
Cazzola, M. et al. (2017): Impact of Mucolytic Agents on COPD Exacerbations: A Pair-wise and Network Meta-analysis. COPD. 2017 Oct;14(5): 552–563. https://www.ncbi.nlm.nih.gov/pubmed/28753070, consultato il: 23.02.2018.
Chambaneau, A. et al. (2016): Nutritional Intake, Physical Activity and Quality of Life in COPD Patients. Int J Sports Med. 2016 Aug;37(9):730–737. https://www.ncbi.nlm.nih.gov/pubmed/27286177, consultato il: 23.02.2018.
Dal Negro, R.W. et al. (2010): Comprehensive effects of supplemented essential amino acids in patients with severe COPD and sarcopenia. Monaldi Arch Chest Dis. 2010 Mar;73(1): 25–33. https://www.ncbi.nlm.nih.gov/pubmed/20499791, consultato il: 23.02.2018.
Dal Negro, R.W. et al. (2012): Essential amino acid supplementation in patients with severe COPD: a step towards home rehabilitation. Monaldi Arch Chest Dis. 2012 Jun;77(2): 67–75. https://www.ncbi.nlm.nih.gov/pubmed/23193843, consultato il: 23.02.2018.
Deutsche Atemwegsliga (2018): Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). Im Internet: https://www.atemwegsliga.de/copd.html?file=tl_files/eigene-dateien/copd/COPD-Leitlinie.pdf, consultato il: 23.02.2018.
Deutsche Gesellschaft für Pneumologie (2018): Was ist COPD? Im Internet: https://www.lungenaerzte-im-netz.de/krankheiten/copd/was-ist-copd/, consultato il: 23.02.2018.
Druml, W. et al. (2015): Enterale und parenterale Ernährung von Patienten mit Niereninsuffizienz. Im Internet: http://www.awmf.org/uploads/tx_szleitlinien/073-009l_S1_Ern%C3%A4hrung_enteral_parenteral_Niereninsuffizenz_2015-01.pdf, consultato il: 23.02.2018.
EFSA (European Food Safety Authority) (2012): SCIENTIFIC OPINION. Statement on the safety of β-carotene use in heavy smokers. EFSA Journal 2012;10(12):2953. https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2012.2953, consultato il 09.04.2018.
El-Attar, M. et al. (2009): Serum trace element levels in COPD patient: the relation between trace element supplementation and period of mechanical ventilation in a randomized controlled trial. Respirology. 2009 Nov;14(8): 1180–1187. https://www.ncbi.nlm.nih.gov/pubmed/19761535, consultato il: 23.02.2018.
Fimognari, F.L. et al. (2009): Hyperhomocysteinaemia and poor vitamin B status in chronic obstructive pulmonary disease. Nutr Metab Cardiovasc Dis. 2009 Nov;19(9): 654–959. https://www.ncbi.nlm.nih.gov/pubmed/19282159, consultato il: 23.02.2018.
Fowdar, K. et al. (2017): The effect of N-acetylcysteine on exacerbations of chronic obstructive pulmonary disease: A meta-analysis and systematic review. Heart Lung. 2017 Mar–Apr;46(2): 120–128. https://www.ncbi.nlm.nih.gov/pubmed/28109565, consultato il: 23.02.2018.
Fujita, S. & Volpi, E. (2006): Amino Acids and Muscle Loss with Aging. J Nutr. 2006 Jan; 136(1 Suppl): 277–280. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3183816/, consultato il: 23.02.2018.
Giudetti, A.M & Cagnazzo, R. (2012): Beneficial effects of n-3 PUFA on chronic airway inflammatory diseases. Prostaglandins Other Lipid Mediat. 2012 Dec;99(3-4): 57–67. https://www.ncbi.nlm.nih.gov/pubmed/23064030, consultato il: 23.02.2018.
Global Initiative for Chronic Obstructive Lung Disease (2017): Global Strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease 2017 report. Im Internet: goldcopd.org/download/326/, consultato il: 23.02.2018.
Greiller, C. L. et al. (2015): Modulation of the immune response to respiratory viruses by vitamin D. Nutrients. 29;7(6):4240–4270. https://www.ncbi.nlm.nih.gov/pubmed/26035247, consultato il: 23.02.2018.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Helmholtz Zentrum München (2018): COPD Diagnose. Im Internet: https://www.lungeninformationsdienst.de/krankheiten/copd/diagnose/index.html, consultato il: 23.02.2018.
Helmholtz Zentrum München (2018): Ernährung bei Lungenerkrankungen. Im Internet: https://www.lungeninformationsdienst.de/therapie/leben-mit-krankheit/ernaehrung/index.html, consultato il: 23.02.2018.
Hirai, D.M. et al. (2017): Oral N-acetylcysteine and exercise tolerance in mild chronic obstructive pulmonary disease. J Appl Physiol (1985). 2017 May 1;122(5): 1351–1361. https://www.ncbi.nlm.nih.gov/pubmed/28255088, consultato il: 23.02.2018.
Horadagoda, C. et al. (2017): Body composition and micronutrient deficiencies in patients with an acute exacerbation of chronic obstructive pulmonary disease. Intern Med J. 2017 Sep;47(9): 1057–1063. https://www.ncbi.nlm.nih.gov/pubmed/28401645, consultato il: 23.02.2018.
Ioanna, G. et al. (2010): A systematic review of the role of vitamin insufficiencies and supplementation in COPD. Respir Res. 2010; 11(1): 171. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3016352/, consultato il: 23.02.2018.
Isbaniah, F. et al. (2011): Echinacea purpurea along with zinc, selenium and vitamin C to alleviate exacerbations of chronic obstructive pulmonary disease: results from a randomized controlled trial. J Clin Pharm Ther. 36(5):568–576. https://www.ncbi.nlm.nih.gov/pubmed/21062330, consultato il: 23.02.2018.
Johnson, K. et al. (2016): High-dose oral N-acetylcysteine fails to improve respiratory health status in patients with chronic obstructive pulmonary disease and chronic bronchitis: a randomized, placebo-controlled trial. Int J Chron Obstruct Pulmon Dis. 2016 Apr 21;11: 799–807. https://www.ncbi.nlm.nih.gov/pubmed/27143871, consultato il: 23.02.2018.
Khan, N.A. et al. (2016): The Effect of Folic Acid Supplementation on Hyperhomocysteinemia and Pulmonary Function Parameters in Chronic Obstructive Pulmonary Disease: A Pilot Study. J Clin Diagn Res. 2016 Nov; 10(11): OC17–OC21. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5198374/, consultato il: 23.02.2018.
Khan, D.M. et al. (2017): Role of Vitamin D in reducing number of acute exacerbations in Chronic Obstructive Pulmonary Disease (COPD) patients. Pak J Med Sci. 2017 May-Jun;33(3): 610–614. https://www.ncbi.nlm.nih.gov/pubmed/28811780, consultato il: 23.02.2018.
Kirkil, G. et al. (2008): Antioxidant effect of zinc picolinate in patients with chronic obstructive pulmonary disease. Respir Med. 2008 Jun;102(6): 840–844. https://www.ncbi.nlm.nih.gov/pubmed/18295467, consultato il: 23.02.2018.
Kokturk, N. et al. (2018): Vitamin D deficiency: What does it mean for chronic obstructive pulmonary disease (COPD)? a compherensive review for pulmonologists. Clin Respir J. 2018 Feb;12(2): 382–397. https://www.ncbi.nlm.nih.gov/pubmed/27925404, consultato il: 23.02.2018.
Lau, C.S. (2016): Probiotics are effective at preventing Clostridium difficile-associated diarrhea: a systematic review and meta-analysis. Int J Gen Med. 2016; 9: 27–37. https://www.ncbi.nlm.nih.gov/pubmed/26955289, consultato il: 23.02.2018.
Lehouck, A. et al. (2012): High doses of vitamin D to reduce exacerbations in chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2012 Jan 17;156(2): 105–14. https://www.ncbi.nlm.nih.gov/pubmed/22250141, consultato il: 23.02.2018.
Lin, Y. et al. (2016): Supplementation of fish oil improves functional capacity and quality of life in patients with chronic obstructive pulmonary disease. Current Topics in Nutraceuticals Research; Coppell 14(3): 191–197. https://search.proquest.com/openview/ce58a6884c60c4bdf0aad5a9b1e3a028/1?pq-origsite=gscholar&cbl=136101, consultato il: 23.02.2018.
Martineau, A.R. et al. (2015): Vitamin D3 supplementation in patients with chronic obstructive pulmonary disease (ViDiCO): a multicentre, double-blind, randomised controlled trial. Lancet Respir Med. 2015 Feb;3(2): 120–130. https://www.ncbi.nlm.nih.gov/pubmed/25476069, consultato il: 23.02.2018.
Martinez de Haas, M.G. et al. (1997): Subnormal vitamin B6 levels in theophylline users. Ned Tijdschr Geneeskd. 1997 Nov 8;141(45): 2176–2179. https://www.ncbi.nlm.nih.gov/pubmed/9550799, consultato il: 23.02.2018.
Meng-Jer, H. et al. (2016): Nutritional supplementation in patients with chronic obstructive pulmonary disease. Journal of the Formosan Medical Association; 115 (8), August 2016: 595–601. https://www.sciencedirect.com/science/article/pii/S0929664615003460#sec7, consultato il: 23.02.2018.
Ng, T.P. et al. (2014): Dietary and supplemental antioxidant and anti-inflammatory nutrient intakes and pulmonary function. Public Health Nutr. 2014 Sep;17(9): 2081–2086. https://www.ncbi.nlm.nih.gov/pubmed/24074036, Consultato il: 23.02.2018.
Paulin, F.V. et al. (2017): Addition of vitamin B12 to exercise training improves cycle ergometer endurance in advanced COPD patients: A randomized and controlled study. Respir Med. 2017 Jan;122: 23–29. https://www.ncbi.nlm.nih.gov/pubmed/27993287, consultato il: 23.02.2018.
Pirabbasi, E. et al. (2013): What are the antioxidant status predictors' factors among male chronic obstructive pulmonary disease (COPD) patients? Glob J Health Sci. 2013 Jan; 5(1): 70–78.https://www.ncbi.nlm.nih.gov/pubmed/23283038, consultato il: 23.02.2018.
Pattani, R. et al. (2013): Probiotics for the prevention of antibiotic-associated diarrhea and Clostridium difficile infection among hospitalized patients: systematic review and meta-analysis. Open Med. 7(2): e56–67. https://www.ncbi.nlm.nih.gov/pubmed/24348885, consultato il: 14.12.2017.
Pirabbasi, E. et al. (2016): Efficacy of Ascorbic Acid (Vitamin C) and/N-Acetylcysteine (NAC) Supplementation on Nutritional and Antioxidant Status of Male Chronic Obstructive Pulmonary Disease (COPD) Patients. J Nutr Sci Vitaminol (Tokyo). 2016;62(1): 54–61. https://www.ncbi.nlm.nih.gov/pubmed/27117852, consultato il: 23.02.2018.
Prakash, S. et al. (2008): Serum magnesium is an independent predictor of frequent readmissions due to acute exacerbation of chronic obstructive pulmonary disease. Respiratory Medicine. 102(7), July 2008: 999–1003. https://www.sciencedirect.com/science/article/pii/S0954611108000875, consultato il: 23.02.2018.
Rossman, M.J. et al. (2013): Oxidative Stress and COPD: The Impact of Oral Antioxidants on Skeletal Muscle Fatigue. Med Sci Sports Exerc. 2013 Jul; 45(7): 1235–1243. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3947987/, consultato il: 23.02.2018.
Salve,V.T. & Atram, J.S. (2016): N-Acetylcysteine Combined with Home Based Physical Activity: Effect on Health Related Quality of Life in Stable COPD Patients- A Randomised Controlled Trial. J Clin Diagn Res. 2016 Dec;10(12): OC16–OC19. https://www.ncbi.nlm.nih.gov/pubmed/28208905, consultato il: 23.02.2018.
Sanguinetti, C.M. (2016): N-acetylcysteine in COPD: why, how, and when? Multidiscip Respir Med. 2016 Feb 3;11: 8. https://www.ncbi.nlm.nih.gov/pubmed/26855777, consultato il: 23.02.2018.
Shen, N.T. et al. (2017): Timely Use of Probiotics in Hospitalized Adults Prevents Clostridium difficile Infection: A Systematic Review With Meta-Regression Analysis. Gastroenterology. 2017 Jun;152(8):1889–1900. https://www.ncbi.nlm.nih.gov/pubmed/28192108, consultato il: 23.02.2018.
Skorodin, M.S. et al. (1995): Magnesium sulfate in exacerbations of chronic obstructive pulmonary disease. Arch Intern Med 155(5): 496–500. https://www.ncbi.nlm.nih.gov/pubmed/7864705, consultato il: 23.02.2018.
Sluyter, J.D. et al. (2017): Effect of Monthly, High-Dose, Long-Term Vitamin D on Lung Function: A Randomized Controlled Trial. Nutrients. 2017 Dec 13;9(12). pii: E1353. doi: 10.3390/nu9121353. https://www.ncbi.nlm.nih.gov/pubmed/29236049, consultato il: 23.02.2018.
Steinbrenner, H. et al. (2015): Dietary Selenium in Adjuvant Therapy of Viral and Bacterial Infections. Adv Nutr. 6(1):73–82. https://www.ncbi.nlm.nih.gov/pubmed/25593145, consultato il: 23.02.2018.
Tanaka, I. et al. (1996): Serum concentrations of the pyridoxal and pyridoxal-5'-phosphate in children during sustained-release theophylline therapy. Arerugi. 1996 Oct;45(10): 1098–1105. https://www.ncbi.nlm.nih.gov/pubmed/8958656, consultato il: 23.02.2018.
Terence, A.R. et al. (2007): Plasma homocysteine is elevated in COPD patients and is related to COPD severity. Int J Chron Obstruct Pulmon Dis. 2007 Sep; 2(3): 313–321. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2695192/, consultato il: 23.02.2018.
von Essen, M.R. et al. (2010): Vitamin D controls T cell antigen receptor signaling and activation of human T cells. Nat Immunol. Apr;11(4):344–9. https://www.ncbi.nlm.nih.gov/pubmed/?term=Vitamin+D+controls+T+cell+antigen+receptor+signaling+and+activation+of+human+T+cells, consultato il: 23.02.2018.
Wood, L.G. (2015): Omega-3 polyunsaturated fatty acids and chronic obstructive pulmonary disease. Curr Opin Clin Nutr Metab Care. 2015 Mar;18(2): 128–132. https://www.ncbi.nlm.nih.gov/pubmed/25581034, consultato il: 23.02.2018.
Zhu, M. et al. (2016): The association between vitamin D and COPD risk, severity, and exacerbation: an updated systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis. 2016 Oct 19;11: 2597–2607. https://www.ncbi.nlm.nih.gov/pubmed/27799758, consultato il: 23.02.2018.