COPD ist eine chronische Lungenerkrankung: Die Atemwege sind verengt und entzündet. Das führt zu Beschwerden wie Husten, Verschleimung und Atemnot. Mikronährstoffe können den Verlauf einer COPD positiv beeinflussen, ihr Fortschreiten verlangsamen und Symptome mildern. Hier erfahren Sie, wie.

Ursachen und Symptome
Symptome einer COPD
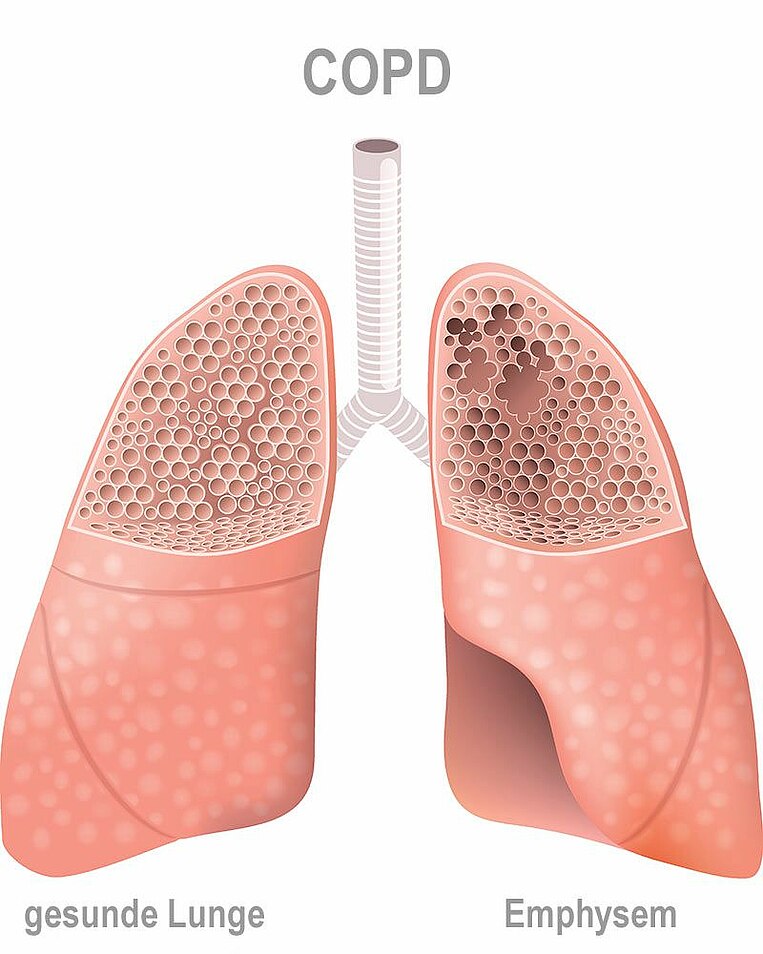
Bei der chronisch-obstruktiven Lungenerkrankung (chronic obstructive pulmonary disease (COPD)) kommen zwei Dinge zusammen: eine chronische Entzündung (Bronchitis) sowie eine Verengung der Atemwege. Damit ist das Atmen behindert – vor allem das Ausatmen. Es wird vermehrt Schleim produziert, der nur schlecht abtransportiert werden kann. Typische Symptome sind Husten und schleimiger Auswurf.
Bei einigen Betroffenen bleibt es bei einer Verengung der Atemwege, insbesondere der Bronchien. Manchmal kollabieren aber feinste Bronchialäste, sodass die Luft aus den Lungenbläschen nicht ausströmen kann. Die Lungenbläschen überblähen und werden mit der Zeit zerstört. Dieser Prozess wird auch als Lungenemphysem bezeichnet. In der Folge kann Sauerstoff und Kohlendioxid nur schlecht ausgetauscht werden. Dann sinkt der Sauerstoffgehalt im Blut. Es tritt Atemnot (Dyspnoe) auf. Zu Beginn der Lungenerkrankung merkt man das meist nur bei körperlicher Belastung, im weiteren Krankheitsverlauf auch im Ruhezustand. Typische Anzeichen einer COPD sind daher abnehmende Leistungsfähigkeit und Müdigkeit.
Bei einer COPD kommt es zu schubweisen Verschlechterungen, sogenannten Exazerbationen.
Info
Laut Definition steht COPD für beide Lungenkrankheiten, also für die chronisch-obstruktive Bronchitis und für die chronisch-obstruktive Bronchitis plus Lungenemphysem.
Ursachen der COPD
Die COPD entwickelt sich meist aus einer chronischen Bronchitis (zum Beispiel durch Rauchen oder jahrelangen Kontakt mit Luftschadstoffen). Aufgrund einer chronischen Entzündung wird Lungengewebe durch körpereigene Enzyme angegriffen (Selbstverdauung). Dabei werden auch elastische Strukturen in den Bronchien geschädigt. Auch Bakterien und Viren können zur Lungenschädigung beitragen.
Eine COPD wird jedoch nicht immer von äußeren Faktoren verursacht, sondern kann auch erblich bedingt sein: So begünstigt ein sogenannter Alpha-1-Antitrypsin-Mangel den Angriff des entzündeten Lungengewebes. Alpha-1-Antitrypsin ist ein Eiweiß, das für den Schutz der Lunge wichtig ist.
Info
Unterschied zwischen Dauerhusten (chronische Bronchitis) und COPD: Bei Dauerhusten mit Verschleimung ist meist eine „einfache“ chronische Bronchitis die Ursache. Bei dieser Form löst eine Entzündung die Symptome aus. Sie ist im Prinzip heilbar, besteht aber meist lebenslang. Durch eine zusätzliche Lungenschädigung entwickelt sich COPD: Die Bronchien verengen sich durch die Entzündung und die Gewebeschädigung dauerhaft. Bei einem Teil der Betroffenen erfolgt auch eine Schädigung der Lungenbläschen. Das beeinträchtigt die Lungenleistung besonders schwer. Die Schädigungen bei COPD heilen nicht mehr aus.
Diagnose der COPD: Einteilung nach Schweregrad
Laut offizieller Leitlinie gibt es verschiedene Schweregrad einer COPD. Zur Einteilung dienen zwei Kriterien:
1. Der Lungenfunktionswert zeigt, wie stark die Funktion der Lunge beeinträchtigt ist. Dazu wird das Luftvolumen gemessen, das ein Betroffener innerhalb einer Sekunde ausatmen kann. Diesen Wert nennen Mediziner exspiratorische Einsekundenkapazität. Man kürzt ihn mit FEV1 ab (Forced Expiratory Volume in 1 Second). Die FEV1-Sollwerte werden individuell berechnet und hängen von der Körpergröße, dem Alter und dem Geschlecht ab. Der Schweregrad der COPD ist abhängig davon, wieviel Prozent des Sollwertes erreicht werden:
- GOLD 1: FEV1 80 Prozent des Sollwertes oder mehr
- GOLD 2: FEV1 50 bis zu 80 Prozent des Sollwertes
- GOLD 3: FEV1 30 bis zu 50 Prozent des Sollwertes
- GOLD 4: FEV1 weniger als 30 Prozent des Sollwertes
2. Ein ABCD-Einteilungsschema ergänzt die GOLD-Klassifizierung. Berücksichtigt werden die Anzahl der akuten Verschlechterungsschübe im vergangenen Jahr sowie der Leidensdruck. A bedeutet, es gibt kaum eine Verschlechterung und nur wenige Symptome; bei D sind es dagegen viele.
Bei COPD kommt es manchmal zu Folgeerkrankungen – zum Beispiel zu einer Herzschwäche oder zu Herzrhythmusstörungen. Bei schwacher Herzleistung entstehen Wassereinlagerungen im Gewebe (Ödeme). COPD macht zudem anfälliger für Atemwegsinfektionen. Bei körperlicher Inaktivität aufgrund von Atemnot drohen Muskel- und Knochenabbau.
Ziele der Behandlung
Wie wird eine COPD klassisch behandelt?
COPD ist nicht heilbar. Bei der Therapie kommen daher nur Medikamente zum Einsatz, welche die Beschwerden lindern. Sie helfen, Verschlechterungen (Exazerbationen) und Komplikationen zu vermeiden:
- Bronchodilatatoren mit Wirkstoffen wie Beta-2-Sympathomimetika (Ventolin®, Serevent®) oder Anticholinergika (Spiriva®, Bretaris®) erweitern die Bronchien und erleichtern das Atmen. Wesentlich seltener wird heute Theophyllin eingesetzt (Unifyl®, Aminophyllin®).
- Entzündungshemmer lindern die entzündliche Reizung und Schwellung in den Bronchien. Sie sollten bei COPD aufgrund möglicher Nebenwirkungen jedoch nicht für einen längeren Zeitraum eingesetzt werden. Typische Medikamente sind cortisonhaltige Inhalationspräparate (AeroBec®, Avamys®), sogenannte Glukokortikoide, und Phosphodiesterase-4-Hemmer (Roflumilast wie Daxas®).
Bei Bedarf kommen weitere Medikamente zum Einsatz: Antibiotika können die Keimbelastung der Lunge senken und damit die Gefahr für Infektionen verringern. Auch Schleimlöser und Hustenmittel werden manchmal vom Arzt verordnet. Schutzimpfungen, etwa gegen Grippe oder Pneumokokken, können begleitende Infekte sowie Lungenentzündungen verhindern.
Körperliches Training, Gymnastik und Atemübungen können die Belastbarkeit von COPD-Betroffenen verbessern und Symptome lindern. Ebenso profitieren sie von einer Sauerstofftherapie mit einem Beatmungsgerät.
Auch Lebensstil und Ernährung spielen eine Rolle: Häufig liegt eine Mangel- oder Fehlernährung vor. Sowohl Übergewicht als auch Untergewicht können den Verlauf verschlechtern. Beides ist zu vermeiden. Um zu verhindern, dass sich die Lungenfunktion weiter verschlechtert, sollten Betroffene mit dem Rauchen aufhören sowie alle Lungenbelastungen am Arbeitsplatz vermeiden.
Sind alle Therapiemaßnahmen ausgeschöpft, kommt auch eine Lungentransplantation in Betracht.
Ziele der Mikronährstoffmedizin
Durch ergänzende Mikronährstoffe lässt sich der Verlauf einer COPD günstig beeinflussen:
- Als Schleimlöser sorgt N-Acetylcystein für leichteres Abhusten.
- Omega-3-Fettsäuren bekämpfen die entzündliche Neigung.
- Entspannendes Magnesium soll die Bronchien erweitern.
- Antioxidatives Vitamin A, C und E schützen vor oxidativem Stress.
- Die Stärkung des Immunsystems durch Vitamin D senkt das Infektionsrisiko.
- B-Vitamine senken erhöhtes Homocystein.
- Aminosäuren oder Eiweiße sind bei Mangelernährung und dadurch bedingtem Muskelabbau sinnvoll.
Info
Zudem könnten Pflanzenstoffe bei COPD hilfreich sein. Vor allem Efeu wird traditionell gegen Husten eingesetzt. Laut Tier- und Laborstudien fördert er die Produktion einer Schutzschicht in der Lunge (Surfactant). Damit wird das Zusammenfallen der Lungenbläschen reduziert und ihre Dehnbarkeit erhöht. Außerdem entspannen sich durch Efeu die Muskelzellen in den Bronchien, was die Verengung lindert. Daneben schwächt er die Entzündung ab.
Erste Daten sprechen in Kombination mit Chinesischem Goldfaden für einen Nutzen bei Menschen mit COPD. Da jedoch weitere Studien fehlen, sollten Behandlungsversuche bei COPD vorerst unter ärztlicher Kontrolle erfolgen. Zur Wirkung von Efeu bei Bronchitis und Husten allgemein gibt es bereits eine lange Erfahrung.
Behandlung mit Mikronährstoffen
N-Acetylcystein: Schleimlöser, Bakterienvernichter, Antioxidans
Wirkweise von N-Acetylcystein bei COPD
Bei COPD wirkt N-Acetylcystein (NAC) auf dreifache Weise:
- Schleimlösung: N-Acetylcystein verflüssigt den Schleim in den Atemwegen, sodass er besser abgehustet werden kann. Die Forschung zeigt, dass N-Acetylcystein die Beschwerden bei COPD mildert und es seltener zu Verschlechterungen kommt. Auch belegt eine Studie, dass N-Acetylcystein zusammen mit regelmäßiger Bewegung die Lebensqualität von Personen mit stabiler COPD verbessert.
- Bekämpfung von Bakterien: Eine ungünstige bakterielle Besiedelung oder Infektionen können eine bestehende COPD verschlechtern. Einige Bakterien bilden zu ihrem Schutz eine Schleimschicht (Biofilm), was die Behandlung mit Antibiotika erschwert. N-Acetylcystein kann diese Biofilme zerstören und die Krankheitserreger möglicherweise angreifbar machen.
- Oxidativer Stress: N-Acetylcystein hilft dabei, körpereigene Antioxidantien wie Glutathion zu regenerieren. Glutathion wirkt gegen oxidativen Stress, der im Zusammenhang mit COPD häufig vorkommt und das Lungengewebe schädigt.
Fazit: N-Acetylcystein kann bei längerer Einnahme über sechs Monate eine akute Verschlechterung sowie die Symptome vermindern. Allerdings hat es nach großen Auswertungen der verfügbaren Studien nicht bei allen Personen eine Wirkung. Vermutlich profitieren Personen am meisten, die nicht mit inhalativen Glukokortikoiden behandelt werden.
N-Acetylcystein: Dosierung und Einnahmeempfehlung
Um eine akute Verschlimmerung einer COPD zu vermeiden, wird empfohlen, täglich 600 bis 1.200 Milligramm N-Acetylcystein einzunehmen. Diese Dosierung gilt auch für Patienten mit chronischer Bronchitis, wenn sie Anzeichen einer Luftwegeverengung aufweisen. Die Studien zeigen, dass N-Acetylcystein über längere Zeiträume (6 Monate) genommen werden muss, um eine Wirkung zu entfalten.
Für eine gute Verträglichkeit sollte die Gesamtdosis in mehreren kleinen Dosen über den Tag verteilt ergänzt werden.
N-Acetylcystein: zu beachten in der Schwangerschaft, bei Erkrankungen und bei Medikamenteneinnahme
Für die Anwendung von N-Acetylcystein bei Schwangeren und Stillenden gibt es noch zu wenig Anhaltspunkte. Darum sollte über die Anwendung ein Arzt entscheiden.
Sprechen Sie auch in den folgenden Fällen die Einnahme mit Ihrem Arzt ab:
- Asthma: Es kann zu allergischen Reaktionen mit einer Verengung der Atemwege kommen.
- Histaminintoleranz: N-Acetylcystein könnte die Intoleranz verschlimmern.
- Magen-Darm-Geschwüre oder Krampfadern im Magen-Darm-Trakt: Es gibt Bedenken, dass die Einnahme von N-Acetylcystein Blutungen auslösen könnte.
Eine Kombination von N-Acetylcystein mit Hustenstillern (Codyl®, Monapax®) darf nicht erfolgen. Aufgrund des eingeschränkten Hustenreflexes ist ein gefährlicher Sekretstau möglich.
N-Acetylcystein kann die Wirkung einiger Antibiotika abschwächen wie Tetracycline (Tetracyclin Wolff®), Aminoglykoside (Amikacin®) und Penicilline (Penicillin Sandoz®). Daher sollten sie mit einem Abstand von mindestens zwei Stunden eingenommen werden.
Möglicherweise verstärkt N-Acetylcystein die Wirkung von gefäßerweiternden Medikamenten mit dem Wirkstoff Nitroglycerin (Corangin®, Nitrangin®). Es besteht die Gefahr, dass der Blutdruck stark sinkt. Kombinieren Sie die Präparate daher nur nach Rücksprache mit Ihrem Arzt.
Vitamin D verbessert die Lungenfunktion
Wirkweise von Vitamin D bei COPD
Etwa 30 bis 75 Prozent der Menschen mit COPD haben einen Vitamin-D-Mangel. Dabei wäre das Vitamin sehr wichtig bei der Behandlung der Erkrankung: Es stärkt das Immunsystem und hilft, Erreger abzuwehren und Entzündungsprozesse zu beenden. Ein Mangel an Vitamin D gilt als Risikofaktor für Atemwegserkrankungen. Auch haben Personen mit Vitamin-D-Mangel ein höheres Risiko für eine COPD oder eine schwere Form der COPD.
Ein Übersichtsartikel zeigt, dass akute COPD-Verschlechterungen seltener auftreten, wenn Betroffene Vitamin-D-Präparate über einen Zeitraum von mehr als drei Monaten einnehmen. Positive Effekte sieht man aber möglicherweise nur, wenn ein akuter Vitamin-D-Mangel besteht. Das vermuten Forscher in einer weiteren Übersichtsarbeit.
Außerdem zeigt eine der beiden Übersichtsarbeiten, dass sich die Lungenfunktion bei einigen Personen durch Vitamin D besserte. Getestet wurden neben Patienten mit COPD auch Asthmatiker und Raucher.
Eine gute Vitamin-D-Versorgung hilft zudem dabei, häufigen Begleiterkrankungen bei COPD vorzubeugen, etwa Osteoporose und Muskelschwäche. Vitamin D sorgt dafür, dass der Körper Calcium für die Knochen aus dem Darm aufnimmt.
Vitamin D: Dosierung und Einnahmeempfehlung bei COPD
Bei einer COPD wird empfohlen, Vitamin D einzunehmen. Die Einnahme sollte täglich erfolgen. Eine monatliche Gabe ist möglicherweise weniger wirksam. Dazu ist eine tägliche Dosis von 1.000 bis 4.000 Internationalen Einheiten angemessen – dies ist jedoch nur ein Schätzwert.
Grundsätzlich richtet sich die genaue Dosis nach den Blutwerten. Als Faustregel für eine langsame, dauerhafte Erhöhung des Vitamin-D-Spiegels gilt: 1.000 Internationale Einheiten Vitamin D pro Tag zusätzlich zur körpereigenen Bildung von etwa 4.500 Internationalen Einheiten erhöhen den Vitamin-D-Spiegel um 10 Nanogramm pro Milliliter.
Da Vitamin D fettlöslich ist, sollte man es für eine gute Aufnahme im Darm zum Essen einnehmen.
Vitamin-D-Status im Labor bestimmen
Mikronährstoff-Experten empfehlen bei COPD, den Vitamin-D-Spiegel regelmäßig prüfen zu lassen (zweimal im Jahr). So kann ein Mangel rechtzeitig erkannt und behoben werden.
Der Vitamin-D-Spiegel wird im Blutserum ermittelt – und zwar durch die Transportform 25(OH)-Vitamin D (Calcidiol). Ein Wert von 40 bis 60 Nanogramm pro Milliliter Blut gilt als optimal.
Vitamin D: zu beachten bei Erkrankungen und Medikamenteneinnahme
Personen mit Nierenerkrankungen sollten Vitamin D nicht ohne Rücksprache mit dem Arzt einnehmen: Sie haben einen gestörten Mineralstoffhaushalt und manchmal zu hohe Calciumspiegel im Blut. Da Vitamin D die Calciumaufnahme im Darm fördert, können die Calciumspiegel zu stark ansteigen. Auch Personen mit Nierensteinen (calciumhaltigen Steinen) müssen aufpassen.
Bei der entzündlichen Bindegewebserkrankung Sarkoidose (Morbus Boeck) sollte Vitamin D nur unter ärztlicher Kontrolle ergänzt werden: Betroffene haben auch häufig hohe Calciumspiegel.
Entwässerungsmedikamente (Diuretika) aus der Gruppe der Thiazide senken die Ausscheidung von Calcium über die Nieren – der Calciumspiegel im Blut ist erhöht. Vitamin D darf nur zusammen mit Thiaziden eingenommen werden, wenn der Calciumspiegel regelmäßig überprüft wird. Dies gilt für die Wirkstoffe Hydrochlorothiazid (Esidrix®), Xipamid (Aquaphor®) und Indapamid (Natrilix®).
Omega-3-Fettsäuren stoppen Entzündungen
Wirkweise von Omega-3-Fettsäuren bei COPD
Bei einer COPD sind die unteren Atemwege häufig entzündet – vor allem wenn die Lungen zusätzlich durch eine Luftverschmutzung belastet sind. Die Omega-3-Fettsäuren Eicosapentaensäure (EPA) und Docosahexaensäure (DHA) dämmen die Entzündungsprozesse ein: Aus ihnen stellt der Körper Stoffe her, die eine Entzündung aktiv beenden. Die Wirkung von Omega-3-Fettsäuren bei verschiedenen entzündlichen Erkrankungen wie Gelenk- und Darmentzündungen oder Arteriosklerose wird zunehmend belegt.
Bei COPD gibt es erste Hinweise anhand von Blutuntersuchungen: Personen mit höheren Omega-3-Fettsäure-Werten im Blut haben einen deutlich leichteren Erkrankungsverlauf.
Zudem lassen erste klinische Studien mit Omega-3-Fettsäure-Präparaten eine positive Wirkung annehmen: Eine Studie zeigt, dass die behandelten Personen körperlich belastbarer waren. Die Autoren beschreiben außerdem eine langsamere Verschlechterung der Lungenfunktion sowie eine verbesserte Lebensqualität der Betroffenen. Zusammen mit Eiweiß und Vitamin D könnten Omega-3-Fettsäuren dazu beitragen, dass der Ernährungszustand und die Leistungsfähigkeit bei COPD verbessert. Das belegt eine kleine hochwertige Studie und zwei Übersichtsarbeiten.
Weitere Untersuchungen müssen sich anschließen, um den Sachverhalt genau zu klären. Zum Beispiel konnte man nicht in jeder Studie fallende Entzündungswerte im Blut nachweisen.
Omega-3-Fettsäuren: Dosierung und Einnahmeempfehlung bei COPD
Begleitend zur Behandlung einer COPD empfehlen Mikronährstoff-Experten täglich 1.000 bis 2.000 Milligramm Omega-3-Fettsäuren mit einem möglichst hohen EPA-Anteil (1.000 Milligramm). EPA wirkt stark entzündungshemmend. Am besten nimmt der Körper Omega-3-Fettsäuren auf, wenn man sie zu den Mahlzeiten einnimmt.
Tipp
Fischöl-Präparate unterscheiden sich stark in der Qualität: Hochwertige Präparate werden von Schadstoffen gereinigt. Krillöl ist von Natur aus hochwertiger, denn es enthält grundsätzlich weniger Schadstoffe.
Omega-3-Fettsäuren: zu beachten bei Erkrankungen und Medikamenteneinnahme
Menschen mit einer akuten Lebererkrankung sowie einer akuten Gallen- oder Bauchspeicheldrüsenentzündung sollten keine Omega-3-Fettsäuren einnehmen.
Da hoch dosierte Omega-3-Fettsäuren die Blutgerinnung herabsetzen könnten, sollten Sie vor Operationen Präparate in Absprache mit Ihrem Arzt besser absetzen. Personen mit Blutgerinnungsstörungen sollten auf die zusätzliche Einnahme von Omega-3-Fettsäuren verzichten.
Ab einer Dosis über 1.000 Milligramm täglich können Omega-3-Fettsäuren die Wirkung von blutverdünnenden Arzneimitteln (Falithrom®, Marcumar®) verstärken. Wenn Sie diese Medikamente einnehmen, sollten Sie die Einnahme von Omega-3-Fettsäuren mit Ihrem Arzt besprechen.
Möglicherweise beeinflussen Omega-3-Fettsäuren den Blutzucker. Daher sollten Diabetiker, die Medikamente einnehmen, ihre Blutzuckerwerte zu Beginn der Einnahme häufiger kontrollieren, um eine Unterzuckerung zu vermeiden. Eventuell ist eine Anpassung der Medikamente nötig.
Erleichtert Magnesium das Atmen?
Wirkweise von Magnesium bei COPD
Magnesium entspannt die Muskulatur der Bronchien und erweitert die Atemwege – das könnte bei COPD-Patienten das Atmen erleichtern.
Untersuchungen zeigen, dass Personen mit COPD deutlich weniger Magnesium zu sich nehmen als gesunde. Wenn der Magnesiumspiegel bei einer COPD sinkt, steigt die Reizbarkeit der Atemwege und die Lungenfunktion ist zunehmend beeinträchtigt. Während eines Exazerbationsschubs ist der Magnesiumspiegel niedriger als bei Personen mit einer stabilen COPD. Es gibt somit verschiedene indirekte Hinweise darauf, dass Magnesium bei COPD helfen könnte.
Darüber hinaus liegen erste Daten zur gezielten Magnesiumtherapie vor: In ersten kleinen hochwertigen Studien erreichten Forscher mit Magnesium und der Standardtherapie ein besseres Lungenvolumen als mit der Standardtherapie allein. Magnesium wurde hier über die Vene (intravenös) gegeben. Darüber hinaus könnte die Einnahme von Präparaten sinnvoll sein: In einer ersten Studie senkte Magnesium die Entzündungswerte im Blut. Das könnte wichtig sein, denn COPD wird durch eine Entzündung mit ausgelöst. Es hatte jedoch kaum Einfluss auf die Symptome.
Dosierung und Einnahmeempfehlung
Achten Sie bei einer COPD auf eine ausreichende Magnesiumzufuhr. Sinnvoll sind 150 bis 250 Milligramm Magnesium pro Tag in Form von Mineralstoffpräparaten. Bei einem Magnesiummangel empfehlen Mikronährstoff-Experten für einen festgelegten Zeitraum auch zwischen 300 und 600 Milligramm.
Für eine gute Verträglichkeit sollten Präparate zum Essen eingenommen werden.
Magnesiumspiegel im Labor ermitteln
Bei COPD kann es sinnvoll sein, den Magnesiumspiegel zu prüfen und die Dosis bei einem Mangel entsprechend anzupassen. Um festzustellen, ob ein Magnesiummangel besteht, wird der Spiegel im Vollblut gemessen. Als normal gelten Werte von 1,38 bis 1,50 Millimol Magnesium pro Liter Vollblut.
Magnesium: zu beachten bei Nierenerkrankungen und Medikamenteneinnahme
Schwache Nieren können überschüssiges Magnesium nicht ausscheiden. Personen mit Nierenerkrankungen sollten es daher nicht über Präparate einnehmen. Sonst besteht die Gefahr, dass sich Magnesium im Blut anreichert.
Magnesium vermindert die Wirkung von Antibiotika aus der Wirkstoffgruppe der Gyrasehemmer (Ciloxan®, Ciprobay®) und Tetrazycline (Doxycyclin®, Doxybene®). Auch die Wirkung von Arzneimitteln bei Osteoporose (Bisphosphonate wie Fosamax®, Bondronat®) wird herabgesetzt. Halten Sie einen Einnahmeabstand von zwei Stunden ein.
Antioxidantien reduzieren oxidativen Stress
Wirkweise von Antioxidantien bei COPD
Bei Patienten mit COPD tritt vermehrt oxidativer Stress auf. Dies bedeutet: Freie Radikale schädigen die Zellen – vor allem in der Lunge. Dadurch werden entzündliche Vorgänge weiter angeheizt, was zu einer laufenden Lungenschädigung führt. Antioxidantien machen freie Radikale normalerweise unschädlich. Allerdings zeigen Studien, dass COPD-Patienten zu wenig Antioxidantien im Blut haben. Marker für oxidativen Stress sind dagegen höher. Folgende Antioxidantien sind bei COPD wichtig:
- Vitamin A: Eine hohe Vitamin-A-Zufuhr über die Ernährung halbiert das Risiko, an COPD zu erkranken. Hohe Vitamin-A-Blutwerte sind mit einer besseren Lungenfunktion verbunden.
- Vitamin C und E: Atemgeräusche, Auswurf und Atemnot kommen bei COPD-Patienten häufiger vor, wenn die Blutspiegel an Vitamin C und E niedrig sind. Zudem ist der Spiegel dieser Vitamine bei einer akuten Verschlechterung geringer als in stabilen Krankheitsphasen. Ein hoher Status steht hingegen in Verbindung mit einer besseren Lungenfunktion. Für die Ergänzung von Vitamin C zur Standardtherapie stellten Forscher eine langsamere Verschlechterung fest. Allerdings verbesserte sich die Lungenfunktion kaum. Die Sterblichkeitsrate ist eventuell geringer bei Betroffenen, die Vitamin-E-Präparate einnehmen.
- Zink und Selen: Die Spiegel der Spurenelemente Zink und Selen sind bei Personen mit COPD verringert – vor allem bei Schwerkranken. Durch Ergänzung von Zink und Selen mussten Personen in einer Studie weniger lange künstlich beatmet werden. In einer anderen Studie verbesserten Zink und Selen mit Vitamin E zusätzlich zum körperlichen Training die Muskelstärke im Vergleich zu einem Scheinmedikament.
Zurzeit geht man davon aus, dass eine gute Versorgung mit Antioxidantien den Ernährungszustand der COPD-Patienten verbessert und dadurch das Risiko für Komplikationen (zum Beispiel Infektionen) verringert. Schädliche Folgen des Rauchens können Antioxidantien allerdings nicht beheben.
Antioxidantien: Dosierung und Einnahmeempfehlung
Grundsätzlich zeigt die Studienlage, dass es am besten ist, Antioxidantien in ihrer natürlichen Zusammensetzung über die Nahrung aufzunehmen: Hoch dosierte Vitamine in isolierter Form − zum Beispiel Vitamin E ausschließlich als alpha-Tocopherol oder die Vitamin-A-Vorstufe Beta-Carotin − eignen sich alleine nicht zur Verbesserung der Symptome bei einer COPD. Es gibt sogar Hinweise, dass sie etwa für Raucher schädlich sein könnten.
Ist eine abwechslungsreiche Ernährung nicht gewährleistet, sollten Präparate natürlich zusammengesetzte und niedrig dosierte Antioxidantien-Mischungen enthalten. Dadurch entsprechen sie so gut wie möglich natürlichen Lebensmitteln. Sinnvoll sind pro Tag bis zu 800 Mikrogramm Vitamin A, 100 bis 150 Milligramm Vitamin C, 20 bis 40 Milligramm Vitamin E, 50 bis 100 Mikrogramm Selen und 10 bis 15 Milligramm Zink. Dabei sollte Vitamin E als Komplex ergänzt werden, der alle Formen (Tocopherole und Tocotrienole) enthält. Es gibt Hinweise, dass vor allem Tocotrienole gegen Entzündungen helfen.
Nehmen Sie die Kapseln oder Tabletten zum Essen ein, da der Körper die Vitamine A und E nur zusammen mit Fett gut aufnehmen kann.
Tipp
Selen in Form von Natriumselenit und Vitamin C sollten nicht zeitgleich eingenommen werden: Durch Natriumselenit wird Vitamin C in eine Form umgewandelt, die der Körper nicht aufnehmen kann. Zwischen der Einnahme sollte deshalb ein Abstand von ein bis zwei Stunden liegen. Alternativ kann man Präparate mit Natriumselenat (und nicht Natriumselenit) wählen. Die Aufnahme wird so nicht beeinträchtigt.
Den oxidativen Stress im Labor bestimmen lassen
Besonders, wenn Sie hoch dosierte Präparate einnehmen, ist es sinnvoll, den Bedarf an Antioxidantien und/oder den oxidativen Stress bestimmen zu lassen. Je nach Labor gibt es verschiedene Tests. Dazu dient zum Beispiel der Marker Malondialdehyd. Er zeigt, in welchem Maße die ungesättigten Fettsäuren durch freie Radikale geschädigt werden. Der Malondialdehyd-Spiegel kann sowohl im Blutserum als auch im Urin gemessen werden. Werte von 0,36 bis 1,4 Mikromol pro Liter Blut oder im Urin 0,2 bis 1,45 Mikromol pro Millimol Kreatinin gelten als normal.
Auch kann der Arzt die Vitamine und Mineralstoffe im Blut messen lassen, zum Beispiel Selen. Normale Werte im Vollblut sollten zwischen 120 und 150 Mikrogramm pro Liter liegen. Liegt der Selenwert über 150 Mikrogramm pro Liter, sollte es nicht zusätzlich aufgenommen werden.
Antioxidantien: zu beachten in der Schwangerschaft, bei Nierenerkrankungen und Medikamenteneinnahme
In der Schwangerschaft sollten Sie auf zusätzliches Vitamin A verzichten: Wird es überdosiert, kann es das ungeborene Kind schädigen. Eine geschwächte Niere kann Vitamin A, Zink und Selen schlechter abbauen und ausscheiden. Die Kontrolle der Blutwerte ist notwendig, um eine Überdosierung zu vermeiden.
Einige verschreibungspflichtige Arzneimittel zur Behandlung von Hauterkrankungen enthalten Retinoide, die zu Vitamin A umgewandelt werden können. Zusammen mit Vitamin A könnten sie zu einer Überdosierung beitragen. Dann sollte man mit dem Arzt sprechen, ob man noch Vitamin A einnehmen kann.
B-Vitamine senken das Thromboserisiko bei COPD
Wirkweise von B-Vitaminen bei COPD
Homocystein ist ein Stoff, der natürlicherweise im Stoffwechsel entsteht. In größeren Mengen kann Homocystein schädliche Wirkungen haben, zum Beispiel auf das Herz-Kreislauf-System (Arteriosklerose). Homocystein wird im Körper entgiftet, wenn ausreichend B-Vitamine verfügbar sind. Dies sind vor allem Vitamin B6, B12 sowie Folsäure.
Untersuchungen zeigen, dass Personen mit COPD einen niedrigen Vitamin-B-Status haben und vermutlich einen erhöhten Homocysteinspiegel. Das könnte das Risiko für Herz-Kreislauf-Erkrankungen erhöhen. Übereinstimmend damit stellten Forscher fest, dass COPD-Patienten ein gesteigertes Risiko für Gefäßverstopfungen (Thrombosen) haben.
Man vermutet, dass bei niedrigerem Homocysteinspiegel nicht nur Folgeerkrankungen bei COPD seltener vorkommen, sondern auch mit einem langsameren Fortschreiten verbunden sind. Hochwertige Studien fehlen aber noch. Auf alle Fälle könnte Vitamin B12 dabei helfen, die Ausdauerleistung von Menschen mit COPD zu steigern. Das zeigt eine hochwertige Studie.
B-Vitamine: Dosierung und Einnahmeempfehlung bei COPD
Mikronährstoff-Experten empfehlen bei COPD eine gute Versorgung mit B-Vitaminen. Dies erreicht man zum Beispiel mit 2 bis 3 Milligramm Vitamin B6, 2 bis 5 Mikrogramm Vitamin B12 und 200 bis 400 Mikrogramm Folsäure. Damit Präparate gut vertragen werden, sollte die Einnahme zum Essen erfolgen.
Ist der Homocysteinspiegel bereits erhöht, ordnen Mikronährstoff-Experten für eine festgelegte Zeit auch höhere Mengen an. Alles Wichtige dazu finden Sie hier.
Homocysteinwerte im Labor bestimmen
Der Homocysteinstatus wird im Blutplasma gemessen. Werte von bis zu 10 Mikromol Homocystein pro Liter gelten als normal. Ab einem Wert von 15 Mikromol Homocystein pro Liter spricht man von einer Homocysteinämie, einem erhöhten Homocysteinspiegel.
B-Vitamine: zu beachten in der Schwangerschaft, bei Erkrankungen und Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sollten Sie hohe Dosen an Folsäure, Vitamin B6 und B12 nur bei einem nachgewiesenen Mangel und nach Absprache mit dem Frauenarzt einnehmen.
Personen mit Nierenerkrankungen sollten Vitamin B12 nur in Form von Methylcobalamin einnehmen, nicht aber als Cyanocobalamin. Es gibt Hinweise darauf, dass Cyanocobalamin in hohen Dosen schädlich ist. Personen mit beeinträchtigter Nieren- und Leberfunktion können erhöhte Vitamin-B12-Blutwerte haben.
Gegen Infektionskrankheiten werden Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®) eingesetzt. Folsäure vermindert die Wirkung dieser Medikamente.
Mit Aminosäuren Muskelabbau verhindern
Wirkweise von Aminosäuren bei COPD
Rund ein Drittel der Personen mit einer mäßigen bis schweren COPD zeigen Muskelabbau. Mediziner bezeichnen diesen Prozess als Sarkopenie. Die durch den Muskelabbau zusätzlich eingeschränkte Belastungsfähigkeit führt oft dazu, dass COPD-Patienten körperliche Bewegung vermeiden, was die Erkrankung noch verschlimmern kann.
Aminosäuren liefern den Muskeln Energie, verhindern ihren Abbau und fördern den Aufbau von Muskelmasse. Mehrere Studien zeigen, dass sich vor allem die Einnahme von essenziellen Aminosäuren und verzweigtkettigen Aminosäuren (BCAA: Branched Chained Amino Acids) über mehrere Monate bei Personen mit schwerer COPD positiv auf den Muskelenergiehaushalt, die geistigen Funktionen und den gefühlten Gesundheitszustand auswirkt. COPD-Patienten mit wenig Muskelmasse haben oft einen niedrigen Blutspiegel an diesen Aminosäuren.
Info
Der Begriff „essenziell“ bedeutet „lebensnotwendig“: Der Körper kann diese Aminosäuren nicht selbst herstellen und muss sie mit der Nahrung aufnehmen. Verzweigtkettige Aminosäuren sind eine besondere Untergruppe der essenziellen Aminosäuren. Zu ihnen zählen Valin, Leucin und Isoleucin.
Dosierung und Einnahmeempfehlung
Um den Verlust von Muskelmasse bei einer COPD auszugleichen, wird empfohlen, 4.000 bis 8.000 Milligramm essenzielle Aminosäuren einzunehmen – darunter am besten 1.200 Milligramm Leucin und jeweils 600 Milligramm Valin und Isoleucin.
Tipp
Anstelle von Aminosäurepräparaten gibt es auch Eiweißshakes, die alle vom Körper benötigten (essenziellen) Aminosäuren enthalten.
Aminosäuren: zu beachten in der Schwangerschaft und Stillzeit sowie bei Erkrankungen
Schwangere und Stillende sollten auf zusätzliche Aminosäuren verzichten. Es liegen keine ausreichenden Studien vor. Die normale Zufuhr über die Nahrung ist aber unproblematisch.
Personen mit eingeschränkter Nierenfunktion sollten die Einnahme von Aminosäuren mit dem Arzt absprechen. Sie sollten nicht zu viele Aminosäuren (und Eiweiße) zuführen, aber auch nicht zu wenig. Kranke Nieren können anfallende Stoffwechselprodukte nur begrenzt ausscheiden. Auch bei schweren Lebererkrankungen oder einer eiweißarmen Diät (wie bei Gicht) sollte die Einnahme mit ärztlicher Begleitung erfolgen.
Bei einem gestörten Zuckerstoffwechsel und Diabetes sollte die Ergänzung von verzweigtkettigen Aminosäuren mit dem Arzt besprochen werden. Sie könnten die Situation verbessern oder verschlechtern. Ärztlicher Rat ist auch bei der seltenen Leucin-induzierten Hypoglykämie notwendig. Hier unterzuckert der Körper, wenn zu viel Leucin zugeführt wird.
Verzweigtkettige Aminosäuren im Blut hemmen die Aufnahme der Aminosäuren Tyrosin und Tryptophan ins Gehirn. Diese werden aber für Botenstoffe benötigt. Menschen mit Depressionen, Migräne oder Parkinson sollten daher nicht mehr als 5.000 Milligramm BCAA aufnehmen. Höhere Dosierungen sollten mit dem Arzt abgesprochen werden.
Manche Krebsarten (wie Leukämie) könnten verzweigtkettige Aminosäuren als Energiequelle nutzen. Bis weitere Daten vorliegen, sollten sie nicht ohne ärztlichen Rat bei Krebs eingesetzt werden. Eine Rücksprache gilt auch für die Nervenkrankheit amyotrophe Lateralsklerose (ALS).
Bei der seltenen Ahornsirupkrankheit (auch Verzweigtkettenkrankheit) dürfen keine verzweigtkettigen Aminosäuren eingenommen werden. Betroffene können sie nicht abbauen.
Dosierungen auf einen Blick
Mikronährstoffempfehlung am Tag bei COPD | |
|---|---|
Vitamine | |
Vitamin A | 800 Mikrogramm (µg) |
Vitamin B6 | 2 bis 3 Milligramm (mg) |
Folsäure | 200 bis 400 Mikrogramm |
Vitamin B12 | 2 bis 5 Mikrogramm |
Vitamin C | 100 bis 150 Milligramm |
Vitamin D | 1.000 bis 4.000 Internationale Einheiten (IE) |
Vitamin-E-Komplex | 20 bis 40 Milligramm |
Spurenelemente | |
Selen | 50 bis 100 Mikrogramm |
Zink | 10 bis 15 Milligramm |
Magnesium | 150 bis 250 Milligramm |
Weitere Stoffe | |
N-Acetylcystein | 600 bis 1.200 Milligramm |
Omega-3-Fettsäuren | 1.000 bis 2.000 Milligramm, mit einem möglichst hohen EPA-Anteil (1.000 Milligramm) |
Essenzielle Aminosäuren | 4.000 Milligramm, mit 1.200 Milligramm Leucin und je 600 Milligramm Valin und Isoleucin |
Laboruntersuchungen auf einen Blick
Sinnvolle Laboruntersuchungen bei COPD | |
|---|---|
Vitamin D (Serum) | 40 bis 60 Nanogramm pro Milliliter (ng/ml) |
Selen (Vollblut) | 120 bis 150 Mikrogramm pro Liter (µg/l) |
Malondialdehyd Blutserum Urin |
0,36 bis 1,4 Mikromol pro Liter (µmol/l) 0,2 bis 1,45 Mikromol pro Millimol Kreatinin (µmol/mmol) |
Magnesium (Vollblut) | 1,38 bis 1,50 Millimol pro Liter (mmol/l) |
Homocystein (Blutplasma) | bis 10 Mikromol pro Liter |
Unterstützung von Medikamenten mit Mikronährstoffen
Vitamin B6 reduziert Nebenwirkungen von Theophyllin
Theophyllin ist ein Stoff, der bronchienerweiternd wirkt und daher bei COPD verschrieben werden kann. Bei Personen, die Theophyllin verwenden, ist der Vitamin-B6-Spiegel häufig erniedrigt. Eine Studie zeigt, dass die Einnahme von Vitamin-B6-Präparaten die Nebenwirkungen von Theophyllin auf das Nervensystem lindert.
Um einen möglichen Vitamin-B6-Mangel bei der Anwendung von Theophyllin auszugleichen, empfehlen Mikronährstoff-Experten, täglich 10 bis 20 Milligramm Vitamin B6 einzunehmen. Da es sich dabei um eine erhöhte Dosierung handelt, ist die Rücksprache mit einem Arzt ratsam.
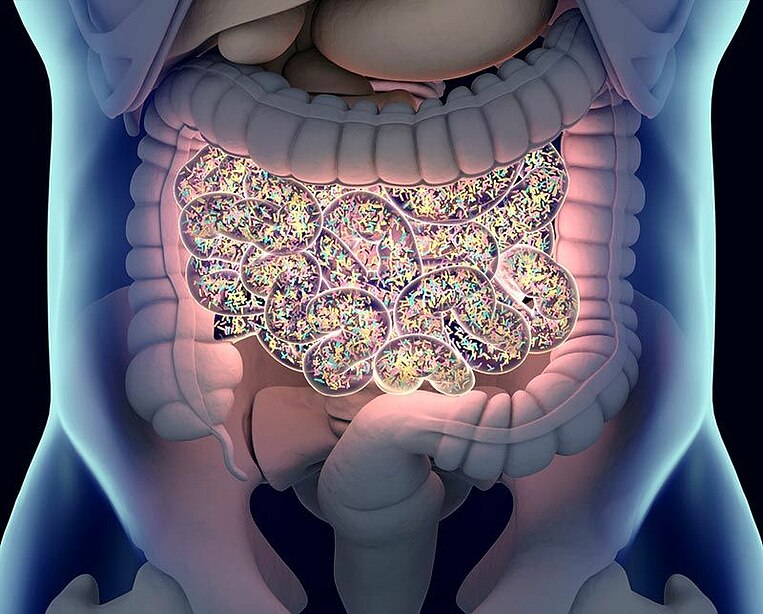
Probiotika gegen antibiotikabedingten Durchfall
Bei rund der Hälfte aller akuten COPD-Verschlechterungen (Exazerbationen) sind Bakterien im Spiel. Gegen Bakterien im Körper kommen Antibiotika zum Einsatz. Sie greifen jedoch auch die „guten“ Keime im Darm an, die wiederum andere krankmachende Erreger abwehren, wie etwa Durchfallerreger.
Durch die Einnahme von Probiotika mit Laktobazillen und der Hefe Saccharomyces boulardii treten Durchfälle im Rahmen einer Antibiotikabehandlung seltener auf und wenn doch, verlaufen sie schwächer und kürzer. Sinnvoll ist eine Dosierung von 10 bis 20 Milliarden Keimen.
Tipp
Wenn das Bakterium Clostridium difficile nach der Antibiotikabehandlung zum Problemkeim geworden ist, verspricht eine Behandlung Lactobacillus casei die beste Linderung.
Halten Sie einen Abstand von zwei bis drei Stunden zwischen der Einnahme von Probiotika und Antibiotika ein, damit die probiotischen Bakterien nicht durch das Antibiotikum abgetötet werden. Nur die Hefe kann begleitend zur Antibiotikaeinnahme genommen werden. Sie ist gegen Antibiotika unempfindlich.
Halten Sie einen Abstand von zwei bis drei Stunden zwischen der Einnahme von Probiotika und Antibiotika ein, damit die probiotischen Bakterien nicht durch das Antibiotikum abgetötet werden. Nur die Hefe kann begleitend zur Antibiotikaeinnahme genommen werden. Sie ist gegen Antibiotika unempfindlich.
Dosierungen auf einen Blick
Mikronährstoffe bei Theophyllineinnahme | |
|---|---|
Vitamin B6 | 10 bis 20 Milligramm (mg) |
Mikronährstoffe bei Antibiotikaeinnahme | |
Probiotika mit Lactobazillen und Hefe | 10 bis 20 Milliarden (10 bis 20 x 109) Keime koloniebildende Einheiten (KBE) |
Zusammenfassung
COPD ist eine Lungenkrankheit mit entzündeten und verengten Atemwegen. Atemnot, Husten und Verschleimung sind typische Symptome.
Mikronährstoffe kommen zum Einsatz, um den Verlauf einer COPD positiv zu beeinflussen. Dazu gehören entzündungshemmende Wirkstoffe wie Omega-3-Fettsäuren. N-Acetylcystein löst darüber hinaus den Schleim und senkt die Gefahr für akute Verschlechterungen. Mit niedrig dosierten Antioxidantien-Mischungen − etwa mit den Vitaminen A, C und E sowie den Mineralstoffen Zink und Selen − gehen Mikronährstoff-Experten den oxidativen Stress bei der Lungenerkrankung an.
Auch Vitamin-D-Mangel wird häufig bei COPD festgestellt und sollte behoben werden. Gegen die Atemwegsverengung setzen Mikronährstoff-Experten muskelentspannendes Magnesium ein. Falls Muskelabbau zum Problem wird, kann man mit Aminosäuren gegensteuern. Wenn COPD-Patienten erhöhte Homocysteinwerte im Blut haben, kann man mit B-Vitaminen eingreifen.
Probiotika unterstützen den Darm, falls eine Antibiotikaeinnahme durch Infektionen nötig wird. Personen mit COPD, die Theophyllin einnehmen, haben häufig einen Vitamin-B6-Mangel. Dann ist ein Vitamin-B6-Präparat nötig.
Verzeichnis der Studien und Quellen
Ahmadi, A. et al. (2012): Nutritional evaluation in chronic obstructive pulmonary disease patients. Pak J Biol Sci 15(10): 501–505. https://www.ncbi.nlm.nih.gov/pubmed/24187906, Stand vom: 23.02.2018.
Ahmadi, A. et al. (2020): Fortified whey beverage for improving muscle mass in chronic obstructive pulmonary disease: a single-blind, randomized clinical trial. Respiratory Research 2020;21:216. https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-020-01466-1, abgerufen am 24.11.2021.
Atlantis, E. & Cochrane, B. (2016): The association of dietary intake and supplementation of specific polyunsaturated fatty acids with inflammation and functional capacity in chronic obstructive pulmonary disease: a systematic review. Int J Evid Based Healthc. 2016 Jun;14(2): 53–63. https://www.ncbi.nlm.nih.gov/pubmed/26134547, Stand vom: 23.02.2018.
Aziz, H.S. (2005): Serum magnesium levels and acute exacerbations of chronic obstructive pulmonary disease: a retrospective study. Ann Clin Lab Sci 35(4): 423–427. https://www.ncbi.nlm.nih.gov/pubmed/16254259, Stand vom: 23.02.2018.
Bagdonas, E. et al. (2015): Novel aspects of pathogenesis and regeneration mechanisms in COPD. Int J Chron Obstruct Pulmon Dis. 2015;10:995–1013. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4459624/, abgerufen am 24.11.2021.
Banerjee, S. & McCormack, S. (2019): Acetylcysteine for Patients Requiring Mucous Secretion Clearance: A Review of Clinical Effectiveness and Safety [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019 Jun 14. https://pubmed.ncbi.nlm.nih.gov/31503431/, abgerufen am 24.11.2021.
Barnes, P.J. (2020): Oxidative stress-based therapeutics in COPD. Redox Biol. 2020 Jun;33:101544. https://pubmed.ncbi.nlm.nih.gov/32336666/, abgerufen am 24.11.2021.
Bartel, P.R. et al. (1994): Vitamin B-6 supplementation and theophylline-related effects in humans. Am J Clin Nutr. 1994 Jul;60(1): 93–99. https://www.ncbi.nlm.nih.gov/pubmed/8017343, Stand vom: 23.02.2018.
Beyer,G. et al. (2021): S3-Leitlinie Pankreatitis. AWMF Registernummer 021 - 003. https://register.awmf.org/assets/guidelines/021-003l_S3_Pankreatitis_2022-04_01.pdf, abgerufen am 09.03.2022.
Blasi, F. et al. (2016): The effect of N-acetylcysteine on biofilms: Implications for the treatment of respiratory tract infections. Respir Med. 2016 Aug;117: 190–197. https://www.ncbi.nlm.nih.gov/pubmed/27492531, Stand vom: 23.02.2018.
Burgerstein, L. et al. (2012): Handbuch Nährstoffe – Vorbeugen und heilen durch ausgewogene Ernährung: Alles über Spurenelemente, Vitamine und Mineralstoffe. 12. Aufl.; Trias
Bussmann, H. et al. (2020): A comparative study on the influence of an ivy preparation and an ivy/thyme combination on the β2-adrenergic signal transduction. Heliyon. 2020 May;6(5):e03960. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7266782/, abgerufen am 24.11.2021.
Calder, P.C. et al. (2018): Targeted medical nutrition for cachexia in chronic obstructive pulmonary disease: a randomized, controlled trial. J Cachexia Sarcopenia Muscle. 2018 Feb;9(1):28-40. https://pubmed.ncbi.nlm.nih.gov/28891198/, abgerufen am 24.11.2021.
Carmago Jr, C.A. et al. (2021): Effect of Monthly Vitamin D Supplementation on Preventing Exacerbations of Asthma or Chronic Obstructive Pulmonary Disease in Older Adults: Post Hoc Analysis of a Randomized Controlled Trial. Nutrients. 2021 Feb 6;13(2):521. https://pubmed.ncbi.nlm.nih.gov/33561963/, abgerufen am 24.11.2021.
Cazzola, M. et al. (2015): Influence of N-acetylcysteine on chronic bronchitis or COPD exacerbations: a meta-analysis. Eur Respir Rev. 2015 Sep;24(137):451–61. https://www.ncbi.nlm.nih.gov/pubmed/26324807, Stand vom: 23.02.2018.
Cazzola, M. et al. (2017): Impact of Mucolytic Agents on COPD Exacerbations: A Pair-wise and Network Meta-analysis. COPD. 2017 Oct;14(5): 552–563. https://www.ncbi.nlm.nih.gov/pubmed/28753070, Stand vom: 23.02.2018.
Chambaneau, A. et al. (2016): Nutritional Intake, Physical Activity and Quality of Life in COPD Patients. Int J Sports Med. 2016 Aug;37(9):730–737. https://www.ncbi.nlm.nih.gov/pubmed/27286177, Stand vom: 23.02.2018.
Chaudhary, D. et al. (2019): Serum Homocysteine Could Be Used as a Predictive Marker for Chronic Obstructive Pulmonary Disease: A Meta-Analysis. Front Public Health. 2019;7:69. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6458233/, abgerufen am 24.11.2021.
Dal Negro, R.W. et al. (2010): Comprehensive effects of supplemented essential amino acids in patients with severe COPD and sarcopenia. Monaldi Arch Chest Dis. 2010 Mar;73(1): 25–33. https://www.ncbi.nlm.nih.gov/pubmed/20499791, Stand vom: 23.02.2018.
Dal Negro, R.W. et al. (2012): Essential amino acid supplementation in patients with severe COPD: a step towards home rehabilitation. Monaldi Arch Chest Dis. 2012 Jun;77(2): 67–75. https://www.ncbi.nlm.nih.gov/pubmed/23193843, Stand vom: 23.02.2018.
Deutsche Atemwegsliga (2018): Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). Im Internet: https://www.atemwegsliga.de/copd.html?file=tl_files/eigene-dateien/copd/COPD-Leitlinie.pdf, Stand vom: 23.02.2018.
Deutsche Gesellschaft für Pneumologie (2018): Was ist COPD? Im Internet: https://www.lungenaerzte-im-netz.de/krankheiten/copd/was-ist-copd/, Stand vom: 23.02.2018.
Druml, W. et al. (2015): Enterale und parenterale Ernährung von Patienten mit Niereninsuffizienz. Im Internet: http://www.awmf.org/uploads/tx_szleitlinien/073-009l_S1_Ern%C3%A4hrung_enteral_parenteral_Niereninsuffizenz_2015-01.pdf, Stand vom: 23.02.2018.
EFSA (European Food Safety Authority) (2012): SCIENTIFIC OPINION. Statement on the safety of β-carotene use in heavy smokers. EFSA Journal 2012;10(12):2953. https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2012.2953, Stand vom 9.4.2018.
El-Attar, M. et al. (2009): Serum trace element levels in COPD patient: the relation between trace element supplementation and period of mechanical ventilation in a randomized controlled trial. Respirology. 2009 Nov;14(8): 1180–1187. https://www.ncbi.nlm.nih.gov/pubmed/19761535, Stand vom: 23.02.2018.
Fimognari, F.L. et al. (2008): Mechanisms of atherothrombosis in chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 2008;3(1):89-96. https://pubmed.ncbi.nlm.nih.gov/18488431/, abgerufen am 24.11.2021.
Fimognari, F.L. et al. (2009): Hyperhomocysteinaemia and poor vitamin B status in chronic obstructive pulmonary disease. Nutr Metab Cardiovasc Dis. 2009 Nov;19(9): 654–959. https://www.ncbi.nlm.nih.gov/pubmed/19282159, Stand vom: 23.02.2018.
Fowdar, K. et al. (2017): The effect of N-acetylcysteine on exacerbations of chronic obstructive pulmonary disease: A meta-analysis and systematic review. Heart Lung. 2017 Mar–Apr;46(2): 120–128. https://www.ncbi.nlm.nih.gov/pubmed/28109565, Stand vom: 23.02.2018.
Fu, L. et al. (2021): Low Vitamin D Status Is Associated with Inflammation in Patients with Chronic Obstructive Pulmonary Disease. J Immunol. 2021 Feb 1; 206(3): 515–523. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7812059/, abgerufen am 24.11.2021.
Fujita, S. & Volpi, E. (2006): Amino Acids and Muscle Loss with Aging. J Nutr. 2006 Jan; 136(1 Suppl): 277–280. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3183816/, Stand vom: 23.02.2018.
Giudetti, A.M. & Cagnazzo, R. (2012): Beneficial effects of n-3 PUFA on chronic airway inflammatory diseases. Prostaglandins Other Lipid Mediat. 2012 Dec;99(3-4): 57–67. https://www.ncbi.nlm.nih.gov/pubmed/23064030, Stand vom: 23.02.2018.
Global Initiative for Chronic Obstructive Lung Disease (2017): Global Strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease 2017 report. Im Internet: goldcopd.org/download/326/, Stand vom: 23.02.2018.
Gouzi, F. et al. (2019): Additional Effects of Nutritional Antioxidant Supplementation on Peripheral Muscle during Pulmonary Rehabilitation in COPD Patients: A Randomized Controlled Trial. Oxid Med Cell Longev. 2019;2019:5496346. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6501222/, abgerufen am 24.11.2021.
Greiller, C. L. et al. (2015): Modulation of the immune response to respiratory viruses by vitamin D. Nutrients. 29;7(6):4240–4270. https://www.ncbi.nlm.nih.gov/pubmed/26035247, Stand vom: 23.02.2018.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Helmholtz Zentrum München (2018): COPD Diagnose. Im Internet: https://www.lungeninformationsdienst.de/krankheiten/copd/diagnose/index.html, Stand vom: 23.02.2018.
Helmholtz Zentrum München (2018): Ernährung bei Lungenerkrankungen. Im Internet: https://www.lungeninformationsdienst.de/therapie/leben-mit-krankheit/ernaehrung/index.html, Stand vom: 23.02.2018.
Hirai, D.M. et al. (2017): Oral N-acetylcysteine and exercise tolerance in mild chronic obstructive pulmonary disease. J Appl Physiol (1985). 2017 May 1;122(5): 1351–1361. https://www.ncbi.nlm.nih.gov/pubmed/28255088, Stand vom: 23.02.2018.
Horadagoda, C. et al. (2017): Body composition and micronutrient deficiencies in patients with an acute exacerbation of chronic obstructive pulmonary disease. Intern Med J. 2017 Sep;47(9): 1057–1063. https://www.ncbi.nlm.nih.gov/pubmed/28401645, Stand vom: 23.02.2018.
Isbaniah, F. et al. (2011): Echinacea purpurea along with zinc, selenium and vitamin C to alleviate exacerbations of chronic obstructive pulmonary disease: results from a randomized controlled trial. J Clin Pharm Ther. 36(5):568–576. https://www.ncbi.nlm.nih.gov/pubmed/21062330, Stand vom: 23.02.2018.
Jahanian, F. et al. (2021): The Effect of Intravenous Magnesium Sulphate as an Adjuvant in the Treatment of Acute Exacerbations of COPD in the Emergency Department: A Double-Blind Randomized Clinical Trial. Ethiop J Health Sci. 2021 Mar;31(2):267-274. https://pubmed.ncbi.nlm.nih.gov/34158778/, abgerufen am 24.11.2021.
Ji, X. et al. (2021): Tocotrienols: Dietary Supplements for Chronic Obstructive Pulmonary Disease. Antioxidants (Basel). 2021 Jun;10(6):883. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8228218/, abgerufen am 24.11.2021.
Johnson, K. et al. (2016): High-dose oral N-acetylcysteine fails to improve respiratory health status in patients with chronic obstructive pulmonary disease and chronic bronchitis: a randomized, placebo-controlled trial. Int J Chron Obstruct Pulmon Dis. 2016 Apr 21;11: 799–807. https://www.ncbi.nlm.nih.gov/pubmed/27143871, Stand vom: 23.02.2018.
Khan, D.M. et al. (2017): Role of Vitamin D in reducing number of acute exacerbations in Chronic Obstructive Pulmonary Disease (COPD) patients. Pak J Med Sci. 2017 May-Jun;33(3): 610–614. https://www.ncbi.nlm.nih.gov/pubmed/28811780, Stand vom: 23.02.2018.
Khan, N.A. et al. (2016): The Effect of Folic Acid Supplementation on Hyperhomocysteinemia and Pulmonary Function Parameters in Chronic Obstructive Pulmonary Disease: A Pilot Study. J Clin Diagn Res. 2016 Nov; 10(11): OC17–OC21. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5198374/, Stand vom: 23.02.2018.
Kirkil, G. et al. (2008): Antioxidant effect of zinc picolinate in patients with chronic obstructive pulmonary disease. Respir Med. 2008 Jun;102(6): 840–844. https://www.ncbi.nlm.nih.gov/pubmed/18295467, Stand vom: 23.02.2018.
Kokturk, N. et al. (2018): Vitamin D deficiency: What does it mean for chronic obstructive pulmonary disease (COPD)? a compherensive review for pulmonologists. Clin Respir J. 2018 Feb;12(2): 382–397. https://www.ncbi.nlm.nih.gov/pubmed/27925404, Stand vom: 23.02.2018.
Kunisaki, K.M. & Rector, T.S. (2011): Vitamin D and responses to inhaled fluticasone in severe chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 2011;6:29–34. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3034285/, abgerufen am 24.11.2021.
Lau, C.S. (2016): Probiotics are effective at preventing Clostridium difficile-associated diarrhea: a systematic review and meta-analysis. Int J Gen Med. 2016; 9: 27–37. https://www.ncbi.nlm.nih.gov/pubmed/26955289, Stand vom: 23.02.2018.
Lee, E.G. & Rhee, C.K. (2020): The clinical efficacy of AG NPP709 (Synatura®) in patients with chronic bronchitis type stable chronic obstructive pulmonary disease. J Thorac Dis. 2020 May;12(5):2435–42. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7330415/, abgerufen am 24.11.2021.
Lehouck, A. et al. (2012): High doses of vitamin D to reduce exacerbations in chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2012 Jan 17;156(2): 105–14. https://www.ncbi.nlm.nih.gov/pubmed/22250141, Stand vom: 23.02.2018.
Li, X. et al. (2020): The efficacy of vitamin D therapy for patients with COPD: a meta-analysis of randomized controlled trials. Ann Palliat Med. 2020 Mar;9(2):286-97. https://pubmed.ncbi.nlm.nih.gov/32156131/, abgerufen am 24.11.2021.
Lin, Y. et al. (2016): Supplementation of fish oil improves functional capacity and quality of life in patients with chronic obstructive pulmonary disease. Current Topics in Nutraceuticals Research; Coppell 14(3): 191–197. https://search.proquest.com/openview/ce58a6884c60c4bdf0aad5a9b1e3a028/1?pq-origsite=gscholar&cbl=136101, Stand vom: 23.02.2018.
Lokesh, K.S. et al. (2021): Vitamin D deficiency is associated with chronic obstructive pulmonary disease and exacerbation of COPD. Clin Respir J. 2021 Apr;15(4):389-399. https://pubmed.ncbi.nlm.nih.gov/33217151/, abgerufen am 24.11.2021.
Martineau, A.R. et al. (2015): Vitamin D3 supplementation in patients with chronic obstructive pulmonary disease (ViDiCO): a multicentre, double-blind, randomised controlled trial. Lancet Respir Med. 2015 Feb;3(2): 120–130. https://www.ncbi.nlm.nih.gov/pubmed/25476069, Stand vom: 23.02.2018.
Martinez de Haas, M.G. et al. (1997): Subnormal vitamin B6 levels in theophylline users. Ned Tijdschr Geneeskd. 1997 Nov 8;141(45): 2176–2179. https://www.ncbi.nlm.nih.gov/pubmed/9550799, Stand vom: 23.02.2018.
Meng-Jer, H. et al. (2016): Nutritional supplementation in patients with chronic obstructive pulmonary disease. Journal of the Formosan Medical Association; 115 (8), August 2016: 595–601. https://www.sciencedirect.com/science/article/pii/S0929664615003460#sec7, Stand vom: 23.02.2018.
Meurer, F. et al. (2021): Ivy leaves dry extract EA 575® mediates biased β2-adrenergic receptor signaling. Phytomedicine. 2021 Sep;90:153645. https://www.sciencedirect.com/science/article/pii/S0944711321001884?via%3Dihub, abgerufen am 24.11.2021.
Mukerji, S. et al. (2015): Intravenous magnesium sulphate as an adjuvant therapy in acute exacerbations of chronic obstructive pulmonary disease: a single centre, randomised, double-blinded, parallel group, placebo-controlled trial: a pilot study. N Z Med J. 2015 Nov 20;128(1425):34-42. https://pubmed.ncbi.nlm.nih.gov/26905985/, abgerufen am 24.11.2021.
Ng, T.P. et al. (2014): Dietary and supplemental antioxidant and anti-inflammatory nutrient intakes and pulmonary function. Public Health Nutr. 2014 Sep;17(9): 2081–2086. https://www.ncbi.nlm.nih.gov/pubmed/24074036, Stand vom: 23.02.2018.
Pattani, R. et al. (2013): Probiotics for the prevention of antibiotic-associated diarrhea and Clostridium difficile infection among hospitalized patients: systematic review and meta-analysis. Open Med. 7(2): e56–67. https://www.ncbi.nlm.nih.gov/pubmed/24348885, Stand vom: 14.12.2017.
Paulin, F.V. et al. (2017): Addition of vitamin B12 to exercise training improves cycle ergometer endurance in advanced COPD patients: A randomized and controlled study. Respir Med. 2017 Jan;122:23-9. https://pubmed.ncbi.nlm.nih.gov/27993287/, abgerufen am 24.11.2021.
Pirabbasi, E. et al. (2013): What are the antioxidant status predictors' factors among male chronic obstructive pulmonary disease (COPD) patients? Glob J Health Sci. 2013 Jan; 5(1): 70–78.https://www.ncbi.nlm.nih.gov/pubmed/23283038, Stand vom: 23.02.2018.
Pirabbasi, E. et al. (2016): Efficacy of Ascorbic Acid (Vitamin C) and/N-Acetylcysteine (NAC) Supplementation on Nutritional and Antioxidant Status of Male Chronic Obstructive Pulmonary Disease (COPD) Patients. J Nutr Sci Vitaminol (Tokyo). 2016;62(1): 54–61. https://www.ncbi.nlm.nih.gov/pubmed/27117852, Stand vom: 23.02.2018.
Pizzini, A. et al. (2018): The Role of Omega-3 Fatty Acids in the Setting of Coronary Artery Disease and COPD: A Review. Nutrients. 2018 Dec;10(12):1864. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6316059/, abgerufen am 24.11.2021.
Prakash, S. et al. (2008): Serum magnesium is an independent predictor of frequent readmissions due to acute exacerbation of chronic obstructive pulmonary disease. Respiratory Medicine. 102(7), July 2008: 999–1003. https://www.sciencedirect.com/science/article/pii/S0954611108000875, Stand vom: 23.02.2018.
Ran, N. et al. (2019): An Updated Overview of Metabolomic Profile Changes in Chronic Obstructive Pulmonary Disease. Metabolites. 2019 Jun;9(6):111. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6631716/, abgerufen am 24.11.2021.
Rossman, M.J. et al. (2013): Oxidative Stress and COPD: The Impact of Oral Antioxidants on Skeletal Muscle Fatigue. Med Sci Sports Exerc. 2013 Jul; 45(7): 1235–1243. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3947987/, Stand vom: 23.02.2018.
Salve,V.T. & Atram, J.S. (2016): N-Acetylcysteine Combined with Home Based Physical Activity: Effect on Health Related Quality of Life in Stable COPD Patients- A Randomised Controlled Trial. J Clin Diagn Res. 2016 Dec;10(12): OC16–OC19. https://www.ncbi.nlm.nih.gov/pubmed/28208905, Stand vom: 23.02.2018.
Sanguinetti, C.M. (2016): N-acetylcysteine in COPD: why, how, and when? Multidiscip Respir Med.2016;11:8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4744393/, abgerufen am 24.11.2021.
Schrumpf, J.A. et al. (2020): Impact of the Local Inflammatory Environment on Mucosal Vitamin D Metabolism and Signaling in Chronic Inflammatory Lung Diseases. Front Immunol. 2020;11:1433. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7366846/, abgerufen am 24.11.2021.
Schulte-Michels, J. et al. (2019): Anti-inflammatory effects of ivy leaves dry extract: influence on transcriptional activity of NFκB. Inflammopharmacology. 2019; 27(2): 339–347. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6482290/, abgerufen am 24.11.2021.
Scoditti, E. et al. (2019): Role of Diet in Chronic Obstructive Pulmonary Disease Prevention and Treatment. Nutrients. 2019 Jun;11(6):1357. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6627281/, abgerufen am 24.11.2021.
Shen, N.T. et al. (2017): Timely Use of Probiotics in Hospitalized Adults Prevents Clostridium difficile Infection: A Systematic Review With Meta-Regression Analysis. Gastroenterology. 2017 Jun;152(8):1889–1900. https://www.ncbi.nlm.nih.gov/pubmed/28192108, Stand vom: 23.02.2018.
Shen, T. et al. (2020): Consumption of Vitamin K and Vitamin A Are Associated With Reduced Risk of Developing Emphysema: NHANES 2007–2016. Front Nutr. 2020;7:47. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7192023/, abgerufen am 24.11.2021.
Skorodin, M.S. et al. (1995): Magnesium sulfate in exacerbations of chronic obstructive pulmonary disease. Arch Intern Med 155(5): 496–500. https://www.ncbi.nlm.nih.gov/pubmed/7864705, Stand vom: 23.02.2018.
Sluyter, J.D. et al. (2017): Effect of Monthly, High-Dose, Long-Term Vitamin D on Lung Function: A Randomized Controlled Trial. Nutrients. 2017 Dec 13;9(12). pii: E1353. doi: 10.3390/nu9121353. https://www.ncbi.nlm.nih.gov/pubmed/29236049, Stand vom: 23.02.2018.
Steinbrenner, H. et al. (2015): Dietary Selenium in Adjuvant Therapy of Viral and Bacterial Infections. Adv Nutr. 6(1):73–82. https://www.ncbi.nlm.nih.gov/pubmed/25593145, Stand vom: 23.02.2018.
Tanaka, I. et al. (1996): Serum concentrations of the pyridoxal and pyridoxal-5'-phosphate in children during sustained-release theophylline therapy. Arerugi. 1996 Oct;45(10): 1098–1105. https://www.ncbi.nlm.nih.gov/pubmed/8958656, Stand vom: 23.02.2018.
Terence, A.R. et al. (2007): Plasma homocysteine is elevated in COPD patients and is related to COPD severity. Int J Chron Obstruct Pulmon Dis. 2007 Sep; 2(3): 313–321. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2695192/, Stand vom: 23.02.2018.
Thatcher, T.H. et al. (2020): “Quenching the fires: pro-resolving mediators, air pollution, and smoking”. Pharmacol Ther. 2019 May;197:212–24. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6537608/, abgerufen am 24.11.2021.
Tsiligianni, I.G. & Van der Molen, T. (2010): A systematic review of the role of vitamin insufficiencies and supplementation in COPD. Respir Res. 2010;11(1):171. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3016352/, abgerufen am 24.11.2021.
Van der Meij, B.S. & Mazurak, V.C. (2020): Fish oil supplementation and maintaining muscle mass in chronic disease: state of the evidence. Curr Opin Clin Nutr Metab Care. 2020 May;23(3):164-73. https://pubmed.ncbi.nlm.nih.gov/32167986/, abgerufen am 24.11.2021.
Von Essen, M.R. et al. (2010): Vitamin D controls T cell antigen receptor signaling and activation of human T cells. Nat Immunol. Apr;11(4):344–9. https://www.ncbi.nlm.nih.gov/pubmed/?term=Vitamin+D+controls+T+cell+antigen+receptor+signaling+and+activation+of+human+T+cells, Stand vom: 23.02.2018.
Wood, L.G. (2015): Omega-3 polyunsaturated fatty acids and chronic obstructive pulmonary disease. Curr Opin Clin Nutr Metab Care. 2015 Mar;18(2): 128–132. https://www.ncbi.nlm.nih.gov/pubmed/25581034, Stand vom: 23.02.2018.
Yu, H. et al. (2021): Effect of Omega-3 Fatty Acids on Chronic Obstructive Pulmonary Disease: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Int J Chron Obstruct Pulmon Dis. 2021; 16: 2677–2686. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8476109/, abgerufen am 24.11.2021.
Zanforlini, B.M. et al. (2021): Clinical trial on the effects of oral magnesium supplementation in stable-phase COPD patients. Aging Clin Exp Res. 2021 Jul 14. https://pubmed.ncbi.nlm.nih.gov/34260036/, abgerufen am 24.11.2021.
Zhu, M. et al. (2016): The association between vitamin D and COPD risk, severity, and exacerbation: an updated systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis. 2016 Oct 19;11: 2597–2607. https://www.ncbi.nlm.nih.gov/pubmed/27799758, Stand vom: 23.02.2018.