Le persone celiache soffrono di un’infiammazione cronica dell’intestino tenue dovuta a un’intolleranza al glutine, contenuto in molti tipi di cereali. I celiaci sono colpiti da diversi disturbi quali diarrea e stanchezza, a cui si aggiungono spesso delle carenze di sostanze nutritive. Per evitare danni costanti alla mucosa dell’intesto tenue, chi soffre di celiachia deve seguire per tutta la vita una dieta priva di glutine. Leggete qui come un aiuto mirato da parte della medicina dei micronutrienti può supportare il trattamento.

Cause e sintomi
Che cosa si intende con celiachia?
La celiachia è una malattia infiammatoria cronica dell’intestino tenue finora considerata incurabile. Gli esperti stimano che dallo 0,5 al 7 percento della popolazione soffra di celiachia. Nei celiaci il sistema immunitario reagisce al glutine, causando intolleranza. Il glutine è contenuto in molti tipi di cereali come frumento, segale, orzo e farro.
Nei celiaci determinati prodotti della scissione del glutine, i cosiddetti oligopeptidi, si accumulano in concentrazioni molto elevate nell’intestino tenue, attivando cellule speciali del sistema immunitario che generano una reazione a catena che porta alla produzione di stress ossidativo e di alterazioni infiammatorie e che danneggia la mucosa intestinale. Questi fenomeni atrofizzano i villi intestinali (atrofia villare). La mucosa dell’intestino tenue è rivestita di questi villi, necessari per assorbire le sostanze nutritive degli alimenti. Se si atrofizzano, il soggetto sviluppa delle carenze nutrizionali. Se la celiachia non viene trattata può portare a complicanze gravi come il tumore all’intestino.
Informazioni
Le infiammazioni croniche dovute alla celiachia possono colpire anche altri organi, come la pelle. Questa forma speciale di celiachia prende il nome di "dermatite erpetiforme di Duhring".
Negli ultimi anni il numero di persone colpite da celiachia è aumentato a causa, si presume, di diversi fattori quali ambiente, infezioni gastrointestinali, diverse abitudini alimentari e anche fattori psico-sociali. Probabilmente questi fattori, insieme a una propensione genetica, causano la patologia.
Sintomi della celiachia
Tra i sintomi della celiachia rientrano perdita di peso, steatorrea (notevole presenza di sostanze grasse non digerite nelle feci) e i cosiddetti edemi da carenza di proteine, ovvero di ritenzione idrica che interessa i tessuti ed è dovuta a una costante carenza proteica. Spesso questa patologia si manifesta già nei bambini. I seguenti sintomi caratterizzano la celiachia classica e possono comparire tra il primo e il terzo anno di vita:
- distensione addominale
- attacchi di diarrea maleodorante
- disturbi della crescita
- calo dell’appetito e disturbi alimentari
- carenza di ferro
- alterazioni comportamentali come la propensione al pianto
A questi possono aggiungersi anche altri sintomi come stanchezza, disturbi del sonno e stipsi. I celiaci sono inoltre più esposti ad altre malattie nelle quali il sistema immunitario attacca i tessuti endogeni (malattie autoimmuni), come ad esempio la tiroidite di Hashimoto. Sono possibili anche complicanze quali intestino irritabile, sindrome dell’intestino permeabile, emicrania, epilessia, depressione, asma, osteoporosi, anemia e malattie del sistema nervoso (neuropatie).
Informazioni
Spesso è difficile assegnare i sintomi alla celiachia, soprattutto nella fase iniziale. Inoltre, i pazienti sono colpiti in misura diversa, rendendo ancora più difficile la diagnosi. A ciò si aggiunge il fatto che la celiachia può anche avere un decorso asintomatico, ovvero privo di sintomi. Questa forma può essere confermata solo attraverso determinati esami di laboratorio o prelevando campioni di tessuto dall’intestino tenue.

Obiettivi del trattamento
Qual è il trattamento classico della celiachia?
L’obiettivo del trattamento è alleviare i disturbi del tratto gastrointestinale e di tutto l’organismo, migliorando così la qualità della vita delle persone colpite. Al momento, l’unica terapia in caso di celiachia è quella di seguire per tutta la vita una dieta priva di glutine così da evitare infiammazioni a livello dell’intestino tenue e danni ai villi intestinali e proteggere i pazienti da possibili complicanze.
Consiglio
La dieta senza glutine andrebbe prescritta da un nutrizionista, anche perché si tratta di un tipo di alimentazione molto difficile da seguire. A causa di impurità durante la produzione, lo stoccaggio e la preparazione, il glutine può essere presente in minima quantità anche negli alimenti che dovrebbero esserne privi. La quantità di glutine che non crea problemi alla maggior parte dei pazienti è inferiore a 10 milligrammi al giorno, e corrisponde circa a dieci briciole di pane.
In alcuni pazienti celiaci i danni all’intestino tenue possono causare anche un’intolleranza al lattosio. In questo caso si consiglia di ridurre anche il consumo di latticini. A volte è necessario ricorrere ai farmaci.
Gli obiettivi della medicina dei micronutrienti
Per evitare una carenza di micronutrienti importanti, i celiaci dovrebbero sottoporsi a rigidi controlli medici e compensare immediatamente eventuali carenze di vitamine e minerali. Una carenza di ferro, in particolare, può aggravare i danni ai villi intestinali.
La medicina dei micronutrienti consente anche di favorire la salute intestinale, alleviare le infiammazioni e supportare il sistema immunitario. I micronutrienti principali in caso di celiachia sono:
- Il ferro compensa una carenza e può evitare complicanze.
- La vitamina D e il calcio rafforzano le ossa.
- Le vitamine del gruppo B degradano l’omocisteina, una citotossina.
- Prebiotici e probiotici favoriscono la salute intestinale.
- Gli acidi grassi omega 3 potrebbero arginare l’infiammazione in caso di celiachia.
- La glutammina può ridurre la permeabilità delle pareti intestinali.
- Gli antiossidanti prevengono i danni ai tessuti e le infiammazioni.
Trattamento con i micronutrienti
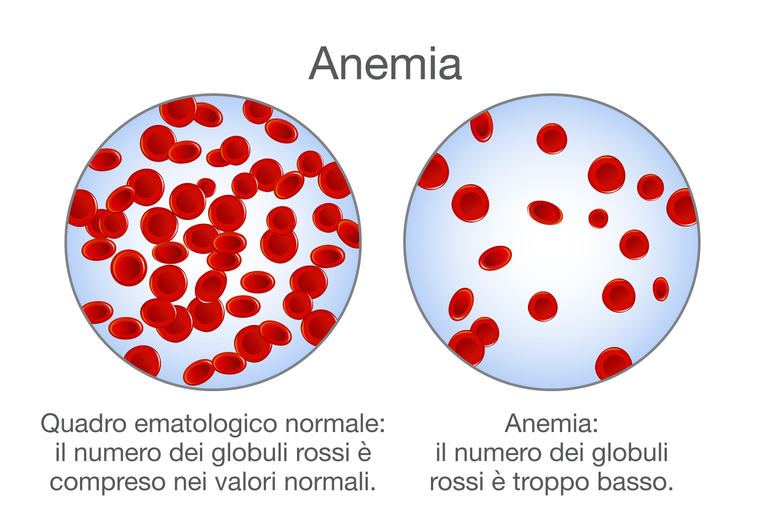
Il ferro contrasta l’anemia
Meccanismo d’azione del ferro
Il ferro è un componente fondamentale dell’emoglobina, la proteina responsabile del colore rosso del sangue. L’organismo ne ha bisogno per trasportare l’ossigeno nelle cellule del corpo. Una costante carenza di ferro causa anemia. Questo limitato trasporto di ossigeno alle cellule causa spesso stanchezza o capogiri. Gli anemici sono pallidi, hanno il respiro corto e riferiscono di avere il battito accelerato.
I danni alla mucosa intestinale correlati alla celiachia non consentono di assorbire quantità sufficienti di ferro attraverso l’alimentazione, quindi una sua carenza è spesso un problema comune tra i malati, come confermato da uno studio osservazionale. Quasi la metà dei celiaci esaminati presentava infatti un’anemia da carenza di ferro.
Uno studio preliminare su pazienti celiaci ha rivelato che una dieta priva di glutine non può, da sola, compensare una carenza di ferro in tutti i pazienti. Inoltre, i pazienti con questo tipo di anemia riuscivano a riprendersi solo molto lentamente dopo sei-dodici mesi. Secondo le direttive della Società italiana di gastroenterologia ed endoscopia digestiva, l’assunzione di ferro è consigliata, soprattutto in caso di anemia da carenza di ferro, per compensare tempestivamente una carenza e contrastare l’anemia.
Dosaggio e consigli sull’assunzione del ferro
La dose di ferro corretta dipende dalla gravità della carenza. Si consiglia di consultare per prima cosa il proprio medico curante, che determinerà il livello ematico del ferro. In caso di grave carenza, gli esperti in micronutrienti consigliano nella maggior parte dei casi una dose giornaliera compresa tra 50 e 200 milligrammi. Se invece la carenza è lieve, possono bastare anche dosi inferiori, ad esempio da 20 a 40 milligrammi.
Il ferro è disponibile in capsule, compresse e fiale da bere. Si consiglia di assumerlo da due a tre ore prima di un pasto per garantirne un assorbimento ottimale, nonostante per molti sia più tollerabile se assunto insieme ai pasti. Se assunto durante i pasti, è preferibile evitare di accompagnarlo ad alimenti o bevande che possono "depredarlo", come caffè, tè, latte, Coca Cola e alimenti integrali. Si consiglia soprattutto di combinare ferro e vitamina C perché quest’ultima consente di assorbirlo meglio a livello intestinale.
Consiglio
Esistono inoltre composti a base di ferro che causano meno disturbi gastrointestinali, quali il fumarato ferroso, il ferro bisglicinato o il gluconato ferroso. Inoltre, è possibile assumere il ferro in capsule: in questo modo il ferro non entra in contatto diretto con la mucosa gastrointestinale e previene possibili disturbi gastrointestinali.
Determinazione dei valori del ferro in laboratorio
Esiste una grande varietà di valori di laboratori che si possono calcolare per determinare l’apporto di ferro, tuttavia non esiste un valore specifico che possa fornire un’indicazione univoca e definitiva. Per questo motivo il medico prende in considerazione diversi valori del ferro come ad esempio quello della ferritina (la proteina di deposito del ferro) e quello della saturazione della transferrina (proteina di trasporto del ferro).
I valori normali della ferritina sono compresi tra 23 e 110 microgrammi per litro nelle donne e tra 34 e 310 microgrammi per litro negli uomini. In entrambi la saturazione della transferrina dovrebbe essere pari al 35 ± 15 percento.
Ferro: da considerare in caso di malattie e assunzione di farmaci
Il ferro è sconsigliato a chi soffre di malattie gastrointestinali, ulcera gastrica o gastrite perché potrebbe peggiorarne i disturbi. Lo stesso vale per chi soffre di disturbi nella sintesi del ferro, quali emocromatosi e anemia mediterranea, nota anche come talassemia, perché potrebbe accumularsi nell’organismo. Chi soffre di gravi patologie che interessano fegato e reni dovrebbe consultare il proprio medico, che deciderà se consentire o meno l’assunzione di ferro.
L’allopurinolo (Allurit®, Zyloric®), un principio attivo utilizzato per il trattamento della gotta, può aumentare i depositi di ferro nel fegato, con effetti dannosi per l’organismo nel lungo termine. Pertanto, non si dovrebbero assumere preparati a base di ferro durante un trattamento con questo principio attivo.
Il ferro riduce inoltre l’assorbimento e l’efficacia di una serie di farmaci, ragion per cui bisogna osservare un intervallo di due o tre ore tra l’assunzione dei preparati a base di ferro e i seguenti principi attivi:
- Antipertensivi: ad esempio gli ACE-inibitori con principi attivi quali benazepril (Zinadril®) o captopril (Tenpril®)
- Farmaci contro l’osteoporosi: ad esempio i bifosfonati con principi attivi quali acido alendronico (Fosamax®) o acido pamidronico (Aredia®)
- Farmaci per la tiroide: tirossina
Per conoscere gli altri farmaci interessati, consultare il testo dedicato al ferro.
La vitamina D e il calcio rafforzano le ossa
Meccanismo d’azione della vitamina D e del calcio
La vitamina D è necessaria per la stabilità delle ossa: incrementa l’assorbimento del calcio a livello intestinale e lo mette a disposizione delle ossa. Inoltre, regola il sistema immunitario, garantendo la moltiplicazione delle cellule difensive in caso di infezione, ha proprietà antinfiammatorie, protegge la mucosa intestinale e la rende impermeabile.
Un’analisi delle cartelle cliniche di 140 bambini celiaci ha mostrato che la maggior parte di loro (70 percento) presentavano una carenza di vitamina D al momento della diagnosi. Una carenza di questa vitamina (e di calcio) aumenta il rischio di fratture ossee e riduce la densità ossea (sintomo dell’osteoporosi). Studi osservazionali hanno evidenziato che i soggetti con celiachia correvano un rischio di fratture ossee del 40 percento superiore rispetto ai soggetti sani e spesso presentavano anche un calo della densità ossea e/o osteoporosi.
I risultati di una meta-analisi condotta su numerosi studi lasciano presumere che una dieta priva di glutine potrebbe compensare una carenza di vitamina D. Anche i valori ematici della vitamina D nei bambini celiaci miglioravano con la dieta, pur non raggiungendo i livelli normali. Uno studio osservazionale condotto su 35 donne ha mostrato che una dieta senza glutine può far aumentare di nuovo la densità ossea. Un altro studio osservazionale condotto sulle donne ha evidenziato inoltre che se i soggetti prendevano la vitamina D e si impegnavano ad assumere quantità di calcio sufficienti, pari a 1.000 milligrammi, attraverso l’alimentazione, il calo di densità ossea dovuto alla celiachia subiva in parte un arresto, se non addirittura un miglioramento.
La carenza di vitamina D è un fenomeno frequente che andrebbe evitato in caso di celiachia. Le linee guida ufficiali sul trattamento di questa patologia consigliano di assumere calcio e vitamina D e di seguire una dieta priva di glutine, in particolare se la celiachia è accompagnata da un riduzione della densità ossea.
Dosaggio e consigli sull’assunzione della vitamina D e del calcio
Gli esperti in micronutrienti consigliano una dose giornaliera da 1.000 a 2.000 unità internazionali di vitamina D e da 600 a 1.200 milligrammi di calcio. La vitamina D è liposolubile e pertanto dovrebbe essere assunta insieme ai pasti, perché i grassi contenuti negli alimenti ne aumentano l’assorbimento a livello intestinale. Se si vuole aumentare l’assorbimento del calcio, occorre assumere dosi superiori a 500 milligrammi, distribuite nel corso della giornata.
Consiglio
La vitaminaK, in particolare la vitamina K2, è importante per la salute delle ossa. Gli integratori di calcio e vitamina D di qualità contengono quindi anche la vitamina K2. Per maggiori informazioni sulla vitamina K, leggere qui.
Determinazione dei livelli di vitamina D in laboratorio
In caso di celiachia si consiglia di controllare i livelli di vitamina D perché in caso di grave carenza può essere necessario aumentare la dose. Una carenza di vitamina D viene determinata rilevandone la forma di trasporto nel sangue: la vitamina D 25(OH) (calcidiolo). Tale misurazione dovrebbe essere eseguita nel siero, la porzione liquida del sangue priva di cellule ematiche. I valori ottimali sono compresi tra 40 e 60 nanogrammi per millilitro.
Vitamina D e calcio: da considerare in caso di assunzione di farmaci e malattie
I diuretici tiazidici riducono la capacità dei reni di eliminare il calcio, che rimane così nel sangue. Poiché la vitamina D aumenta il livello di calcio nel sangue, dovrebbe essere assunta insieme ai tiazidici solo se tale livello viene controllato regolarmente. Tra i tiazidici si annoverano i principi attivi idroclorotiazide (Disalunil®, Esidrex®), indapamide (ad esempio Indamol®, Ipamix®) e xipamide (ad esempio Aquafor®, Neotri®). L’assunzione di vitamina D e calcio va concordata con il proprio medico.
Chi soffre di nefropatie come insufficienza renale cronica e calcoli renali dovrebbe evitare la vitamina D e il calcio senza aver prima consultato il proprio medico, perché la vitamina D incrementa l’assorbimento del calcio nell’intestino e ne aumenta i livelli nel sangue, che non possono essere normalizzati dai reni malati. Di conseguenza chi soffre di calcoli potrebbe correre un maggiore rischio di recidiva.
La vitamina D e il calcio sono sconsigliati a chi soffre di sarcoidosi (morbo di Boeck), perché questi soggetti spesso presentano livelli ematici di calcio molto elevati, che aumenterebbero ulteriormente se assumessero anche vitamina D e ulteriori dosi di calcio. Lo stesso vale per chi soffre di ipercalcemia, che si manifesta ad esempio a seguito di iperparatiroidismo (come nel caso di carcinomi paratiroidei), metastasi ossee e tumore del midollo osseo (mieloma multiplo).
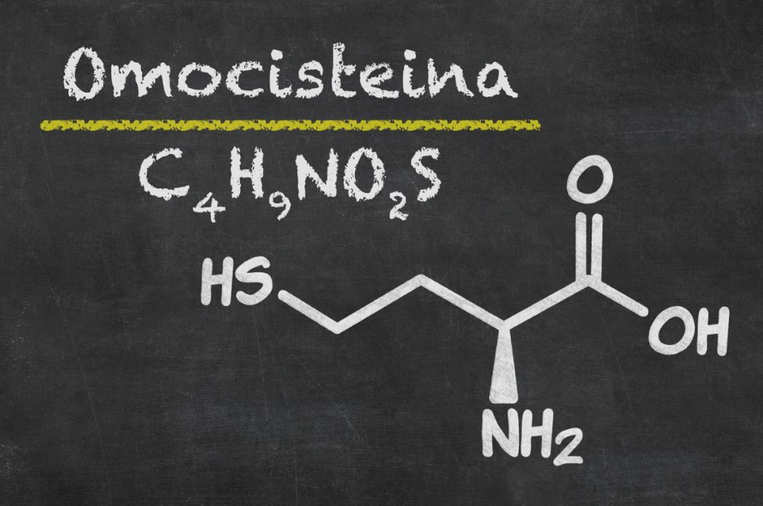
Le vitamine del gruppo B riducono i livelli elevati di omocisteina
Meccanismo d’azione delle vitamine del gruppo B
Le vitamine del gruppo B sono indispensabili all’organismo per eliminare l’omocisteina, una sostanza nociva per le cellule che, se raggiunge livelli elevati, rappresenta un fattore di rischio per le malattie cardiovascolari. È quindi necessario eliminare costantemente questo prodotto intermedio nocivo del metabolismo. La vitamina B12 riduce inoltre le reazioni infiammatorie. Le vitamine del gruppo B sono necessarie anche per la rigenerazione dell’intestino in quanto responsabili della divisione cellulare. Questa funzione è ancora più importante in caso di celiachia.
Da un’osservazione del comportamento alimentare dei celiaci, risulta che questi pazienti assumono quantità insufficienti di vitamine del gruppo B, i cui livelli possono essere riportati nella norma seguendo una dieta priva di glutine. Tuttavia, questo tipo di alimentazione può portare alla carenza di importanti fonti di vitamine del gruppo B, come ad esempio i germi di frumento. Per garantire un apporto sufficiente, in caso di celiachia è fondamentale un’integrazione delle vitamine del gruppo B, come confermato da uno studio osservazionale. In tale studio, circa la metà degli adulti che aveva seguito per diversi anni una dieta senza glutine presentava bassi livelli ematici di acido folico e vitamina B6, associati a un livello elevato di omocisteina.
Uno studio clinico ha confermato i benefici apportati dalle vitamine del gruppo B. Gli adulti in studio che soffrivano di celiachia da anni e che avevano ricevuto integrazioni di acido folico, vitamina B6 e vitamina B12 per sei mesi presentavano valori ematici di omocisteina nella norma e anche le loro condizioni generali miglioravano.
Dosaggio e consigli sull’assunzione delle vitamine del gruppo B
In caso di celiachia gli esperti in micronutrienti consigliano di assumere ogni giorno vitamine del gruppo B, in particolare:
- da 1 a 3 milligrammi di vitamina B6
- fino a 500 microgrammi di vitamina B12
- da 400 a 800 microgrammi di acido folico (sotto forma di acido 5-metiltetraidrofolico)
Poiché le vitamine del gruppo B sono tutte essenziali per la celiachia e si integrano le une con le altre, si consiglia di assumerle sempre insieme, meglio se insieme ai pasti e con un po’ di liquido per migliorarne la tollerabilità gastrica.
Determinazione dei livelli di omocisteina in laboratorio
Chi soffre di celiachia dovrebbe sottoporsi a controlli regolari del livello di omocisteina così da rilevare eventuali carenze di vitamine del gruppo B. L’omocisteina viene misurata nel plasma, la componente liquida del sangue priva di cellule ematiche. I valori normali sono compresi tra 5 e 9 micromoli per litro.
Vitamine del gruppo B: da considerare in caso di gravidanza, allattamento e malattie
Durante la gravidanza e l’allattamento le donne celiache dovrebbero assumere dosi elevate di vitamine del gruppo B solo in caso di comprovata carenza. Le raccomandazioni generali per la gravidanza sono consultabili qui.
I diabetici con problemi renali e i pazienti con disturbi renali devono prestare particolare attenzione. Questi ultimi non dovrebbero inoltre assumere la vitamina B12 sotto forma di cianocobalamina, bensì di metilcobalamina, poiché la prima è probabilmente nociva a dosaggi elevati per questo tipo di pazienti.
L’assunzione di vitamine del gruppo B dopo l’impianto di stent e dopo un infarto non è stata ancora studiata a sufficienza, ma in tali casi si ipotizza un loro effetto negativo. Di conseguenza, si dovrebbe evitare di assumere dosi elevate di vitamina B12 (da 60 a 400 microgrammi al giorno) e acido folico (da 800 a 1.200 microgrammi al giorno).
Un aiuto all’intestino dai prebiotici e probiotici
Meccanismo d’azione di prebiotici e probiotici
Un intestino sano è il requisito fondamentale per compensare eventuali carenze nutrizionali e per proteggersi dalle infiammazioni. Nel nostro intestino vivono innumerevoli batteri, definiti in linea generale flora intestinale. I prebiotici e i probiotici possono influenzare positivamente la composizione della flora intestinale.
- I prebiotici sono fibre come l’amido resistente. Si tratta di fibre indigeribili per l’uomo ma che rappresentano il nutrimento ideale per alcune specie di batteri dell’intestino. I prebiotici modificano positivamente la flora batterica.
- I probiotici sono i più piccoli esseri viventi al mondo, come i batteri e i lieviti, tra cui ad esempio i batteri dell’acido lattico come il Lactobacillus. Questi e altri batteri favoriscono la degradazione del glutine a livello intestinale e rappresentano un nuovo approccio terapeutico per la celiachia.
Esistono inoltre evidenze di una correlazione tra la composizione della flora intestinale e la comparsa e la progressione della celiachia. Si presume che si attivino i seguenti meccanismi: la flora intestinale rafforza la mucosa intestinale e favorisce il sistema immunitario perché attiva le sostanze antinfiammatorie oppure perché contribuisce a rendere impermeabile l’intestino.
Numerosi studi osservazionali hanno mostrato come i pazienti celiaci presentassero uno squilibrio della flora intestinale, ovvero più ceppi batterici dannosi e meno ceppi favorevoli per la salute come i bifidobatteri, rispetto ai soggetti sani. Nei celiaci i bifidobatteri potrebbero contrastare le infiammazioni associate al glutine, come rivela uno studio clinico condotto su un numero ridotto di soggetti. Il Bifidobacterium infantis alleviava infatti i sintomi gastrointestinali nei casi di celiachia non trattata. Uno studio preliminare indica inoltre che l’integrazione di prebiotici (inulina arricchita con oligofruttosio) a una dieta senza glutine nei bambini e nei ragazzi celiaci potrebbe migliorare sensibilmente il livello ematico di vitamina D e vitamina E.
I risultati finora ottenuti negli studi su prebiotici e probiotici in caso di celiachia sono promettenti, ma devono essere supportati da ulteriori studi clinici.
Dosaggio e consigli sull’assunzione di prebiotici e probiotici
In linea generale, gli esperti in micronutrienti consigliano, in caso di malattie intestinali croniche, una dose quotidiana compresa tra 1 e 20 miliardi (da 1 a 20 x 109) di unità formanti colonie (UFC) di lattobacilli e bifidobatteri. Gli studi condotti su pazienti celiaci hanno dimostrato che 2 miliardi (2 x 109) di unità formanti colonie sono la dose efficace e, quindi, la quantità minima che dovrebbe essere presente in ogni buon integratore. Per ottenere degli effetti positivi evidenti, i probiotici vanno assunti regolarmente e per lunghi periodi di tempo, perché il loro numero nell’intestino diminuisce di nuovo non appena si interrompe il trattamento.
Gli esperti in micronutrienti consigliano di scegliere, tra i prebiotici, l’amido resistente (fino a 25 grammi al giorno), spesso ottenuto dal mais e, quindi, privo di glutine. Un primo studio ha mostrato che 10 grammi di inulina arricchita con oligofruttosio aveva effetti positivi, ma che alcuni pazienti celiaci non tolleravano il fruttosio contenuto nel prodotto. In linea generale si consiglia di assumere le fibre in modo graduale. Questo significa che è consigliabile iniziare con una dose ridotta (ad esempio 5 grammi) distribuita nell’arco della giornata e aumentarla lentamente, perché l’intestino deve abituarsi a questo aumento di fibre.
Probiotici: da considerare in caso di malattie e assunzione di farmaci
Alcuni batteri probiotici, tra cui Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis ed Enterococcus faecium, potrebbero produrre istamina a livello intestinale, causando disturbi nei soggetti intolleranti a questo mediatore chimico.
Si sconsiglia l’uso di probiotici a pazienti molto deboli con difese immunitarie basse, a persone con catetere venoso centrale (ad esempio sottoposti a chemioterapia) e a chi soffre di valvulopatie e di sindrome dell’intestino corto.
La glutammina può ridurre la permeabilità intestinale in caso di celiachia?
Meccanismo d’azione della glutammina
La glutammina fornisce il combustibile per le cellule dell’intestino tenue e preserva la struttura e la funzione intestinale. È quindi fondamentale per consentire alla mucosa intestinale di rigenerarsi rapidamente quando viene danneggiata. Lo stesso vale anche in caso di infiammazioni.
Uno studio osservazionale condotto su bambini celiaci ha evidenziato che presentavano livelli ematici di glutammina inferiori rispetto ai bambini sani. Minore era il livello di glutammina nel sangue, maggiore era il numero di anticorpi contro il tessuto connettivo. In alcuni pazienti celiaci questi anticorpi attaccano i tessuti connettivi come ad esempio la mucosa intestinale. Non è ancora noto, però, se un’integrazione di glutammina possa ridurre il numero di questi anticorpi.
Uno studio preliminare condotto su un numero ridotto di pazienti con il morbo di Chron, un’infiammazione cronica intestinale, ha fornito le prime evidenze del fatto che la glutammina potrebbe ridurre la permeabilità dell’intestino che, nel caso del morbo di Crohn e anche della celiachia, è particolarmente elevata. Un intestino molto permeabile consente la fuoriuscita di grandi quantità di sostanze alimentari che attivano il sistema immunitario causando processi infiammatori cronici. La glutammina favorisce la permeabilità intestinale anche in pazienti che assumono analgesici (farmaci antinfiammatori non steroidei), in pazienti che si sottopongo a chemioterapia e in pazienti in terapia intensiva, come confermato da studi preliminari e da una meta-analisi di diversi studi.
È quindi possibile che la glutammina possa incrementare l’impermeabilità dell’intestino anche in pazienti celiaci e contrastare i processi infiammatori. Tuttavia, al momento non esistono studi su pazienti celiaci.
Dosaggio e consigli sull’assunzione della glutammina
Gli esperti in micronutrienti consigliano a chi segue una dieta senza glutine molto rigida di assumere ogni giorno da 4.500 a 9.000 milligrammi di glutammina e controllare se i sintomi migliorano. In caso contrario, o se peggiorassero, si dovrebbe consultare il proprio medico.
Informazioni
È stato dimostrato che la glutammina aumenta il numero di anticorpi a livello intestinale. Da un lato questo consente all’intestino di difendersi meglio, ma dall’altro potrebbe aumentare il numero di anticorpi contro il glutine, con il conseguente eventuale peggioramento dei disturbi nei celiaci che non seguono una dieta rigida.
L’organismo è in grado di sintetizzare meglio la glutammina se viene assunta in piccole dosi nel corso della giornata, preferibilmente mezz’ora prima dei pasti.
Glutammina: da considerare in caso di malattie
La glutammina è sconsigliata in caso di disturbi della funzione renale ed epatica. Se degradata, la glutammina produce azoto (ammonio), che deve poi essere a sua volta decontaminato da reni e fegato. Nelle persone con disturbi che colpiscono questi due organi, essi non sono in grado di svolgere correttamente tale funzione.
Gli acidi grassi omega-3 possono controllare le reazioni infiammatorie
Meccanismo d’azione degli acidi grassi omega-3

In caso di celiachia determinati componenti del glutine (oligopeptidi) attivano delle sostanze infiammatorie e lo stress ossidativo. Gli omega-3 possono contrastare le reazioni infiammatorie, ad esempio regolando l’attivazione di importanti trasmettitori infiammatori, e si rivelano così fondamentali per il trattamento della celiachia.
La loro efficacia contro alcune patologie infiammatorie è già stata dimostrata, ad esempio in una meta-analisi sull’artrite reumatoide. Anche chi soffre di infiammazioni intestinali croniche potrebbe beneficiare degli omega-3, come dimostrato da un’analisi di diversi studi. I risultati dei singoli casi tuttavia non confermano questi risultati, probabilmente perché sono state somministrate dosi differenti o perché i soggetti in studio partivano da condizioni diverse. Si presume infatti che i benefici siano minori in chi presenta già livelli di omega-3 buoni.
Non sono stati ancora condotti studi per valutare l’efficacia degli omega-3 in caso di celiachia. Tuttavia, poiché si tratta di sostanze antinfiammatorie, vale la pena provare ad assumerle.
Dosaggio e consigli sull’assunzione degli acidi grassi omega-3
In caso di infiammazioni intestinali croniche, gli esperti in micronutrienti raccomandano una dose giornaliera di 2.000 milligrammi di omega-3. Sono consigliati in particolare gli integratori con una quantità superiore di acido eicosapentaenoico (EPA), che ha un forte effetto antinfiammatorio. L’EPA è presente ad esempio nell’olio di pesce. Chi lo assume dovrebbe tenere sotto controllo i sintomi e, se peggiorano, consultare il proprio medico.
Consiglio
Chi sceglie gli integratori di olio di pesce deve assicurarsi che siano di buona qualità e acquistare solo integratori particolarmente puri, quindi privi di residui come i metalli pesanti che potrebbero danneggiare ulteriormente l’intestino.
Determinazione dell’indice omega-3 in laboratorio
L’Indice omega-3 consente di determinare un’eventuale carenza mediante la misurazione della percentuale di EPA e DHA negli eritrociti, ovvero nei globuli rossi. L’indice omega-3 è espresso in percentuale e dovrebbe essere superiore a 8, ad indicare che 8 acidi grassi su 100 presenti nei globuli rossi sono acidi grassi omega-3 di alta qualità.
Acidi grassi omega-3: da considerare in caso di assunzione di anticoagulanti, malattie e prima di interventi chirurgici
Poiché gli acidi grassi omega-3 hanno un effetto anticoagulante, se assunti a dosi superiori a 1.000 milligrammi possono potenziare l’azione dei farmaci anticoagulanti. Prima dell’assunzione si consiglia dunque di consultare il proprio medico, che controllerà regolarmente il tempo di protrombina (tempo di Quick). Tra gli anticoagulanti interessati figurano:
- Derivati cumarinici (come Coumadin®)
- Acido acetilsalicilico (ASA, Aspirina®)
- Eparina (Calciparina®)
- Nuovi anticoagulanti orali: apixaban (Eliquis®), dabigatran (Pradaxa®), edoxaban (Lixiana®) e rivaroxaban (Xarelto®)
Si sconsiglia l’assunzione di acidi grassi omega-3 in caso di malattie renali, malattie epatiche, pancreatite o colecistite acute. Anche chi soffre di problemi di coagulazione o deve sottoporsi a un intervento chirurgico dovrebbe consultare il proprio medico, che confermerà o meno se è possibile continuare ad assumere gli integratori a base di omega-3. Alcuni medici consigliano di sospendere l’impiego di questi preparati una o due settimane prima dell’operazione.
Gli antiossidanti prevengono i danni ai tessuti e le infiammazioni
Meccanismo d’azione degli antiossidanti
Secondo studi condotti a livello cellulare, in caso di celiachia si verifica una disfunzione nell’equilibrio tra radicali liberi e antiossidanti. Questo provoca un maggiore stress ossidativo che danneggia le cellule intestinali, fino al loro decesso. Gli antiossidanti neutralizzano i radicali pericolosi e contrastano le infiammazioni e i danni ai tessuti, oltre ad avere altre proprietà benefiche:
- La vitamina E, la vitamina C e i carotenoidi regolano il sistema immunitario e attivano i trasmettitori infiammatori.
- Anche lo zinco e il selenio sono importanti per il buon funzionamento del sistema immunitario. In caso di diarrea, lo zinco contribuisce a rinnovare la mucosa intestinale danneggiata.
- I polifenoli contenuti nel tè verde, come l’epigallocatechina gallato (EGCG) e la quercetina, rafforzano la barriera intestinale.
Studi osservazionali rivelano che i pazienti celiaci spesso non assumono quantità sufficienti di antiossidanti importanti come la vitamina E e lo zinco. Una carenza di antiossidanti potrebbe contribuire all’insorgenza di complicanze nei soggetti celiaci. Tuttavia, finora non sono stati condotti studi a sufficienza sui benefici degli antiossidanti in caso di celiachia. Alcuni esami di laboratorio mostrano che antiossidanti quali la quercetina e la vitamina C riducono l’attivazione di mediatori dell’infiammazione e potrebbero quindi alleviare i disturbi. Sembra inoltre che l’EGCG riduca la concentrazione delle proteine tossiche che si accumulano a livello intestinale nei pazienti celiaci. Un case study dimostra anche che la vitamina E potrebbe ridurre i sintomi della celiachia.
Una cosa è certa: lo stress ossidativo potenzia questo disturbo, quindi gli antiossidanti potrebbero aiutare ad alleviarne i sintomi, sebbene siano necessari studi clinici per confermarlo.
Dosaggio e consigli sull’assunzione di antiossidanti
In caso di celiachia, gli esperti in micronutrienti consigliano di assumere antiossidanti, in particolare:
- Vitamina C: da 200 a 500 milligrammi al giorno
- Vitamina E: da 20 a 50 milligrammi al giorno
- Zinco: da 15 a 30 milligrammi al giorno
- Carotenoidi: da 2 a 5 milligrammi al giorno
In linea di massima è meglio preferire un integratore combinato anziché dei singoli antiossidanti, perché gli integratori combinati spesso contengono anche altri antiossidanti come il selenio, la quercetina o l’EGCG in dosi bilanciate. Le vitamine C ed E andrebbero sempre assunte insieme per ottenere un effetto integrato. Spesso un integratore combinato contiene una dose del singolo antiossidante inferiore rispetto a un integratore singolo.
Si consiglia di assumere la vitamina E e i carotenoidi insieme ai pasti perché, essendo sostanze liposolubili, in questo modo vengono assorbite meglio. Anche lo zinco andrebbe preso insieme ai pasti per migliorarne la tollerabilità gastrica.
Determinazione dello stato antiossidante in laboratorio
Per sapere se il rapporto tra radicali liberi e antiossidanti è equilibrato, è possibile determinare il cosiddetto stato antiossidante nel sangue. Ciò è consigliabile soprattutto se si prevede l’assunzione di grandi quantità di antiossidanti, che possono risultare nocivi se l’organismo ne dispone già a sufficienza.
I metodi di rilevazione variano da un laboratorio all’altro e possono includere, accanto all’esame del sangue, anche analisi di saliva e urina. I valori normali dello stato antiossidante generale sono compresi tra 1,13 e 1,57 millimoli per litro.
Antiossidanti: da considerare in caso di malattie e assunzione di farmaci
In casi isolati, chi soffre di gravi problemi digestivi dovuti a celiachia (malassorbimento) presenta anche una carenza di vitamina K, da compensare prima di prendere la vitamina E poiché espone il soggetto a un maggiore rischio di emorragia. Nella fase di compensazione di una carenza di vitamine E e K si dovrebbero controllare i valori di coagulazione.
I fumatori non dovrebbero superare una dose giornaliera di 50 milligrammi di vitamina E sotto forma di alfa-tocoferolo isolato, poiché esposti al pericolo di emorragia cerebrale e a un lieve aumento del rischio di carcinoma al polmone, soprattutto se l’alfa-tocoferolo è combinato con dosi elevate di betacarotene (superiori a 10 milligrammi). Anche gli ex fumatori e chi è esposto all’amianto deve fare molta attenzione.
Si sconsigliano i carotenoidi a chi soffre di danni epatici e malattie renali. I pazienti nefropatici dovrebbero evitare gli integratori alimentari contenenti zinco perché la dose in eccesso non può essere eliminata correttamente dai reni malati.
Lo zinco si lega a determinati antibiotici e farmaci contro l’osteoporosi (bifosfonati come Fosamax®, Bonasol®) rendendoli inefficaci, quindi si consiglia di attendere almeno due ore tra le due assunzioni.
Dosaggi in breve
Dosi giornaliere consigliate in caso di celiachia | |
|---|---|
Vitamine | |
Vitamina D | da 1.000 a 2.000 unità internazionali (UI) |
Vitamina B6 | da 1 a 3 milligrammi (mg) |
Vitamina B12 | fino a 500 microgrammi (µg) sotto forma di metilcobalamina |
Acido folico | da 400 a 800 microgrammi sotto forma di acido 5-metiltetraidrofolico |
Vitamina C | da 200 a 500 milligrammi |
Vitamina E | da 20 a 50 milligrammi |
Minerali | |
Ferro | da 50 a 200 milligrammi in caso di grave carenza da 20 a 40 milligrammi in caso di lieve carenza |
Calcio | da 600 a 1.200 milligrammi |
Zinco | da 15 a 30 milligrammi |
Flavonoidi | |
Carotenoidi | da 2 a 5 milligrammi |
Aminoacidi | |
Glutammina | da 4.500 a 9.000 milligrammi |
Altro | |
Probiotici (lattobacilli e bifidobatteri) | da 1 a 20 miliardi di unità formanti colonie (UFC) |
Prebiotici (ad esempio amido resistente) | fino a 25 grammi (g) |
Acidi grassi omega-3 (con un’elevata percentuale di EPA) | 2.000 milligrammi |
Esami di laboratorio consigliati in breve
Esami del sangue consigliati in caso di celiachia | |
|---|---|
Valori normali | |
Ferritina (stato del ferro) | Donne: da 23 a 110 microgrammi per litro (µg/l) Uomini: da 34 a 310 microgrammi per litro |
Saturazione della transferrina (stato del ferro) | 35 ± 15 percento (%) |
Vitamina D | da 40 a 60 nanogrammi per millilitro (ng/ml) |
Omocisteina | da 5 a 9 micromoli per litro (µmol/l) |
Indice omega-3 | superiore all’8 percento |
Stato generale degli antiossidanti | da 1,13 a 1,57 millimoli per litro (mmol/l) |
Riepilogo
La celiachia è una malattia infiammatoria cronica dell’intestino tenue. Il sistema immunitario di chi ne soffre attacca il glutine, una proteina contenuta in molti tipi di cereali (intolleranza al glutine). La medicina dei micronutrienti può aiutare a migliorare la salute dell’intestino, alleviare le infiammazioni, sostenere il sistema immunitario e integrare le vitamine e i minerali mancanti. Le infiammazioni dovute alla celiachia danneggiano la mucosa intestinale, contrastando così l’assorbimento di importanti micronutrienti.
I pazienti presentano quindi spesso una carenza di ferro, da compensare con integratori per prevenire l’anemia. La vitamina D e il calcio rafforzano le ossa, mentre le vitamine del gruppo B degradano l’omocisteina, una citotossina che, se permane a livelli elevati per troppo tempo, può danneggiare i vasi e incrementare il rischio di malattie a carico dell’apparato cardiocircolatorio.
I prebiotici e i probiotici rafforzano la barriera intestinale e, in caso di celiachia, regolano un possibile squilibrio della flora intestinale. L’organismo ha bisogno della glutammina per rifornire di energia le cellule dell’intestino tenue. È stato anche dimostrato che la glutammina favorisce l’impermeabilizzazione dell’intestino in presenza di altre infiammazioni intestinali croniche. Inoltre, gli omega-3 e gli antiossidanti sono in grado di arginare le infiammazioni e i danni ossidativi associati alla celiachia.
Indice degli studi e delle fonti
Aleanzi, M. et al. (2001): Celiac disease: antibody recognition against native and selectively deamidated gliadin peptides. Clin Chem 2001;47(11):2023-8. https://www.ncbi.nlm.nih.gov/pubmed/11673371, consultato il: 26.02.2019.
Annibale, B. et al. (2001): Efficacy of gluten-free diet alone on recovery from iron deficiency anemia in adult celiac patients. Am J Gastroenterol 2001;96(1):132-7. https://www.ncbi.nlm.nih.gov/pubmed/11197242, consultato il: 26.02.2019.
Benjamin, J. et al. (2012): Glutamine and whey protein improve intestinal permeability and morphology in patients with Crohn’s disease: a randomized controlled trial. Dig Dis Sci 2012;57(4):1000-12. https://www.ncbi.nlm.nih.gov/pubmed/22038507, consultato il: 25.02.2019.
Bernardo, D. et al. (2012): Ascorbate-dependent decrease of the mucosal immune inflammatory response to gliadin in coeliac disease patients. Allergol Immunopathol (Madr) 2012;40(1):3-8. https://www.ncbi.nlm.nih.gov/pubmed/21420224, consultato il: 26.02.2019.
Chander, A.M. et al. (2018): Cross-Talk Between Gluten, Intestinal Microbiota and Intestinal Mucosa in Celiac Disease: Recent Advances and Basis of Autoimmunity. Front Microbiol. 2018; 9: 2597. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6221985/, consultato il: 25.03.2019.
Conte, M.P. et al. (2006): Gut-associated bacterial microbiota in paediatric patients with inflammatory bowel disease. Gut 2006;55(12):1760-7. https://www.ncbi.nlm.nih.gov/pubmed/16648155, consultato il: 26.02.2019.
Conte, M.P. et al. (2018): Probiotics in celiac disease. Nutrients 2018;10(12):E1824. https://www.ncbi.nlm.nih.gov/pubmed/30477107, consultato il: 26.02.2019.
Cristofori, F. et al. (2018): Probiotics in Celiac Disease. Nutrients. 2018 Dec; 10(12): 1824. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6316269/, consultato il: 25.03.2019.
Deora, V. et al. (2017): Serum vitamins and minerals at diagnosis and follow-up in children with celiac disease. J Pedatr Gastroenterol Nutr 2017;65(2):185-89. https://www.ncbi.nlm.nih.gov/pubmed/28738401, consultato il: 26.02.2019.
De-Souza, D.A. & Greene, L.J. (2005): Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Crit Care Med. 2005 May;33(5):1125-35. https://www.ncbi.nlm.nih.gov/pubmed/15891348, consultato il: 25.03.2019.
De Stefano, D. et al. (2007): Lycopene, quercetin and tyrosol prevent macrophage activation induced by gliadin and IFN-gamma. Eur J Pharmacol 2007;566(1):192-9. https://www.ncbi.nlm.nih.gov/pubmed/?term=coeliac+disease+quercetin, consultato il: 26.02.2019.
Dias, R. et al. (2018): Molecular insights on the interaction and preventive potential of epigallocatechin-3-gallate in celiac disease. Int J Biol Macromol 2018;112:1029-37. https://www.ncbi.nlm.nih.gov/pubmed/?term=celiac+disease+egcg, consultato il: 26.02.2019.
Felber, J. et al. (2014): S2k-Leitlinie Zöliakie. AWMF-Register-Nr. 021/021. https://www.awmf.org/uploads/tx_szleitlinien/021-021l_S2k_Z%C3%B6liakie_05_2014_01.pdf, consultato il: 26.02.2019.
Ferretti, G. et al. (2012): Celiac disease, inflammation and oxidative damage: a nutrigenetic approach. Nutrients 2012;4(4):243-57. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3347005/, consultato il: 26.02.2019.
Grehn, S. et al. (2001): Dietary habits of Swedish adult coeliac patients treated by a gluten-free diet for 10 years. Scand J Nutr/Näringsforskning 2001;45(1):178-82. https://www.tandfonline.com/doi/pdf/10.3402/fnr.v45i0.1795?needAccess=true, consultato il: 26.02.2019.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Hallert, C. et al. (2002): Evidence of poor vitamin status in coeliac patients on a gluten-free diet for 10 years. Aliment Pharmacol Ther. 2002 Jul;16(7):1333-9. https://www.ncbi.nlm.nih.gov/pubmed/12144584?dopt=Abstract, consultato il: 25.03.2019.
Hallert, C. et al. (2009): Clinical trial: B-vitamins improve health in patients with coeliac disease living on gluten-free diet. Aliment Pharmacol Ther 2009;29(8):811-6. https://www.ncbi.nlm.nih.gov/pubmed/19154566, consultato il: 26.02.2019.
Hond, E.D. et al. (1999): Effect of glutamine on the intestinal permeability changes induced by indomethacin in humans. Aliment Pharmacol Ther 1999;13(5):679-85. https://www.ncbi.nlm.nih.gov/pubmed/10233193, consultato il: 26.02.2019.
Hozyasz, K. et al. (2003): Low vitamin E as a possible cause of complications in celiac disease. Indian J Gastroenterol 2003;22(6):237-8. https://www.ncbi.nlm.nih.gov/pubmed/15030047, consultato il: 26.02.2019.
Janeczko, C.E. et al. (2009): Supplemental vitamin K improves the stability of anticoagulation in a patient with low tissue stores of vitamin K secondary to coeliac disease. BMJ Case Rep 2009;2009:bcr10.2008.1067. https://www.ncbi.nlm.nih.gov/pubmed/21686472, consultato il: 26.02.2019.
Klemenak, M. et al. (2015): Administration of Bifidobacterium breve Decreases the Production of TNF-α in Children with Celiac Disease. Dig Dis Sci. 2015 Nov;60(11):3386-92. https://www.ncbi.nlm.nih.gov/pubmed/26134988, consultato il: 25.03.2019.
Li, Y. et al. (2006): Oral glutamine ameliorates chemotherapy-induced changes of intestinal permeability and does not interfere with the antitumor effect of chemotherapy in patients with breast cancer: a prospective randomized trial. Tumori 2006;92(5):396-401. https://www.ncbi.nlm.nih.gov/pubmed/17168431, consultato il: 26.02.2019.
Matysiak-Budnik, T. et al. (2008): Secretory IgA mediates retrotranscytosis of intact gliadin peptides via the transferrin receptor in celiac disease. J Exp Med 2008;205(1):143-54. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2234361/, consultato il: 26.02.2019.
Miles, E.A. & Calder, P.C. (2012): Influence of marine n-3 polyunsaturated fatty acids on immune function and a systematic review of their effects on clinical outcomes in rheumatoid arthritis. Br J Nutr 2012;107 Suppl 2:S171-84. https://www.ncbi.nlm.nih.gov/pubmed/22591891, consultato il: 26.02.2019.
Pizzini, A. et al. (2018): The role of omega-3 fatty acids in the setting of coronary artery disease and COPD: a review. Nutrients 2018;10(12):1864. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6316059/, consultato il: 26.02.2019.
Pool-Zobel, B.L. (2007): Gesundheitsfördernde Eigenschaften von Inulin und Oligofruktose, Teil 2. Ernährungs-Umschau 2007;54:70-80. https://www.ernaehrungs-umschau.de/fileadmin/Ernaehrungs-Umschau/pdfs/pdf_2007/02_07/EU02_70_72_77_80.pdf, consultato il: 25.02.2019.
Qinghui, M. et al. (2017): Leaky Gut As a Danger Signal for Autoimmune Diseases. Front Immunol. 2017; 8: 598. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5440529/, consultato il: 25.03.2019.
Olivares, M. et al. (2014): Double-blind, randomised, placebo-controlled intervention trial to evaluate the effects of Bifidobacterium longum CECT 7347 in children with newly diagnosed coeliac disease. Br J Nutr. 2014 Jul 14;112(1):30-40. https://www.ncbi.nlm.nih.gov/pubmed/24774670, consultato il: 25.03.2019.
Rawal, P. et al. (2010): Zinc supplementation to patients with celiac disease – is it required? J Trop Pediatr 2010;56(6):391-7. https://www.ncbi.nlm.nih.gov/pubmed/20176568, consultato il: 26.02.2019.
Romanczuk, B. et al. (2016): Analysis of the concentration of vitamin E in erythrocytes of patients with celiac disease. Prz Gastroenterol 2016;11(4):282-285. https://www.ncbi.nlm.nih.gov/pubmed/28053684, consultato il: 26.02.2019.
Scaioli, E. et al. (2017): The imbalance between n-6/n-3 polyunsaturated fatty acids and inflammatory bowel disease: a comprehensive review and future therapeutic perspectives. Int J Mol Sci 2017;18(12):E2619. https://www.ncbi.nlm.nih.gov/pubmed/29206211, consultato il: 26.02.2019.
Sevinc, E. et al. (2016): Plasma glutamine and cystine are decreased and negatively correlated with endomysial antibody in children with celiac disease. Asia Pac J Clin Nutr 2016;25(3):452-456. http://apjcn.nhri.org.tw/server/APJCN/25/3/452.pdf, consultato il: 25.03.2019.
Schuppan, D. et al. (2013): Diagnostik und Therapie der Zöliakie. Dtsch Arztebl Int 2013;110(49):835-46. https://www.aerzteblatt.de/archiv/150736/Diagnostik-und-Therapie-der-Zoeliakie, consultato il: 26.02.2019.
Smecuol, E. et al. (2013): Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol 2013;47(2):139-47. https://www.ncbi.nlm.nih.gov/pubmed/23314670, consultato il: 26.02.2019.
Thorvardur, R. et al. (2007): Hematologic manifestation of celiac disease. Blood 2007;109:412-21. http://www.bloodjournal.org/content/109/2/412.full?sso-checked=true, consultato il: 26.02.2019.
Valdimarsson, T. et al. (1996): Reversal of osteopenia with diet in adult coeliac disease. Gut. 1996 Mar;38(3):322-7. https://www.ncbi.nlm.nih.gov/pubmed/8675082, consultato il: 25.03.2019.
Veselinovic, M. et al. (2017): Clinical benefits of n-3 PUFA and ɤ-linolenic acid in patients with rheumatoid arthritis. Nutrients 2017;9(4):E325. https://www.ncbi.nlm.nih.gov/pubmed/28346333, consultato il: 26.02.2019.
Visser, J. et al. (2009): Tight junctions, intestinal permeability, and autoimmunity celiac disease and type 1 diabetes paradigms. Ann N Y Acad Sci 2009;1165:195-205. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2886850/, consultato il: 26.02.2019.
Welstead, L. (2015): The gluten-free diet in the 3rd millennium: rules, risks and opportunities. Diseases 2015;3(3):136-49. https://www.mdpi.com/2079-9721/3/3/136/htm, consultato il: 26.02.2019.
Wenkai, R. et al. (2016): Glutamine-Induced Secretion of Intestinal Secretory Immunoglobulin A: A Mechanistic Perspective. Front Immunol. 2016; 7: 503. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5121228/, consultato il: 25.03.2019.
Wierdsma, N.J. et al. (2013): Vitamin and mineral deficiencies are highly prevalent in newly diagnosed celiac disease patients. Nutrients 2013;5(10):3975-92. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3820055/, consultato il: 26.02.2019.
Yan Chun, L. et al. (2015): Critical Roles of Intestinal Epithelial Vitamin D Receptor Signaling in Controlling Gut Mucosal Inflammation. J Steroid Biochem Mol Biol. 2015 Apr; 148: 179–183. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4361385/, consultato il: 25.03.2019.
Zanchetta, M.B. et al. (2017): Impaired bone microarchitecture improves after one year on gluten-free diet: a prospective longitudinal HRpQCT study in women with celiac disease. J Bone Miner Res 2017;32(1):135-42. https://www.ncbi.nlm.nih.gov/pubmed/27447366, consultato il: 26.02.2019.
Zingone, F. & Ciacci, C. (2018): The value and significance of 25(OH) and 1,25(OH) vitamin D serum levels in adult coeliac patients: A review of the literature. Dig Liver Dis. 2018 Aug;50(8):757-760. https://www.ncbi.nlm.nih.gov/pubmed/29773507, consultato il: 25.03.2019.