Menschen mit Zöliakie leiden unter einer chronischen Entzündung des Dünndarms. Diese wird durch eine Unverträglichkeit gegen das in vielen Getreidesorten enthaltene Gluten ausgelöst. Die Betroffenen leiden unter verschiedenen Beschwerden wie Durchfall und Müdigkeit. Außerdem weisen sie häufig Nährstoffmängel auf. Um eine dauerhafte Schädigung der Dünndarmschleimhaut zu vermeiden, müssen Zöliakie-Patienten ein Leben lang eine glutenfreie Diät einhalten. Lesen Sie, wie der gezielte Einsatz der Mikronährstoffmedizin die Behandlung unterstützen kann.

Ursachen und Symptome
Was versteht man unter einer Zöliakie?
Bei einer Zöliakie handelt es sich um eine entzündliche und chronische Erkrankung des Dünndarms, die bisher nicht heilbar ist. Experten schätzen, dass zwischen 0,5 und 7 Prozent der Bevölkerung an einer Zöliakie leiden. Bei den betroffenen Personen richtet sich das eigene Immunsystem gegen das Klebereiweiß Gluten (Glutenunverträglichkeit). Gluten ist in Getreidesorten wie Weizen, Roggen, Gerste und Dinkel enthalten.
Bei Zöliakie-Patienten sammeln sich im Dünndarm hohe Konzentrationen von bestimmten Spaltprodukten des Glutens, sogenannte Oligopeptide. Oligopeptide aktivieren spezielle Zellen des Immunsystems und lösen dadurch eine Kettenreaktion aus, die zu oxidativem Stress und entzündlichen Veränderungen führt sowie die Darmschleimhaut schädigt. Durch diese Schädigung verkümmern die Darmzotten (Zottenatrophie). Die Dünndarmschleimhaut ist mit solchen Zotten ausgekleidet. Diese braucht der Körper, um die Inhaltsstoffe der Nahrung aufzunehmen. Verkümmern die Zotten, kommt es zu Nährstoffmängeln. Unbehandelt kann eine Zöliakie zu schwerwiegenden Folgeerkrankungen wie Darmkrebs führen.
Info
Die ständigen Entzündungen bei Zöliakie können auch andere Organe, zum Beispiel die Haut, betreffen. Diese Sonderform nennt sich „Dermatitis herpetiformis Duhring“.
In den letzten Jahren stieg die Zahl der Menschen an, die von einer Zöliakie betroffen sind. Als Ursache dafür werden verschiedene Auslöser aus der Umwelt, Magen-Darm-Infekte, veränderte Ernährungsgewohnheiten und auch psychosoziale Faktoren vermutet. Wahrscheinlich lösen diese, in Zusammenspiel mit einer genetischen Veranlagung, das Krankheitsbild aus.
Anzeichen einer Zöliakie
Zu den Symptomen der Zöliakie zählen Gewichtsverlust, Fettstuhl und sogenannte Eiweißmangelödeme. Das sind Wassereinlagerungen im Gewebe infolge eines anhaltenden Eiweißmangels. Häufig wird die Erkrankung bereits bei Kleinkindern entdeckt. Folgende Symptome kennzeichnen die klassische Zöliakie und können zwischen dem ersten und dritten Lebensjahr beobachtet werden:
- aufgeblähter Bauch
- übelriechende Durchfälle
- Wachstumsstörungen
- verminderter Appetit und Essstörungen
- Eisenmangel
- verändertes Verhalten oder Wesensveränderungen, wie zum Beispiel Weinerlichkeit
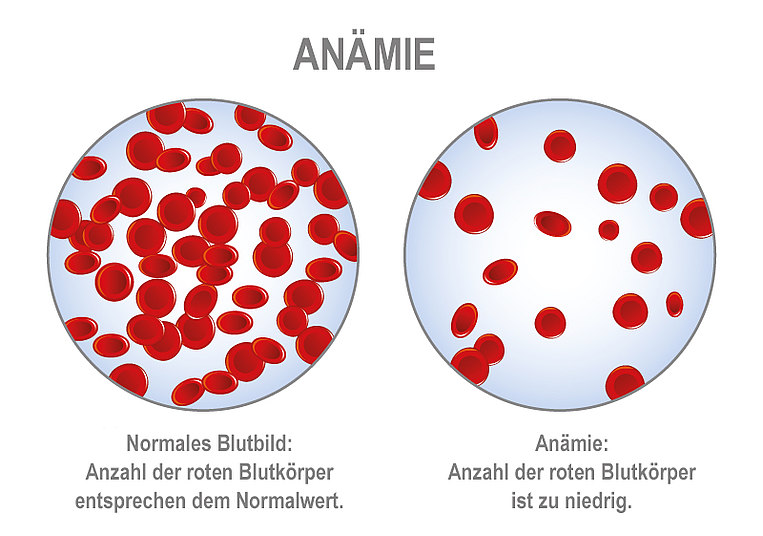
Auch weitere Symptome wie Müdigkeit, Schlafstörungen und Verstopfung können auftreten. Zöliakie-Patienten sind außerdem anfällig für weitere Erkrankungen, bei denen sich das Immunsystem gegen körpereigenes Gewebe richtet (Autoimmunkrankheiten) – zum Beispiel Hashimoto. Zudem sind Begleiterkrankungen möglich wie Reizdarm, Leaky-Gut-Syndrom, Migräne, Epilepsie, Depressionen, Asthma, Osteoporose, Blutarmut (Anämie) und Erkrankungen des Nervensystems (Neuropathien).
Info
Oft lassen sich die Krankheitsanzeichen, vor allem zu Beginn der Erkrankung, schwer zuordnen. Auch sind sie bei den Patienten unterschiedlich stark ausgeprägt, was eine Diagnose zusätzlich erschwert. Darüber hinaus kann eine Zöliakie sogar ohne Symptome, also „asymptomatisch“, verlaufen. Diese Form der Zöliakie lässt sich nur mittels bestimmter Laboruntersuchungen oder über Gewebeproben aus dem Dünndarm nachweisen.

Ziele der Behandlung
Wie wird Zöliakie klassisch behandelt?
Ziel der Behandlung ist es, die Beschwerden im Magen-Darm-Trakt und im gesamten Körper zu lindern und so die Lebensqualität der Betroffenen zu verbessern. Derzeit ist eine lebenslange glutenfreie Diät die einzige Therapie der Zöliakie, um Entzündungen im Dünndarm und die Schädigung der Darmzotten zu vermeiden sowie den Patienten vor möglichen Folgeerkrankungen zu schützen.
Tipp
Die Einführung einer glutenfreien Diät sollte in Zusammenarbeit mit einer Ernährungsfachkraft erfolgen. Die Ernährung komplett glutenfrei zu gestalten, ist nur schwer möglich, da auch in vermeintlich glutenfreien Lebensmitteln aufgrund von Verunreinigungen bei der Herstellung, Lagerung und Zubereitung geringe Mengen an Gluten enthalten sein können. Die Menge an Gluten, die bei den meisten Patienten keine Probleme auslöst, liegt bei unter 10 Milligramm pro Tag. Dies entspricht etwa zehn Brotbröseln.
Die Schädigung des Dünndarms kann bei einigen Zöliakie-Patienten auch zu einer Milchzucker-Unverträglichkeit (Laktoseintoleranz) führen. Dann sollte der Konsum von Milchprodukten reduziert werden. In einigen Fällen kann auch die unterstützende Einnahme von Medikamenten sinnvoll sein.
Ziele der Mikronährstoffmedizin
Um einen Mangel an wichtigen Mikronährstoffen zu vermeiden, sollten Zöliakie-Patienten engmaschig ärztlich untersucht werden. Liegt ein Mangel an Vitaminen und Mineralstoffen vor, muss dieser ausgeglichen werden. Besonders ein Mangel an Eisen kann die Schädigung der Dünndarmzotten verstärken.
Mithilfe der Mikronährstoffmedizin ist es zudem möglich, die Darmgesundheit zu fördern, Entzündungen zu dämpfen und das Immunsystem zu unterstützen. Die wichtigsten Mikronährstoffe bei Zöliakie sind:
- Eisen gleicht einen Mangel aus und kann Folgeerkrankungen vermeiden.
- Vitamin D und Calcium stärken die Knochen.
- B-Vitamine bauen das Zellgift Homocystein ab.
- Prä- und Probiotika fördern die Darmgesundheit.
- Omega3-Fettsäuren können möglicherweise bei einer Zöliakie die Entzündung eindämmen.
- Glutamin kann die Durchlässigkeit der Darmwand senken.
- Antioxidantien beugen Gewebeschäden und Entzündungen vor.
Behandlung mit Mikronährstoffen
Eisen hilft gegen Blutarmut
Wirkweise von Eisen
Eisen ist ein wesentlicher Bestandteil von Hämoglobin, dem roten Blutfarbstoff. Der Körper braucht Hämoglobin, um Sauerstoff in die Körperzellen zu bringen. Ein anhaltender Mangel an Eisen führt zu einer Blutarmut (Eisenmangelanämie). Durch den eingeschränkten Transport von Sauerstoff fühlen sich Betroffene oft müde oder schwindelig. Sie sind blass und kurzatmig oder berichten von starkem Herzklopfen.
Durch die geschädigte Darmschleimhaut bei Zöliakie wird zu wenig Eisen aus der Nahrung aufgenommen. Ein Mangel an Eisen ist daher ein häufiges Problem der Erkrankung. Eine Beobachtungsstudie verdeutlicht dies: Fast die Hälfte der untersuchten Zöliakie-Patienten wiesen eine Eisenmangelanämie auf.
Eine Vorstudie an Zöliakie-Patienten zeigt, dass eine glutenfreie Diät allein den Mangel an Eisen nicht bei allen Patienten ausgleichen kann. Die Patienten erholten sich außerdem erst sehr langsam nach sechs bis zwölf Monaten von einer Eisenmangelanämie. Laut der Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselerkrankungen ist die Einnahme von Eisen, vor allem bei einer Eisenmangelanämie, empfehlenswert, um den Mangel frühzeitig zu beheben und der Blutarmut entgegenzuwirken.
Dosierung und Einnahmeempfehlung von Eisen
Die richtige Dosierung von Eisen ist abhängig von der Stärke des Mangels. Es ist daher empfehlenswert, vorab den Eisenspiegel im Blut von Ihrem behandelnden Arzt bestimmen zu lassen. Bei einem starken Mangel empfehlen Mikronährstoff-Experten meist zwischen 50 und 200 Milligramm pro Tag. Bei einem leichten Eisenmangel können auch niedrigere Dosierungen ausreichen, zum Beispiel 20 bis 40 Milligramm.
Eisen ist als Kapsel, Tablette und als Trinkfläschchen (Eisen-Ampullen) erhältlich. Für eine optimale Aufnahme im Körper ist es empfehlenswert, Eisen zwei bis drei Stunden vor einer Mahlzeit einzunehmen. Viele vertragen eine Einnahme zur Mahlzeit allerdings besser. Wenn Sie Eisen zur Mahlzeit einnehmen, achten Sie darauf, dass wenig „Eisenräuber“ wie Kaffee, Tee, Milch, Cola und Vollkornprodukte Bestandteil der Mahlzeit sind. Es ist außerdem sinnvoll, Eisen mit Vitamin C zu kombinieren. Vitamin C sorgt dafür, dass Eisen im Darm besser aufgenommen werden kann.
Tipp
Es sind Eisenverbindungen erhältlich, die weniger Magen-Darm-Beschwerden verursachen. Hierzu zählen Eisenfumarat, Eisenbisglycinat oder Eisengluconat. Zudem gibt es die Möglichkeit, das Eisen zu verkapseln: Dadurch kommt die Magen-Darm-Schleimhaut nicht direkt mit dem Eisen in Kontakt, was wiederum keine Magen-Darm-Beschwerden hervorruft.
Eisenwert im Labor bestimmen lassen
Es gibt eine Vielzahl von Laborwerten, die für die Beurteilung der Eisenversorgung ermittelt werden können; jedoch kann kein einzelner Laborwert eine eindeutige Aussage über die Eisenversorgung treffen. Für die Beurteilung zieht der Arzt deshalb mehrere Eisen-Laborwerte heran, wie zum Beispiel das Speichereisen (Ferritin) und das Transporteisen (Transferrin-Sättigung).
Die Normalwerte für Ferritin bei Frauen liegen bei 23 bis 110 Mikrogramm pro Liter und bei Männern bei 34 bis 310 Mikrogramm pro Liter. Die Transferrin-Sättigung liegt bei Frauen und Männern bei 35 ± 15 Prozent.
Eisen: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei Magen-Darm-Erkrankungen, Magengeschwüren oder Magenschleimhautentzündungen sollte kein Eisen eingenommen werden, da sich die Beschwerden verschlimmern könnten. Ebenfalls muss bei Eisenverwertungsstörungen auf die Einnahme von Eisen verzichtet werden, da es sich im Körper anreichern kann. Dazu zählen die Eisenspeicherkrankheit (Hämochromatose) und die Mittelmeeranämie (Thalassämie). Bei schweren Erkrankungen von Leber und Niere sollten Sie mit Ihrem Arzt Rücksprache halten, ob Sie Eisen einnehmen dürfen.
Der Wirkstoff Allopurinol (Zyloric®, Allobeta®) zur Behandlung von Gicht kann die Speicherung von Eisen in der Leber erhöhen. Auf Dauer ist dies für den Körper schädlich. Eisenpräparate sollten demnach nicht während einer Behandlung mit diesem Wirkstoff eingenommen werden.
Eisen vermindert zudem die Aufnahme und die Wirkung einer Reihe von Medikamenten. Halten Sie daher bei folgenden Wirkstoffen einen Einnahmeabstand von zwei bis drei Stunden ein, nachdem Sie ein Eisenpräparat eingenommen haben:
- Blutdrucksenker: zum Beispiel ACE-Hemmer mit Wirkstoffen wie Benazepril (Lotensin HCT®) oder Captopril (Tensobon®)
- Osteoporose-Medikamente: zum Beispiel Bisphosphonate mit Wirkstoffen wie Alendronat (Fosamax®) oder Pamidronat (Aredia®)
- Schilddrüsenmedikamente: Thyroxin (L-Thyroxin®)
Welche Medikamente noch betroffen sind, erfahren Sie im Text zu Eisen.
Vitamin D und Calcium stärken die Knochen
Wirkweise von Vitamin D und Calcium
Vitamin D ist notwendig für stabile Knochen: Es erhöht im Darm die Aufnahme von Calcium und stellt dem Knochen so diesen wichtigen Baustoff zur Verfügung. Außerdem reguliert Vitamin D das Immunsystem, indem es dafür sorgt, dass sich die Abwehrzellen im Fall einer Infektion teilen. Vitamin D hat auch entzündungshemmende Eigenschaften, kann die Schleimhaut des Darms schützen und diesen abdichten.
Eine Untersuchung der Krankenakten von 140 Kindern mit Zöliakie ergab, dass bei den meisten (70 Prozent) zum Zeitpunkt der Diagnosestellung ein Vitamin-D-Mangel vorlag. Eine Unterversorgung mit Vitamin D (und Calcium) erhöht das Risiko für Knochenbrüche und einer geringen Knochendichte (Osteoporose). So zeigen Beobachtungsstudien an erwachsenen Zöliakie-Patienten, dass deren Risiko für Knochenbrüche im Vergleich zu Gesunden um bis zu 40 Prozent erhöht ist. Die Betroffenen weisen auch häufig eine verminderte Knochendichte und/oder Osteoporose auf.
Vermutlich kann eine glutenfreie Diät einen Mangel an Vitamin D ausgleichen. Zu diesem Ergebnis kommen die meisten Studien einer Übersichtsarbeit. Auch bei Kindern mit Zöliakie konnten sich die Blutwerte von Vitamin D durch die Einhaltung der Diät verbessern, allerdings lagen diese noch nicht im Normalbereich. Eine kleine Beobachtungsstudie an 35 Frauen zeigt, dass sich auch die Knochendichte durch eine glutenfreie Diät wieder erhöhen kann. Nahmen Betroffene Vitamin D ein und achteten auf eine ausreichende Calciumzufuhr von 1.000 Milligramm über die Nahrung, ließ sich die durch eine Zöliakie verursachte Abnahme der Knochendichte sogar zum Teil wieder umkehren. Das zeigt eine weitere Beobachtungsstudie an Frauen.
Ein Vitamin-D-Mangel ist häufig und sollte bei Zöliakie vermieden werden. Insbesondere wenn eine verminderte Knochendichte vorliegt, wird in der offiziellen Behandlungs-Leitlinie zur Einnahme von Vitamin D und Calcium zusammen mit einer glutenfreien Diät geraten.
Dosierung und Einnahmeempfehlung von Vitamin D und Calcium
Mikronährstoff-Experten empfehlen eine Tagesdosis von 1.000 bis 2.000 Internationale Einheiten Vitamin D sowie 600 bis 1.200 Milligramm Calcium. Da Vitamin D ein fettlösliches Vitamin ist, sollte es gemeinsam mit dem Essen eingenommen werden. Fett aus der Mahlzeit steigert die Aufnahme im Darm. Um die Aufnahme von Calcium zu steigern, nehmen Sie Dosierungen ab 500 Milligramm in mehreren Dosen über den Tag verteilt ein.
Tipp
Für gesunde Knochen ist außerdem Vitamin K wichtig – besonders Vitamin K2. Gute Vitamin-D- und Calciumpräparate enthalten daher auch Vitamin K2. Alles über Vitamin K erfahren Sie hier.
Vitamin-D-Wert im Labor bestimmen lassen
Bei Zöliakie wird empfohlen, den Vitamin-D-Wert überprüfen zu lassen, da bei einem starken Mangel eine höhere Dosierung nötig sein kann. Dazu wird die Transportform im Blut bestimmt, das sogenannte 25(OH)-Vitamin D (Calcidiol). Es wird im Blutserum gemessen, der Flüssigkeit des Blutes ohne die Blutzellen. Die idealen Werte für Vitamin D im Serum liegen bei 40 bis 60 Nanogramm pro Milliliter.
Vitamin D und Calcium: zu beachten bei Medikamenteneinnahme und Erkrankungen
Entwässerungsmedikamente aus der Gruppe der Thiazide senken die Calciumausscheidung über die Nieren. Das bedeutet, Calcium bleibt im Blut. Da Vitamin D den Calciumspiegel im Blut erhöht, sollte Vitamin D nur gemeinsam mit Thiaziden eingenommen werden, wenn der Calciumspiegel regelmäßig kontrolliert wird. Dazu gehört der Wirkstoff Hydrochlorothiazid (Disalunil®, Esidrix®). Weitere Thiazide sind Indapamid (zum Beispiel Inda Puren®, Sicco®) und Xipamid (zum Beispiel Aquaphor®, Neotri®). Sprechen Sie die Einnahme von Vitamin D und Calcium dann mit Ihrem Arzt ab.
Personen mit Nierenerkrankungen wie chronischer Nierenschwäche und Nierensteinen (calciumhaltige Steine) sollten Vitamin D und Calcium nicht ohne Rücksprache mit dem Arzt einnehmen: Vitamin D steigert die Calciumaufnahme im Darm, sodass die Blutwerte von Calcium ansteigen. Kranke Nieren können überschüssiges Calcium jedoch nicht gut ausscheiden. Bei Nierensteinpatienten könnte dadurch das Rückfallrisiko gesteigert werden.
Bei der entzündlichen Bindegewebserkrankung Sarkoidose (Morbus Boeck) sollten Vitamin D und Calcium nicht eingenommen werden: Sarkoidose-Patienten haben häufig schon hohe Calciumspiegel im Blut, die durch die Einnahme von Vitamin D und Calcium zusätzlich steigen würden. Auch bei zu hohen Calciumwerten (Hypercalcämie) sollten Sie auf die Einnahme von Calcium verzichten. Das kommt zum Beispiel bei einer Überfunktion der Nebenschilddrüse (zum Beispiel bei Nebenschilddrüsentumoren), bei Knochenmetastasen und Knochenmarkkrebs (Multiples Myelom) vor.
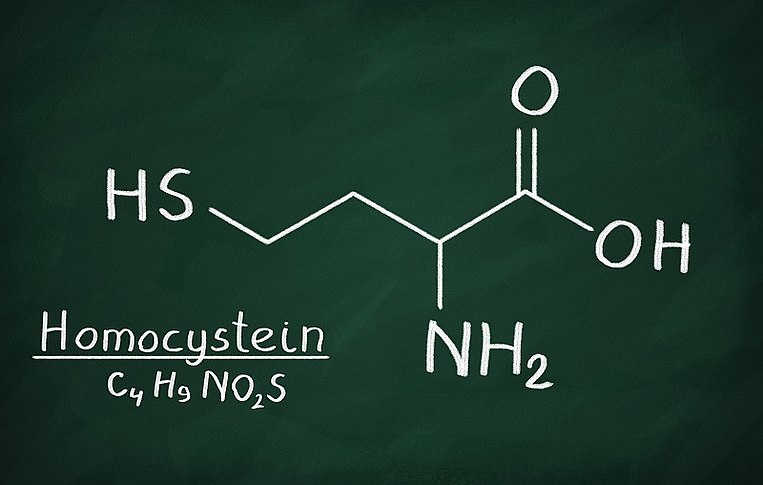
B-Vitamine senken erhöhte Homocysteinwerte
Wirkweise von B-Vitaminen
B-Vitamine benötigt der Körper, um das Zellgift Homocystein abzubauen. Hohe Werte stellen einen Risikofaktor für Herz-Kreislauf-Erkrankungen dar. Daher muss dieses schädliche Zwischenprodukt des Stoffwechsels beständig entsorgt werden. Vitamin B12 drosselt zudem Entzündungsreaktionen. Darüber hinaus sind B-Vitamine für die Regeneration des Darms notwendig, da sie für die Zellteilung benötigt werden. Eine ausreichende Versorgung ist daher bei Zöliakie wichtig.
Zöliakie-Patienten nehmen, einer Beobachtung des Ernährungsverhaltens zufolge, zu wenig B-Vitamine auf. Unter einer glutenfreien Diät kann sich die Versorgung mit B-Vitaminen normalisieren. Allerdings können dadurch auch wichtige Quellen für B-Vitamine wegfallen, wie zum Beispiel Weizenkeime. Deshalb kann die Einnahme von B-Vitaminen bei Zöliakie eine wichtige Rolle dabei spielen, die ausreichende Versorgung zu gewährleisten. Eine Beobachtungsstudie verdeutlicht dies: Etwa die Hälfte der Erwachsenen, die über mehrere Jahre eine glutenfreie Diät einhielten, hatten zu wenig Folsäure und Vitamin B6 im Blut, was erhöhte Homocysteinspiegel nach sich zieht.
Eine hochwertige Studie untermauert den Nutzen von B-Vitaminen: Bei Erwachsenen mit langjähriger Zöliakie, die sechs Monate lang zusätzlich Folsäure, Vitamin B6 und Vitamin B12 einnahmen, normalisierten sich die Homocysteinwerte im Blut und ihr allgemeines Wohlbefinden verbesserte sich.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Mikronährstoff-Experten empfehlen bei Zöliakie eine tägliche Einnahme von B-Vitaminen, insbesondere:
- 1 bis 3 Milligramm Vitamin B6
- bis zu 500 Mikrogramm Vitamin B12
- 400 bis 800 Mikrogramm Folsäure (als direkt verwertbares 5-Methyltetrahydrofolat)
Da sich die B-Vitamine in ihrer Wirkung ergänzen, sollten sie idealerweise auch als Kombination eingenommen werden. Sinnvoll ist zudem die Einnahme mit etwas Flüssigkeit zu einer Mahlzeit. Dadurch verbessert sich die Verträglichkeit für den Magen.
Homocysteinwert im Labor bestimmen lassen
Bei Zöliakie wird empfohlen, den Homocysteinwert überprüfen zu lassen, um einen möglichen Mangel an B-Vitaminen zu erkennen. Homocystein wird im Blutplasma bestimmt. Das ist der flüssige Teil des Blutes ohne Blutzellen. Als Normwerte gelten 5 bis 9 Mikromol pro Liter.
B-Vitamine: zu beachten in der Schwangerschaft und Stillzeit sowie bei Erkrankungen
B-Vitamine bei Zöliakie sollten in hoher Dosierung in der Schwangerschaft und Stillzeit nur bei einem nachgewiesenen Mangel eingenommen werden. Allgemeine Empfehlungen für Schwangere finden Sie hier.
Diabetiker mit geschädigten Nieren und Nierenpatienten müssen besonders umsichtig sein: Vitamin B12 sollten Nierenpatienten nicht in Form von Cyanocobalamin, sondern als Methylcobalamin einsetzen. Cyanocobalamin ist für Nierenpatienten vermutlich hoch dosiert schädlich.
Nach dem Setzen von Gefäßstützen (Stents) und nach einem Herzinfarkt ist die Gabe kombinierter B-Vitamine noch nicht ausreichend erforscht. Möglicherweise wirken B-Vitamine hier negativ. Hohe Dosen an Vitamin B12 (60 bis 400 Mikrogramm pro Tag) und Folsäure (800 bis 1.200 Mikrogramm pro Tag) sollten dann vermieden werden.
Prä- und Probiotika bieten dem Darm Unterstützung
Wirkweise von Prä- und Probiotika
Ein gesunder Darm ist Voraussetzung für den Ausgleich von Nährstoffmängeln und zur Abwehr von Entzündungen. In unserem Darm leben unzählige Bakterien, die in ihrer Gesamtheit als Darmflora bezeichnet werden. Prä- und Probiotika können die Zusammensetzung der Darmflora positiv beeinflussen:
- Präbiotika sind Ballaststoffe wie resistente Stärke. Für den Menschen sind sie unverdaulich, für einige Bakterienarten im Darm jedoch die ideale Nahrung. Durch die Gabe von Präbiotika ändern sich die Bakterienverhältnisse vorteilhaft.
- Probiotika sind kleinste Lebewesen wie Bakterien oder Hefepilze. Hierzu zählen zum Beispiel Milchsäurebakterien wie Lactobacillus. Dieses und andere Bakterien können den Abbau von Gluten im Darm fördern, was möglicherweise einen neuen Behandlungsansatz für Zöliakie darstellt.
Es gibt außerdem Hinweise darauf, dass die Zusammensetzung der Darmflora mit dem Auftreten und dem Fortschreiten der Zöliakie zusammenhängt. Folgende Mechanismen werden vermutet: Die Darmflora stärkt die Darmschleimhaut, wirkt sich positiv auf das Immunsystem durch die Bereitstellung entzündungshemmender Substanzen aus oder unterstützt die Abdichtung des Darms.
In mehreren Beobachtungsstudien wurden Ungleichgewichte in der Darmflora von Patienten mit Zöliakie nachgewiesen: Sie haben möglicherweise mehr schädliche Bakterienarten und weniger gesundheitlich förderliche Arten wie Bifidobakterien im Vergleich zu gesunden Menschen. Bifidobakterien könnten die durch Gluten vermittelten Entzündungen bei Zöliakie bekämpfen. Darauf deutet eine kleine hochwertige Studie hin: Die Einnahme von Bifidobacterium infantis linderte die Magen-Darm-Symptome bei unbehandelter Zöliakie. Eine Vorstudie liefert zudem Hinweise, dass die Ergänzung einer glutenfreien Diät um Präbiotika (Oligofruktose-angereichertes Inulin) bei Kindern und Jugendlichen mit Zöliakie eine deutliche Verbesserung des Vitamin-D- und Vitamin-E-Status bewirken könnte.
Die bisherigen Ergebnisse von Prä- und Probiotika bei Zöliakie klingen vielversprechend, müssen jedoch durch weitere hochwertige Studien gestützt werden.
Dosierung und Einnahmeempfehlung von Prä- und Probiotika
Mikronährstoff-Experten empfehlen generell bei chronischen Darmerkrankungen eine Dosierung von 1 bis 20 Milliarden (1 bis 20 x 109) koloniebildenden Einheiten (KBE) Laktobazillen und Bifidobakterien pro Tag. In Studien waren bei Zöliakie-Patienten 2 Milliarden (2 x 109) koloniebildende Einheiten wirksam, sodass diese Menge mindestens im Präparat enthalten sein sollte. Damit gesundheitsförderliche Effekte spürbar sind, müssen Probiotika regelmäßig über einen längeren Zeitraum eingenommen werden. Sobald man damit aufhört, nimmt auch die Zahl der probiotischen Bakterien im Darm wieder ab.
Bei Präbiotika empfehlen Mikronährstoff-Experten zum Beispiel resistente Stärke (bis zu 25 Gramm täglich). Sie wird häufig aus Mais gewonnen und ist damit glutenfrei. In einer ersten Studie zeigten zwar 10 Gramm Oligofruktose-angereichertes Inulin positive Effekte, allerdings vertragen einige Zöliakie-Patienten den Fruchtzucker (Fruktose) nicht gut. Bei Ballaststoffen empfiehlt sich generell eine einschleichende Einnahme. Das bedeutet: Beginnen Sie mit einer niedrigen Dosierung (zum Beispiel 5 Gramm) über den Tag verteilt und steigern Sie die Dosis langsam. Der Darm muss sich meist erst an die erhöhte Ballaststoffzufuhr gewöhnen.
Probiotika: zu beachten bei Erkrankungen und Medikamenteneinnahme
Einige probiotische Bakterien bilden möglicherweise Histamin im Darm. Dazu zählen: Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis und Enterococcus faecium. Daher kann eine Probiotikaeinnahme bei einer Histaminintoleranz Beschwerden hervorrufen.
Sehr geschwächte Patienten mit unterdrücktem Immunsystem, Personen mit zentralen Venenzugängen (zum Beispiel bei Chemotherapie), Herzklappenerkrankungen und Kurzdarmsyndrom sollten keine Probiotika einnehmen.
Kann Glutamin die Durchlässigkeit des Darms bei Zöliakie verringern?
Wirkweise von Glutamin
Glutamin sorgt für die Ernährung der Dünndarmzellen und ist der wichtigste Energielieferant. Es erhält damit die Funktion sowie Struktur des Darms aufrecht. Dies ist besonders für eine schnellere Regeneration bei Schädigungen der Darmschleimhaut wichtig. Auch bei Entzündungen bewirkt Glutamin eine schnellere Erholung des Darms.
Eine Beobachtungsstudie an Kindern mit Zöliakie zeigt, dass sie im Vergleich zu gesunden Kindern weniger Glutamin im Blut hatten. Je weniger Glutamin im Blut war, desto mehr Antikörper gegen eigenes Bindegewebe waren zu finden. Antikörper bewirken, dass bei einigen Zöliakie-Patienten Bindegewebe wie die Darmschleimhaut angegriffen wird. Ob aber eine zusätzliche Glutaminzufuhr diese Antikörper senken kann, ist noch ungewiss.
Eine kleine Vorstudie an Patienten mit der chronisch-entzündlichen Darmerkrankung Morbus Crohn liefert erste Hinweise, dass Glutamin die Durchlässigkeit des Darms verringern kann. Die Durchlässigkeit des Darms ist bei Morbus Crohn – ebenso wie bei einer Zöliakie – erhöht. Durch einen stark durchlässigen Darm wird das Immunsystem vermehrt mit Nahrungsmittelbestandteilen konfrontiert und es kann zu chronischen Entzündungsprozessen kommen. Auch bei Patienten, die Schmerzmittel (nicht steroidale Antirheumatika) einnehmen, bei einer Chemotherapie und bei Intensiv-Patienten wirkte sich Glutamin günstig auf die Durchlässigkeit des Darms aus. Das belegen Vorstudien und eine Übersichtsarbeit über mehrere Studien.
Es besteht deshalb die Möglichkeit, dass Glutamin auch bei einer Zöliakie die Dichtigkeit des Darms erhöhen und dem Entzündungsprozess entgegenwirken kann. Studien mit Zöliakie-Patienten gibt es jedoch noch nicht.
Dosierung und Einnahmeempfehlung von Glutamin
Im Rahmen einer streng glutenfreien Diät empfehlen Mikronährstoff-Experten bei Zöliakie 4.500 bis 9.000 Milligramm Glutamin täglich. Beobachten Sie dabei, ob sich Ihre Symptome verbessern. Falls sie sich verschlechtern, halten Sie Rücksprache mit Ihrem Arzt.
Info
Es gibt Hinweise darauf, dass Glutamin die Menge an Antikörpern im Darm erhöht. Dadurch kann sich der Darm zwar besser wehren, allerdings könnten auch die Antikörper gegen das Gluten zunehmen und die Beschwerden verschlimmern – besonders wenn Gluten nicht streng gemieden wird.
Der Körper kann Glutamin am besten verarbeiten, wenn es verteilt über den Tag in mehreren kleinen Dosen eingenommen wird – am besten mindestens eine halbe Stunde vor der Mahlzeit.
Glutamin: zu beachten bei Erkrankungen
Bei Störungen der Nieren- und Leberfunktion sollte kein Glutamin eingesetzt werden. Wird Glutamin abgebaut, entsteht Stickstoff (Ammonium), der wiederum entgiftet werden muss. Bei Störungen der Nieren- und Leberfunktion ist die Entgiftung jedoch beeinträchtigt.
Omega-3-Fettsäuren können Entzündungsreaktionen kontrollieren
Wirkweise von Omega-3-Fettsäuren

Bei Zöliakie führen bestimmte Bestandteile des Glutens (Oligopeptide) zur Freisetzung entzündlicher Substanzen und oxidativem Stress. Omega-3-Fettsäuren können Entzündungsreaktionen beeinflussen, beispielsweise indem sie die Freisetzung wichtiger Entzündungsbotenstoffe regulieren. Deshalb könnten sie von großer Bedeutung für die Therapie der Zöliakie sein.
Bei einigen entzündlichen Erkrankungen wurde die Wirkung der Omega-3-Fettsäuren schon nachgewiesen. Eine Übersichtsarbeit zeigt zum Beispiel, dass Omega-3-Fettsäuren bei rheumatoider Arthritis positiv wirken. Auch Menschen mit chronisch entzündlichen Darmerkrankungen könnten von Omega-3-Fettsäuren profitieren, wie eine Auswertung verschiedener Studien zeigt. Die einzelnen Studien kommen jedoch zu gemischten Ergebnissen. Mögliche Gründe könnten unterschiedliche Dosierungen sein oder die Ausgangsversorgung: Ist man schon gut mit Omega-3-Fettsäuren versorgt, ist der Nutzen vermutlich eher gering.
Ob Omega-3-Fettsäuren bei einer Zöliakie helfen, wurde bislang nicht in Studien untersucht. Aufgrund ihrer entzündungshemmenden Eigenschaften ist die Einnahme jedoch einen Versuch wert.
Dosierung und Einnahmeempfehlung von Omega-3-Fettsäuren
Mikronährstoff-Experten empfehlen bei chronischen Darmerkrankungen eine Tagesdosis von 2.000 Milligramm Omega-3-Fettsäuren. Besonders geeignet sind Präparate mit einem höheren Gehalt an Eicosapentaensäure (EPA): Sie wirkt stark entzündungshemmend. EPA kommt zum Beispiel in Fischöl vor. Beobachten Sie bei der Einnahme Ihre Symptome. Verschlechtern sie sich, halten Sie Rücksprache mit Ihrem Arzt.
Tipp
Achten Sie bei Fischölpräparate auf die Qualität und kaufen Sie nur Präparate, die speziell gereinigt wurden. Durch eine Reinigung werden Rückstände wie Schwermetalle entfernt, die den Darm zusätzlich belasten könnten.
Omega-3-Index im Labor bestimmen lassen
Ob Sie gut mit Omega-3-Fettsäuren versorgt sind, erfahren Sie durch den Omega-3-Index. Dabei misst das Labor den Anteil der Omega-3-Fettsäuren (Eicosapentaensäure, kurz EPA und Docosahexaensäure, kurz DHA) in den roten Blutzellen (Erythrozyten). Der Omega-3-Index wird in Prozent angegeben und sollte optimalerweise über 8 liegen. Dies würde bedeuten, dass 8 von 100 Fettsäuren in den roten Blutzellen hochwertige Omega-3-Fettsäuren sind.
Omega-3-Fettsäuren: zu beachten bei Einnahme von Blutverdünnern, Erkrankungen und vor Operationen
Da Omega-3-Fettsäuren blutverdünnend wirken, könnten sie ab einer Dosierung von 1.000 Milligramm die Wirkung von Blutgerinnungshemmern verstärken. Besprechen Sie daher die Einnahme mit Ihrem Arzt: Er kann die Blutgerinnungszeit (Quick-Wert) regelmäßig kontrollieren. Zu den Blutverdünnern zählen:
- Cumarin-Derivate (wie Marcumar® und Coumadin®)
- Acetylsalicylsäure (ASS, Aspirin®)
- Heparin (Clexane®)
- neue orale Antikoagulanzien: Apixaban (Eliquis®), Dabigatran (Pradaxa®), Edoxaban (Lixiana®) und Rivaroxaban (Xarelto®)
Bei akuten Leber- oder Nierenerkrankungen, einer akuten Bauchspeicheldrüsenentzündung oder einer Gallenblasenentzündung sollten Omega-3-Fettsäuren nicht eingenommen werden. Auch wenn Sie eine Blutgerinnungsstörung haben oder sich einer Operation unterziehen müssen, sollten Sie die Einnahme von Omega-3-Fettsäuren zuvor mit dem Arzt abklären. Einige Ärzte empfehlen, ein bis zwei Wochen vor der Operation auf Omega-3-Präparate zu verzichten.
Antioxidantien beugen Gewebeschäden und Entzündungen vor
Wirkweise von Antioxidantien
Zellstudien zufolge ist bei einer Zöliakie die Balance zwischen freien Radikalen und Radikalfängern (Antioxidantien) gestört. Es entsteht vermehrt oxidativer Stress, der die Zellen des Darms nachhaltig schädigen und zum Zelltod führen kann. Antioxidantien entgiften die gefährlichen Radikale und wirken dadurch Entzündungen und Gewebeschäden entgegen. Darüber hinaus haben sie weitere nützliche Eigenschaften:
- Vitamin E und C sowie Carotinoide regulieren das Immunsystem und die Freisetzung entzündlicher Botenstoffe.
- Auch Zink und Selen sind für ein funktionierendes Immunsystem wichtig. Außerdem trägt Zink bei Durchfällen zur Erneuerung der geschädigten Darmschleimhaut bei.
- Grüntee-Polyphenole wie Epigallocatechingallat (EGCG) und Quercetin stärken die Barrierefunktion des Darms.
Beobachtungsstudien weisen darauf hin, dass Patienten mit einer Zöliakie oft nicht ausreichend mit wichtigen Antioxidantien, wie Vitamin E und Zink, versorgt sind. Ein Mangel an Antioxidantien könnte zu Komplikationen bei einer Zöliakie beitragen. Der Nutzen einer Antioxidantien-Einnahme für Zöliakie-Patienten ist bislang allerdings nur unzureichend untersucht. Einzelne Laborversuche deuten an, dass Antioxidantien, wie Quercetin und Vitamin C, die Freisetzung von Entzündungsbotenstoffen verringern und somit die Beschwerden lindern könnten. EGCG scheint zudem die Konzentration der giftigen Eiweiße zu senken, die sich bei Zöliakie-Patienten im Darm ansammeln. Darüber hinaus liefert ein Fallbericht Hinweise, dass Vitamin E die Symptome bei Zöliakie mindern könnte.
Als gesichert gilt, dass oxidativer Stress die Zöliakie verstärken kann. Somit könnte die Einnahme von Antioxidantien helfen, die Symptome zu lindern, auch wenn weitere hochwertige Studien erforderlich sind, um dies zu belegen.
Dosierung und Einnahmeempfehlung von Antioxidantien
Mikronährstoff-Experten empfehlen bei Zöliakie die Einnahme von Antioxidantien – insbesondere:
- Vitamin C: 200 bis 500 Milligramm pro Tag
- Vitamin E: 20 bis 50 Milligramm pro Tag
- Zink: 15 bis 30 Milligramm pro Tag
- Carotinoide: 2 bis 5 Milligramm pro Tag
Grundsätzlich ist es sinnvoller, ein Kombinationspräparat anstelle der einzelnen Antioxidantien einzunehmen. Sie enthalten oft auch weitere Antioxidantien wie Selen, Quercetin oder EGCG in abgestimmter Dosierung. Vitamin E und Vitamin C sollten immer zusammen angewendet werden, da sie sich in ihrer Wirkung ergänzen. Die Dosierung der Einzelbestandteile kann in einem Kombinationspräparat oft niedriger sein als in einem Einzelpräparat.
Nehmen Sie Vitamin E und Carotinoide am besten zu einer Mahlzeit ein, da die fettlöslichen Stoffe so am besten aufgenommen werden. Auch Zink sollte zum Essen eingenommen werden: So erhöht sich die Verträglichkeit für den Magen.
Antioxidantien-Status im Labor bestimmen lassen
Um herauszufinden, ob das Verhältnis zwischen freien Radikalen und Antioxidantien ausgeglichen ist, kann der sogenannte antioxidative Status im Blut bestimmt werden. Dies empfiehlt sich vor allem dann, wenn Antioxidantien in sehr großen Mengen eingenommen werden: Ist der Körper bereits gut mit Antioxidantien versorgt, können zu hohe Dosierungen schädlich sein.
Dazu, gibt es viele Möglichkeiten, die sich je nach Labor unterscheiden. Beispielsweise können neben dem Blut auch Speichel und Urin für eine Bestimmung herangezogen werden. Als Normalwerte für den Gesamt-Antioxidantien-Status im Blut gelten Werte zwischen 1,13 und 1,57 Millimol pro Liter.
Antioxidantien: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei einer schweren Verdauungsschwäche durch Zöliakie (Malabsorption) kann in Einzelfällen ein Vitamin-K-Mangel vorliegen. Bei einem Vitamin-K-Mangel droht eine hohe Blutungsgefahr, sodass erst der Vitamin-K-Mangel ausgeglichen werden muss, bevor Vitamin E eingenommen wird. Beim Ausgleich des Mangels an Vitamin E und K sollten die Gerinnungswerte kontrolliert werden.
Vitamin E als isoliertes Alpha-Tocopherol sollte bei Rauchern wegen einer möglichen Gefahr an Hirnblutungen nicht über 50 Milligramm pro Tag dosiert werden. Darüber hinaus wurde ein leicht erhöhtes Lungenkrebsrisiko gefunden – besonders wenn Alpha-Tocopherol mit hoch dosiertem Beta-Carotin (mehr als 10 Milligramm) kombiniert wird. Auch ehemalige Raucher und Menschen mit Asbestbelastung müssen vorsichtig sein.
Carotinoide sollten bei Leberschäden und Nierenerkrankungen nicht eingenommen werden. Auch sollten Patienten mit Nierenerkrankungen Zink nicht über Nahrungsergänzungsmittel einnehmen. Kranke Nieren können überschüssiges Zink nicht gut ausscheiden.
Zink bindet bestimmte Antibiotika (zum Beispiel Ciloxan®, Floxal®, Achromycin® oder Vibramycin®) und Osteoporose-Medikamente (Bisphosphonate, zum Beispiel Fosamax®, Bonefos® oder Bondronat®). Dies kann sie unwirksam machen, weshalb ein Einnahmeabstand von mindestens zwei Stunden zu beachten ist.
Dosierungen auf einen Blick
Empfehlung pro Tag bei Zöliakie | |
|---|---|
Vitamine | |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten (IE) |
Vitamin B6 | 1 bis 3 Milligramm (mg) |
Vitamin B12 | bis zu 500 Mikrogramm (µg) als Methylcobalamin |
Folsäure | 400 bis 800 Mikrogramm als 5-Methyltetrahydrofolat |
Vitamin C | 200 bis 500 Milligramm |
Vitamin E | 20 bis 50 Milligramm |
Mineralstoffe | |
Eisen | 50 bis 200 Milligramm bei starkem Mangel 20 bis 40 Milligramm bei leichtem Mangel |
Calcium | 600 bis 1.200 Milligramm |
Zink | 15 bis 30 Milligramm |
Pflanzenstoffe | |
Carotinoide | 2 bis 5 Milligramm |
Aminosäuren | |
Glutamin | 4.500 bis 9.000 Milligramm |
Sonstige | |
Probiotika (Laktobazillen und Bifidobakterien) | 1 bis 20 Milliarden koloniebildende Einheiten (KBE) |
Präbiotika (zum Beispiel resistente Stärke) | bis zu 25 Gramm (g) |
Omega-3-Fettsäuren (mit hohem EPA-Anteil) | 2.000 Milligramm |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei Zöliakie | |
|---|---|
Normalwerte | |
Ferritin (Eisenstatus) | Frauen: 23 bis 110 Mikrogramm pro Liter (µg/l) Männer: 34 bis 310 Mikrogramm pro Liter |
Transferrin-Sättigung (Eisenstatus) | 35 ± 15 Prozent (%) |
Vitamin D | 40 bis 60 Nanogramm pro Milliliter (ng/ml) |
Homocystein | 5 bis 9 Mikromol pro Liter (µmol/l) |
Omega-3-Index | über 8 Prozent |
Gesamt-Antioxidantien-Status | 1,13 bis 1,57 Millimol pro Liter (mmol/l) |
Zusammenfassung
Bei einer Zöliakie handelt es sich um eine entzündliche und chronische Erkrankung des Dünndarms. Bei Betroffenen richtet sich das eigene Immunsystem gegen das in vielen Getreidesorten enthaltene Eiweiß Gluten (Glutenunverträglichkeit). Die Mikronährstoffmedizin kann helfen, die Darmgesundheit zu fördern, Entzündungen zu dämpfen, das Immunsystem zu unterstützen und fehlende Vitamine und Mineralstoffe zu ergänzen. Bei einer Zöliakie ist durch die Entzündung die Darmschleimhaut geschädigt, was die Aufnahme wichtiger Mikronährstoffe beeinträchtigt.
Häufig haben Patienten deshalb ein Eisenmangel. Die Einnahme von Eisen gleicht den Mangel bei Zöliakie aus und beugt einer Blutarmut vor. Vitamin D und Calcium stärken die Knochen und B-Vitamine befreien den Körper von dem Zellgift Homocystein. Ist Homocystein dauerhaft erhöht, kann es die Blutgefäße schädigen und das Risiko für Herz-Kreislauf-Erkrankungen erhöhen.
Prä- und Probiotika stärken die Darmbarriere und regulieren bei Zöliakie eine möglicherweise gestörte Darmflora. Glutamin benötigt der Körper, um die Zellen des Dünndarms mit Energie zu versorgen. Bei anderen chronischen Darmerkrankungen gibt es zudem Hinweise, dass Glutamin die Dichtigkeit des Darms fördert. Außerdem könnten Omega-3-Fettsäuren und Antioxidantien in der Lage sein, Entzündungen und oxidative Schäden im Rahmen einer Zöliakie einzudämmen.
Verzeichnis der Studien und Quellen
Aleanzi, M. et al. (2001): Celiac disease: antibody recognition against native and selectively deamidated gliadin peptides. Clin Chem 2001;47(11):2023-8. https://www.ncbi.nlm.nih.gov/pubmed/11673371, abgerufen am: 26.02.2019.
Annibale, B. et al. (2001): Efficacy of gluten-free diet alone on recovery from iron deficiency anemia in adult celiac patients. Am J Gastroenterol 2001;96(1):132-7. https://www.ncbi.nlm.nih.gov/pubmed/11197242, abgerufen am: 26.02.2019.
Benjamin, J. et al. (2012): Glutamine and whey protein improve intestinal permeability and morphology in patients with Crohn’s disease: a randomized controlled trial. Dig Dis Sci 2012;57(4):1000-12. https://www.ncbi.nlm.nih.gov/pubmed/22038507, abgerufen am: 25.02.2019.
Bernardo, D. et al. (2012): Ascorbate-dependent decrease of the mucosal immune inflammatory response to gliadin in coeliac disease patients. Allergol Immunopathol (Madr) 2012;40(1):3-8. https://www.ncbi.nlm.nih.gov/pubmed/21420224, abgerufen am: 26.02.2019.
Chander, A.M. et al. (2018): Cross-Talk Between Gluten, Intestinal Microbiota and Intestinal Mucosa in Celiac Disease: Recent Advances and Basis of Autoimmunity. Front Microbiol. 2018; 9: 2597. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6221985/, abgerufen am: 25.03.2019.
Conte, M.P. et al. (2006): Gut-associated bacterial microbiota in paediatric patients with inflammatory bowel disease. Gut 2006;55(12):1760-7. https://www.ncbi.nlm.nih.gov/pubmed/16648155, abgerufen am: 26.02.2019.
Conte, M.P. et al. (2018): Probiotics in celiac disease. Nutrients 2018;10(12):E1824. https://www.ncbi.nlm.nih.gov/pubmed/30477107, abgerufen am: 26.02.2019.
Cristofori, F. et al. (2018): Probiotics in Celiac Disease. Nutrients. 2018 Dec; 10(12): 1824. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6316269/, abgerufen am: 25.03.2019.
Deora, V. et al. (2017): Serum vitamins and minerals at diagnosis and follow-up in children with celiac disease. J Pedatr Gastroenterol Nutr 2017;65(2):185-89. https://www.ncbi.nlm.nih.gov/pubmed/28738401, abgerufen am: 26.02.2019.
De-Souza, D.A. & Greene, L.J. (2005): Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Crit Care Med. 2005 May;33(5):1125-35. https://www.ncbi.nlm.nih.gov/pubmed/15891348, abgerufen am: 25.03.2019.
De Stefano, D. et al. (2007): Lycopene, quercetin and tyrosol prevent macrophage activation induced by gliadin and IFN-gamma. Eur J Pharmacol 2007;566(1):192-9. https://www.ncbi.nlm.nih.gov/pubmed/?term=coeliac+disease+quercetin, abgerufen am: 26.02.2019.
Dias, R. et al. (2018): Molecular insights on the interaction and preventive potential of epigallocatechin-3-gallate in celiac disease. Int J Biol Macromol 2018;112:1029-37. https://www.ncbi.nlm.nih.gov/pubmed/?term=celiac+disease+egcg, abgerufen am: 26.02.2019.
Felber, J. et al. (2014): S2k-Leitlinie Zöliakie. AWMF-Register-Nr. 021/021. https://www.awmf.org/uploads/tx_szleitlinien/021-021l_S2k_Z%C3%B6liakie_05_2014_01.pdf, abgerufen am: 26.02.2019.
Ferretti, G. et al. (2012): Celiac disease, inflammation and oxidative damage: a nutrigenetic approach. Nutrients 2012;4(4):243-57. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3347005/, abgerufen am: 26.02.2019.
Grehn, S. et al. (2001): Dietary habits of Swedish adult coeliac patients treated by a gluten-free diet for 10 years. Scand J Nutr/Näringsforskning 2001;45(1):178-82. https://www.tandfonline.com/doi/pdf/10.3402/fnr.v45i0.1795?needAccess=true, abgerufen am: 26.02.2019.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Hallert, C. et al. (2002): Evidence of poor vitamin status in coeliac patients on a gluten-free diet for 10 years. Aliment Pharmacol Ther. 2002 Jul;16(7):1333-9. https://www.ncbi.nlm.nih.gov/pubmed/12144584?dopt=Abstract, abgerufen am: 25.03.2019.
Hallert, C. et al. (2009): Clinical trial: B-vitamins improve health in patients with coeliac disease living on gluten-free diet. Aliment Pharmacol Ther 2009;29(8):811-6. https://www.ncbi.nlm.nih.gov/pubmed/19154566, abgerufen am: 26.02.2019.
Hond, E.D. et al. (1999): Effect of glutamine on the intestinal permeability changes induced by indomethacin in humans. Aliment Pharmacol Ther 1999;13(5):679-85. https://www.ncbi.nlm.nih.gov/pubmed/10233193, abgerufen am: 26.02.2019.
Hozyasz, K. et al. (2003): Low vitamin E as a possible cause of complications in celiac disease. Indian J Gastroenterol 2003;22(6):237-8. https://www.ncbi.nlm.nih.gov/pubmed/15030047, abgerufen am: 26.02.2019.
Janeczko, C.E. et al. (2009): Supplemental vitamin K improves the stability of anticoagulation in a patient with low tissue stores of vitamin K secondary to coeliac disease. BMJ Case Rep 2009;2009:bcr10.2008.1067. https://www.ncbi.nlm.nih.gov/pubmed/21686472, abgerufen am: 26.02.2019.
Klemenak, M. et al. (2015): Administration of Bifidobacterium breve Decreases the Production of TNF-α in Children with Celiac Disease. Dig Dis Sci. 2015 Nov;60(11):3386-92. https://www.ncbi.nlm.nih.gov/pubmed/26134988, abgerufen am: 25.03.2019.
Li, Y. et al. (2006): Oral glutamine ameliorates chemotherapy-induced changes of intestinal permeability and does not interfere with the antitumor effect of chemotherapy in patients with breast cancer: a prospective randomized trial. Tumori 2006;92(5):396-401. https://www.ncbi.nlm.nih.gov/pubmed/17168431, abgerufen am: 26.02.2019.
Matysiak-Budnik, T. et al. (2008): Secretory IgA mediates retrotranscytosis of intact gliadin peptides via the transferrin receptor in celiac disease. J Exp Med 2008;205(1):143-54. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2234361/, abgerufen am: 26.02.2019.
Miles, E.A. & Calder, P.C. (2012): Influence of marine n-3 polyunsaturated fatty acids on immune function and a systematic review of their effects on clinical outcomes in rheumatoid arthritis. Br J Nutr 2012;107 Suppl 2:S171-84. https://www.ncbi.nlm.nih.gov/pubmed/22591891, abgerufen am: 26.02.2019.
Pizzini, A. et al. (2018): The role of omega-3 fatty acids in the setting of coronary artery disease and COPD: a review. Nutrients 2018;10(12):1864. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6316059/, abgerufen am: 26.02.2019.
Pool-Zobel, B.L. (2007): Gesundheitsfördernde Eigenschaften von Inulin und Oligofruktose, Teil 2. Ernährungs-Umschau 2007;54:70-80. https://www.ernaehrungs-umschau.de/fileadmin/Ernaehrungs-Umschau/pdfs/pdf_2007/02_07/EU02_70_72_77_80.pdf, abgerufen am: 25.02.2019.
Qinghui, M. et al. (2017): Leaky Gut As a Danger Signal for Autoimmune Diseases. Front Immunol. 2017; 8: 598. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5440529/, abgerufen am: 25.03.2019.
Olivares, M. et al. (2014): Double-blind, randomised, placebo-controlled intervention trial to evaluate the effects of Bifidobacterium longum CECT 7347 in children with newly diagnosed coeliac disease. Br J Nutr. 2014 Jul 14;112(1):30-40. https://www.ncbi.nlm.nih.gov/pubmed/24774670, abgerufen am: 25.03.2019.
Rawal, P. et al. (2010): Zinc supplementation to patients with celiac disease – is it required? J Trop Pediatr 2010;56(6):391-7. https://www.ncbi.nlm.nih.gov/pubmed/20176568, abgerufen am: 26.02.2019.
Romanczuk, B. et al. (2016): Analysis of the concentration of vitamin E in erythrocytes of patients with celiac disease. Prz Gastroenterol 2016;11(4):282-285. https://www.ncbi.nlm.nih.gov/pubmed/28053684, abgerufen am: 26.02.2019.
Scaioli, E. et al. (2017): The imbalance between n-6/n-3 polyunsaturated fatty acids and inflammatory bowel disease: a comprehensive review and future therapeutic perspectives. Int J Mol Sci 2017;18(12):E2619. https://www.ncbi.nlm.nih.gov/pubmed/29206211, abgerufen am: 26.02.2019.
Sevinc, E. et al. (2016): Plasma glutamine and cystine are decreased and negatively correlated with endomysial antibody in children with celiac disease. Asia Pac J Clin Nutr 2016;25(3):452-456. http://apjcn.nhri.org.tw/server/APJCN/25/3/452.pdf, abgerufen am: 25.03.2019.
Schuppan, D. et al. (2013): Diagnostik und Therapie der Zöliakie. Dtsch Arztebl Int 2013;110(49):835-46. https://www.aerzteblatt.de/archiv/150736/Diagnostik-und-Therapie-der-Zoeliakie, abgerufen am: 26.02.2019.
Smecuol, E. et al. (2013): Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol 2013;47(2):139-47. https://www.ncbi.nlm.nih.gov/pubmed/23314670, abgerufen am: 26.02.2019.
Thorvardur, R. et al. (2007): Hematologic manifestation of celiac disease. Blood 2007;109:412-21. http://www.bloodjournal.org/content/109/2/412.full?sso-checked=true, abgerufen am: 26.02.2019.
Valdimarsson, T. et al. (1996): Reversal of osteopenia with diet in adult coeliac disease. Gut. 1996 Mar;38(3):322-7. https://www.ncbi.nlm.nih.gov/pubmed/8675082, abgerufen am: 25.03.2019.
Veselinovic, M. et al. (2017): Clinical benefits of n-3 PUFA and ɤ-linolenic acid in patients with rheumatoid arthritis. Nutrients 2017;9(4):E325. https://www.ncbi.nlm.nih.gov/pubmed/28346333, abgerufen am: 26.02.2019.
Visser, J. et al. (2009): Tight junctions, intestinal permeability, and autoimmunity celiac disease and type 1 diabetes paradigms. Ann N Y Acad Sci 2009;1165:195-205. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2886850/, abgerufen am: 26.02.2019.
Welstead, L. (2015): The gluten-free diet in the 3rd millennium: rules, risks and opportunities. Diseases 2015;3(3):136-49. https://www.mdpi.com/2079-9721/3/3/136/htm, abgerufen am: 26.02.2019.
Wenkai, R. et al. (2016): Glutamine-Induced Secretion of Intestinal Secretory Immunoglobulin A: A Mechanistic Perspective. Front Immunol. 2016; 7: 503. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5121228/, abgerufen am: 25.03.2019.
Wierdsma, N.J. et al. (2013): Vitamin and mineral deficiencies are highly prevalent in newly diagnosed celiac disease patients. Nutrients 2013;5(10):3975-92. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3820055/, abgerufen am: 26.02.2019.
Yan Chun, L. et al. (2015): Critical Roles of Intestinal Epithelial Vitamin D Receptor Signaling in Controlling Gut Mucosal Inflammation. J Steroid Biochem Mol Biol. 2015 Apr; 148: 179–183. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4361385/, abgerufen am: 25.03.2019.
Zanchetta, M.B. et al. (2017): Impaired bone microarchitecture improves after one year on gluten-free diet: a prospective longitudinal HRpQCT study in women with celiac disease. J Bone Miner Res 2017;32(1):135-42. https://www.ncbi.nlm.nih.gov/pubmed/27447366, abgerufen am: 26.02.2019.
Zingone, F. & Ciacci, C. (2018): The value and significance of 25(OH) and 1,25(OH) vitamin D serum levels in adult coeliac patients: A review of the literature. Dig Liver Dis. 2018 Aug;50(8):757-760. https://www.ncbi.nlm.nih.gov/pubmed/29773507, abgerufen am: 25.03.2019.