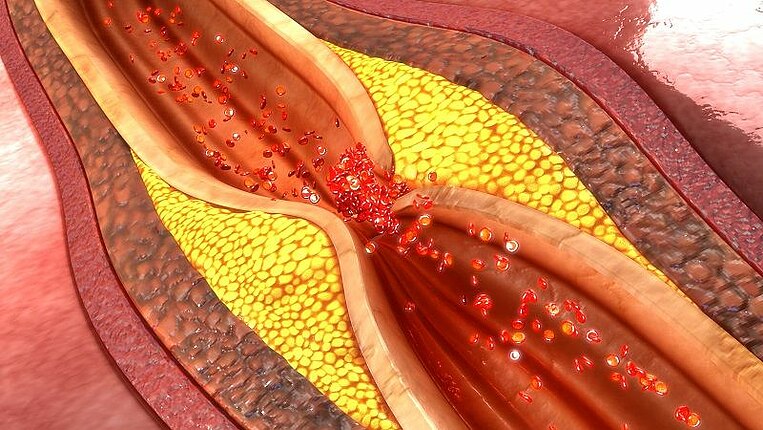
Bei einer Hyperhomocysteinämie ist der Spiegel an Homocystein im Blut erhöht. Homocystein ist ein körpereigener Stoff, der bei Stoffwechselprozessen entsteht. Es gilt als Zellgift. Ein erhöhter Homocysteinwert ist daher ein wichtiger Risikofaktor für Herz-Kreislauf-Erkrankungen wie Thrombosen, Embolien, Arteriosklerose, Herzinfarkt und Schlaganfall. Außerdem vermuten Forscher, dass Homocystein bei der Entstehung von Parkinson und Demenzerkrankungen wie Alzheimer beteiligt ist. Bestimmte Mikronährstoffe sind notwendig, um Homocystein im Körper abzubauen. So können Sie helfen, das Risiko für zahlreiche Folgeerkrankungen zu senken.
Ursachen und Symptome
Was ist Homocystein?
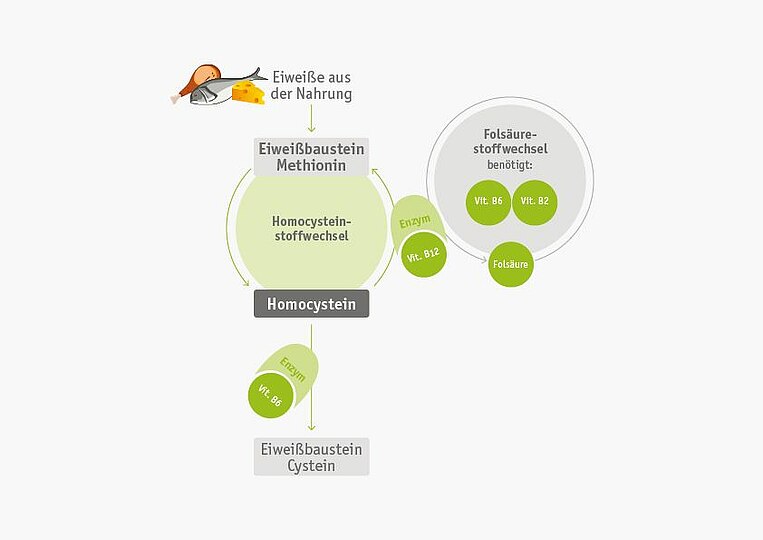
Homocystein ist ein schädliches Zwischenprodukt, das natürlicherweise im Stoffwechsel entsteht und beständig entgiftet werden muss. Damit der Stoff in unschädliche Verbindungen umgewandelt werden kann, sind verschiedene Vitamine notwendig. Dabei werden aus dem Homocystein wieder ungefährliche Stoffe, nämlich die Eiweißbausteine (Aminosäuren) Methionin oder Cystein. Eine Erhöhung der Homocysteinwerte im Blut nennt man in der Medizin Hyperhomocysteinämie oder kurz Homocysteinämie.
Hyperhomocysteinämie − Ursachen
Normalerweise hält der Körper den Homocysteinspiegel im normalen Rahmen, sodass seine schädliche Wirkung auf die Blutgefäße vermieden wird. Verschiedene Faktoren können jedoch dazu führen, dass sich Homocystein im Blut ansammelt:
- Vitaminmangel: Eine Hyperhomocysteinämie ist meist die Folge eines Mangels an den Vitaminen B6, B12 und Folsäure. Die Minderversorgung mit diesen Mikronährstoffen steigt mit fortschreitendem Alter und ungesunder Lebensweise. Ein Mangel an B-Vitaminen tritt häufiger bei Magen-Darm-Erkrankungen auf, etwa bei chronischer Magenschleimhautentzündung (Gastritis), bei chronisch-entzündlichen Darmerkrankungen (CED) oder während einer strengen Diät bei Zöliakie (Gluten-Unverträglichkeit).
- Chronische Nierenschwäche: Ist die Nierenfunktion eingeschränkt, kann Homocystein nicht ausreichend über die Niere ausgeschieden werden.
- Medikamente: Arzneimittel wie Cholesterin- und andere Blutfettsenker (Fibrate) oder Anti-Parkinson-Mittel (L-Dopa) können hohe Homocysteinwerte verursachen. Auch die Langzeiteinnahme von Antiepileptika (Phenytoin, Carbamazepin, Valproinsäure) begünstigt eine Hyperhomocysteinämie; ebenso Medikamente, die die Bildung der Magensäure hemmen (Protonenpumpenhemmer). Magensäurehemmer setzen außerdem die Aufnahme von Vitamin B12 herab, das für den Abbau von Homocystein wichtig ist.
- Alkohol: Durch Alkohol werden Enzyme im Homocysteinstoffwechsel gehemmt. Bereits moderater Alkoholgenuss kann Homocystein in die Höhe treiben.
- Eiweißreiche Ernährung: Eine hohe Zufuhr an tierischen Eiweißen kann die Homocysteinwerte erhöhen, wenn der Stoffwechsel gestört ist.
- Stoffwechselerkrankungen: Erkrankungen wie Schilddrüsenunterfunktion oder eine Zuckerkrankheit (Diabetes) sind mit einer Entgleisung der Homocysteinwerte verbunden.
- Darmflora: Die Mikroorganismen wie Bakterien im Darm (Mikrobiota) könnten Einfluss auf den Homocysteinstoffwechsel haben. Ungünstige Bakterien produzieren weniger B-Vitamine und stellen sogar Homocystein her.
- Schlafstörungen: Atemstörungen im Schlaf (Schlafapnoe) stehen im Verdacht, erhöhte Homocysteinspiegel zu verursachen.
- Sport: Extreme körperliche Anstrengung ist ebenfalls ein möglicher Grund für das Ansteigen der Spiegel.
- Gendefekt: Aufgrund von vererbten Gendefekten kann der Homocysteinspiegel steigen. Dabei funktionieren einige Enzyme gar nicht oder nicht richtig (zum Beispiel bei einem MTHFR- oder Cystathionin-Beta-Synthasemangel).
Info
Der MTHFR-Mangel ist ein sehr häufiger Gendefekt. Dabei arbeitet ein Enzym nicht richtig, welches Folsäure aktiviert. Hat man nur ein defektes Gen (das betrifft 40 Prozent der Menschen), ist die Enzymaktivität um etwa 30 Prozent geringer, was meist keine Folgen hat. Bei zwei defekten Genen ist die Enzymaktivität jedoch um ungefähr 70 Prozent vermindert. An dieser Form leiden rund 16 Prozent der gesamten Bevölkerung. Das heißt, ungefähr eine von sechs Personen ist betroffen.
Daneben gibt es viele andere, seltenere und schwere Formen. Bei einigen steigen die Blutwerte extrem an. Dann wird Homocystein über den Urin ausgeschieden (Homocystinurie). Schätzungen zufolge ist nur eine von 300.000 Personen betroffen.]
Homocysteinämie: Symptome erhöhter Spiegel
Ein erhöhter Homocysteinspiegel zeigt keine Symptome. Meistens wird er erst bemerkt, wenn Folgeerkrankungen auftreten.
Mediziner vermuten, dass erhöhte Homocysteinwerte die Funktion der Gefäßzellen verändern und dabei thrombotische und arteriosklerotische Veränderungen in den Gefäßen begünstigen. Sie nutzen Homocystein daher auch als Marker, um das Risiko für Erkrankungen einzuschätzen, die durch Hyperhomocysteinämie entstehen können. Dazu gehören laut Beobachtungsstudien:
- Arteriosklerose (Gefäßverkalkung)
- Demenz wie eine Alzheimererkrankung
- Parkinson
- Osteoporose (Knochenschwund)
- Herzkreislauf-Komplikationen bei Nierenerkrankungen (Nierenschwäche)
- Komplikationen bei Diabetes (Zuckerkrankheit) wie Nervenschäden
- depressive Verstimmung oder Depression
- Altersabhängige Makuladegeneration (AMD) und grüner Star (Glaukom)
- Schwangerschaftskomplikationen wie Präeklampsie, Fehlgeburten, Wachstumsstörungen sowie Muskel- und Skelettveränderungen, Neuralrohrdefekte
- Atemstörungen im Schlaf (Schlafapnoe)
Im Falle eines schweren Gendefektes (Homocystinurie) können bereits im Kindesalter Symptome wie Kurzsichtigkeit, geistige Behinderung, Wirbelsäulenverkrümmung oder Osteoporose auftreten. Im frühen Erwachsenenalter ist das Risiko für Folgeerkrankungen wie Herzinfarkt, Schlaganfall, Thrombosen und Embolien erhöht.
Ziele der Behandlung
Wie werden erhöhte Homocysteinspiegel klassisch behandelt?
Die erbliche Stoffwechselerkrankung (Homocystinurie) ist als Erkrankung anerkannt. Die erworbene Homocysteinämie gilt noch nicht als Krankheit. Die herkömmliche Behandlung zielt in beiden Fällen darauf ab, die Homocysteinwerte zu senken. Dadurch könnten Folgeerkrankungen vermieden und die Lebenserwartung erhöht werden. Zum Einsatz kommt eine Mikronährstofftherapie in erster Linie mit Folsäure, Vitamin B6 (Pyridoxin), B12 (Cobalamin) und Betain. Außerdem wird eine gesunde Lebensweise mit regelmäßiger Bewegung empfohlen.
Homocystein kann man auch etwas über die Ernährung beeinflussen: Da Homocystein aus der Aminosäure Methionin entsteht, sollte die Zufuhr begrenzt werden. Dies wird nur Patienten mit einer genetisch bedingten Homocystinurie empfohlen. Da alle Eiweißquellen den Baustein Methionin enthalten, muss man mit künstlichen Mischungen arbeiten. Die Aminosäure Methionin sollte darin nicht enthalten sein.
Um das Risiko von Blutgerinnseln (Thromboembolien) vorzubeugen, werden Patienten häufig auch mit gerinnungshemmenden Mitteln wie Acetylsalicylsäure (ASS) behandelt.
Ziele der Mikronährstoffmedizin
Wie in der klassischen Medizin behandelt die Mikronährstoffmedizin hohe Homocysteinwerte mit Vitaminen. Da erhöhte Homocysteinspiegel oft auf einen Vitaminmangel zurückgehen, ist dieses Vorgehen sinnvoll. Bewährt haben sich folgende Stoffe:
- B-Vitamine helfen bei der Entgiftung von Homocystein.
- Cholin und Betain unterstützen die Wirkung der B-Vitamine
- Omega3-Fettsäuren verstärken den Effekt auf die Homocysteinwerte und wirken entzündungshemmend.
- N-Acetylcystein senkt den Homocysteinspiegel und verbessert die Gefäßfunktion.
Behandlung mit Mikronährstoffen
Homocystein senken mit Folsäure, Vitamin B2, B6 und B12
Wirkweise von B-Vitaminen
Für die Entgiftung von Homocystein benötigt der Körper verschiedene B-Vitamine. Liegt ein Mangel vor, entwickelt sich eine Hyperhomocysteinämie. Die Minderversorgung mit B-Vitaminen nimmt vor allem mit fortschreitendem Alter zu.
Expertenwissen
Möglicherweise ist Homocystein nicht die eigentliche Ursache für das erhöhte arteriosklerotische Risiko. Einige Ergebnisse lassen vermuten, dass eine schlechte Versorgung mit Folsäure zu einer eingeschränkten Verfügbarkeit von Stickstoffmonoxid (NO) führt. Dieser Botenstoff ist für die Gefäßerweiterung verantwortlich. Stattdessen entsteht dann oxidativer Stress, welcher die Gefäßerkrankung noch weiter vorantreibt. Erste Studien lassen vermuten, dass Folsäure über eine bessere NO-Versorgung wirkt. Auch Pflanzenstoffe wie Resveratrol greifen hier positiv ein.
Vitamin B12: Vitamin B12 sorgt dafür, dass Homocystein in den Eiweißbaustein Methionin zurückverwandelt wird.
Vitamin B6: Mithilfe von Vitamin B6 setzt der Körper Homocystein zum Eiweißbaustein Cystein um.
Folsäure: Folsäure wird dafür gebraucht, dass das Enzym zum Homocysteinabbau immer wieder von Neuem zur Verfügung steht. Außerdem sind für diese Regeneration Vitamin B6 und Vitamin B2 unentbehrlich.
Vitamin B2: Folsäure muss erst aktiviert werden, um zu wirken. Der Körper benötigt dabei auch Vitamin B2. Ein Teil der Menschen hat genetisch bedingt eine Aktivierungsschwäche. Dann ist Vitamin B2 besonders wichtig.
Die Wirkung von B-Vitaminen auf den Homocysteinspiegel ist gut untersucht. Zahlreiche Studien belegen eine Senkung. Ob das jedoch einen gesundheitlichen Nutzen hat, ist dagegen umstritten: Man kann nicht immer genau beziffern, ob und wie gut Herzinfarkte, Schlaganfälle, Thrombosen oder Osteoporose durch B-Vitamine vermieden werden. Einige Hinweise gibt es allerdings:
- Die Einnahme von Folsäure für 36 Monate reduzierte in ersten Studien das Schlaganfallrisiko um 18 Prozent. Auch eine Übersichtsarbeit bestätigte anhand von Beobachtungsstudien ein leicht geringeres Schlaganfallrisiko bei einer hohen Aufnahme von Folsäure und Vitamin B6 über die Nahrung.
- B-Vitamine senkten in hochwertigen Studien bei hohen Homocysteinwerten das Risiko für Knochenbrüche bei Älteren sowie Nervenschäden bei Diabetes.
- Folsäure könnte vor allem bei einer schlechten Versorgung mit Omega-3-Fettsäuren und erhöhten Homocysteinwerten eine Verbesserung der geistigen Fähigkeiten erzielen.
Fazit: B-Vitamine sind eine vergleichsweise kostengünstige Homocystein-Therapie, die wahrscheinlich das Risiko von Alterserkrankungen des Herz-Kreislauf-Systems oder Demenz senkt. Die Kombination mit anderen Stoffen wie Arginin oder Resveratrol scheint für die Versorgung mit dem Botenstoff NO sinnvoll zu sein.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Um die Homocysteinwerte zu senken, empfehlen Mikronährstoff-Experten anfänglich höher dosierte B-Vitamine:
- Vitamin B2: 1 bis 5 Milligramm pro Tag
- Vitamin B6: 5 bis 15 Milligramm pro Tag
- Vitamin B12: 10 bis 500 Mikrogramm pro Tag (als Methylcobalamin)
- Folsäure: 200 bis 600 Mikrogramm pro Tag (als direkt verwertbares 5-Methyltetrahydrofolat)
Wenn die Homocysteinwerte gesunken sind, sollte die Dosierung der B-Vitamine langfristig reduziert werden: zum Beispiel bis 4 Milligramm Vitamin B2, bis 5 Milligramm Vitamin B6, bis 50 Mikrogramm Vitamin B12 und bis 400 Mikrogramm Folsäure. Ganz absetzen sollte man die B-Vitamine nicht, da ohne den Ausgleich der Ursache die Homocysteinwerte sonst wieder ansteigen.
Tipp
Folsäure (oder Folat) muss im Körper erst aktiviert werden, um wirken zu können. Diese bioaktive Form nennt man auch 5-Methyltetrahydrofolat (5-MTHF). Bei etwa der Hälfte aller Menschen läuft aber die Aktivierung aufgrund einer genetischen Veranlagung verlangsamt ab. Bei 5 bis 15 Prozent der Bevölkerung ist der Prozess sogar um etwa 70 Prozent schlechter. Darum ist es besser, keine Folsäure (oder Folat), sondern direkt 5-Methyltetrahydrofolat zuzuführen. Darüber hinaus hilft Vitamin B2, dass Folsäure besser aktiviert werden kann.
Die Versorgung mit B-Vitaminen bestimmen lassen
Der Homocysteinwert selbst gilt als indirektes Maß für die Versorgung mit B-Vitaminen: Fehlen sie, ist der Wert erhöht. Zudem sollte der Wert regelmäßig begleitend zur Therapie überprüft werden. Homocystein wird im Blutplasma bestimmt. Das ist der flüssige Teil des Blutes ohne Blutzellen. Als Normwert gelten 5 bis 9 Mikromol pro Liter.
Info
Bei einem Wert von 10 bis 25 Mikromol pro Liter spricht man von einer milden Form von Hyperhomocysteinämie. Werte zwischen 25 bis 50 Mikromol pro Liter kennzeichnen eine moderate und Konzentrationen von 50 bis 500 Mikromol pro Liter eine schwere Form. Ab 100 Mikromol pro Liter liegt in der Regel auch eine Homocystinurie vor. Dann erreicht vermehrt Homocystein den Urin.
Außerdem sollten die Vitamin-B12-Werte bestimmt werden. Einerseits kann man so gezielter eingreifen. Andererseits lässt sich dadurch eine Überversorgung verhindern – vor allem, wenn Vitamin B12 für längere Zeit in hohen Dosierungen eingenommen wird (über 55 Mikrogramm). Am besten ist die Messung von Holotranscobalamin (HoloTC) als aktive Form von Vitamin B12 im Blutserum. Das Serum ist der flüssige Teil des Blutes ohne Blutzellen und ohne Gerinnungsfaktoren. Normalwerte liegen bei über 54 Pikomol Holotranscobalamin pro Liter.
Wie man Folsäure bestimmt, erfahren Sie hier.
B-Vitamine: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
B-Vitamine sollten in hoher Dosierung während der Schwangerschaft und Stillzeit nur bei einem nachgewiesenen Mangel und nach Absprache mit dem Frauenarzt eingenommen werden.
Nierenpatienten müssen besonders umsichtig sein: Sie sollten Vitamin B12 nicht in Form von Cyanocobalamin, sondern als Methylcobalamin ergänzen. Cyanocobalamin ist für Nierenpatienten vermutlich hoch dosiert schädlich.
Nach dem Setzen von Gefäßstützen (Stents) und nach einem Herzinfarkt sind kombinierte B-Vitamine vermutlich positiv. Allerdings sollten hohe Dosen vermieden werden: Vitamin B6 (ab 40 Milligramm pro Tag), Vitamin B12 (ab 60 Mikrogramm pro Tag) und Folsäure (ab 800 Mikrogramm pro Tag).
Bei Krebs und hohem Krebsrisiko (Raucher) könnte dauerhaft hoch dosiertes Vitamin B12 und Folsäure das Fortschreiten oder die Entwicklung fördern. Dann sollte die Ergänzung von Vitamin B12 über 55 Mikrogramm und Folsäure über 500 Mikrogramm mit dem Arzt abgesprochen sein.
Vitamin B6 kann in hoher Dosierung (über 5 Milligramm pro Tag) die Wirkung von Antiepileptika wie Phenobarbital (Luminal®) und Phenytoin (Phenhydan®, Zentropil®) sowie Parkinsonmittel wie Levodopa (L-Dopa) (Levopar®, Madopar®) abschwächen. Daher sollten diese Wirkstoffe nicht zusammen mit Vitamin B6 eingenommen werden.
Gegen Infektionskrankheiten werden Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®) eingesetzt. Folsäure vermindert die Wirkung dieser Medikamente.
Cholin und Betain unterstützen die Wirkung der B-Vitamine
Wirkweise von Betain
Betain zählt im weitesten Sinne zu den Aminosäuren. Es wurde zuerst in Roter Bete entdeckt, woher auch der Name stammt. Der Körper kann Betain auch aus dem Stoff Cholin in der Leber selbst herstellen. Cholin kommt zum Beispiel in Fleisch und Eiern vor.
Cholin und Betain liefern Bausteine (Methylgruppen), die der Körper benötigt, um Homocystein unschädlich zu machen und in Methionin umzuwandeln. Das ist besonders wichtig für die optimale Entwicklung des Nervensystems und für die geistigen Fähigkeiten. Beobachtende Studien zeigen, dass eine höhere Zufuhr an Cholin und Betain über die Ernährung mit geringeren Homocysteinwerten in Verbindung steht – vor allem, wenn die Teilnehmer gleichzeitig niedrige Folsäure- und Vitamin-B12-Werte haben.
Auch für die Einnahme der Stoffe liegen Daten vor:
- Cholin: In einer ersten Studie senkten täglich 2.600 Milligramm Phosphatidylcholin (spezielle Cholinverbindung) leicht erhöhtes Homocystein. Zudem verbesserte ein Kombinationspräparat mit Cholin und B-Vitaminen in einer Vorstudie zusammen mit Sport den Homocystein-Stoffwechsel.
- Betain: Eine Übersichtsarbeit zeigt, dass die Homocysteinwerte durchschnittlich um 1,3 Mikromol pro Liter sinken, wenn täglich bis zu 4.000 Milligramm Betain eingenommen werden. Das geschah meistens für mindestens sechs Wochen.
Besonders, wenn die Homocysteinwerte nicht auf B-Vitamine ansprechen, kann Betain sinnvoll sein: Eine Studie zeigt, dass die Kombination aus Folsäure und Betain die Werte nach vier Wochen senkte, während für Vitamin B6 und B12 kein Effekt beobachtet wurde.
Dosierung und Einnahmeempfehlung von Cholin und Betain
Zur Senkung erhöhter Homocysteinwerte wurden in Studien bis zu 2.600 Milligramm Phosphatidylcholin eingesetzt. Im Schnitt liefern 100 Milligramm Phosphatidylcholin 13 Milligramm Cholin. Umgerechnet liegt die in der Mikronährstoffmedizin empfohlene Dosierung deshalb bei 200 bis 300 Milligramm Cholin pro Tag.
Betain empfehlen Mikronährstoff-Experten vor allem dann, wenn sich durch B-Vitamine keine Besserung erreichen lässt. Laut Studien sind pro Tag zwischen 500 und 4.000 Milligramm nötig. Eine Homocysteinabnahme erfolgt in Abhängigkeit von der Dosierung: je höher die Dosis, desto stärker die Senkung. Bei Dosierungen über 400 Milligramm Betain sollte mit dem Mikronährstoff-Experten gesprochen werden. Ab 3.000 Milligramm pro Tag könnte Betain bei Risikopatienten die Cholesterin- oder Triglyceridwerte erhöhen. Daher sollte die Betain-Therapie begleitet werden, vor allem in den ersten sechs Monaten.
Cholin und Betain werden am besten verteilt über den Tag zu den Mahlzeiten eingenommen. Selten wird Betain nicht vertragen. Sollten Sehstörungen, morgendliche Kopfschmerzen und Erbrechen auftreten, muss die Therapie abgebrochen und ein Arzt aufgesucht werden.
Cholin und Betain: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sind Cholin und Betain grundsätzlich wichtig. Allerdings sollten sie nicht ohne Rücksprache mit dem Frauenarzt eingenommen werden. Es liegen keine Untersuchungen zur Sicherheit in der empfohlenen Dosierung vor.
Die Einnahme von hoch dosiertem Cholin sollte bei bereits bestehenden Herz-Kreislauf-Erkrankungen nur in Rücksprache mit dem Mikronährstoff-Experten oder Arzt erfolgen. Bestimmte Abbauprodukte von Cholin (Trimethylamin-N-oxid) könnten die Erkrankung verschlimmern – vor allem, wenn die Darmflora gestört ist. Denn dann kommt es vermehrt zur Entstehung dieser Abbauprodukte. Darüber hinaus könnten die Abbauprodukte von Cholin einen bestehenden Diabetes verschlimmern. Diabetiker sollten die Einnahme daher mit dem Arzt besprechen.
Bei Patienten mit geschädigten Nieren reicht die Nierenfunktion möglicherweise nicht mehr aus, um Abbauprodukte von Phosphatidylcholin auszuscheiden. Daher sollten Personen mit Nierenerkrankungen zur Sicherheit auf Präparate mit Phosphatidylcholin oder Cholin verzichten.
Bei einigen Krebszellen ist der Cholinstoffwechsel verändert. Krebspatienten sollten zur Sicherheit kein hoch dosiertes Cholin einnehmen.
Wird Cholin als Phosphatidylcholin eingenommen, sind Wechselwirkungen mit blutgerinnungshemmenden Medikamenten möglich, wie Phenprocoumon (Falithrom®, Marcumar®) oder Warfarin (wie Coumadin®). Die Einnahme sollte dann mit dem Arzt besprochen werden. Eventuell sind Kontrollen der Blutgerinnungswerte nötig.
Omega-3-Fettsäuren wirken entzündungshemmend
Wirkweise von Omega-3-Fettsäuren

Omega-3-Fettsäuren wie EPA (Eicosapentaensäure) und DHA (Docosahexaensäure) wirken entzündungshemmend und schützen die Blutgefäße, senken erhöhte Blutfette und lindern über die blutgefäßerweiternde Wirkung den Bluthochdruck. Darüber hinaus sind sie in der Lage, erhöhte Homocysteinwerte zu senken. Das zeigen nicht nur Untersuchungen an Tieren und Beobachtungen an Menschen. In ersten kleineren Studien am Menschen gab es ebenfalls positive Wirkungen auf die Homocysteinwerte bei:
- Diabetikern mit Fettstoffwechselstörung (Dyslipidämie),
- leichten geistigen Problemen (kognitiven Störungen),
- Patienten mit einem akuten Herzinfarkt und bei
- Männern mit erhöhten Blutfettwerten (Cholesterin und Triglyceriden).
Die Forscher vermuten, dass Omega-3-Fettsäuren vor allem einen Einfluss auf den Stoffwechsel der Aminosäure Methionin als Vorläufer von Homocystein haben. Vermutlich senken Omega-3-Fettsäuren in Kombination mit B-Vitaminen die Homocysteinspiegel am besten. Darauf deutet eine Übersichtsarbeit hin.
Info
Homocystein steht vermutlich mit Depressionen in Zusammenhang. Für Omega-3-Fettsäuren wurde auch eine antidepressive Wirkung gezeigt. Es gibt also mehrere Gründe, bei hohen Homocysteinwerten Omega-3-Fettsäuren einzunehmen.
Dosierung und Einnahmeempfehlung von Omega-3-Fettsäuren
Erfolgreich getestet wurden 1.500 bis 2.000 Milligramm Omega-3-Fettsäuren (EPA und DHA) pro Tag. Omega-3-Fettsäuren sollten zu den Mahlzeiten eingenommen werden. Zusammen mit den Fetten aus der Nahrung gelangen sie besser vom Darm ins Blut.
Achten Sie bei der Auswahl des Präparats auf eine hohe Qualität. EPA und DHA sind in Fischöl enthalten. Dieses kann jedoch mit Schadstoffen belastet sein. Durch eine spezielle Reinigung ist sichergestellt, dass die Eigenschaften der wertvollen Fettsäuren voll zur Geltung kommen. Alternativ liefern auch Algen- und Krillöl diese Omega-3-Fettsäuren. Die Öle sind von Natur aus selten mit Schadstoffen belastet. Algenöl eignet sich außerdem für Vegetarier und Veganer.
Omega-3-Index im Labor bestimmen lassen
Die Omega-3-Fettsäuren EPA und DHA lagern sich in den roten Blutkörperchen (Erythrozyten) ein und lassen sich so im Rahmen einer Blutuntersuchung bestimmt. Der prozentuale Anteil der beiden Omega-3-Fettsäuren im Blut wird als Omega-3-Index bezeichnet.
Eine Untersuchung ist insbesondere bei Arteriosklerose und Herzkreislauf-Erkrankungen wichtig. Der Omega-3-Index sollte im optimalen Fall bei acht bis elf Prozent liegen.
Omega-3-Fettsäuren: zu beachten bei Erkrankungen und Medikamenteneinnahme
Menschen mit einer akuten Lebererkrankung oder einer akuten Gallen- oder Bauchspeicheldrüsenentzündung sollten keine Omega-3-Fettsäuren einnehmen.
Möglicherweise beeinflussen Omega-3-Fettsäuren den Blutzucker. Diabetiker, die Medikamente einnehmen, sollten ihre Blutzuckerwerte zu Beginn der Einnahme häufiger kontrollieren, um eine Unterzuckerung zu vermeiden. Eventuell ist eine Anpassung der Medikamente nötig.
Bestimmte Herzrhythmusstörungen (Vorhofflimmern) könnten bei Vorerkrankungen häufiger auftreten, wenn mehr als 1.000 Milligramm Omega-3-Fettsäuren pro Tag eingesetzt werden. Dann sollte die Einnahme mit dem Arzt oder Mikronährstoff-Experten besprochen werden. Er kann das Risiko abwägen und begleitend die Versorgung (Omega-3-Index) kontrollieren.
Hoch dosierte Omega-3-Fettsäuren (über 1.000 Milligramm pro Tag) wirken vermutlich blutverdünnend. Daher sollten Personen mit Blutgerinnungsstörungen die Einnahme zuvor mit dem Arzt abklären. Gleiches gilt vor einer geplanten Operation. In einer Vorstudie stieg das Blutungsrisiko nicht (2.000 Milligramm). Bisher gibt es jedoch wenig Daten.
Die Einnahme von Blutverdünnern wie Warfarin (Coumadin®) oder Phenprocoumon (Marcumar®) zusammen mit mehr als 1.000 Milligramm Omega-3-Fettsäuren sollte ebenfalls mit einem Arzt besprochen werden. Er kann die Gerinnungswerte regelmäßig kontrollieren und bei Bedarf die Dosis anpassen.
N-Acetylcystein verbessert die Gefäßfunktion
Wirkweise von N-Acetylcystein
N-Acetylcystein (NAC) kann hohe Werte an Homocystein im Blut senken. Forscher gehen davon aus, dass Homocystein sich mit Molekülen verbindet. Dadurch kann es nicht ausgeschieden werden. Acetylcystein dürfte Homocystein aus diesen Bindungen befreien, sodass es verarbeitet oder ausgeschieden werden kann.
In Studien hatte NAC generell eine dosisabhängige Wirkung auf den Homocysteinspiegel. Das heißt: Je höher die Dosierung, desto stärker sank der Homocysteinspiegel im Blut. Eine hochwertige Studie zeigt zudem, dass NAC eine ebenso gute Wirkung wie Folsäure haben kann: Die achtwöchige Einnahme von 600 Milligramm war dabei wirksam. Auch verbesserte sich die Funktion der Blutgefäße.
NAC hat noch weitere günstige Effekte auf die Gefäße: Es wirkt antioxidativ. Oxidative Vorgänge tragen zu Arteriosklerose bei. Daneben liefert NAC Bausteine für die Bildung von Glutathion, das von den antioxidativen Schutzsystemen des Körpers gebraucht wird. Eine Übersichtsarbeit bestätigt, dass NAC die Marker für oxidativen Stress und Entzündungen senkt.
Durch diese Wirkungen kann NAC auch auf die Folgeerkrankungen erhöhter Homocysteinwerte einen positiven Effekt haben: Laut einer Übersichtsarbeit verringerte es Herz-Kreislauf-Erkrankungen bei Nierenpatienten.
Dosierung und Einnahmeempfehlung von N-Acetylcystein
Bei erhöhten Homocysteinwerten empfehlen Mikronährstoff-Experten meist eine Dosierung von 500 bis 1.500 Milligramm pro Tag. Sinnvoll ist eine Einnahme über den Tag verteilt, zum Beispiel dreimal 500 bis 600 Milligramm. Dadurch verbessert sich die Verträglichkeit.
NAC sollte nach dem Essen eingenommen werden.
N-Acetylcystein: zu beachten in der Schwangerschaft, Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Da keine ausreichenden Erfahrungen zu NAC bei Schwangeren und Stillenden vorliegen, sollte die Einnahme kritisch vom Frauenarzt abgewogen werden.
Sprechen Sie auch in den folgenden Fällen die Einnahme mit dem Arzt ab:
- Asthma: Es kann zu allergischen Reaktionen mit einer Verengung der Atemwege kommen.
- Histaminintoleranz: NAC könnte die Intoleranz verschlimmern.
- Magen-Darm-Geschwür: Es gibt Bedenken, dass NAC Blutungen auslösen könnte.
- Leberschwäche: Bei schwacher Leberfunktion wird NAC langsamer abgebaut, daher sollte die Dosis gesenkt werden.
NAC kann die Wirkung mancher Antibiotika wie Tetracycline (Tetracyclin Wolff®), Streptomycin (Strepto-Fatol®) oder Penicilline (Penicillin Sandoz®) abschwächen. Daher sollten Patienten, die diese Antibiotika und NAC einnehmen, einen zeitlichen Abstand von mindestens zwei Stunden einhalten.
NAC wirkt schleimlösend. Daher sollte auf die gleichzeitige Einnahme von Hustenblockern (Antitussiva wie Monapax®, Codyl®) verzichtet werden. Ansonsten kann der Hustenreflex eingeschränkt werden. Die Folge wäre ein Sekretstau.
Möglicherweise verstärkt NAC die Wirkung von gefäßerweiternden Medikamenten mit dem Wirkstoff Nitroglycerin (Corangin®, Nitrangin®). Der Blutdruck könnte stark sinken. Kombinieren Sie die Präparate daher nur nach Rücksprache mit Ihrem Arzt.
Dosierungen auf einen Blick
Mikronährstoff-Empfehlung bei erhöhten Homocysteinwerten pro Tag | |
|---|---|
| Vitamine |
Vitamin B2 | akut: 1 bis 5 Milligramm (mg) langfristig: bis 4 Milligramm |
Vitamin B6 | akut: 5 bis 15 Milligramm (Homocystinurie: 200 bis 1.200 Milligramm) langfristig: bis 5 Milligramm |
Folsäure als 5-Methyltetrahydrofolat | akut: 200 bis 600 Mikrogramm (µg) langfristig: bis 400 Mikrogramm |
Vitamin B12 als Methylcobalamin | akut: 10 bis 500 Mikrogramm langfristig: bis 50 Mikrogramm |
Sonstige | |
Betain | 500 bis 4.000 Milligramm |
Cholin | 200 bis 300 Milligramm |
Omega-3-Fettsäuren | 1.500 bis 2.000 Milligramm mit einem möglichst hohen Anteil an EPA |
N-Acetylcystein | 500 bis 1.500 Milligramm |
Sinnvolle Blutuntersuchungen bei erhöhten Homocystein-Spiegeln
Optimalwerte | |
|---|---|
Omega-3-Index (Erythrozyten) | 8 bis 11 Prozent (%) |
Homocystein (Plasma) | < 10 Mikromol pro Liter (µmol/l) |
Vitamin B12 als Holotranscobalamin (Serum) | über 54 Pikomol pro Liter (pmol/l) |
Zusammenfassung
Bei einer Hyperhomocysteinämie ist der Homocysteinspiegel im Blut erhöht. Dies schädigt die Gefäßwände. Homocystein ist ein Risikomarker für Thrombosen, Embolien, Arteriosklerose, Herzinfarkt, Schlaganfall und für weitere Erkrankungen wie Alzheimer und Parkinson. Bestimmte Mikronährstoffe helfen dabei, Homocystein im Körper abzubauen, und könnten so das Risiko für zahlreiche Erkrankungen senken.
Insbesondere B-Vitamine wie Vitamin B2, B6, B12 und Folsäure wirken erhöhten Homocysteinwerten entgegen. Sie werden bei einer Hyperhomocysteinämie als Behandlung empfohlen. Zusätzlich sind Cholin und Betain sinnvoll: Sie unterstützen den Körper beim Abbau von Homocystein.
Omega-3-Fettsäuren wie EPA und DHA könnten ebenfalls den Spiegel des Homocysteins leicht senken. Dabei verstärken sie die Wirkung der B-Vitamine deutlich. Zusätzlich wirken sie entzündungshemmend, schützen die Blutgefäße und senken erhöhte Blutfette sowie den Bluthochdruck.
N-Acetylcystein verringert den Homocysteinspiegel ebenfalls und verbessert darüber hinaus die Gefäßfunktion. Nicht zuletzt wirkt es antioxidativ und schützt die Blutgefäße vor Schäden.
Verzeichnis der Studien und Quellen
Alternative Medicine Review (2003): Betaine. Thorne Research, Inc. All Rights Reserved. http://archive.foundationalmedicinereview.com/publications/8/2/193.pdf, abgerufen am 15.11.2019.
Anamnart, C. & Kitjarak, R. (2021): Effects of vitamin B12, folate, and entacapone on homocysteine levels in levodopa-treated Parkinson's disease patients: A randomized controlled study. J Clin Neurosci. 2021 Jun;88:226-31. https://pubmed.ncbi.nlm.nih.gov/33992189/, abgerufen am 27.04.2022.
Ao, M. et al. (2017): High prevalence of vitamin B-12 insufficiency in patients with Crohn's disease. Asia Pac J Clin Nutr. 2017;26(6):1076-1081. https://www.ncbi.nlm.nih.gov/pubmed/28917233, abgerufen am 10.04.2018.
Araghi, S.O. (2021): Long-term effects of folic acid and vitamin-B12 supplementation on fracture risk and cardiovascular disease: Extended follow-up of the B-PROOF trial. Clin Nutr. 2021 Mar;40(3):1199-206. https://pubmed.ncbi.nlm.nih.gov/32800386/, abgerufen am 27.04.2022.
Ashtary-Larky, D. et al. (2021): Effects of betaine supplementation on cardiovascular markers: A systematic review and Meta-analysis. Crit Rev Food Sci Nutr. 2021 Mar 25;1-18. https://pubmed.ncbi.nlm.nih.gov/33764214/, abgerufen am 27.04.2022.
Bai, D. et al. (2021): Effects of Folic Acid Combined with DHA Supplementation on Cognitive Function and Amyloid-β-Related Biomarkers in Older Adults with Mild Cognitive Impairment by a Randomized, Double Blind, Placebo-Controlled Trial. J Alzheimers Dis. 2021;81(1):155-67. https://pubmed.ncbi.nlm.nih.gov/33749643/, abgerufen am 27.04.2022.
Bala, R. et al. (2021): Hyperhomocysteinemia and low vitamin B12 are associated with the risk of early pregnancy loss: A clinical study and meta-analyses. Nutr Res. 2021 Jul;91:57-66. https://pubmed.ncbi.nlm.nih.gov/34134041/, abgerufen am 27.04.2022.
Biesalski, H.K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H.K. (2019): 6 Mikrobiota und Mikronährstoffe. https://www.thieme-connect.de/products/ebooks/lookinside/10.1055/b-0039-168620, abgerufen am 27.04.2022.
Biesalski, H.K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Borchard-Tuch, C. (2007): Homocystein. Vitamin-B-Prophylaxe in der Diskussion, in: Pharmazeutische Zeitung. Ausgabe 35/2007. https://www.pharmazeutische-zeitung.de/index.php?id=3591, abgerufen am 13.02.2018.
Borrione, P. et al. (2007): Hyperhomocysteinemia in winter elite athletes: a longitudinal study. J Endocrinol Invest 2007;30(5):367-75. https://pubmed.ncbi.nlm.nih.gov/17598967/, abgerufen am 08.02.2023.
Budoff, M.J. et al. (2009): Aged garlic extract supplemented with B vitamins, folic acid and L-arginine retards the progression of subclinical atherosclerosis: a randomized clinical trial. Prev Med 2009;49(2-3):101-7. https://pubmed.ncbi.nlm.nih.gov/19573556/, abgerufen am 08.02.2023.
Carrizzo, A. et al. (2022): SIRT1 pharmacological activation rescues vascular dysfunction and prevents thrombosis in MTHFR deficiency. Cell Mol Life Sci 2022 Jul 11;79(8):410. https://pubmed.ncbi.nlm.nih.gov/35821533/, abgerufen am 08.02.2023.
Chen, L. et al. (2020): Dietary Intake of Homocysteine Metabolism-Related B-Vitamins and the Risk of Stroke: A Dose-Response Meta-Analysis of Prospective Studies. Adv Nutr. 2020 Nov 16;11(6):1510-28. https://pubmed.ncbi.nlm.nih.gov/32503038/, abgerufen am 27.04.2022.
Chen, S. et al. (2020): Serum homocysteine and risk of dementia in Japan. J Neurol Neurosurg Psychiatry. 2020 May;91(5):540-546. https://pubmed.ncbi.nlm.nih.gov/32234968/, abgerufen am 17.02.2021.
Cianciolo, G. et al. (2017): Folic Acid and Homocysteine in Chronic Kidney Disease and Cardiovascular Disease Progression: Which Comes First? Cardiorenal Med. 2017 Oct;7(4):255-266. https://www.ncbi.nlm.nih.gov/pubmed/29118764, abgerufen am 13.03.2018.
Clarke, R. et al. (2010): Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals. Arch Intern Med. 2010 Oct 11;170(18):1622-31. https://www.ncbi.nlm.nih.gov/pubmed/20937919, abgerufen am 12.02.2018.
Cortese, C. & Motti, C. (2001): MTHFR gene polymorphism, homocysteine and cardiovascular disease. Public Health Nutr 2001;4(2B):493-7. https://pubmed.ncbi.nlm.nih.gov/11683544/, abgerufen am 08.02.2023.
Dawson, S.L. et al. (2016): A combination of omega-3 fatty acids, folic acid and B-group vitamins is superior at lowering homocysteine than omega-3 alone: A meta-analysis. Nutr Res. 2016 Jun;36(6):499-508. https://www.ncbi.nlm.nih.gov/pubmed/27188895, abgerufen am 14.02.2018.
de Mello Gomide Loures, C. et al. (2019): Hemostatic Abnormalities in Dementia: A Systematic Review and Meta-Analysis. Semin Thromb Hemost. 2019 Jul;45(5):514-522. https://pubmed.ncbi.nlm.nih.gov/31096308/, abgerufen am 17.02.2021.
Dean, L. et al. (2016): Medical Genetics Summaries [Internet]. Bethesda (MD): National Center for Biotechnology Information (US); 2012-2012 Mar 8 [updated 2016 Oct 27]. https://www.ncbi.nlm.nih.gov/pubmed/28520345, abgerufen am 07.02.2018.
Deris, I. (2001): Hyperhomocysteinämie: Vitaminsubstitution wird empfohlen. Dtsch Arztebl 2001; 98(45): A-2981. https://www.aerzteblatt.de/archiv/29412/Hyperhomocysteinaemie-Vitaminsubstitution-wird-empfohlen, abgerufen am 14.02.2018.
DiNatale, J.C. & Crowe-White, K.M. (2022): Effects of resveratrol supplementation on nitric oxide-mediated vascular outcomes in hypertension: A systematic review. Nitric Oxide 2022;129:74-81. https://pubmed.ncbi.nlm.nih.gov/36341766/, abgerufen am 08.02.2023.
Dinckal, M.H. et al. (2003): Effect of homocysteine-lowering therapy on vascular endothelial function and exercise performance in coronary patients with hyperhomocysteinaemia. Acta Cardiol. 2003;58:389–396. https://www.ncbi.nlm.nih.gov/pubmed/14609303, abgerufen am 13.02.2018.
Earnest, C.P. (2012): Complementary effects of multivitamin and omega-3 fatty acid supplementation on indices of cardiovascular health in individuals with elevated homocysteine. Int J Vitam Nutr Res. 2012 Feb;82(1):41-52. https://www.ncbi.nlm.nih.gov/pubmed/22811376, abgerufen am 14.02.2018.
European Food Safety Authority (2017): Safety of betaine as a novel food pursuant to Regulation(EC) No 258/97. EFSA Journal 2017;15(11):5057. https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2017.5057, abgerufen am 13.08.2018.
European Medicines Agency (2016): Cystadane, INN-betaine anhydrous. https://www.ema.europa.eu/en/documents/product-information/cystadane-epar-product-information_de.pdf, abgerufen am 15.11.2019.
Faghfouri, A.H. et al. (2020): The effects of N-acetylcysteine on inflammatory and oxidative stress biomarkers: A systematic review and meta-analysis of controlled clinical trials. Eur J Pharmacol. 2020 Oct 5;884:173368. https://pubmed.ncbi.nlm.nih.gov/32726657/, abgerufen am 27.04.2022.
Finkelstein, J.D. (2000): Pathways and regulation of homocysteine metabolism in mammals. Semin Thromb Hemost. 2000;26(3):219-25. https://pubmed.ncbi.nlm.nih.gov/11011839/, abgerufen am 9.10.2023.
Frosst, P. et al. (1995): A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nature genetics, 10(1), 111–113. https://pubmed.ncbi.nlm.nih.gov/7647779/, abgerufen am 9.10.2023.
Gariballa, S. (2011): Testing homocysteine-induced neurotransmitter deficiency, and depression of mood hypothesis in clinical practice. Age Ageing. 2011 Nov;40(6):702-5. https://www.ncbi.nlm.nih.gov/pubmed/21771745, abgerufen am 13.02.2018.
Gariballa, S. (2012): Effects of mixed dietary supplements on total plasma homocysteine concentrations (tHcy): a randomized, double-blind, placebo-controlled trial. Int J Vitam Nutr Res. 2012 Aug;82(4):260-6. https://www.ncbi.nlm.nih.gov/pubmed/23591663, abgerufen am 13.02.2018.
Gillies, N.A. et al. (2022): Nutritional supplementation alters associations between one-carbon metabolites and cardiometabolic risk profiles in older adults: a secondary analysis of the Vienna Active Ageing Study. Eur J Nutr. 2022 Feb;61(1):169-82. https://pubmed.ncbi.nlm.nih.gov/34240265/, abgerufen am 27.04.2022.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2018): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 4. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Guieu, R. et al. (2022): Hyperhomocysteinemia and cardiovascular diseases. Ann Biol Clin (Paris) 2022;80(1):7-14. https://pubmed.ncbi.nlm.nih.gov/35129442/, abgerufen am 08.02.2023.
Hildebrandt, W. et al. (2015): Oral N-acetylcysteine reduces plasma homocysteine concentrations regardless of lipid or smoking status. The American Journal of Clinical Nutrition. 2015 Nov;102(5):1014-1024. https://academic.oup.com/ajcn/article/102/5/1014/4564368, abgerufen am 23.03.2018.
Homocysteine Lowering Trialists’ Collaboration (2005): Dose-dependent effects of folic acid on blood concentrations of homocysteine: a meta-analysis of the randomized trials. Am J Clin Nutr. 2005 Oct;82(4):806-12. https://www.ncbi.nlm.nih.gov/pubmed/?term=Homocysteine%20Lowering%20Trialists%27%20Collaboration%5BCorporate%20Author%5D, abgerufen am 12.02.2018.
Horigan, G. et al. (2010): Riboflavin lowers blood pressure in cardiovascular disease patients homozygous for the 677C-->T polymorphism in MTHFR. J Hypertens 2010;28(3):478-86. https://pubmed.ncbi.nlm.nih.gov/19952781/, abgerufen am 08.02.2023.
House, A.A. et al. (2010): Effect of B-vitamin therapy on progression of diabetic nephropathy: a randomized controlled trial. JAMA. 2010 Apr 28;303(16):1603-9. https://www.ncbi.nlm.nih.gov/pubmed/20424250, abgerufen am 12.03.2018.
Huang, P. et al. (2015): Homocysteine and the risk of age-related macular degeneration: a systematic review and meta-analysis. Sci Rep. 2015 Jul 21;5:10585. https://www.ncbi.nlm.nih.gov/pubmed/26194346, abgerufen am 13.02.2018.
Huang, T. et al. (2015): Effect of vitamin B-12 and n-3 polyunsaturated fatty acids on plasma homocysteine, ferritin, C-reaction protein, and other cardiovascular risk factors: a randomized controlled trial. Asia Pac J Clin Nutr. 2015;24(3):403-11. https://www.ncbi.nlm.nih.gov/pubmed/26420180, abgerufen am 14.02.2018.
James, P.T. et al. (2019): A novel nutritional supplement to reduce plasma homocysteine in nonpregnant women: A randomised controlled trial in The Gambia. PLoS Med. 2019 Aug 13;16(8):e1002870. https://pubmed.ncbi.nlm.nih.gov/31408467/, abgerufen am 27.04.2022.
Jarrett, H. et al. (2022): Vitamin B-6 and riboflavin, their metabolic interaction, and relationship with MTHFR genotype in adults aged 18-102 years. Am J Clin Nutr 2022;116(6):1767-78. https://pubmed.ncbi.nlm.nih.gov/36264281/, abgerufen am 08.02.2023.
Jernerén, F. et al. (2019): Homocysteine Status Modifies the Treatment Effect of Omega-3 Fatty Acids on Cognition in a Randomized Clinical Trial in Mild to Moderate Alzheimer's Disease: The OmegAD Study. J Alzheimers Dis. 2019;69(1):189-97. https://pubmed.ncbi.nlm.nih.gov/30958356/, abgerufen am 27.04.2022.
Kancherla, V. et al. (2021): A 2019 global update on folic acid-preventable spina bifida and anencephaly. Birth Defects Res. 2021 Jan 1;113(1):77-89. https://pubmed.ncbi.nlm.nih.gov/33124747/, abgerufen am 27.04.2022.
Kasperczyk, S. et al. (2016): Effect of N-acetylcysteine administration on homocysteine level, oxidative damage to proteins, and levels of iron (Fe) and Fe-related proteins in lead-exposed workers. Toxicol Ind Health. 2016 Sep;32(9):1607-18. https://www.ncbi.nlm.nih.gov/pubmed/25731901, abgerufen am 13.03.2018.
Kosmadakis, G. et al. (2013): Vitamins in dialysis: who, when and how much? Renal Failure. 2014 Feb;36(4): 638-650. https://www.tandfonline.com/doi/full/10.3109/0886022X.2014.882714?scroll=top&needAccess=true, abgerufen am 23.03.2018.
Koyama, K. et al. (2010): Randomized controlled trial of the effect of short-term coadministration of methylcobalamin and folate on serum ADMA concentration in patients receiving long-term hemodialysis. Am J Kidney Dis. 2010 Jun;55(6):1069-78. https://www.ncbi.nlm.nih.gov/pubmed/20430500, abgerufen am 09.04.2018.
Kumar, A. et al. (2017): The metabolism and significance of homocysteine in nutrition and health. Nutr Metab (Lond). 2017; 14: 78. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5741875/, abgerufen am 07.02.2018
Laha, A. et al. (2018): Connecting homocysteine and obesity through pyroptosis, gut microbiome, epigenetics, peroxisome proliferator-activated receptor γ, and zinc finger protein 407. Can J Physiol Pharmacol. 2018 Oct;96(10):971-6. https://pubmed.ncbi.nlm.nih.gov/29890083/, abgerufen am 27.04.2022.
Lange, H. et al. (2004): Folate therapy and in-stent restenosis after coronary stenting. N Engl J Med. 2004 Jun 24;350(26):2673-81. https://www.ncbi.nlm.nih.gov/pubmed/15215483, abgerufen am 13.03.2018.
Leclerc, D. (2000-2013): Molecular Biology of Methylenetetrahydrofolate Reductase (MTHFR) and Overview of Mutations/Polymorphisms. In: Madame Curie Bioscience Database [Internet]. Austin (TX): Landes Bioscience; 2000-2013. https://www.ncbi.nlm.nih.gov/books/NBK6561, abgerufen am 07.02.2018.
Lee, J. E. et al. (2010): Are Dietary Choline and Betaine Intakes Determinants of Total Homocysteine Concentration? Am J Clin Nutr. 2010 May;91(5):1303-10 https://pubmed.ncbi.nlm.nih.gov/20219967/, abgerufen am 18.05.2020.
Lemarié, C. A. et al. (2011): Mthfr deficiency induces endothelial progenitor cell senescence via uncoupling of eNOS and downregulation of SIRT1. Am J Physiol Heart Circ Physiol 2011;300(3):H745-H753. https://pubmed.ncbi.nlm.nih.gov/21169404/, abgerufen am 08.02.2023.
Levy, J. et al. (2021): Cardiovascular manifestations of intermediate and major hyperhomocysteinemia due to vitamin B12 and folate deficiency and/or inherited disorders of one-carbon metabolism: a 3.5-year retrospective cross-sectional study of consecutive patients. Am J Clin Nutr 2021;113(5):1157-67. https://pubmed.ncbi.nlm.nih.gov/33693455/, abgerufen am 08.02.2023.
Li, J. et al. (2018): Homocysteine level in patients with obstructive sleep apnea/hypopnea syndrome and the impact of continuous positive airway pressure treatment. Adv Clin Exp Med . 2018 Nov;27(11):1549-54. https://pubmed.ncbi.nlm.nih.gov/30066499/, abgerufen am 27.04.2022.
Li, J. et al. (2020): Correlations between blood lipid, serum cystatin C, and homocysteine levels in patients with Parkinson's disease. Psychogeriatrics. 2020 Mar;20(2):180-188. https://pubmed.ncbi.nlm.nih.gov/31828903/, abgerufen am 17.02.2021.
Li, S. et al. (2021): The preventive efficacy of vitamin B supplements on the cognitive decline of elderly adults: a systematic review and meta-analysis. BMC Geriatr. 2021 Jun 16;21(1):367. https://pubmed.ncbi.nlm.nih.gov/34134667/, abgerufen am 27.04.2022.
Li, W. et al. (2021): Nonocular Influencing Factors for Primary Glaucoma: An Umbrella Review of Meta-Analysis. Ophthalmic Res. 2021;64(6):938-50. https://pubmed.ncbi.nlm.nih.gov/34517373/, abgerufen am 27.04.2022.
Li, X. et al. (2021): The effect of metformin on homocysteine levels in patients with polycystic ovary syndrome: A systematic review and meta-analysis. J Obstet Gynaecol Res. 2021 May;47(5):1804-16. https://pubmed.ncbi.nlm.nih.gov/33650273/, abgerufen am 27.04.2022.
Lindschinger, M. et al. (2019): A Randomized Pilot Trial to Evaluate the Bioavailability of Natural versus Synthetic Vitamin B Complexes in Healthy Humans and Their Effects on Homocysteine, Oxidative Stress, and Antioxidant Levels. Oxid Med Cell Longev. 2019 Dec 12;2019:6082613. https://pubmed.ncbi.nlm.nih.gov/31915511/, abgerufen am 27.04.2022.
Liu, F. et al. (2021): 5,10-methylenetetrahydrofolate reductase C677T gene polymorphism and peripheral arterial disease: A meta-analysis. Vascular. 2021 Dec;29(6):913-9. https://pubmed.ncbi.nlm.nih.gov/33357155/, abgerufen am 27.04.2022.
Liu, C. et al. (2022): Hyperhomocysteinemia Increases Risk of Metabolic Syndrome and Cardiovascular Death in an Elderly Chinese Community Population of a 7-Year Follow-Up Study. Front Cardiovasc Med 2022 Feb 10;8:811670. https://pubmed.ncbi.nlm.nih.gov/35224027/, abgerufen am 08.02.2023.
Lonn, E. et al. (2006): Homocysteine lowering with folic acid and B vitamins in vascular disease. N Engl J Med. 2006 Apr 13;354(15):1567-77. https://www.ncbi.nlm.nih.gov/pubmed/16531613, abgerufen am 13.02.2018.
López-Sobaler, A.M. et al. (2021): Importance of choline in cognitive function. Nutr Hosp. 2021 Jan 13;37(Spec No2):18-23. https://pubmed.ncbi.nlm.nih.gov/32993309/, abgerufen am 27.04.2022.
Lurz, E. et al. (2020): Vitamin B12 Deficiency Alters the Gut Microbiota in a Murine Model of Colitis. Front Nutr. 2020 Jun 5;7:83. https://pubmed.ncbi.nlm.nih.gov/32582756/, abgerufen am 27.04.2022.
Maroto-Sánchez, B. et al. (2019): Rehydration during exercise prevents the increase of homocysteine concentrations. Amino Acids 2019;51(2):193-204. https://pubmed.ncbi.nlm.nih.gov/30264170/, abgerufen am 08.02.2023.
Martí-Carvajal, A.J. et al. (2017): Homocysteine-lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev. 2017 Aug 17;8(8):CD006612. https://pubmed.ncbi.nlm.nih.gov/28816346/, abgerufen am 27.04.2022.
Martucci, M. et al. (2020): Twelve-Week Daily Consumption of ad hoc Fortified Milk with ω-3, D, and Group B Vitamins Has a Positive Impact on Inflammaging Parameters: A Randomized Cross-Over Trial. Nutrients. 2020 Nov 22;12(11):3580. https://pubmed.ncbi.nlm.nih.gov/33266447/, abgerufen am 27.04.2022.
McAuley, E. et al. (2016): Riboflavin status, MTHFR genotype and blood pressure: current evidence and implications for personalised nutrition. Proc Nutr Soc. 2016 Aug;75(3):405-14. https://www.ncbi.nlm.nih.gov/pubmed/27170501, abgerufen am 14.02.2018.
McMahon, A. et al. (2016): Novel Approaches to Investigate One-Carbon Metabolism and Related B-Vitamins in Blood Pressure. Nutrients 2016 Nov 11;8(11):720. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5133106/, abgerufen am 08.02.2023.
McNulty, H. et al. (2017): Riboflavin, MTHFR genotype and blood pressure: A personalized approach to prevention and treatment of hypertension. Mol Aspects Med 2017;53:2-9. https://pubmed.ncbi.nlm.nih.gov/27720779/, abgerufen am 08.02.2023.
McRae, M.P. (2013): Betaine supplementation decreases plasma homocysteine in healthy adult participants: a meta-analysis. J Chiropr Med. 2013 Mar;12(1):20-5. https://www.ncbi.nlm.nih.gov/pubmed/23997720, abgerufen am 13.08.2018.
Menzel, D. (2018): L-Arginine and B vitamins improve endothelial function in subjects with mild to moderate blood pressure elevation. Eur J Nutr 2018;57(2):557-568. https://pubmed.ncbi.nlm.nih.gov/27817128/, abgerufen am 08.02.2023.
Miao, L. et al. (2021): No causal effects of plasma homocysteine levels on the risk of coronary heart disease or acute myocardial infarction: A Mendelian randomization study. Eur J Prev Cardiol. 2021 Apr 10;28(2):227–34. https://pubmed.ncbi.nlm.nih.gov/33838042/, abgerufen am 27.04.2022.
Morris, A.A. et al. (2017): Guidelines for the diagnosis and management of cystathionine beta-synthase deficiency. J Inherit Metab Dis 2017;40(1):49-74. https://pubmed.ncbi.nlm.nih.gov/27778219/, abgerufen am 08.02.2023.
Mottaghi, T. et al. (2019): Effect of folic acid supplementation on nerve conduction velocity in diabetic polyneuropathy patients. Neurol Res. 2019 Apr;41(4):364-8. https://pubmed.ncbi.nlm.nih.gov/30730785/, abgerufen am 27.04.2022.
Murawska-Ciałowicz, E. et al. (2021): BDNF Impact on Biological Markers of Depression-Role of Physical Exercise and Training. Int J Environ Res Public Health. 2021 Jul 15;18(14):7553. https://pubmed.ncbi.nlm.nih.gov/34300001/, abgerufen am 27.04.2022.
N.N. (2003): Betaine. Alternative Medicine Review 2003:8(2). http://archive.foundationalmedicinereview.com/publications/8/2/193.pdf, abgerufen am 13.08.2018.
Ojeda-Granados, C. et al. (2020): A Regionalized Genome-Based Mexican Diet Improves Anthropometric and Metabolic Parameters in Subjects at Risk for Obesity-Related Chronic Diseases. Nutrients. 2020 Feb 28;12(3):645. https://pubmed.ncbi.nlm.nih.gov/32121184/, abgerufen am 27.04.2022.
Oliveira, V.H.F. et al. (2019): Homocysteine-lowering exercise effect is greater in hyperhomocysteinemic people living with HIV: a randomized clinical trial. Appl Physiol Nutr Metab. 2019 Nov;44(11):1165-71. https://pubmed.ncbi.nlm.nih.gov/30861351/, abgerufen am 27.04.2022.
Olthof, M.R. et al. (2005): Choline supplemented as phosphatidylcholine decreases fasting and postmethionine-loading plasma homocysteine concentrations in healthy men. Am J Clin Nutr. 2005 Jul;82(1):111-7. https://www.ncbi.nlm.nih.gov/pubmed/16002808, abgerufen am 18.05.2020
Orphanet Report Series, Rare Diseases Collection (2018): Nummer 2, Januar 2018. http://www.orpha.net/orphacom/cahiers/docs/DE/Pravalenzen_seltener_Krankheiten_absteigender_Pravalenz_oder_Falle.pdf, abgerufen am 13.02.2018.
Oussalah, A. et al. (2011): Meta-analysis: hyperhomocysteinaemia in inflammatory bowel diseases. Aliment Pharmacol Ther. 2011 Nov;34(10):1173-84. https://www.ncbi.nlm.nih.gov/pubmed/21967576, abgerufen am 12.02.2018.
Paduchová, Z. et al. (2021): The Effect of Omega-3 Fatty Acids on Thromboxane, Brain-Derived Neurotrophic Factor, Homocysteine, and Vitamin D in Depressive Children and Adolescents: Randomized Controlled Trial. Nutrients. 2021 Mar 27;13(4):1095. https://pubmed.ncbi.nlm.nih.gov/33801688/, abgerufen am 27.04.2022.
Pietrzik, K. (2010): Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics. Clin Pharmacokinet. 2010 Aug;49(8):535-48. https://www.ncbi.nlm.nih.gov/pubmed/20608755, abgerufen am 14.02.2018.
Prinz-Langenohl, R. et al. (2009): [6S]-5-methyltetrahydrofolate increases plasma folate more effectively than folic acid in women with the homozygous or wild-type 677C-->T polymorphism of methylenetetrahydrofolate reductase. Br J Pharmacol. 2009 Dec;158(8):2014-21. https://www.ncbi.nlm.nih.gov/pubmed/19917061, abgerufen am 14.02.2018.
Rajdl, D. et al. (2016): Effect of Folic Acid, Betaine, Vitamin B6, and Vitamin B12 on Homocysteine and Dimethylglycine Levels in Middle-Aged Men Drinking White Wine. Nutrients. 2016 Jan 12;8(1). https://www.ncbi.nlm.nih.gov/pubmed/26771632, abgerufen am 13.08.2018.
Rasmussen, J. (2019): The LipiDiDiet trial: what does it add to the current evidence for Fortasyn Connect in early Alzheimer's disease? Clin Interv Aging. 2019 Aug 15;14:1481-92. https://pubmed.ncbi.nlm.nih.gov/31616139/, abgerufen am 27.04.2022.
Reulecke, B. und Denecke, J. (2009): Diagnostik und Therapie der Homocystinurie. Kinder- und Jugendmedizin. 2009 (Vol. 9): Heft 5, pp. 289-293. https://silo.tips/download/keywords-homocystinuria-methionine-metabolism-homocysteine, abgerufen am 09.03.2018.
Rizowy, G.M. et al. (2020): Is the gut microbiota dysbiotic in patients with classical homocystinuria? Biochimie. 2020 Jun;173:3-11. https://pubmed.ncbi.nlm.nih.gov/32105814/, abgerufen am 27.04.2022.
Rizzo, G. & Laganà, A.S. (2020): The Link between Homocysteine and Omega-3 Polyunsaturated Fatty Acid: Critical Appraisal and Future Directions. Biomolecules. 2020 Feb 2;10(2):219. https://pubmed.ncbi.nlm.nih.gov/32024302/, abgerufen am 27.04.2022.
Rosario, D. et al. (2021): Systematic analysis of gut microbiome reveals the role of bacterial folate and homocysteine metabolism in Parkinson's disease. Cell Rep. 2021 Mar 2;34(9):108807. https://pubmed.ncbi.nlm.nih.gov/33657381/, abgerufen am 27.04.2022.
Rutsch, A. et al. (2020): The Gut-Brain Axis: How Microbiota and Host Inflammasome Influence Brain Physiology and Pathology. Front Immunol. 2020 Dec 10;11:604179. https://pubmed.ncbi.nlm.nih.gov/33362788/, abgerufen am 27.04.2022.
Saadat, P. et al. (2018): Serum Homocysteine Level in Parkinson's Disease and Its Association with Duration, Cardinal Manifestation, and Severity of Disease. Parkinsons Dis. 2018 May 2;2018:5813084. https://pubmed.ncbi.nlm.nih.gov/29854384/, abgerufen am 17.02.2021.
Saposnik, G. (2011): The Role of Vitamin B in Stroke Prevention: A Journey From Observational Studies to Clinical Trials and Critique of the Vitamins To Prevent Stroke. Stroke. 2011 Jan;42:838-842. http://stroke.ahajournals.org/content/42/3/838, abgerufen am 23.03.2018.
Satapathy, S. et al. (2020): Folic acid and vitamin B12 supplementation in subjects with type 2 diabetes mellitus: A multi-arm randomized controlled clinical trial. Complement Ther Med. 2020 Sep;53:102526. https://pubmed.ncbi.nlm.nih.gov/33066869/, abgerufen am 27.04.2022.
Scaglione, F. und Panzavolta, G. (2014): Folate, folic acid and 5-methyltetrahydrofolate are not the same thing. Xenobiotica. 2014 May;44(5):480-8. https://www.ncbi.nlm.nih.gov/pubmed/24494987, abgerufen am 14.02.2018.
Schneider, M.P. et al. (2011): Folic acid treatment normalizes NOS-dependence of vascular tone in the metabolic syndrome. Obesity (Silver Spring) 2011;19(5):960-7. https://pubmed.ncbi.nlm.nih.gov/20864946/, abgerufen am 08.02.2023.
Schwab, U. et al. (2006): Orally administered betaine has an acute and dose-dependent effect on serum betaine and plasma homocysteine concentrations in healthy humans. J Nutr. 2006 Jan;136(1):34-8. https://www.ncbi.nlm.nih.gov/pubmed/16365055, abgerufen am 13.08.2018
Shirodaria, C. et al. (2007): Global improvement of vascular function and redox state with low-dose folic acid: implications for folate therapy in patients with coronary artery disease. Circulation 2007;115(17):2262-70. https://pubmed.ncbi.nlm.nih.gov/17420345/, abgerufen am 08.02.2023.
Shlobin, N.A. et al. (2020): Folate fortification and supplementation in prevention of folate-sensitive neural tube defects: a systematic review of policy. J Neurosurg Pediatr. 2020 Dec 18;27(3):294-310. https://pubmed.ncbi.nlm.nih.gov/33338998/, abgerufen am 27.04.2022.
Singh, M. et al. (2021): High-methionine diet in skeletal muscle remodeling: epigenetic mechanism of homocysteine-mediated growth retardation. Can J Physiol Pharmacol. 2021 Jan;99(1):56-63. https://pubmed.ncbi.nlm.nih.gov/32799662/, abgerufen am 27.04.2022.
Spence, J.D. (2013): B vitamin therapy for homocysteine: renal function and vitamin B12 determine cardiovascular outcomes. Clin Chem Lab Med. 2013 Mar;51(3):633-7. https://www.ncbi.nlm.nih.gov/pubmed/23449527, abgerufen am 23.03.2018.
Spence, J.D. (2021): Reducing the Risk of Stroke in Patients with Impaired Renal Function: Nutritional Issues. J Stroke Cerebrovasc Dis. 2021 Sep;30(9):105376. https://pubmed.ncbi.nlm.nih.gov/33214054/, abgerufen am 27.04.2022.
Spence, J.D. et al. (2017): B vitamins in stroke prevention: time to reconsider. The Lancet Neurology. 2017 Sep;16(9):750 - 760. https://www.ncbi.nlm.nih.gov/pubmed/28816120, abgerufen am 23.03.2018.
Stanger, O. & Weger, M. (2003): Interactions of homocysteine, nitric oxide, folate and radicals in the progressively damaged endothelium. Clin Chem Lab Med 2003;41(11):1444-54. https://pubmed.ncbi.nlm.nih.gov/14656024/, abgerufen am 08.02.2023.
Stanhewicz, A.E. et al. (2015): Folic acid supplementation improves microvascular function in older adults through nitric oxide-dependent mechanisms. Clin Sci (Lond) 2015;129(2):159-67. https://pubmed.ncbi.nlm.nih.gov/25748442/, abgerufen am 08.02.2023.
Stanhewicz, A. E. & Kenney, W. L. (2017): Role of folic acid in nitric oxide bioavailability and vascular endothelial function. Nutr Rev 2017 Jan;75(1):61-70. https://pubmed.ncbi.nlm.nih.gov/27974600/, abgerufen am 08.02.2023.
Strain, J.J. et al. (2004): B-vitamins, homocysteine metabolism and CVD. Proc Nutr Soc. 2004 Nov;63(4):597-603. https://www.ncbi.nlm.nih.gov/pubmed/15831132, abgerufen am 12.02.2018.
Sun, F. et al: (2017): Correlation of Maternal Serum Homocysteine in the First Trimester with the Development of Gestational Hypertension and Preeclampsia. Med Sci Monit. 2017; 23: 5396–5401. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5699171/, abgerufen am 12.02.2018.
Sydow, K. et al. (2003): ADMA and oxidative stress are responsible for endothelial dysfunction in hyperhomocyst(e)inemia: effects of L-arginine and B vitamins. Cardiovasc Res 2003;57(1):244-52. https://pubmed.ncbi.nlm.nih.gov/12504835/, abgerufen am 08.02.2023.
Tchantchou, F. (2006): Homocysteine metabolism and various consequences of folate deficiency. J Alzheimers Dis. 2006 Aug;9(4):421-7. https://pubmed.ncbi.nlm.nih.gov/16917151/, abgerufen am 9.10.2023.
Title, L.M. et al. (2006): Folic acid improves endothelial dysfunction in type 2 diabetes--an effect independent of homocysteine-lowering. Vasc Med 2006;11(2):101-9. https://pubmed.ncbi.nlm.nih.gov/16886840/, abgerufen am 08.02.2023.
Troesch, B. et al. (2016): Potential Links between Impaired One-Carbon Metabolism Due to Polymorphisms, Inadequate B-Vitamin Status, and the Development of Alzheimer's Disease. Nutrients. 2016 Dec 10;8(12). pii: E803. https://www.ncbi.nlm.nih.gov/pubmed/27973419, abgerufen am 12.02.2018.
Vacek, T.P. et al. (2013): The role of homocysteine in bone remodeling. Clin Chem Lab Med. 2013;51:579–590. https://www.ncbi.nlm.nih.gov/pubmed/23449525, abgerufen am 13.02.2018.
Valente, F.X. et al. (2015): B vitamins related to homocysteine metabolism in adults celiac disease patients: a cross-sectional study. Nutr J. 2015 Oct 20;14:110. https://www.ncbi.nlm.nih.gov/pubmed/26487487, abgerufen am 12.02.2018.
van Etten, R.W. et al. (2002): Impaired NO-dependent vasodilation in patients with Type II (non-insulin-dependent) diabetes mellitus is restored by acute administration of folate. Diabetologia 2002;45(7):1004-10. https://pubmed.ncbi.nlm.nih.gov/12136399/, abgerufen am: 08.02.2023.
van der Linden, I.J. et al. (2006): Genetic variation in genes of folate metabolism and neural-tube defect risk. Proc Nutr Soc 65(2):204-15. https://pubmed.ncbi.nlm.nih.gov/16672082/, abgerufen am 9.10.2023.
Van Hattum, E.S. et al. (2007): Does folate therapy reduce the risk of coronary restenosis? Neth Heart J. 2007 Jan;15(1):12-5. https://www.ncbi.nlm.nih.gov/pubmed/17612702, abgerufen am 23.03.2018.
van Soest, A.P.M. et al. (2021): Positive effects of folic acid supplementation on cognitive aging are dependent on ω-3 fatty acid status: a post hoc analysis of the FACIT trial. Am J Clin Nutr. 2021 Apr 6;113(4):801-9. https://pubmed.ncbi.nlm.nih.gov/33564824/, abgerufen am 27.04.2022.
Ventura, P. et al. (2003): Urinary and Plasma Homocysteine and Cysteine Levels During Prolonged Oral N-acetylcysteine Therapy. Pharmacology 2003 Jun;68(2):105-14. https://pubmed.ncbi.nlm.nih.gov/12711838/ abgerufen am 08.02.2023.
Ventura, P. et al. (1999): N -Acetyl-cysteine reduces homocysteine plasma levels after single intravenous administration by increasing thiols urinary excretion. Pharmacol Res 1999;40(4):345-50. https://pubmed.ncbi.nlm.nih.gov/10527647/, abgerufen am 08.02.2023.
Wang, X. et al. (2007): Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007 Jun 2;369(9576):1876-82. https://www.ncbi.nlm.nih.gov/pubmed/17544768, abgerufen am 13.02.2018.
Ward, M. et al. (2020): Impact of the common MTHFR 677C→T polymorphism on blood pressure in adulthood and role of riboflavin in modifying the genetic risk of hypertension: evidence from the JINGO project. BMC Med 2020 Nov 11;18(1):318. https://pubmed.ncbi.nlm.nih.gov/33172445/, abgerufen am 08.02.2023.
Wilson, C.P. et al. (2013): Blood pressure in treated hypertensive individuals with the MTHFR 677TT genotype is responsive to intervention with riboflavin: findings of a targeted randomized trial. Hypertension 2013;61(6):1302-8. https://pubmed.ncbi.nlm.nih.gov/23608654/, abgerufen am 08.02.2023.
Wolters, M. et al. (2005): Effect of multivitamin supplementation on the homocysteine and methylmalonic acid blood concentrations in women over the age of 60 years. Eur J Nutr. 2005 Mar;44(3):183-92. https://www.ncbi.nlm.nih.gov/pubmed/15309436, abgerufen am 14.02.2018.
Xiao, Y. et al. (2013): Dietary protein and plasma total homocysteine, cysteine concentrations in coronary angiographic subjects. Nutr J. 2013; 12: 144. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4176105/, abgerufen am 07.02.2018.
Ye, M. et al. (2021): N-acetylcysteine for chronic kidney disease: a systematic review and meta-analysis. Am J Transl Res. 2021 Apr 15;13(4):2472-85. https://pubmed.ncbi.nlm.nih.gov/34017406/, abgerufen am 27.04.2022.
Yilmaz, H. et al. (2007): Effects of folic acid and N-acetylcysteine on plasma homocysteine levels and endothelial function in patients with coronary artery disease. Acta Cardiol. 2007 Dec;62(6):579-85. https://www.ncbi.nlm.nih.gov/pubmed/18214123, abgerufen am 13.03.2018.
Yılmaz, N. & Eren, E. (2009): Homocysteine oxidative stress and relation to bone mineral density in post-menopausal osteoporosis. Aging Clin Exp Res. 2009;21:353–357. https://www.ncbi.nlm.nih.gov/pubmed/19959926, abgerufen am 13.02.2018.
Yuyun, M. F. et al. (2018): Endothelial dysfunction, endothelial nitric oxide bioavailability, tetrahydrobiopterin, and 5-methyltetrahydrofolate in cardiovascular disease. Where are we with therapy?. Microvasc Res 2018;119:7-12. https://pubmed.ncbi.nlm.nih.gov/29596860/, abgerufen am 08.02.2023.
Zawieja, E.E. et al. (2021): Betaine Supplementation Moderately Increases Total Cholesterol Levels: A Systematic Review and Meta-Analysis. J Diet Suppl. 2021;18(1):105-17. https://pubmed.ncbi.nlm.nih.gov/31809615/, abgerufen am 27.04.2022.
Zhang, W.T. et al. (2020): Associations of OSAHS complicated by cerebral infarction with intestinal flora, inflammatory factors, homocysteine and adiponectin expression. Eur Rev Med Pharmacol Sci. 2020 Dec;24(24):12993-999. https://pubmed.ncbi.nlm.nih.gov/33378050/, abgerufen am 27.04.2022.
Zhao, W. et al. (2022): The interaction of hypertension and homocysteine increases the risk of mortality among middle-aged and older population in the United States. J Hypertens 2022;40(2):254-63. https://pubmed.ncbi.nlm.nih.gov/34475348/, abgerufen am 08.02.2023.
Zhao, W. et al. (2022): Association of Homocysteine and Insulin Resistance with Increased Risk of Mortality in a Nondiabetic Population: Third National Health and Nutrition Examination Survey. Metab Syndr Relat Disord 2022;20(5):255-63. https://pubmed.ncbi.nlm.nih.gov/35467972/, abgerufen am 08.02.2023.
Zheng, S. et al. (2017): Association of ulcerative colitis with transcobalamin II gene polymorphisms and serum homocysteine, vitamin B12, and folate levels in Chinese patients. Immunogenetics. 2017 Jul;69(7):421-428. https://www.ncbi.nlm.nih.gov/pubmed/28526947, abgerufen am 10.04.2018.
Zhou, Y. et al. (2014): Association between plasma homocysteine status and hypothyroidism: a meta-analysis. Int J Clin Exp Med. 2014;7:4544. https://www.ncbi.nlm.nih.gov/pubmed/19959926, abgerufen am 13.02.2018.
Zhou, L. et al. (2022): Associations of Serum and Red Blood Cell Folate With All-Cause and Cardiovascular Mortality Among Hypertensive Patients With Elevated Homocysteine. Front Nutr 2022 Feb 25;9:849561. https://pubmed.ncbi.nlm.nih.gov/35284465/, abgerufen am 08.02.2023.
Zuin, M. et al. (2021): Methylenetetrahydrofolate reductase C667T polymorphism and susceptibility to late-onset Alzheimer's disease in the Italian population. Minerva Med. 2021 Jun;112(3):365-71. https://pubmed.ncbi.nlm.nih.gov/32700867/, abgerufen am 27.04.2022.