Morbus Basedow ist eine chronische Autoimmunerkrankung. Das körpereigene Immunsystem bildet dabei Antikörper gegen das Gewebe der Schilddrüse. Dadurch wird die Schilddrüse überaktiv und gibt vermehrt Schilddrüsenhormone ab. Es kommt zu einer Schilddrüsenüberfunktion mit Herzrasen, Nervosität und Schlafstörungen. Lesen Sie, wie Mikronährstoffe die Schilddrüse bei Morbus Basedow schützen und die Symptome lindern können.
Ursachen und Symptome
Wie entsteht ein Morbus Basedow?
Bei Morbus Basedow bildet das körpereigene Immunsystem Antikörper gegen das Gewebe der Schilddrüse. Man spricht von einer Autoimmunerkrankung. Die Antikörper binden an die Zellen der Schilddrüse und aktivieren sie. Dadurch bilden sie vermehrt Schilddrüsenhormone. Es kommt zu einer Schilddrüsenüberfunktion.
Warum das eigene Immunsystem gesundes Gewebe angreift, ist noch unklar. Man vermutet, aber äußere Einflüsse wie Stress, Schwangerschaft, Rauchen, Umweltchemikalien oder Viruserkrankungen als Auslöser. Auch eine genetische Veranlagung wird diskutiert. Daneben könnte ein Selen- und Vitamin-D-Mangel sowie ein Jodüberschuss zur Entstehung beitragen.
Welche Symptome treten bei einem Morbus Basedow auf?
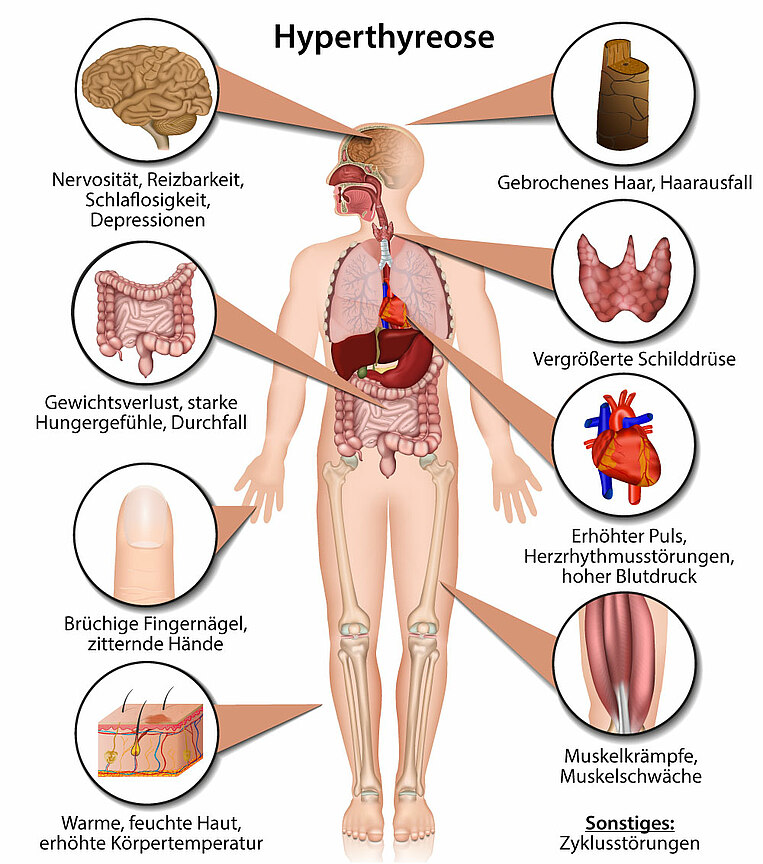
Beim Morbus Basedow treten zu Beginn häufig nur wenige oder keine Symptome auf. Beim Fortschreiten der Erkrankung kann es aber zu unterschiedlichen Beschwerden kommen. Da die Schilddrüse das „Gaspedal des Körpers“ ist, werden verschiedene Funktionen überstimuliert. Es treten auf:
- Herzrasen, Herzrhythmusstörungen und hoher Blutdruck
- Nervosität, Schlafstörungen
- Durchfall, Gewichtsverlust
- Erschöpfung
- Schwitzen und Unverträglichkeit für Wärme
- Haarausfall
- Zittern der Hände
- Stimmungsschwankungen bis hin zu Aggressivität
- Zyklusstörungen bei der Frau, Impotenz beim Mann
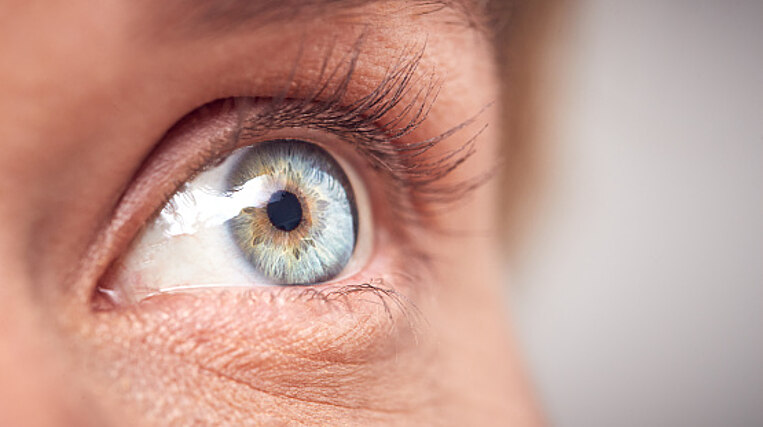
Bei mehr als der Hälfte aller Erkrankten treten sichtbar die Augen hervor. Umgangssprachlich spricht man dabei von Glubschaugen. Entzündungen in der Augenhöhle und Veränderungen am Bindegewebe und Fettkörper drücken dabei die Augen aus dem Schädel. Das führt vermehrt zu Sehstörungen und Augenbeschwerden (endokrine Orbitopathie). In schweren Fällen kommt es auch zu einer Schwellung der Unterschenkel, Hände und Füße.
Bei manchen Patienten wächst die Schilddrüse. Die Folge ist eine Schilddrüsenvergrößerung (Kropf oder Struma). Das kann zu Enge- oder Druckgefühlen im Halsbereich und beim Schlucken und Atmen führen.
Je länger der Morbus Basedow besteht, desto stärker sind die Symptome. In schweren Fällen kann es zu einer lebensbedrohlichen Schilddrüsenhormonvergiftung kommen.
Info
Autoimmunerkrankungen treten oft gehäuft auf. Auch bei Morbus Basedow ist das Risiko für weitere Immunerkrankungen erhöht. Darunter sind Zöliakie, Diabetes mellitus Typ 1, die Weißfleckenkrankheit der Haut, autoimmune Gastritis oder eine Nebennierenunterfunktion (Morbus Addison).
Ziele der Behandlung
Wie wird Morbus Basedow klassisch behandelt?
Da Morbus Basedow zu einer Schilddrüsenüberfunktion führt, wird die Bildung der Schilddrüsenhormone mit Medikamenten meistens für ein Jahr blockiert (sogenannte Thyreostatika mit den Wirkstoffen Carbimazol wie Carbimazol - 1 A Pharma®, Carbistad®, Thiamazol wie Favistan® und Thyrozol®, Propylthiouracil wie Propycil® und Perchlorat wie Irenat®). In der Hälfte aller Fälle ist Morbus Basedow nach dem Absetzen ausgeheilt.
Sollten die Medikamente nicht helfen, kann die Schilddrüsenfunktion durch eine Radiojodtherapie oder eine Schilddrüsenoperation ausgeschaltet werden. Das überaktive Schilddrüsengewebe wird bei der Radiojodtherapie zerstört und bei einer Operation entfernt. Danach sind Betroffene lebenslang auf die Einnahme von Schilddrüsenhormonen angewiesen, um eine Schilddrüsenunterfunktion zu vermeiden. Diese Hormontherapie ist jedoch verträglicher als eine dauernde Einnahme von Thyreostatika.
Augensymptome (Orbitopathie) können ebenfalls gelindert werden: Trockene Augen werden oft mit Augentropfen, Salben und Gelen behandelt. Sie enthalten befeuchtende Wirkstoffe wie Povidon oder Hydroxypropylmethylcellulose. Bei hervortretenden Augen und Schwellungen wird Cortison als Entzündungshemmer eingesetzt. Auch bei den seltenen Schwellungen der Unterschenkel, Hände und Füße wird in schweren Fällen Cortison angewendet. Übliche Wirkstoffe sind beispielsweise Prednison (wie Decortin®, Lodotra®), Prednisolon (wie Alpicort®) und Methylprednisolon (wie Medrol®).
Ziele der Mikronährstoffmedizin
Die klassische Behandlung von Morbus Basedow kann durch Mikronährstoffe ergänzt werden. Durch die Schilddrüsenüberfunktion steigt der oxidative Stress. Dieser kann mit Antioxidantien gelindert werden. Antioxidative Vitamine und Mineralstoffe verringern auch Entzündungen des Gewebes und verlangsamen dadurch das Fortschreiten der Erkrankung.
Folgende Stoffe werden in der Mikronährstoffmedizin hauptsächlich eingesetzt:
- Antioxidative Vitamine und Pflanzenstoffe lindern oxidativen Stress bei Morbus Basedow.
- Selen stärkt die körpereigene Abwehr von freien Radikalen.
- Vitamin D reguliert das überaktive Immunsystem.
Darüber hinaus können bestimmte Mikronährstoffe die Wirkung der klassischen Medikamente verstärken oder deren Nebenwirkungen abschwächen.
Behandlung mit Mikronährstoffen
Antioxidantien reduzieren oxidativen Stress
Wirkweise von Antioxidantien
Die Schilddrüse hat einen gefährlichen Stoffwechsel, bei dem freie Radikale oxidativen Stress auslösen. Oxidativer Stress verändert körpereigene Eiweiße, sodass sie unter Umständen vom Immunsystem als „Fremdstoffe“ angegriffen werden. Das kann eine Ursache von autoimmunen Schilddrüsenerkrankungen sein und die Erkrankung verschlimmern. Daher müssen freie Radikale laufend durch Antioxidantien entgiftet werden.
Laut Beobachtungsstudien haben Personen mit einer Schilddrüsenüberfunktion erhöhten oxidativen Stress. Typische Antioxidantien wie Vitamin E und Coenzym Q10 sind dagegen im Blut verringert.
Eine erste kleine Studie zur Einnahme von Antioxidantien zeigte positive Effekte: Ein Präparat mit Vitamin E, C, Beta-Carotin, Kupfer, Zink, Mangan und Selen senkte den oxidativen Stress bei Morbus Basedow. Diese Wirkung war vergleichbar mit einem Thyreostatikum (Methimazol). Die Patienten hatten zudem weniger Symptome, wenn der oxidative Stress abnahm (gemessen im Urin).
Viele Basedow-Patienten haben Augenbeschwerden. Laborversuche zeigen, dass oxidativer Stress und Entzündungen an diesen Prozessen beteiligt sind. Antioxidantien könnten beide Zustände hemmen. Hinweise liegen aus Untersuchungen im Labor vor für Beta-Carotin, Vitamin C, Quercetin, Curcumin, Resveratrol, Grüntee-EGCG und zum Teil für N-Acetylcystein (NAC).
Erhöhter oxidativer Stress bei Morbus Basedow wird oft durch Medikamente gesenkt. Antioxidantien könnten die Behandlung unterstützen und Beschwerden zusätzlich lindern. Es liegen bereits ermutigende Studien vor. Für endgültige Beweise ist es noch zu früh. Fest steht aber, dass die Ernährung reich an Antioxidantien sein sollte.
Antioxidantien: Dosierung und Einnahmeempfehlung
Zur Unterstützung der Behandlung von Morbus Basedow empfehlen Mikronährstoff-Experten fast immer ein niedrig dosiertes Kombinationspräparat. Dadurch ergänzen sich die Wirkungen der Antioxidantien. Neben Vitaminen und Mineralstoffen sollten auch sekundäre Pflanzenstoffe enthalten sein. Antioxidantien kommen in Lebensmitteln auch immer in Kombination vor.
Folgende Dosierungen und Kombinationen sind vorgeschlagen:
- Vitamin C: 200 bis 300 Milligramm
- Vitamin E: 20 bis 40 Milligramm
- Coenzym Q10: 50 bis 100 Milligramm
- Curcumin: 15 bis 30 Milligramm
- Grüntee-Extrakt: 60 bis 130 Milligramm (mit 50 bis 100 Milligramm Catechinen)
Die Präparate sollten zum Essen eingenommen werden, damit sich die Verträglichkeit verbessert. Zudem hilft das Fett aus der Mahlzeit die fettlöslichen Wirkstoffe optimal aufzunehmen.
Info
Einige Studien liefern Hinweise, dass bei der Einnahme von Antioxidantien das Gesamt- und das LDL-Cholesterin von Basedow-Patienten ansteigen könnten. Personen mit bereits erhöhten Cholesterinspiegeln sollten daher ihre Werte regelmäßig überprüfen lassen.

Antioxidantien im Labor bestimmen lassen
Antioxidantien und freie Radikale (Oxidantien) müssen im Gleichgewicht sein. Vor allem bei der Einnahme von hoch dosierten Antioxidantien empfiehlt es sich, den antioxidativen Status im Labor bestimmen zu lassen. Er gibt Aufschluss darüber, ob das Verhältnis zwischen freien Radikalen und Antioxidantien ausgeglichen ist.
Normalwerte des Gesamt-Antioxidantienstatus im Blutserum liegen zwischen 1,13 und 1,57 Millimol pro Liter. Das Blutserum ist die Flüssigkeit des Blutes ohne Zellen und ohne Gerinnungsfaktoren. Es gibt aber auch viele andere Untersuchungsmethoden, aus denen sich andere Normalwerte ergeben. Im Zweifelsfall zählen deshalb die Werte, die das Labor vorgibt.
Antioxidantien: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen oder bei Medikamenten
In der Schwangerschaft und Stillzeit wird eine Vitamin-C-Zufuhr von 110 Milligramm beziehungsweise 150 Milligramm empfohlen. Höhere Mengen sollte man zur Sicherheit mit dem Arzt absprechen. Mengen bis 1.800 Milligramm pro Tag sind aber wahrscheinlich sicher. Auch für Coenzym Q10 gilt eine ärztliche Rücksprache. Die Studienlage zu Pflanzenstoffen, etwa aus Curcumin und Grüntee, ist nicht ausreichend, um eine Einnahme von Präparaten bei Schwangeren oder Stillenden bedenkenlos empfehlen zu können.
Da Vitamin C die Eisenaufnahme verbessert, sollten Menschen mit einer Eisenspeicherkrankheit (Hämochromatose) Vitamin C nur unter ärztlicher Aufsicht ergänzen.
Curcumin sollte nicht bei vorhandenen Gallensteinen angewendet werden, da es die Produktion von Gallensäuren anregt. Es könnte zu einem verstopften Gallengang mit starken Schmerzen (Kolik) kommen. Ein „Zuviel“ an Galle kann auch Durchfälle verursachen. Personen, die zu einer Überproduktion an Gallensaft neigen, und Menschen mit akuten Durchfallerkrankungen sollten daher ebenfalls auf Curcumin verzichten.
Coenzym Q10 kann die Wirkung bestimmter Blutgerinnungshemmer herabsetzen. Die Einnahme sollte mit dem Arzt abgesprochen werden. Dies gilt für Cumarin-Derivate (Vitamin-K-Antagonisten) wie Phenprocoumon (Marcumar®, Falithrom®) und Warfarin (Coumadin®).
Personen, die Medikamente zur Regulierung des Blutdrucks wie Captopril (Lopirin Cor®) oder Hydrochlorothiazid (wie Esidrix®) einnehmen, sollten die Einnahme von Coenzym Q10 vorsichtshalber mit dem Arzt absprechen: Es wirkt blutdrucksenkend. Gleiches gilt bei Medikamenten gegen Diabetes, um eine Unterzuckerung zu vermeiden. Coenzym Q10 kann den Blutzuckerspiegel verringern.
Menschen mit Lungenerkrankungen wie Asthma, die Medikamente mit Theophyllin nehmen (Bronchoretard®, Tromphyllin®), sollten kein Coenzym Q10 nehmen. Es verzögert den Abbau des Medikaments.
Pflanzenextrakte können die Wirkung einiger Medikamente verstärken oder abschwächen: Informationen finden sie unter den Artikeln zu Grüntee oder Curcumin.
Antioxidantien wie Vitamin C, Coenzym Q10 und Grüntee-Extrakt können außerdem die Wirkung von Krebsmedikamenten herabsenken, wie die des Blutkrebs-Medikaments Bortezomib (Velcade®) sowie die von Doxorubicin (wie Adriblastin®, Ribodoxo®) und Cisplatin (wie Cis-GRY®). Sie sollten deshalb, während einer solchen Behandlung nur nach Absprache mit dem Arzt eingenommen werden.
Selen schützt die Schilddrüse
Wirkweise von Selen
Bei Morbus Basedow entsteht oxidativer Stress in der Schilddrüse und bei der Überproduktion der Schilddrüsenhormone. Er trägt außerdem zu den hervortretenden Augen und Muskelbeschwerden bei. Selen ist ein unverzichtbarer Bestandteil von körpereigenen antioxidativen Enzymen, die oxidativen Stress abwehren. Darüber hinaus ist Selen Bestandteil von Enzymen zum Auf- und Abbau von Schilddrüsenhormonen. Erst durch eine gute Selenversorgung kann die Schilddrüsenfunktion optimal ablaufen. Nebenbei braucht der Körper Selen, um Entzündungen zu dämpfen.
Nach mehreren Beobachtungsstudien ist der oxidative Stress bei den Betroffenen häufig erhöht. Auch ein niedriger Selenspiegel trat bei Autoimmunerkrankungen wie Morbus Basedow häufig auf.
Selen könnte die Symptome bessern: Zum gezielten Einsatz von Selen bei Morbus Basedow gibt es bereits erste Übersichtsarbeiten. In diesen senkte Selen die Konzentration der Antikörper gegen das Schilddrüsengewebe. Ebenso wurden die Symptome an den Augen gelindert und die Lebensqualität der Betroffenen verbessert. Auch eine schnellere Normalisierung der Schilddrüsenfunktion wurde durch eine Ergänzung der medikamentösen Behandlung mit Selen erzielt.
Die verfügbaren Studien liefern ermutigende Ergebnisse zur Wirkung von Selen. Wenn die Einnahme von Selen gestoppt wurde, hielt die Linderung der Augensymptome sogar in der Regel mindestens zwölf Monate an. In Leitlinien anerkannt ist die Selengabe vorerst aber nur bei Augensymptomen des Morbus Basedow. Bisher wurden jedoch keine negativen Auswirkungen beobachtet. Darum ist die Ergänzung von Selen bei Schilddrüsenerkrankungen einen Versuch wert.
Info
Andere Mineralstoffe wie Zink, Mangan und Kupfer sind ebenfalls für die körpereigenen Entgiftungssysteme wichtig. Diese Systeme greifen ineinander. Darum sollten diese Mineralstoffe grundsätzlich immer gleichzeitig zur Verfügung stehen. Ob bei Basedow häufig ein Mangel dieser Mineralstoffe vorliegt oder eine Störung der antioxidativen Entgiftung, ist aber noch nicht geklärt.
Dosierung und Einnahmeempfehlung von Selen
Für Selen wird in der Mikronährstofftherapie bei Schilddrüsenerkrankungen eine Einnahme von 100 bis 200 Mikrogramm pro Tag empfohlen – idealerweise in Rücksprache mit dem Mikronährstoff-Experten, da Selen auf Dauer überdosiert werden kann. Selen sollte am besten zu einer Mahlzeit eingenommen werden. Dadurch verbessert sich die Verträglichkeit für den Magen.
Tipp
Selen sollte vorzugsweise als anorganische Verbindungen wie Natriumselenat oder -selenit zugeführt werden. Bei organischem Selen, wie Selen-Hefe und Selenomethionin, ist die Gefahr einer Überdosierung deutlich höher. Diese Verbindungen können sich im Körper anreichern. Daher sollten organische Verbindungen auf Dauer deutlich niedriger dosiert werden.
Achten Sie bei Multivitaminpräparaten mit Vitamin C darauf, dass die Verbindung Natriumselenat enthalten ist. Die Aufnahme von Natriumselenit wird durch Vitamin C gehemmt.
Selen im Labor bestimmen lassen
Bei der regelmäßigen Einnahme von Selen sollte die Selenversorgung bestimmt werden, damit es nicht überdosiert wird. Selen sollte idealerweise im Vollblut (mit allen Blutzellen) gemessen werden. Dies ist aussagekräftiger als die Bestimmung im Serum (Blutflüssigkeit). Normale Werte liegen zwischen 120 bis 150 Mikrogramm pro Liter Vollblut.
Selen: zu beachten bei Erkrankungen
Selen sollte bei chronischer Nierenschwäche nicht ohne Blutkontrolle über Präparate eingenommen werden. Schwache Nieren können überschüssiges Selen nicht richtig ausscheiden und die Konzentration im Blut könnte zu stark ansteigen.
Es besteht der Verdacht, dass Selen das Risiko für Diabetes beeinflussen könnte. Zu hohe und zu niedrige Selenwerte sollten deshalb vermieden werden. Ohne Blutkontrolle und Rücksprache mit dem Arzt sollten Menschen mit Diabetes und hohem Diabetesrisiko kein Selen einnehmen.
Bei Krebs und einer Krebstherapie sollte die Einnahme von Selen immer mit dem behandelten Arzt besprochen werden. Der Arzt kann durch entsprechende Blutkontrollen die geeignete Dosis festlegen. Denn in den meisten Fällen sollte bei Krebs sowohl ein Mangel als auch eine Überversorgung mit Selen vermieden werden.
Vitamin D reguliert das Immunsystem
Wirkweise von Vitamin D
Vitamin D reguliert das Immunsystem und spielt eine Rolle bei vielen Autoimmunerkrankungen wie Hashimoto. Bei Morbus Basedow ist laut mehreren Beobachtungsstudien ein Zusammenhang mit einem Vitamin-D-Mangel möglich, jedoch weniger klar. Allerdings könnte eine Verbindung zwischen dem Vitamin-D-Mangel und den Augensymptomen bestehen. Beobachtungsstudien lieferten außerdem Hinweise, dass Vitamin D nach der Behandlung vor Rückfällen schützen könnte.
Bei Morbus Basedow kann der Mineralstoffhaushalt gestört sein, da die Knochen vermehrt umgebaut werden. Dann steigen die Calciumwerte zu hoch an. Vitamin D könnte den Zustand bessern: In einer ersten Studie normalisierten sich die Werte, wenn Vitamin D gegeben wurde. Dies war mit einem Medikament (Methimazol) nicht der Fall. Gebessert hatten sich auch die Schilddrüsenhormone sowie der Antikörperspiegel (TRAP), welche die Schilddrüse zu sehr anregen. Das berichten zwei Vorstudien. Außerdem konnte in einer weiteren Vorstudie eine günstige Wirkung auf die Schilddrüsengröße und die Augensymptome beobachtet werden.
Bei etwa der Hälfte aller Patienten mit Morbus Basedow kommt es nach einer operativen Entfernung der Schilddrüse zu einem krankhaft verminderten Calciumspiegel. Grund ist die Schädigung der Nebenschilddrüse, die für einen ausgeglichenen Calciumspiegel verantwortlich ist. Darum gehören Vitamin D und Calcium zur Standardtherapie. Man vermutet, dass eine vorbeugende Behandlung sowie eine laufende Überwachung der Werte wichtig ist. Häufig können die Werte damit verbessert werden. Das zeigen Übersichtsarbeiten.
Es gibt viele Daten, die auf einen Zusammenhang von Vitamin-D-Mangel und Autoimmunerkrankungen schließen lassen. Vitamin D könnte Symptome bei Morbus Basedow verbessern und Rückfälle vermeiden. Gegen Muskelbeschwerden hilft Vitamin D jedoch nicht, sie könnten sich sogar verschlimmern. Insgesamt sind für die genauere Abklärung der Wirkung weitere Studien notwendig. Da ein Vitamin-D-Mangel bei uns aber sehr häufig ist, kann sich die Einnahme lohnen.
Expertenwissen
Wie gut Vitamin D hilft, könnte auch von der Genetik abhängen. Es gibt nämlich viele Varianten des Vitamin-D-Rezeptors, welcher die Wirkung von Vitamin D auslöst (Andockstelle). So wurde ein Zusammenhang zwischen bestimmten Genotypen des Rezeptors und dem Risiko für Morbus Basedow sowie der Orbitopathie beobachtet.
Dosierung und Einnahmeempfehlung von Vitamin D
Um einem Mangel vorzubeugen, wird empfohlen, 1.000 bis 2.000 Internationale Einheiten Vitamin D einzunehmen. Die genaue Dosierung hängt vom aktuellen Vitamin-D-Spiegel ab, der im Labor bestimmt werden kann.
Generell ist es ratsam, die Einnahme von Vitamin D bei Morbus Basedow mit dem Arzt abzusprechen. Eine Schilddrüsenüberfunktion oder die Behandlung kann den Calciumspiegel entgleisen lassen. Der Arzt muss prüfen, ob Vitamin D den Calciumspiegel normalisiert.
Nach einer Schilddrüsenoperation könnte auch die Ergänzung von Vitamin D zusammen mit Calcium sinnvoll sein. Dies sollte jedoch ein Arzt oder Mikronährstoff-Experte entscheiden und die Mineralstoff- und Nierenwerte überwachen. Nach der Operation steigt das Risiko für Nierensteine und Gewebsverkalkungen. Treten Beschwerden auf, kann die alleinige Gabe von Vitamin D versucht werden.
Vitamin D ist fettlöslich. Es sollte daher für eine bessere Aufnahme im Darm immer zu einer Mahlzeit eingenommen werden.
Tipp
Magnesium beeinflusst ebenfalls den Calciumstoffwechsel. Nach einer Schilddrüsenoperation fallen auch die Magnesiumwerte. Dies kann erniedrigten Calciumspiegeln (Hypocalcämie) vorangehen. Daher sollten auch diese beiden Mineralstoffe immer im Gleichgewicht gehalten werden. Dies könnte die Erholung nach der Operation beschleunigen.
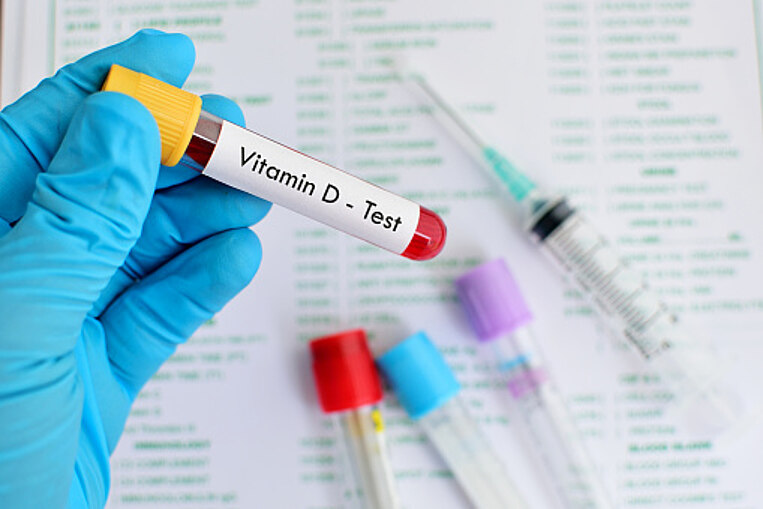
Vitamin D im Labor bestimmen lassen
Am besten lässt man seinen Vitamin-D-Spiegel zweimal im Jahr bestimmen. Im Labor wird dann die Transportform im Blutserum gemessen – das sogenannte 25(OH)-Vitamin D. Für einen bestmöglichen gesundheitlichen Nutzen sollte der Wert zwischen 40 und 60 Nanogramm pro Milliliter liegen. Es kann vorkommen, dass sich die Vitamin-D-Werte im Blut je nach Labor unterscheiden. Deshalb empfiehlt es sich zur Kontrolle des Verlaufs, Vitamin D immer im selben Labor untersuchen zu lassen.
Da bei Morbus Basedow der Calciumhaushalt oft gestört ist und Vitamin D zu einem Anstieg des Calciumspiegels führen kann, ist es sinnvoll bei einer Ergänzung auch die Blutwerte von Calcium zu überwachen. Calcium wird im Blutplasma bestimmt, das ist der flüssige Teil des Blutes ohne Zellen. Eine Calciumkonzentration zwischen 2,2 und 2,65 Millimol pro Liter ist im Gleichgewicht.
Vitamin D: zu beachten bei Erkrankungen und Medikamenten
Bei einigen Krankheiten ist ein gestörter Calcium- und Phosphatstoffwechsel möglich, zum Beispiel bei der Bindegewebserkrankung Sarkoidose.sowie einer Nebenschilddrüsenüberfunktion. Betroffene sollten dann Vitamin D nur unter ärztlicher Kontrolle ergänzen.
Nierenpatienten sollten Vitamin D nur einnehmen, wenn bei ihnen ein Mangel nachgewiesen wurde und der Arzt die Calciumwerte kontrolliert. Bei ihnen kann der Calciumhaushalt gestört sein. Zu hohe Calciumwerte sind möglich. Es würde zu einer Überdosierung führen. Auch Personen mit Nierensteinen (calciumhaltige Steine) müssen aufpassen.
Bestimmte Entwässerungsmedikamente (Thiazide) senken die Calciumausscheidung über die Nieren. Vitamin D sollte nur gemeinsam mit Thiaziden eingenommen werden, wenn der Calciumspiegel regelmäßig kontrolliert wird. Dazu gehören Hydrochlorothiazid (Disalunil®, Esidrix®), Indapamid (zum Beispiel Inda Puren®, Sicco®) und Xipamid (zum Beispiel Aquaphor®, Neotri®).
Dosierungen auf einen Blick
Empfehlung pro Tag bei Morbus Basedow | |
|---|---|
Vitamine | |
Vitamin C | 200 bis 300 Milligramm (mg) |
Vitamin E | 20 bis 40 Milligramm |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten (IE) oder je nach Blutspiegel |
Mineralstoffe | |
Selen (als Natriumselenat oder -selenit) | 100 bis 200 Mikrogramm (µg) |
Sonstige Nährstoffe und Pflanzenstoffe | |
Coenzym Q10 | 50 bis 100 Milligramm |
Curcumin | 15 bis 30 Milligramm |
Grüntee-Extrakt | 60 bis 130 Milligramm |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei Morbus Basedow | |
|---|---|
Normalwerte | |
Gesamt-Antioxidantienstatus (Serum) | 1,13 bis 1,57 Millimol pro Liter (mmol/l) oder je nach Labor |
Selen (Vollblut) | 120 bis 150 Mikrogramm pro Liter (µg/l) |
Vitamin D (Serum) | 40 bis 60 Nanogramm pro Milliliter (ng/ml) |
Calcium (Plasma) | 2,2 und 2,65 Millimol pro Liter |
Unterstützung von Medikamenten mit Mikronährstoffen
Antioxidantien verbessern die Wirkung von Medikamenten bei Schilddrüsenüberfunktion
Antioxidantien, wie Selen, unterstützen die Wirkung des Thyreostatikums Methimazol. In ersten Studien konnte die Ergänzung von Selen zusammen mit Methimazol die Schilddrüsenhormone und -antikörper stärker senken als Methimazol allein. Daher vermuten Forscher, dass diese Kombination die Schilddrüsenaktivität verbessert. Eine hochwertige Studie hat dies jedoch nicht bestätigt. Allerdings könnten die Probanden bereits ausreichend mit Selen versorgt gewesen sein. Personen, die keinen Selenmangel hatten, profitierten nämlich nicht.
Mikronährstoff-Experten empfehlen begleitend zu Thyreostatika meist ein Kombinationspräparat – zum Beispiel mit 100 bis 200 Mikrogramm Selen, 200 bis 300 Milligramm Vitamin C und 20 bis 40 Milligramm Vitamin E.
Vitamin D könnte die Thyreostatika-Wirkung verbessern
Auch Vitamin D könnte die Wirkung von Methimazol verbessern. In einer hochwertigen Studie verringerte Vitamin D in Kombination mit dem Medikament die Schilddrüsengröße und linderte die Augenbeschwerden. Dabei wurde monatlich hoch dosiertes Vitamin D in den Muskel gespritzt. Die Behandlung erfolgte drei Monate und wurde mit einer alleinigen Therapie mit Methimazol verglichen. In einer kleinen hochwertigen Studie schlug außerdem die Therapie mit Methimazol schneller an, wenn ein Mangel an Vitamin D und Selen ausgeglichen worden war.
Auf die Muskelfunktion hatte Vitamin D in einer weiteren hochwertigen Studie begleitend zu Medikamenten jedoch keinen Effekt. Im Gegenteil: Eine Verbesserung der Muskelfunktion wurde verhindert. Woran dies liegt, ist unklar.
Vitamin D könnte positiv auf die medikamentöse Behandlung des Morbus Basedow wirken. Aufgrund von möglichen Nebenwirkungen sollte die Vitamin-D-Dosierung jedoch zwischen 1.000 und 2.000 Internationalen Einheiten pro Tag liegen. Bei höheren Dosierungen ist bei Morbus Basedow die Rücksprache mit einem Mikronährstoff-Experten angeraten.
Calcium und Vitamin D lindern Nebenwirkungen von Cortison
Bei Schwellungen oder Symptomen der Augen durch Morbus Basedow wird Cortison eingesetzt. Die Medikamente unterdrücken das Immunsystem und wirken entzündungshemmend. Allerdings stört Cortison den Calciumstoffwechsel. Wenn es über längere Zeit eingenommen wird, kann es zu einem Calciummangel kommen: Cortison verursacht eine verminderte Calciumaufnahme über den Darm sowie eine vermehrte Ausscheidung über die Nieren.
Eine dauerhafte Cortisoneinnahme führt zu einem gestörten Knochenstoffwechsel. Dadurch steigt das Risiko für Osteoporose. Daher ist beim längeren Einsatz von Cortison eine Calciumeinnahme (1.000 Milligramm) zu empfehlen. Damit Calcium gut aufgenommen wird, sollte der Körper ausreichend mit Vitamin D versorgt sein. Sinnvoll sind 1.000 und 2.000 Internationale Einheiten pro Tag.
Da Calcium nach einer Schilddrüsenoperation nicht immer verträglich ist, sollte ein Arzt über die Einnahme entscheiden und die Werte überwachen.
Tipp
Für gesunde Knochen ist außerdem Vitamin K wichtig – vor allem die Unterform K2. Es sorgt dafür, dass Calcium in die Knochen eingelagert wird.
Dosierungen auf einen Blick
Mikronährstoffempfehlung pro Tag bei Medikamenten | |
|---|---|
Methimazol | |
Selen | 100 bis 200 Mikrogramm (µg) |
Vitamin C | 200 bis 300 Milligramm (mg) |
Vitamin E | 20 bis 40 Milligramm |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten (IE) oder je nach Blutspiegel |
Cortison | |
Calcium | 1.000 Milligramm |
Vitamin D | 1.000 bis 2.000 Internationale Einheiten oder je nach Blutspiegel |
Zusammenfassung
Morbus Basedow ist eine Autoimmunerkrankung. Das Immunsystem bildet dabei Antikörper gegen das Gewebe der Schilddrüse. Sie regen die Schilddrüse an, vermehrt Schilddrüsenhormone zu bilden. Es kommt zu einer Schilddrüsenüberfunktion.
Morbus Basedow kann medikamentös behandelt werden. Mikronährstoffe unterstützen dies, zum Beispiel kann oxidativer Stress durch Antioxidantien gelindert werden. Wichtig sind Vitamin C, Vitamin E, Coenzym Q10 und Pflanzenstoffe. Antioxidantien könnten außerdem Symptome von Morbus Basedow lindern – vor allem Beschwerden an den Augen. Auch Selen schützt die Schilddrüse vor Angriffen des Immunsystems und vor oxidativem Stress. Zudem ist Selen unentbehrlich für den Auf- und Abbau von Schilddrüsenhormonen.
Betroffene haben oft einen Vitamin-D-Mangel. Vitamin D ist wichtig zur Regulation des Immunsystems und des Calciumspiegels. Man vermutet, dass die Ergänzung von Vitamin D Morbus Basedow verbessern und Rückfälle vermeiden könnte. Auch nach Operationen könnte es helfen, den Calciumspiegel zu normalisieren.
Daneben kann man die Wirkung der Medikamente (Thyreostatika) bei Morbus Basedow durch Mikronährstoffe unterstützen. Antioxidantien, wie Selen, Vitamin C und E, verringern oxidativen Stress. Cortison wird zur Linderung der Augenbeschwerden eingesetzt – allerdings oft mit Nebenwirkungen: Auf Dauer stört Cortison den Knochenstoffwechsel. Calcium in Kombination mit Vitamin D kann diesen Nebenwirkungen entgegenwirken.
Verzeichnis der Studien und Quellen
Al-Sharefi, A. et al. (2019): Is calcium supplementation always needed in patients with hypoparathyroidism? Clin Endocrinol (Oxf). 2019 Jun;90(6):775-80. https://pubmed.ncbi.nlm.nih.gov/30801749/, abgerufen am 16.07.2023.
Annerbo, M. et al. (2014): Left-shifted relation between calcium and parathyroid hormone in Graves' disease. J Clin Endocrinol Metab 2014 Feb;99(2):545-51. https://www.ncbi.nlm.nih.gov/pubmed/24248181, abgerufen am 08.05.2020.
Antonelli, A. et al. (2020): Graves' disease: Epidemiology, genetic and environmental risk factors and viruses. Best Pract Res Clin Endocrinol Metab. 2020 Jan;34(1):101387. https://pubmed.ncbi.nlm.nih.gov/32107168/, abgerufen am 16.07.2023.
Ashraff, S. et al. (2016): Vitamin D supplementation in Graves' disease and risk of relapse. Society for Endocrinology 2016 Nov;44 BioScientifica:257. https://www.endocrine-abstracts.org/ea/0044/ea0044p257, abgerufen am 08.05.2020.
Baltaci, A.K. et al. (2019): Review: The role of zinc in the endocrine system. Park j Pharm Sci 2019 Jan;32(1):231-9. https://www.ncbi.nlm.nih.gov/pubmed/30772815, abgerufen am 08.05.2020.
Bednarczuk, T. & Schomburg L. (2020): Challenges and perspectives of selenium supplementation in Graves’ disease and orbitopathy. Hormones (Athens) 2020 Nov;19(1):31-39. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7033064, abgerufen am 08.05.2020.
Bednarczuk, T. & Schomburg, L. (2020): Challenges and perspectives of selenium supplementation in Graves' disease and orbitopathy. Hormones (Athens). 2020 Mar;19(1):31-9. https://pubmed.ncbi.nlm.nih.gov/31721133/, abgerufen am 16.07.2023.
Bianchi, G. et al. (1999): Oxidative stress and anti-oxidant metabolites in patients with hyperthyroidism: effect of treatment. Horm Metab Res 1999 Nov;31(11):620-4. https://www.ncbi.nlm.nih.gov/pubmed/10598831, abgerufen am 08.05.2020.
Chen, K. et al. (2017): Hyperthyroidism-associated hypercalcemic crisis. A case report and review of the literature. Medicine (Baltimore) 2017 Jan;96(4):e6017. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5287984/, abgerufen am 08.05.2020.
Chen, M.D. et al. (2000): Leptin concentration and the Zn/Cu ratio in plasma in women with thyroid disorder. Biol Trace Elem Res 2000 Jun;75(1-3):99-105. https://www.ncbi.nlm.nih.gov/pubmed/11051600, abgerufen am 08.05.2020.
Chincholikar, S.P. & Ambiger, S. (2018): Association of Hypomagnesemia with Hypocalcemia after Thyroidectomy. Indian J Endocrinol Metab. 2018 Sep-Oct;22(5):656-60. https://pubmed.ncbi.nlm.nih.gov/30294577/, abgerufen am 16.07.2023.
Cho, Y.Y. & Chung, Y.J. (2020): Vitamin D supplementation does not prevent the recurrence of Graves’ disease. Sci Rep 2020 Jan; 10(1):1-7. https://www.nature.com/articles/s41598-019-55107-9, abgerufen am 08.05.2020.
Deutsche Gesellschaft für Endokrinologie (2016-2020): Morbus Basedow. https://www.endokrinologie.net/krankheiten-schilddruese-basedow.php, abgerufen am 08.05.2020.
Deutsche Gesellschaft für Endokrinologie (Hrsg.) (o.J.): Morbus Basedow. https://www.endokrinologie.net/krankheiten-schilddruese-basedow.php, abgerufen am 16.07.2023.
Donahue, C. et al. (2021): Does Preoperative Calcium and Calcitriol Decrease Rates of Post-Thyroidectomy Hypocalcemia? A Randomized Clinical Trial. J Am Coll Surg. 2021 Jun;232(6):848-54. https://pubmed.ncbi.nlm.nih.gov/33631337/, abgerufen am 16.07.2023.
Edafe, O. et al. (2014): Systematic review and meta-analysis of predictors of post-thyroidectomy hypocalcaemia. Br J Surg 2014 Mar;101(4):307-20. https://www.ncbi.nlm.nih.gov/pubmed/24402815, abgerufen am 08.05.2020.
Erdamer, H. et al. (2008): The effect of hypothyroidism, hyperthyroidism, and their treatment on parameters of oxidative stress and antioxidant status. Clin Chem Lab Med 2008 May; 46(7):1004-10. https://www.ncbi.nlm.nih.gov/pubmed/18605962, abgerufen am 08.05.2020.
Gallo, D. et al. (2022): Add-On Effect of Selenium and Vitamin D Combined Supplementation in Early Control of Graves' Disease Hyperthyroidism During Methimazole Treatment. Front Endocrinol (Lausanne). 2022 Jun 15;13:886451. https://pubmed.ncbi.nlm.nih.gov/35784564/, abgerufen am 16.07.2023.
Grove-Laugesen, D. et al. (2020): Effects of Supplemental Vitamin D on Muscle Performance and Quality of Life in Graves' Disease: A Randomized Clinical Trial. Thyroid. 2020 May;30(5):661-71. https://pubmed.ncbi.nlm.nih.gov/31910101/, abgerufen am 16.07.2023.
Grove-Laugesen, D. et al. (2020): Effects of Supplemental Vitamin D on Muscle Performance and Quality of Life in Graves' Disease: A Randomized Clinical Trial. Thyroid 2020 Feb. https://www.ncbi.nlm.nih.gov/pubmed/31910101, abgerufen am 08.05.2020.
Grzegory, A. & Pomorski, L. (2018): Perioperative calcium and vitamin D supplementation in patients undergoing thyroidectomy - literature review. Pol Przegl Chir. 2018 Jun 13;90(4):46-50. https://pubmed.ncbi.nlm.nih.gov/30220675/, abgerufen am 16.07.2023.
Guerra, L.N. et al. (2005): Antioxidants and methimazole in the treatment of Graves' disease: effect on urinary malondialdehyde levels. Clin Chim Acta 2005 Feb;352(1-2):115-20. https://www.ncbi.nlm.nih.gov/pubmed/15653105, abgerufen am 08.05.2020.
Hammerstad, S.S. et al. (2013): Excessive decrease in serum magnesium after total thyroidectomy for Graves' disease is related to development of permanent hypocalcemia. World J Surg. 2013 Feb;37(2):369-75. https://pubmed.ncbi.nlm.nih.gov/23188529/, abgerufen am 16.07.2023.
He, M. et al. (2020): The potential markers involved in newly diagnosed graves' disease and the development of active graves' orbitopathy. Cytokine 2020 Mar;127:154998. https://www.ncbi.nlm.nih.gov/pubmed/31972501, abgerufen am 08.05.2020.
Heisel, C.J. et al. (2020): Serum Vitamin D Deficiency Is an Independent Risk Factor for Thyroid Eye Disease. Ophthalmic Plast Reconstr Surg. 2020 Jan/Feb;36(1):17-20. https://pubmed.ncbi.nlm.nih.gov/31568022/, abgerufen am 16.07.2023.
Hillary, S.L. et al. (2022): Quality of Life in Post-Surgical Hypoparathyroidism (PoSH) in Thyroid and Parathyroid Surgery. World J Surg. 2022 Dec;46(12):3025-33. https://pubmed.ncbi.nlm.nih.gov/36184675/, abgerufen am 16.07.2023.
Hillary, S.L. et al. (2022): Quality of Life in Post-Surgical Hypoparathyroidism (PoSH) in Thyroid and Parathyroid Surgery. World J Surg. 2022;46(12):3025–33. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9636109/, abgerufen am 16.07.2023.
Kahaly, G.J. et al. (2017): Double-Blind, Placebo-Controlled, Randomized Trial of Selenium in Graves Hyperthyroidism. J Clin Endocrinol Metab. 2017 Nov 1;102(11):4333-41. https://pubmed.ncbi.nlm.nih.gov/29092078/, abgerufen am 16.07.2023.
Kaur, A. et al. (2010): Oxidative stress profile in graves' ophthalmopathy in Indian patients. Orbit 2010 Apr;29(2):97-101. https://www.ncbi.nlm.nih.gov/pubmed/20394549, abgerufen am 08.05.2020.
Khozam, S.A. et al. (2022): Association Between Vitamin D Deficiency and Autoimmune Thyroid Disorder: A Systematic Review. Cureus. 2022 Jun 12;14(6):e25869. https://pubmed.ncbi.nlm.nih.gov/35836431/, abgerufen am 16.07.2023.
Kim, C.Y. et al. (2015): Therapeutic Effect of Resveratrol on Oxidative Stress in Graves' Orbitopathy Orbital Fibroblasts. Invest Ophthalmol Vis Sci 2015 Oct;56(1):6352-61. https://www.ncbi.nlm.nih.gov/pubmed/26436888, abgerufen am 08.05.2020.
Kim, D. (2017): The Role of Vitamin D in Thyroid Diseases. Int J Mol Sci. 2017 Sep; 18(9):1949. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5618598/, abgerufen am 16.07.2023.
Lanzolla, G. et al. (2020): Antioxidant Therapy in Graves' Orbitopathy. Front Endocrinol (Lausanne). 2020 Dec 14;11:608733. https://pubmed.ncbi.nlm.nih.gov/33381085/, abgerufen am 16.07.2023.
Lanzolla, G. et al. (2020): Cholesterol Serum Levels and Use of Statins in Graves' Orbitopathy: A New Starting Point for the Therapy. Front Endocinol (Lausanne) 2020 Jan; 10:933. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6987298/, abgerufen am 08.05.2020.
Lanzolla, G. et al. (2021): Selenium in the Treatment of Graves' Hyperthyroidism and Eye Disease. Front Endocrinol (Lausanne). 2021 Jan 26;11:608428. https://pubmed.ncbi.nlm.nih.gov/33574798/, abgerufen am 16.07.2023.
Lee, J.S. et al. (2019): Therapeutic Effect of Curcumin, a Plant Polyphenol Extracted From Curcuma longae, in Fibroblasts From Patients With Graves' Orbitopathy. Invest Ophthalmol Vis Sci 2019 Oct;60(13):4129-40. https://www.ncbi.nlm.nih.gov/pubmed/31593984, abgerufen am 08.05.2020.
Lee, J.Y. et al. (2016): The Effect of (-)-Epigallocatechin-3-Gallate on IL-1β Induced IL-8 Expression in Orbital Fibroblast from Patients with Thyroid-Associated Ophthalmopathy. PLoS One 2016 Feb; 11(2):e018645. https://www.ncbi.nlm.nih.gov/pubmed/26848751, abgerufen am 08.05.2020.
Leo, M. et al. (2017): Effects of selenium on short-term control of hyperthyroidism due to Graves' disease treated with methimazole: results of a randomized clinical trial. J Endocrinol Invest. 2017 Mar;40(3):281-7. https://pubmed.ncbi.nlm.nih.gov/27734319/, abgerufen am 16.07.2023.
Liu, R. H. et al. (2020): Association of Hypocalcemia and Magnesium Disorders With Thyroidectomy in Commercially Insured Patients. JAMA Otolaryngol Head Neck Surg. 2020 Mar 1;146(3):237-46. https://pubmed.ncbi.nlm.nih.gov/31917427/, abgerufen am 16.07.2023.
Maciejewski, A. et al. (2020): The Role of Vitamin D Receptor Gene Polymorphisms in Thyroid-Associated Orbitopathy. Ocul Immunol Inflamm 2020 Apr;28(3):354-61. https://www.ncbi.nlm.nih.gov/pubmed/31424978, abgerufen am 08.05.2020.
Mangaraj, S. et al. (2019): Evaluation of Vitamin D Status and its Impact on Thyroid Related Parameters in New Onset Graves' Disease- A Cross-sectional Observational Study. Indian J Endocrinol Metab 2019 Jan;23(1):35-9. https://www.ncbi.nlm.nih.gov/pubmed/31016150, abgerufen am 08.05.2020.
Marinò, M. et al. (2018): Mechanistic Pathways of Selenium in the Treatment of Graves' Disease and Graves' Orbitopathy. Horm Metab Res 2018 Dec;50(12):887-93. https://www.ncbi.nlm.nih.gov/pubmed/30096720, abgerufen am 08.05.2020.
Mei, X. et al. (2021): Prevalence of hyperthyroidism with hypercalcemia in Xindu district and the efficacy of vitamin D3 treatment in these patients: a randomized trial. Ann Palliat Med. 2021 Sep;10(9):9640-9. https://pubmed.ncbi.nlm.nih.gov/34628889/, abgerufen am 16.07.2023.
Mihai, R. & Thakker, R.V. (2021): MANAGEMENT OF ENDOCRINE DISEASE: Postsurgical hypoparathyroidism: current treatments and future prospects for parathyroid allotransplantation. Eur J Endocrinol. 2021 May; 184(5):R165–R175. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8052514/, abgerufen am 16.07.2023.
Planck, T. et al. (2018): Vitamin D in Graves Disease: Levels, Correlation with Laboratory and Clinical Parameters, and Genetics. Eur Thyroid J 2018 Jan;7(1):27-33. https://www.karger.com/Article/Fulltext/484521, abgerufen am 08.05.2020.
Rotondi, M. & Chiovato L. (2013): Vitamin D deficiency in patients with Graves’ disease: probably something more than a casual association. Endocrine 2012 Aug;43;3-5. https://link.springer.com/article/10.1007/s12020-012-9776-y, abgerufen am 08.05.2020.
Rotondo Dottore, G. et al. (2018): Action of three bioavailable antioxidants in orbital fibroblasts from patients with Graves' orbitopathy (GO): a new frontier for GO treatment? J Endocrinol Invest 2018 Feb;41 (2):193-201. https://www.ncbi.nlm.nih.gov/pubmed/28656526, abgerufen am 08.05.2020.
Rotondo Dottore, G. et al. (2018): Antioxidant effects of β-carotene, but not of retinol and vitamin E, in orbital fibroblasts from patients with Graves' orbitopathy (GO). J Endocrinol Invest 2018 Jul;41(7):815-20. https://www.ncbi.nlm.nih.gov/pubmed/29256181, abgerufen am 08.05.2020.
Rowe, C.W. et al. (2019): High-dose preoperative cholecalciferol to prevent post-thyroidectomy hypocalcaemia: A randomized, double-blinded placebo-controlled trial. Clin Endocrinol (Oxf= 2019 Feb;90(2):343-50. https://www.ncbi.nlm.nih.gov/pubmed/30387163, abgerufen am 08.05.2020.
Sessa, L. et al. (2022): Post-thyroidectomy hypocalcemia: Is a routine preferable over a selective supplementation? Am J Surg. 2022 Jun;223(6):1126-31. https://pubmed.ncbi.nlm.nih.gov/34711410/, abgerufen am 16.07.2023.
Sheriba, N.A. et al. (2017): Effect of vitamin D 3 in treating hyperthyroidism in patients with graves’ disease. The Egyptian Journal of Internal Medicine 2017 Jan;29:64–70. https://www.researchgate.net/publication/319105652, abgerufen am 08.05.2020.
Suwannasarn, M. et al. (2017): Single measurement of intact parathyroid hormone after thyroidectomy can predict transient and permanent hypoparathyroidism: a prospective study. Asian J Surg 2017 Sep; 40(5):350-6. https://www.ncbi.nlm.nih.gov/pubmed/26780986, abgerufen am 08.05.2020.
Taheriniya, S. et al. (2021): Vitamin D and thyroid disorders: a systematic review and Meta-analysis of observational studies. BMC Endocr Disord. 2021 Aug 21;21(1):171. https://pubmed.ncbi.nlm.nih.gov/34425794/, abgerufen am 16.07.2023.
Tsai, C.C. et al. (2011): Increased response to oxidative stress challenge in Graves' ophthalmopathy orbital fibroblasts. Mol Vis 2011 Oct;17:2782-8. https://www.ncbi.nlm.nih.gov/pubmed/22065933, abgerufen am 08.05.2020.
Tsai, C.C. et al. (2013): The protective effect of antioxidants on orbital fibroblasts from patients with Graves' ophthalmopathy in response to oxidative stress. Mol Vis 2013 Apr; 19:927-34. https://www.ncbi.nlm.nih.gov/pubmed/23687429, abgerufen am 08.05.2020.
Valea, A. & Georgescu, C.E. (2018): Selenoproteins in human body: focus on thyroid pathophysiology. Hormones (Athens) 2018 Jun;17(2):183-96. https://www.ncbi.nlm.nih.gov/pubmed/29873029, abgerufen am 08.05.2020.
Veneti, S. et al. (2019): Association between vitamin D receptor gene polymorphisms and Graves' disease: a systematic review and meta-analysis. Endocrine. 2019 Aug;65(2):244-51. https://pubmed.ncbi.nlm.nih.gov/30924084/, abgerufen am 16.07.2023.
Veneti, S. et al. (2019): Association between vitamin D receptor gene polymorphisms and Graves' disease: a systematic review and meta-analysis. Endocrine 2019 Aug;65(2):244-51. www.ncbi.nlm.nih.gov/pubmed/30924084, abgerufen am 08.05.2020.
Vieira, I.H. et al. (2020): Vitamin D and Autoimmune Thyroid Disease-Cause, Consequence, or a Vicious Cycle? Nutrients. 2020 Sep 11;12(9):2791. https://pubmed.ncbi.nlm.nih.gov/32933065/, abgerufen am 16.07.2023.
Vondra, K. et al. (2015): Vitamin D and thyroid diseases. Physiol Res 2015 Jun; 64(2):95-100. https://www.ncbi.nlm.nih.gov/pubmed/26680495, abgerufen am 08.05.2020.
Vrca, V.B. et al. (2012): Antioxidant supplementation and serum lipids in patients with Graves' disease: effect on LDL-cholesterol. Acta Pharm 2012 Mar;62(1):155-22. https://www.ncbi.nlm.nih.gov/pubmed/22472454, abgerufen am 08.05.2020.
Winther, K.H. et al. (2020): Selenium in thyroid disorders - essential knowledge for clinicians. Nat Rev Endocrinol. 2020 Mar;16(3):165-76. https://pubmed.ncbi.nlm.nih.gov/32001830/, abgerufen am 16.07.2023.
Winther, K.H. et al. (2020): Selenium in thyroid disorders - essential knowledge for clinicians. Nat Rev Endocrinol 2020 Mar;16(3):165-76. https://www.ncbi.nlm.nih.gov/pubmed/32001830, abgerufen am 08.05.2020.
Xu, B. et al. (2019): A pilot study on the beneficial effects of additional selenium supplementation to methimazole for treating patients with Graves’ disease. Turk J Med Sci. 2019 Jun 18;49(3):715-22. https://pubmed.ncbi.nlm.nih.gov/31023005/, abgerufen am 16.07.2023.
Xu, B. et al. (2019): A pilot study on the beneficial effects of additional selenium supplementation to methimazole for treating patients with Graves’ disease. Truk J Med Sci 2019 Jun;49(3):715-22. https://www.ncbi.nlm.nih.gov/pubmed/31023005, abgerufen am 08.05.2020.
Yoon, J.S. et al. (2013): Cigarette smoke extract-induced adipogenesis in Graves' orbital fibroblasts is inhibited by quercetin via reduction in oxidative stress. J Endocrinol 2013 Jan; 216(2):145-56. https://www.ncbi.nlm.nih.gov/pubmed/23143154, abgerufen am 08.05.2020.
Yoshida, K. (2007): [Erythrocyte carbonic anhydrase I and zinc concentrations in thyrotoxicosis reflect integrated thyroid hormone levels over the previous few months]. Rinsho Byori 2007 Jun;55(6):560-5. https://www.ncbi.nlm.nih.gov/pubmed/17657991, abgerufen am 08.05.2020.
Zawadzka-Starczewska, K. et al. (2022): Novel Insight into Non-Genetic Risk Factors of Graves' Orbitopathy. Int J Environ Res Public Health. 2022 Dec 16;19(24):16941. https://pubmed.ncbi.nlm.nih.gov/36554821/, abgerufen am 16.07.2023.
Zheng, H. et al. (2018): Effects of Selenium Supplementation on Graves' Disease: A Systematic Review and Meta-Analysis. Evid Based Complement Alternat Med. 2018 Sep 26;2018:3763565. https://pubmed.ncbi.nlm.nih.gov/30356415/, abgerufen am 16.07.2023.
Zieren, H.U. (o.J.): Autoimmunkrankheit Morbus Basedow. Deutsches Schilddrüsenzentraum GmbH (Hrsg.). https://www.deutsches-schilddruesenzentrum.de/wissenswertes/schilddruesenerkrankungen/morbus-basedow/, abgerufen am 08.05.2020.