Bei einer Dünndarmfehlbesiedlung sind Bakterien im Dünndarm angesiedelt, die eigentlich im Dickdarm vorkommen. Der Dünndarm ist dafür jedoch nicht ausgestattet. Es kann daher zu verschiedenen Bauchbeschwerden wie Durchfall kommen. Auch ist ein allgemeines Unwohlsein möglich. Die Fehlbesiedlung verursacht zudem oft einen Mangel an bestimmten Mikronährstoffen – vor allem an Vitaminen. Lesen Sie hier, wie Sie die Beschwerden mithilfe der Mikronährstoffmedizin lindern und einen Mangel ausgleichen können.

Ursachen und Symptome
Definition
Bei einer Dünndarmfehlbesiedlung ist die Darmflora (Mikrobiota) im Dünndarm gestört: Es haben sich zu viele oder „falsche“ Bakterien aus dem Dickdarm angesiedelt. Normalerweise kommen im Dünn- und Dickdarm unterschiedliche Bakterien vor. Von Natur aus ist der Dünndarm weniger stark besiedelt.Bei einer Dünndarmfehlbesiedlung ist die Darmflora (Mikrobiota) im Dünndarm gestört: Es haben sich zu viele oder „falsche“ Bakterien aus dem Dickdarm angesiedelt. Normalerweise kommen im Dünn- und Dickdarm unterschiedliche Bakterien vor. Von Natur aus ist der Dünndarm weniger stark besiedelt.
Eine Dünndarmfehlbesiedlung wird oft als „SIBO“ bezeichnet. SIBO ist die englische Abkürzung für „small intestinal bacterial overgrowth“. Die Übersetzung lautet „bakterielle Überwucherung des Dünndarms“. Im Deutschen hat sich der Begriff „Dünndarmfehlbesiedlung“ („DDFB“) eingebürgert.
Tipp
Es gibt verschiedene Arten der Fehlbesiedelung. Neben der Dünndarmfehlbesiedelung kennt man auch eine Dickdarmfehlbesiedelung oder Darmpilz. Informationen zur Mikronährstoffmedizin bei einer Dickdarmfehlbesiedelung finden Sie im Text „Darmflora-Störung“.
Ursachen
Die Ursachen können Medikamente, Erkrankungen oder Operationen sein. Eine Dünndarmfehlbesiedlung tritt auf, wenn bestimmte Körperfunktionen nicht reibungslos funktionieren – zum Beispiel:
- Schwache Entkeimung: Magensäure und Gallenflüssigkeit haben antibakterielle Wirkungen. Einige Medikamente hemmen die Säureproduktion im Magen, zum Beispiel Säureblocker wie Omeprazol (zum Beispiel Antra MUPS®) oder H2-Rezeptor-Antagonisten wie Cimetidin (zum Beispiel CimLich®). Auch Erkrankungen der Gallenblase können SIBO auslösen.
- Gestörte Darmbewegungen: Darmbewegungen verhindern, dass sich im Dünndarm zu viele Bakterien befinden, denn Bakterien werden mit dem Stuhl ausgeschieden. Ist die Darmbewegung zu schwach oder erfolgt sie in die falsche Richtung, kommt es zu Störungen. Dies ist möglich bei Nervenerkrankungen, Schilddrüsenunterfunktion, Diabetes, Alkoholkrankheit, chronischem Durchfall, Verstopfung, Reizdarm, Leberzirrhose oder Organversagen. Auch im Alter oder nach bariatrischen Operationen wie Magenverkleinerungen kann es zu Störungen kommen.
- Darmflora-Störung: Für die Abwehr krankmachender Bakterien sowie für die Bildung von Abwehrzellen ist eine gesunde Darmflora unerlässlich. Ein geschwächtes Immunsystem begünstigt die Fehlbesiedelung. Ebenso verschiebt eine Behandlung mit Antibiotika das bakterielle Gleichgewicht manchmal.
- Anatomische Gründe: Dazu gehört eine Schädigung der „Tür“ zwischen Dünn- und Dickdarm. Die sogenannte Ileocoecalklappe schützt davor, dass Bakterien aus dem Dickdarm in den Dünndarm gelangen. Auch können Verengungen, Fisteln oder Divertikel der Grund sein.
- Durchblutungsstörungen: Wenn der Darm schlecht mit Blut versorgt wird, sinkt seine Fähigkeit zur Verteidigung. Deshalb begünstigen Herzerkrankungen und Durchblutungsstörungen SIBO.
- Darmentzündungen: Eine Entzündung schädigt die Darmschleimhaut, sodass Keime häufiger eindringen können. Das betrifft zum Beispiel Colitis ulcerosa, Morbus Crohn oder Zöliakie.
- Schwache Verdauung: Werden zu wenig Enzyme produziert, bleiben Nahrungsbestandteile im Darm liegen. Bakterien nutzen diese und vermehren sich. Dabei entstehen auch Gase und giftige Verbindungen, die den Darm belasten. SIBO tritt zum Beispiel bei Bauchspeicheldrüsenentzündung oder Mukoviszidose auf und wenn bestimmte Zucker nicht verdaut werden können (Laktoseintoleranz, Fruktoseintoleranz (Zöliakie) [Link]).
Symptome und Folgen
Typischerweise haben Betroffene nüchtern kaum Beschwerden – dafür aber vermehrt nach dem Essen. Bakterien aus dem Dickdarm bilden im Dünndarm vor allem Gase. Es kommt zu Blähungen, Blähbauch, Schmerzen, Völlegefühl und Verdauungsbeschwerden. Manchmal treten zudem Durchfall oder Übelkeit auf – in anderen Fällen ist Verstopfung möglich. Betroffene fühlen sich oft schwach.
Da eine intakte Schleimhaut im Dünndarm für die Nährstoffaufnahme sehr wichtig ist, kann es zu einem Mangel kommen. Betroffen sind Kohlenhydrate, Eiweiße und Fette. Doch auch die fettlöslichen Vitamine A, D, E und K können möglicherweise schlechter aufgenommen werden. Zudem kann die Aufnahme von Vitamin B12 eingeschränkt sein.
Verschiedene Erkrankungen hängen mit einer Dünndarmfehlbesiedelung zusammen. Es ist jedoch schwierig zu unterscheiden, ob SIBO die Ursache oder die Folge ist. Dazu gehören:
- Darmerkrankungen: Bakterien-Gifte greifen die Darmschleimhaut an und begünstigen so Reizdarm oder chronisch-entzündliche Darmerkrankungen.
- Unverträglichkeiten: Bei einer Fehlbesiedelung wird die Darmschleimhaut undicht (Leaky-Gut-Syndrom [Link]) und Bakterien sowie ihre Stoffwechselprodukte gelangen ins Blut. Das Risiko für Allergien steigt. Auch kann es zu einer Unverträglichkeit für Nahrungsmittel kommen.
- Nervenkrankheiten und psychische Probleme: Verbindungen aus dem Darm gelangen durch SIBO ins Blut und Gehirn. Man vermutet, dass einige Erkrankungen wie Parkinson, Multiple Sklerose oder Epilepsie dadurch mit ausgelöst werden. Daneben könnte es zu „Brainfog“ oder psychischen Störungen mit Angst und Stress kommen.
- Lebererkrankungen: SIBO belastet die Leber und kann Lebererkrankungen wie Fettleber und Zirrhose begünstigen.
- Entzündliche Erkrankungen: Durch Fehlbesiedelungen kommt es zu stillen Entzündungen, die wiederum das Risiko für Herz-Kreislauf-Erkrankungen, Stoffwechselentgleisungen und Gelenkentzündungen erhöhen.
Ziele der Behandlung
Wie wird eine Dünndarmfehlbesiedlung klassisch behandelt?
Die Behandlung einer Dünndarmfehlbesiedlung beruht auf drei Säulen:
Bekämpfung der Ursachen: Ziel ist es, die Grunderkrankung zu behandeln. Sind Medikamente Auslöser für die Dünndarmfehlbesiedlung, sollten sie – soweit möglich – abgesetzt werden. Darmveränderungen wie Verengungen, Fisteln und Divertikel werden bei Bedarf operativ behandelt.
Medikamentöse Behandlung: Um die „falschen“ Bakterien zu bekämpfen, können Antibiotika wie Erythromycin (zum Beispiel Erythrocin® Neo), Rifaximin (Xifaxan®) oder Metronidazol (zum Beispiel Arilin® und Metronidazol Stada®) verschrieben werden. Wenn nötig, werden auch Mittel gegen die schwache Darmbewegung, gegen Übelkeit und Erbrechen verordnet, zum Beispiel Domperidon (Motilium®).
Ernährungstherapie: Der Verzicht auf bestimmte Kohlenhydrate wird als Unterstützung der Therapie bei Dünndarmfehlbesiedlung vorgeschlagen. Beim „Kohlenhydrat-Fasten“ werden Zuckerarten ausgespart, aus denen Bakterien schnell Energie ziehen. Dies sind sogenannte fermentierte Oligo-, Di- und Monosaccharide sowie Polyole (kurz FODMAP`s). Unverträglich können zum Beispiel Traubenzucker (Glucose), Milchzucker (Lactose) oder Fruchtzucker (Fruktose) sein. Komplexe Kohlehydrate wie Stärke sind meist verträglicher. Eine zertifizierte Ernährungsfachkraft hilft bei der Umstellung.
Ziele der Mikronährstoffmedizin
Die Mikronährstoffmedizin hat das Ziel, eine Unterversorgung mit Mikronährstoffen durch die Dünndarmfehlbesiedlung auszugleichen. Meist empfehlen Experten deshalb ein Kombinationspräparat, das den Bedarf an Vitaminen und Mineralstoffen deckt. Dazu gehören vor allem die fettlöslichen Vitamine A, D, E und K.
Zudem soll die Darmschleimhaut wiederaufgebaut und geschützt werden. Durch den Aufbau der Darmschleimhaut wird eine erhöhte Infektanfälligkeit und das Auftreten von Lebensmittelallergien vermieden.
Weitere wichtige Mikronährstoffe sind:
- Glutamin stärkt die Darmwand.
- Vitamin B12 gleicht einen Mangel aus.
- Omega-3-Fettsäuren sowie Quercetin und Rutin lindern Entzündungen.
- Probiotika verringern eventuell Durchfall, Verstopfung und Schmerzen.
Info
Möglicherweise kann auch eine ballaststoffreiche Ernährung sinnvoll sein. Die Ergänzung von Ballaststoffpräparaten wurde jedoch noch nicht ausreichend untersucht. Ballaststoffe könnten auch einen negativen Effekt auf die Fehlbesiedelung im Dünndarm haben: Forscher fanden bei Menschen, die viele Ballaststoffe zu sich nahmen, eine Fehlbesiedelung.
Zudem ist noch nicht klar, welche Ballaststoffe am besten wären. Möglicherweise haben nur lösliche Ballaststoffe eine Wirkung. Lösliche Ballaststoffe sind beispielsweise Pektine und Beta-Glucane. Einige lösliche Ballaststoffe enthalten jedoch Fruktose (Inulin oder Fructooligosaccharide). Fruktose ist bei einer Dünndarmfehlbesiedelung nicht geeignet (FODMAP-Diät). Für Kleie wurde bisher zum Beispiel kein positiver, aber auch kein negativer Effekt gefunden.
Behandlung mit Mikronährstoffen
Glutamin dichtet die Darmwand ab
Wirkweise von Glutamin
Die Aminosäure Glutamin ernährt die Zellen im Dünndarm (Enterozyten) und fördert ihre Regeneration, wenn sie geschädigt sind. So trägt Glutamin dazu bei, dass der Darm besser abgedichtet ist: Es können weniger Schadstoffe und Bakterien in den Blutkreislauf gelangen und Folgebeschwerden auslösen. Da Glutamin den Immunzellen als Nährstoff dient, fördert es außerdem die Abwehr. In der Summe dürfte es die Barrierefunktion der Darmschleimhaut verbessern.
Vorstudien und teils hochwertige Studien zeigen, dass Glutamin Schleimhautentzündungen verringerte und die Durchlässigkeit der Schleimhaut reduzierte. Das betraf chronische Darmentzündungen, Gallenerkrankungen, Durchblutungsstörungen, Darmschädigung durch einige Schmerzmittel (nicht steroidale Antirheumatika) sowie schwerkranke, mangelernährte Patienten. Allerdings zeigen nicht alle Studien eine Wirkung, wie Forscher in einer Übersichtsarbeit feststellten. Bei Schwerkranken kann zudem eine negative Wirkung nicht ausgeschlossen werden, sodass sie Glutamin nur unter ärztlicher Aufsicht ergänzen sollten.
Glutamin wurde bereits bei verschiedenen Störungen der Darmfunktion untersucht. Studien speziell zu einer Dünndarmfehlbesiedlung fehlen aber bislang. Die Einnahme von Glutamin könnte jedoch dabei helfen, den Darm abzudichten.
Dosierung und Einnahmeempfehlung von Glutamin
Um die Darmwand bei einer Dünndarmfehlbesiedlung zu stärken, empfehlen Mikronährstoff-Experten die Einnahme von 4.000 bis 9.000 Milligramm Glutamin pro Tag. In der Praxis haben sich auch manchmal schon 3.000 Milligramm täglich bewährt.
Die Einnahme erfolgt idealerweise 30 Minuten vor einer Mahlzeit und verteilt auf mehrere Portionen – zum Beispiel morgens, mittags und abends. So kann der Körper Glutamin optimal aufnehmen.
Glutamin: zu beachten bei Erkrankungen
Patienten mit schweren Lebererkrankungen wie einer Leberzirrhose dürfen kein Glutamin einnehmen: Es wird mehr Ammoniak gebildet, was die Erkrankung verschlimmern kann. Schwerkranke Personen (wie Menschen mit Organversagen) dürfen ohne ärztliche Aufsicht kein Glutamin einnehmen. Auch bei Störungen der Nierenfunktion sollte ein Arzt über die Dosis von Glutamin entscheiden. Das Gleiche gilt für Menschen in einem hohen Lebensalter.
Bei Krebs und einer Krebstherapie muss die Einnahme von Glutamin ebenfalls mit dem Arzt abgesprochen werden. Viele Krebszellarten nutzen Glutamin zum Wachstum.
Vitamin-B12-Mangel bei Dünndarmfehlbesiedlung ausgleichen
Wirkweise von Vitamin B12
Vitamin B12 übernimmt zahlreiche Aufgaben im Körper. Es ist zum Beispiel an der Blutbildung beteiligt. Zudem spielt es eine wichtige Rolle für ein funktionierendes Nervensystem: Vitamin B12 wird für die Bildung von Botenstoffen gebraucht und ist mitverantwortlich für den Schutz der Nervenzellen.
Bei einer Dünndarmfehlbesiedlung kommt es oft zu einem Mangel, der sich unter anderem durch Müdigkeit, Konzentrationsstörungen und Taubheitsgefühle zeigt. Grund hierfür ist die verminderte Aufnahme von Vitamin B12 im Darm. Aus Tierstudien weiß man, dass die schädlichen Bakterien bei einer Dünndarmfehlbesiedlung Vitamin B12 verbrauchen. Zusätzlich wird die Aufnahme durch die Darmschädigung erschwert.
Bei Menschen mit Magen-Darm-Erkrankungen sollte die Vitamin-B12-Versorgung immer im Auge behalten werden, um einen Mangel zu vermeiden.
Dosierung und Einnahmeempfehlung von Vitamin B12
Bei einer Dünndarmfehlbesiedlung empfehlen Mikronährstoff-Experten täglich 10 bis 20 Mikrogramm Vitamin B12, um einem Mangel vorzubeugen. Liegt bereits ein Mangel vor, empfiehlt ein Arzt in der Regel bis zum Ausgleich des Mangels eine höhere Dosierung (je nach Ausprägung zwischen 250 und 1.000 Mikrogramm pro Tag).
Idealerweise wird Vitamin B12 als Methylcobalamin eingenommen. Um die Verträglichkeit für den Magen zu erhöhen, ist die Einnahme mit den Mahlzeiten empfehlenswert.
Tipp
Meist liegt ein Vitamin-B12-Mangel nicht allein vor, sondern gemeinsam mit anderen B-Vitaminen wie Folsäure. Deshalb empfehlen Mikronährstoff-Experten zur Basisabsicherung ein Kombinationspräparat mit B-Vitaminen, um einem Mangel bei einer Dünndarmfehlbesiedlung vorzubeugen.
Vitamin B12 im Labor bestimmen lassen
Bei einer länger vorliegenden Dünndarmfehlbesiedlung sollte der Vitamin-B12-Spiegel überprüft werden. Gerade, wenn die Beschwerden über Monate hinweg andauern, leeren sich die Vitamin-B12-Speicher.
Die Versorgung wird idealerweise als Holotranscobalamin (HoloTC) in der Blutflüssigkeit (Serum) gemessen. Dies ist aussagekräftiger als die direkte Messung von Vitamin B12. Liegt der Wert über 54 Pikomol pro Liter, ist die Versorgung ausreichend.
Vitamin B12: zu beachten in der Schwangerschaft und bei Erkrankungen
In der Schwangerschaft sollten hohe Vitamin-B12-Mengen über 5 Mikrogramm nur nach Absprache mit dem Arzt eingenommen werden.
Personen mit Nierenerkrankungen sollten Vitamin B12 nicht in Form von Cyanocobalamin einnehmen, sondern als Methylcobalamin. Cyanocobalamin ist für Nierenpatienten hoch dosiert vermutlich schädlich. Die Verbindung liefert Cyanid, das sich bei kranken Nieren im Körper anreichern kann. Bei Krebs sollte man die Einnahme von Vitamin B12 mit dem Arzt absprechen.
Omega 3 unterstützt die Bildung von gesundheitsfördernden Bakterien im Dünndarm
Wirkweise von Omega-3-Fettsäuren
Omega-3-Fettsäuren sind für ihre entzündungslindernde Wirkung bekannt. Sie können aber auch die Zusammensetzung der Darmflora beeinflussen, denn sie steigern die Vermehrung gesundheitsfördernder Bakterien. Diese produzieren Buttersäure (Butyrat), welches der Darm für die Regeneration nutzen kann. Außerdem wird der Darminhalt dadurch angesäuert. In einer sauren Umgebung wachsen ungünstige Bakterien weniger gut. Die gesundheitsfördernden Bakterien sind zudem für eine intakte Darmwand wichtig.
Mehrere vorläufige Studien bestätigen, dass Omega-3-Fettsäuren ungünstige Bakterienstämme reduzieren. Dazu gehören Firmicuten, die mit Übergewicht in Verbindung stehen. Die Anzahl gesundheitsfördernder Bakterien, wie Laktobazillen und Bifidobakterien, nahm durch Omega-3-Fettsäuren hingegen zu.
Obwohl Omega-3-Fettsäuren bei entzündlichen Darmerkrankungen eingesetzt werden, wurde ihre Wirkung bei einer Dünndarmfehlbesiedlung noch nicht untersucht. Auch zu den Effekten auf die Darmflora liegen nur wenige und zum Teil widersprüchliche Studien vor. Da Omega-3-Fettsäuren aber nachweislich chronische Entzündungen abschwächen, könnten sie auch bei einer Dünndarmfehlbesiedlung nützlich sein. Ein Arzt sollte den Einsatz überwachen.

Dosierung und Einnahmeempfehlung von Omega-3-Fettsäuren
Um die Entzündung bei einer Dünndarmfehlbesiedlung zu lindern, empfehlen Mikronährstoff-Experten die Einnahme von 1.000 bis 2.000 Milligramm Omega-3-Fettsäuren pro Tag. Vor allem Eicosapentaensäure (EPA) wirkt entzündungshemmend. Sie kommt in Fisch-, Krill- oder Algenöl vor.
Omega-3-Präparate sollten mit dem Essen eingenommen werden: Das Fett aus der Mahlzeit wird benötigt, damit sie gut aufgenommen werden.
Besteht der Verdacht auf eine akute Infektion im Darm, zum Beispiel durch einen Virus, sollte die Einnahme mit einem Arzt besprochen werden. Eine gewisse entzündliche Aktivität ist für die Abwehr wichtig.
Omega-3-Fettsäuren im Labor bestimmen lassen
Vor allem bei chronischen Entzündungen lohnt die Bestimmung des Omega-3-Index. Dadurch kann festgestellt werden, ob man ausreichend mit Omega-3-Fettsäuren versorgt ist. Der Omega-3-Index gibt an, wie viel Omega-3-Fettsäuren (EPA und DHA) in den roten Blutzellen vorhanden sind. Idealerweise liegt der Index über 8 Prozent.
Omega-3-Fettsäuren: zu beachten bei Erkrankungen und Medikamenteneinnahme
Menschen mit einer akuten Leber-, Gallen- oder Bauchspeicheldrüsenentzündung sollten keine Omega-3-Fettsäuren einnehmen. Möglicherweise senken Omega-3-Fettsäuren den Blutzucker. Daher sollten Diabetiker, die Medikamente einnehmen, ihre Blutzuckerwerte zu Beginn der Einnahme häufiger kontrollieren, um eine Unterzuckerung zu vermeiden. Eventuell ist eine Anpassung der Medikamente nötig.
Bestimmte Herzrhythmusstörungen (Vorhofflimmern) könnten bei Vorerkrankungen häufiger auftreten, wenn mehr als 1.000 Milligramm Omega-3-Fettsäuren pro Tag eingesetzt werden. Liegen Herzrhythmusstörungen vor, sollte die Einnahme mit dem Arzt oder Mikronährstoff-Experten besprochen werden. Er kann das Risiko abwägen und begleitend die Versorgung kontrollieren.
Omega-3-Fettsäuren wirken hoch dosiert vermutlich blutverdünnend. Daher sollten Personen mit einer Blutgerinnungsstörung die Einnahme zuvor mit dem Arzt abklären. Gleiches gilt vor einer geplanten Operation. In einer Vorstudie stieg das Blutungsrisiko nicht (2.000 Milligramm). Bisher gibt es jedoch wenig Daten.
Ab einer Dosis von 1.000 Milligramm pro Tag könnten Omega-3-Fettsäuren die Wirkung von Blutgerinnungshemmern verstärken. Daher sollte die Einnahme mit dem Arzt abgesprochen sein. Möglicherweise ist die Anpassung der Dosis erforderlich. Betroffen sind Cumarin-Derivate wie Phenprocoumon (Marcumar®) oder Warfarin (Coumadin®) sowie Acetylsalicylsäure (ASS, Aspirin®), Heparin (Clexane®) und neue orale Antikoagulanzien: Apixaban (Eliquis®), Dabigatran (Pradaxa®), Edoxaban (Lixiana®) und Rivaroxaban (Xarelto®).
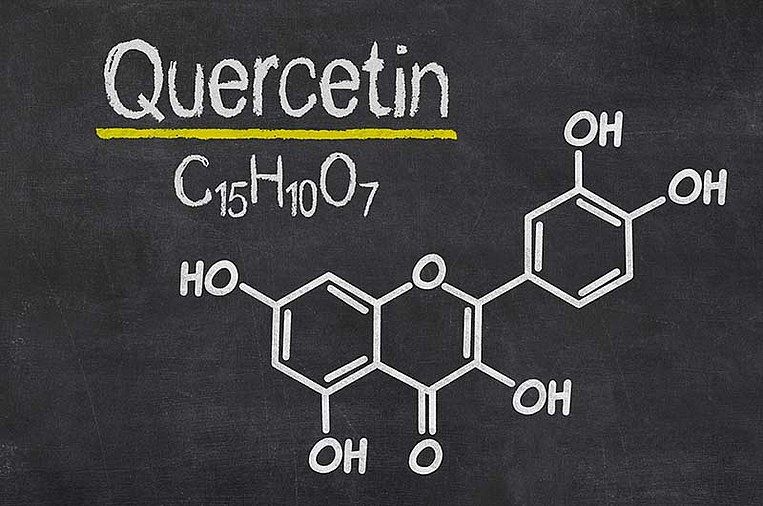
Quercetin und Rutin: pflanzliche Entzündungshemmer
Wirkweise von Quercetin und Rutin
Quercetin und Rutin gehören zu den Flavonoiden. Diese Pflanzenstoffe haben entzündungslindernde Eigenschaften. Zusätzlich reduzieren sie oxidativen Stress, der die Zellen und ihr Erbgut schädigt. In Laborversuchen und Tierstudien zeigte sich, dass Quercetin und Rutin Entzündungen lindern und die Darmflora positiv beeinflussen. Quercetin dichtet den Darm zudem ab und verbessert die Regeneration.
Studien an Menschen mit einer Dünndarmfehlbesiedlung fehlen bislang. Es liegen aber Hinweise aus Beobachtungstudien vor, dass sich eine Flavonoid-reiche Ernährung positiv auf die Darmgesundheit auswirkt. Sie verringerte zum Beispiel die Durchlässigkeit der Darmschleimhaut und linderte Entzündungen. Daher kann sich die Ergänzung von Flavonoiden trotzdem lohnen.
Vor allem die Flavonoide Quercetin und Rutin werden traditionell bei Entzündungen im Darm angewendet. Quercetin wirkt dabei bevorzugt im Dünndarm. Rutin ist bei Entzündungen im Dickdarm besser geeignet.
Info
Es gibt daneben Pflanzenstoffe, die gegen Bakterien wirken und den Darm abdichten. Das wurde zum Beispiel für Ingwer und Oreganoöl gezeigt. Sie könnten bei einer Fehlbesiedelung ebenfalls normalisierend wirken. Auch Berberin aus Berberitze ist vielversprechend. Studien zu SIBO gibt es jedoch noch nicht.
Dosierung und Einnahmeempfehlung von Quercetin und Rutin
Mikronährstoff-Experten empfehlen meist eine Kombination verschiedener Flavonoide in Form eines Kombinationspräparates. So kann die Wirksamkeit gefördert werden, da sich Flavonoide gegenseitig unterstützen. Das Präparat sollte am besten 300 Milligramm gemischte Flavonoide mit Quercetin und Rutin enthalten.
Flavonoid-Präparate werden mit den Mahlzeiten eingenommen. Dadurch sind Quercetin und Rutin gut verträglich für den Magen.
Quercetin und Rutin: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Schwangere und Stillende sollten auf eine Einnahme von Quercetin verzichten. Es fehlen Untersuchungen zur Sicherheit. Die Einnahme von Rutin sollte mit dem Arzt abgesprochen sein.
Bei Nierenerkrankungen sollten Quercetin und Rutin nur in Absprache mit einem Arzt eingenommen werden. Schwache Nieren können die Pflanzenstoffe eventuell nicht richtig ausscheiden. Personen, die an Wassereinlagerungen infolge einer Herzerkrankung leiden, sollten kein Rutin ergänzen.
Quercetin könnte ein Enzym in der Leber hemmen, das den Abbau von Medikamenten fördert. Die kombinierte Einnahme mit Medikamenten sollte daher mit dem Arzt abgesprochen sein. Betroffen sind beispielsweise Benzodiazepine (Diazepam wie Faustan®, Valocordin®), Calciumkanalblocker (Amlodipin wie Norvasc®), Immunsuppressiva (Colinsan®), Statine (Simvastatin wie Zocor®) und Antibiotika wie Gyrasehemmer, Chinolone (wie Ciloxan®) oder Makrolidantibiotika (wie Claromycin®). Auch eine erhöhte Blutungsneigung bei Einnahme von Blutverdünnern wie Phenprocoumon (Falithrom®) ist vorstellbar, aber nicht bewiesen.
Da Quercetin und Rutin antioxidativ wirken, könnte in hoher Dosierung die Wirkung von Krebsmedikamenten gehemmt werden. Sprechen Sie eine Einnahme daher mit dem Arzt ab.
Quercetin und Rutin könnten eine Krebstherapie beeinflussen. Der Einsatz sollte mit dem Therapeuten abgesprochen werden.
Probiotika: weniger Verstopfung und Durchfall bei Dünndarmfehlbesiedlung?
Wirkweise von Probiotika
Probiotika sind Mikroorganismen (meist Bakterien), die einen gesundheitsfördernden Effekt haben, weil sie die Zusammensetzung der Darmflora regulieren. Laktobazillen und Bifidobakterien zum Beispiel verdrängen schädliche Bakterien und könnten so bei einer Dünndarmfehlbesiedlung helfen. Darüber hinaus können Probiotika zu einer Stärkung der Darmwand und zur Linderung von Entzündungen beitragen. Vermutet wird außerdem, dass sie die natürlichen Darmbewegungen und das Immunsystem fördern.
Forscher schlussfolgern in einer Übersichtsarbeit, dass die Fehlbesiedelung durch Probiotika häufig beseitigt werden kann. Auch verbesserten sich Beschwerden wie Bauchschmerzen. Daneben sind weitere Studien vielversprechend:
Reizdarm: Besonders wirksam waren Probiotika bei Reizdarmpatienten mit einer Dünndarmfehlbesiedlung. Eine kleine Vorstudie zeigt: Die 30-tägige Einnahme der Bakterien Bifidobacterium lactis, Lactobacillus acidophilus, Lactobacillus plantarum und der Hefe Saccharomyces boulardii führte zu einer deutlichen Verbesserung. Sowohl Durchfall als auch Verstopfung nahmen ab.
Fettleber: Betroffene mit einer nicht alkoholischen Fettleber leiden häufig an einer Dünndarmfehlbesiedlung. Vorläufige Studien liefern Hinweise, dass Probiotika als unterstützende Behandlung infrage kommen.
Magenbypass: Sogenannte bariatrische Operationen zur Behandlung von Fettleibigkeit (Adipositas) können zu Verdauungsproblemen und einer Fehlbesiedlung des Dünndarms führen. In einer ersten Studie besserte sich der Blähbauch mit einem Probiotikum.
Magen-Darm-Krebs: Bei Krebskranken kann man eine Dünndarmfehlbesiedlung finden. In einer Vorstudie verringerten Bifidobakterien die bakterielle Fehlbesiedelung. Auch besserten sich so allgemeine Magen-Darm-Symptome. In einer weiteren Vorstudie erwiesen sich Probiotika sogar als wirksamer als ein Antibiotikum (Metronidazol).
Trotz erster vielversprechender Ergebnisse sind weitere Studien notwendig. Noch ist nicht klar, ob Probiotika allen Betroffenen mit Fehlbesiedelung helfen. In schweren Fällen könnte es durch Probiotika auch zu einer Verschlechterung kommen. Unklar ist auch, welche Bakterienarten empfohlen werden können. Vermutlich profitieren insbesondere Reizdarmsyndrom-Patienten mit einer Dünndarmfehlbesiedlung von Probiotika.
Dosierung und Einnahmeempfehlung von Probiotika
Bei einer Dünndarmfehlbesiedlung könnte eine tägliche Dosierung von 10 bis 20 x 109 koloniebildenden Einheiten sinnvoll sein. Werden geringere Mengen ergänzt, ist nicht klar, ob die Bakterien in ausreichender Zahl lebend im Darm ankommen. Generell sollten die Präparate zur Mahlzeit eingenommen werden.
Die Einnahme sollte immer mit einem Arzt abgesprochen sein, denn nicht immer sind Probiotika bei einer Dünndarmfehlbesiedlung hilfreich. Nicht eingesetzt werden sollten sie zum Beispiel bei Betroffenen, die gleichzeitig eine verlangsamte Darmbewegung haben.
Probiotika sollten nicht gleichzeitig mit Antibiotika eingenommen werden, da Antibiotika die probiotischen Bakterien abtöten würden. Halten Sie einen Einnahmeabstand von zwei bis drei Stunden ein.
Expertenwissen
Der Nutzen von Probiotika ist möglicherweise von der Art der Fehlbesiedelung abhängig. Speziell bei einer Überbesiedelung mit Bakterien aus dem Dickdarm kann nicht ausgeschlossen werden, dass sich die Beschwerden verstärken, wenn Probiotika eingesetzt werden, die auch im Dickdarm vorkommen. Vermutlich gibt es für jede SIBO-Form bestimmte vorteilhafte probiotische Bakterien. Häufig eingesetzt wurden die Laktobazillen und Bifidobakterien sowie Bacillus coagulans und die Hefe Saccharomyces boulardii. In jedem Fall sollte der Therapieverlauf ärztlich überwacht werden.
Probiotika: zu beachten in der Schwangerschaft und bei Erkrankungen
Bei Bluthochdruck in der Schwangerschaft sind Probiotika zu wenig getestet. Sie könnten die Beschwerden verstärken. In diesem Fall sollte man lieber auf Ballaststoffe ausweichen.
Personen mit einer Histaminintoleranz sollten bei der Auswahl von Probiotika auf die Zusammensetzung achten. Folgende probiotische Bakterien können Histamin im Darm bilden: Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis und Enterococcus faecium. Es könnte dann zu Beschwerden kommen.
Patienten, die sehr schwach sind und bei denen das Immunsystem unterdrückt ist, sollten keine Probiotika einnehmen. Gleiches gilt für Personen mit zentralen Venenzugängen (zum Beispiel bei Chemotherapie), mit Herzklappenerkrankungen oder dem Kurzdarmsyndrom.
Dosierungen auf einen Blick
| Empfehlung pro Tag bei Dünndarmfehlbesiedlung | |
|---|---|
| Vitamin | |
| Vitamin B12 | 10 bis 12 Mikrogramm (μg) |
| Amino- und Fettsäuren | |
| Glutamin | 3.000 bis 9.000 Milligramm (mg) |
| Omega-3-Fettsäuren (vor allem EPA) | 1.000 bis 2.000 Milligramm |
| Pflanzenstoffe und Probiotika | |
| Flavonoidmischung mit Quercetin und Rutin | 300 Milligramm |
| Probiotika | 10 bis 20 Milliarden (10 bis 20 x 109) koloniebildende Einheiten (KBE) |
Sinnvolle Laboruntersuchungen auf einen Blick
| Sinnvolle Blutuntersuchungen bei Dünndarmfehlbesiedlung | |
| Normalwerte | |
| Vitamin B12 (HoloTC) | über 54 Pikomol pro Liter (pmol/l) |
| Omega-3-Index | über 8 Prozent (%) |
Unterstützung von Medikamenten mit Mikronährstoffen
Probiotika bringen die Darmflora nach Antibiotikatherapie ins Gleichgewicht
Bei einer Dünndarmfehlbesiedlung werden manchmal Antibiotika eingesetzt, um die ungünstigen Bakterien im Dünndarm abzutöten. Da Antibiotika aber nicht zwischen gesundheitsfördernden und schädlichen Bakterien unterscheiden, töten sie alle ab. Dadurch können Nebenwirkungen wie Durchfall auftreten.
Probiotika bauen die Darmflora wieder auf. Dadurch verringern sie Durchfall oder beugen ihm sogar vor. Das zeigen zahlreiche hochwertige Studien. Auch wurde in einer Vorstudie gezeigt, dass die Einnahme von Laktobazillen gemeinsam mit Antibiotika die Beschwerden einer Dünndarmfehlbesiedlung lindert. Probiotika können deshalb in Rücksprache mit dem Arzt die Therapie unterstützen.
Generell empfehlen Mikronährstoff-Experten die tägliche Einnahme von 1 bis 20 Milliarden (1 bis 20 x 109) koloniebildende Einheiten, um die Darmflora nach einer Antibiotika-Therapie wiederaufzubauen.
Dosierungen auf einen Blick
| Empfehlung pro Tag bei Antibiotika-Einnahme | |
| Probiotika | 1 bis 20 Milliarden (1 bis 20 x 109) koloniebildende Einheiten (KBE) |
Zusammenfassung
Bei einer Dünndarmfehlbesiedlung haben sich zu viele oder falsche Bakterien aus dem Dickdarm im Dünndarm angesiedelt. Dort lösen sie Beschwerden aus – zum Beispiel Bauchschmerzen, Blähungen und Durchfall. Es kann auch zu einem Mangel an Vitaminen kommen, da die Darmschleimhaut geschädigt wird.
Die Mikronährstoffmedizin unterstützt die klassischen Behandlungsmethoden. Die Aminosäure Glutamin fördert den Aufbau und die Erhaltung einer starken Darmwand und könnte bei Dünndarmfehlbesiedlung helfen. Vitamin B12 ist wichtig, um einen möglichen Mangel auszugleichen. Gegen die Darmentzündung könnten Omega-3-Fettsäuren und die Pflanzenstoffe Quercetin und Rutin helfen.
Probiotika sind bei einer Dünndarmfehlbesiedlung aus verschiedenen Gründen wichtig: Sie könnten zur Linderung der Symptome beitragen und die Verdrängung der ungünstigen Bakterien unterstützen. Noch fehlen aber ausreichend Studien, sodass in jedem Fall der Arzt über die Einnahme entscheiden sollte. Begleitend zu einer Antibiotika-Einnahme können sie jedoch sinnvoll sein: Sie verringern die Nebenwirkungen von Antibiotika.
Verzeichnis der Studien und Quellen
Achamrah, N. et al. (2017): Glutamine and the regulation of intestinal permeability: from bench to bedside. Curr Opin Clin Nutr Metab Care 2017 Jan:20:86-91. https://www.ncbi.nlm.nih.gov/pubmed/27749689, abgerufen am 27.08.2019.
Achufusi, T.G.O. et al. (2020): Small Intestinal Bacterial Overgrowth: Comprehensive Review of Diagnosis, Prevention, and Treatment Methods. Cureus. 2020 Jun; 12(6): e8860. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7386065/, abgerufen am 02.02.2024
Alcaraz, F. et al. (2020). Surgical Management of Small Intestinal Bacterial Overgrowth After Roux-en-Y Gastric Bypass. Obes Surg 2020 Nov;30(11):4677-8. https://pubmed.ncbi.nlm.nih.gov/32594468/, abgerufen am: 11.05.2021.
Arif, H. et al. (2018): Flavonoids-induced redox cycling of copper ions leads to generation of reactive oxygen species: A potential role in cancer chemoprevention. Int J Biol Macromol 2018 Jan:106:569-78. https://pubmed.ncbi.nlm.nih.gov/28834706/, abgerufen am 22.08.2019.
AWMF (2018): S2k Leitlinie - Komplikationen der Leberzirrhose. https://www.awmf.org/uploads/tx_szleitlinien/021-017l_S2k_Komplikationen-der-Leberzirrhose_2019-04.pdf, abgerufen am 27.08.2019.
Banaszak, M. et al. (2023): Association between Gut Dysbiosis and the Occurrence of SIBO, LIBO, SIFO and IMO. Microorganisms. 2023 Feb 24;11(3):573. https://pubmed.ncbi.nlm.nih.gov/36985147/, abgerufen am 02.02.2024
Barrett, J. et al. (2008): Probiotic effects on intestinal fermentation patterns in patients with irritable bowel syndrome. World J Gastroenterol 2008 Aug:14:5020-4. https://www.ncbi.nlm.nih.gov/pubmed/18763284, abgerufen am 22.08.2019.
Benjamin, J. et al. (2012): Glutamine and whey protein improve intestinal permeability and morphology in patients with Crohn's disease: a randomized controlled trial. Dig Dis Sci 2012 Apr:57:1000-12. https://pubmed.ncbi.nlm.nih.gov/22038507/, abgerufen am 27.08.2019.
Chen, W. C. & Quigley, E. (2014): Probiotics, prebiotics & synbiotics in small intestinal bacterial overgrowth: Opening up a new therapeutic horizon! Indian J Med Res 2014 Nov:140:582-4. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4311309/, abgerufen am 11.05.2021.
Costantini, L. et al. (2017): Impact of Omega-3 Fatty Acids on the Gut Microbiota. Int J Mol Sci 2017 Dec:18. https://pubmed.ncbi.nlm.nih.gov/29215589/, abgerufen am 11.05.2021.
Den Hond, E. et al. (1999): Effect of long-term oral glutamine supplements on small intestinal permeability in patients with Crohn's disease. JPEN J Parenter Enteral Nutr 1999 Jan-Feb:23:7-11. https://www.ncbi.nlm.nih.gov/pubmed/9888411, abgerufen am 27.08.2019.
Di Stefano, M. et al. (2005). Treatment of small intestine bacterial overgrowth. European Review for Medical and Pharmacological Sciences 2005;9:217-22. https://www.europeanreview.org/wp/wp-content/uploads/319.pdf, abgerufen am: 11.05.2021.
Dukowicz, A. et al. (2007): Small Intestinal Bacterial Overgrowth. Gastroenterol Hepatol (N Y). 2007 Feb:3:112-22. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3099351/, abgerufen am 11.05.2021
Ferolla, S.M. et al. (2015): Probiotics as a complementary therapeutic approach in nonalcoholic fatty liver disease. World J Hepatol 2015 Mar;7(3):559-65.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4381178, abgerufen am 22.08.2019.
Fialho, A. et al. (2016): Association between small intestinal bacterial overgrowth and deep vein thrombosis. Gastroenterol Rep (Oxf). 2016 Nov;4(4):299-303. https://pubmed.ncbi.nlm.nih.gov/27044499/, abgerufen am 02.02.2024
Greco, A. et al. (2015): Glucose breath test and Crohn's disease: Diagnosis of small intestinal bacterial overgrowth and evaluation of therapeutic response. Scand J Gastroenterol 2015:50:1376-81. https://pubmed.ncbi.nlm.nih.gov/25990116/, abgerufen am 11.05.2021.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gurdan, A. et al. (2023): Small Intestinal Bacterial Overgrowth and Non-Alcoholic Fatty Liver Disease: What Do We Know in 2023? Nutrients. 2023 Mar; 15(6): 1323. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10052062/, abgerufen am 02.02.2024
Habtemariam, S. & Belai, A. (2018): Natural Therapies of the Inflammatory Bowel Disease: The Case of Rutin and its Aglycone, Quercetin. Mini Rev Med Chem 2018:18:234-43. https://www.ncbi.nlm.nih.gov/pubmed/28117024, abgerufen am 22.08.2019.
Hond, E. et al. (1999): Effect of glutamine on the intestinal permeability changes induced by indomethacin in humans. Aliment Pharmacol Ther 1999 May:13:679-85. https://pubmed.ncbi.nlm.nih.gov/10233193/, abgerufen am 27.08.2019.
Howard, G. & Wo, J. (2018): Fat Soluble Vitamin, B12 and Iron Deficiency in Patients with Coliform Small Intestinal Bacterial Overgrowth (SIBO). Proceedings of IMPRS 2018 Dec:1:1. http://journals.iupui.edu/index.php/IMPRS/article/view/22706, abgerufen am 12.03.2020.
Jun, D.W. et al. (2010): Association between small intestinal bacterial overgrowth and peripheral bacterial DNA in cirrhotic patients. Dig Dis Sci. 2010 May;55(5):1465-71. https://pubmed.ncbi.nlm.nih.gov/19517230/, abgerufen am 02.02.2024
Khalighi, A. et al. (2014): Evaluating the efficacy of probiotic on treatment in patients with small intestinal bacterial overgrowth (SIBO)--a pilot study. Indian J Med Res 2014 Nov:140:604-8. https://www.ncbi.nlm.nih.gov/pubmed/25579140, abgerufen am 27.08.2019.
Kim, M. et al. (2017): The Roles of Glutamine in the Intestine and Its Implication in Intestinal Diseases. Int J Mol Sci 2017 May:18. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454963/, abgerufen am 11.05.2021
Kim, M.H. & Kim, H. (2017): The Roles of Glutamine in the Intestine and Its Implication in Intestinal Diseases. Int J Mol Sci 2017 May;18(5):1051. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454963/, abgerufen am 27.08.2019.
Kinashi, Y. & Hase, K. (2021): Partners in Leaky Gut Syndrome: Intestinal Dysbiosis and Autoimmunity. Front Immunol. 2021; 12: 673708. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8100306/, abgerufen am 02.02.2024
Kossewska, J. et al. (2022): Personality, Anxiety, and Stress in Patients with Small Intestine Bacterial Overgrowth Syndrome. The Polish Preliminary Study. Int J Environ Res Public Health. 2022 Dec 21;20(1):93. https://pubmed.ncbi.nlm.nih.gov/36612414/, abgerufen am 02.02.2024
Kwon, K. et al. (2005): Dietary rutin, but not its aglycone quercetin, ameliorates dextran sulfate sodium-induced experimental colitis in mice: attenuation of pro-inflammatory gene expression. Biochem Pharmacol 2005 Feb:69:395-406. https://www.ncbi.nlm.nih.gov/pubmed/15652231, abgerufen am 11.05.2021
Leventogiannis, K. et al. (2019): Effect of a Preparation of Four Probiotics on Symptoms of Patients with Irritable Bowel Syndrome: Association with Intestinal Bacterial Overgrowth. Probiotics Antimicrob Proteins 2019 Jun;11(2):627-34. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6541575/, abgerufen am 22.08.2019.
Li X. et al. (2021): Association of small intestinal bacterial overgrowth with Parkinson's disease: a systematic review and meta-analysis. Gut Pathog. 2021 Apr 16;13(1):25. https://pubmed.ncbi.nlm.nih.gov/33863370/, abgerufen am 02.02.2024
Li, N. et al. (2004): Glutamine regulates Caco-2 cell tight junction proteins. Am J Physiol Gastrointest Liver Physiol 2004 Sept;287(3):G726-33. https://pubmed.ncbi.nlm.nih.gov/15130874/, abgerufen am 27.08.2019.
Li, Y. et al. (2006): Oral glutamine ameliorates chemotherapy-induced changes of intestinal permeability and does not interfere with the antitumor effect of chemotherapy in patients with breast cancer: a prospective randomized trial. Tumori 2006 Sep-Oct:92:396-401. https://www.ncbi.nlm.nih.gov/pubmed/17168431, abgerufen am 27.08.2019.
Liang, S. et al. (2016): Effect of probiotics on small intestinal bacterial overgrowth in patients with gastric and colorectal cancer. Turk J Gastroenterol 2016 May;27(3):227-32. https://pubmed.ncbi.nlm.nih.gov/27210778/, abgerufen am 22.08.2019.
Lyu, Y et al. (2022): Biological Activities Underlying the Therapeutic Effect of Quercetin on Inflammatory Bowel Disease. Mediators Inflamm. 2022; 2022: 5665778. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9338876/, abgerufen am 02.02.2024
Moayyedi, P. et al. (2014). The effect of fiber supplementation on irritable bowel syndrome: a systematic review and meta-analysis. Am J Gastroenterol 2014 Sep;109(9):1367-74. https://pubmed.ncbi.nlm.nih.gov/25070054/, abgerufen am: 11.05.2021
Mottaghi, A. et al. (2016): Efficacy of glutamine-enriched enteral feeding formulae in critically ill patients: a systematic review and meta-analysis of randomized controlled trials. Asia Pac J Clin Nutr 2016:25:504-12. https://www.ncbi.nlm.nih.gov/pubmed/27440684 und http://apjcn.nhri.org.tw/server/APJCN/25/3/504.pdf, abgerufen am 11.05.2021.
Najafzadh, M. et al. (2009): Flavonoids inhibit the genotoxicity of hydrogen peroxide (H(2)O(2)) and of the food mutagen 2-amino-3-methylimadazo[4,5-f]-quinoline (IQ) in lymphocytes from patients with inflammatory bowel disease (IBD). Mutagenesis 2009 Sep:24:405-11. https://www.ncbi.nlm.nih.gov/pubmed/19553277, abgerufen am 22.08.2019.
Nickles, M.A. et al. (2021). Alternative Treatment Approaches to Small Intestinal Bacterial Overgrowth: A Systematic Review. J Altern Complement Med 2021 Feb;27(2):108-19. https://pubmed.ncbi.nlm.nih.gov/33074705/, abgerufen am: 11.05.2021.
Ogden, H.B. et al. (2022): Acute L-glutamine supplementation does not improve gastrointestinal permeability, injury or microbial translocation in response to exhaustive high intensity exertional-heat stress. Eur J Sport Sci. 2022 Dec;22(12):1865-1876. https://pubmed.ncbi.nlm.nih.gov/34726114/, abgerufen am 02.02.2024
Parveen, N. & Shadab, G. (2017): The dual clastogenic and anti-clastogenic properties of quercetin is dose dependent. Front Biosci (Schol Ed) 2017 Jan:9:139-53. https://www.ncbi.nlm.nih.gov/pubmed/27814580, abgerufen am 11.05.2021.
Quan, Z. F. et al. (2004): Effect of glutamine on change in early postoperative intestinal permeability and its relation to systemic inflammatory response. World J Gastroenterol 2004 Jul:10:1992-4. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4572248/, abgerufen am 27.08.2019.
Rao, S.S.C. & Bhagatwala, J. (2019). Small Intestinal Bacterial Overgrowth: Clinical Features and Therapeutic Management. Clin Transl Gastroenterol 2019 Oct;10(10):e00078. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6884350/, abgerufen am: 11.05.2021.
Rao, S.S.C. & Bhagatwala, J. (2019): Small Intestinal Bacterial Overgrowth: Clinical Features and Therapeutic Management. Clin Transl Gastroenterol. 2019 Oct; 10(10): e00078. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6884350/, abgerufen am 02.02.2024
Rao, S.S.C. et al. (2018): Brain fogginess, gas and bloating: a link between SIBO, probiotics and metabolic acidosis. Clin Transl Gastroenterol 2018 Jun;9(6):162. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6006167/, abgerufen am 11.05.2021.
Saffouri, G.B. et al. (2019). Small intestinal microbial dysbiosis underlies symptoms associated with functional gastrointestinal disorders. Nat Commun 2019 May;10(1):2012. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6494866/, abgerufen am: 11.05.2021.
Schulze-Lohmann, P. (2012): Balaststoffe: Grundlagen – präventives Potenzial – Empfehlungen für die Lebensmittelauswahl. Ernährungs Umschau I 2012;7:408-17. https://www.ernaehrungs-umschau.de/fileadmin/Ernaehrungs-Umschau/pdfs/pdf_2012/07_12/EU07_2012_408_417.qxd.pdf, abgerufen am: 11.05.2021.
Shabbir, U. et al. (2021): Curcumin, Quercetin, Catechins and Metabolic Diseases: The Role of Gut Microbiota. Nutrients. 2021 Jan; 13(1): 206. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7828240/, abgerufen am 02.02.2024
Shah, A. et al. (2022): Links between celiac disease and small intestinal bacterial overgrowth: A systematic review and meta-analysis. J Gastroenterol Hepatol. 2022 Oct;37(10):1844-1852. https://pubmed.ncbi.nlm.nih.gov/35734803/, abgerufen am 02.02.2024
Shi, J. et al. (2020). Effect of Combined Live Probiotics Alleviating the Gastrointestinal Symptoms of Functional Bowel Disorders. Gastroenterol Res Pract 2020 Sep 17;2020:4181748. https://pubmed.ncbi.nlm.nih.gov/33014039/, abgerufen am: 11.05.2021.
Soifer, L.O. et al. (2010): Comparative clinical efficacy of a probiotic vs. an antibiotic in the treatment of patients with intestinal bacterial overgrowth and chronic abdominal functional distension: a pilot study. Acta Gastroenterol Latinoam 2010 Dec;40(4):323-7. https://www.ncbi.nlm.nih.gov/pubmed/21381407, abgerufen am 22.08.2019.
Takakura, W. & Pimentel, M.(2020): Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome - An Update. Front Psychiatry. 2020 Jul 10:11:664. https://pubmed.ncbi.nlm.nih.gov/32754068/, abgerufen am 02.02.2024
Twardowska, A. et al. (2022): Preventing Bacterial Translocation in Patients with Leaky Gut Syndrome: Nutrition and Pharmacological Treatment Options. Int J Mol Sci. 2022 Mar; 23(6): 3204. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8949204/, abgerufen am 02.02.2024.
Vezza, T. et al. (2016): Flavonoids in Inflammatory Bowel Disease: A Review. Nutrients. 2016 Apr; 8(4): 211. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4848680, abgerufen am: 27.02.2020.
Wagner, N.R.F. et al. (2021). Effects of Probiotics Supplementation on Gastrointestinal Symptoms and SIBO after Roux-en-Y Gastric Bypass: a Prospective, Randomized, Double-Blind, Placebo-Controlled Trial. Obes Surg 2021 Jan;31(1):143-50. https://pubmed.ncbi.nlm.nih.gov/32780258/, abgerufen am: 11.05.2021.
Ward, R.E. et al. (2016): A High Flavonoid Diet Reduces Gut Permeability, Short Chain Fatty Acid Production and Decreases Gut Inflammation in Overweight and Obese Men and Women. The FASEB Journal 2016 Apr;30(1):420.5. https://faseb.onlinelibrary.wiley.com/doi/abs/10.1096/fasebj.30.1_supplement.420.5, abgerufen am: 27.02.2020.
Watson, H. et al. (2018): A randomised trial of the effect of omega-3 polyunsaturated fatty acid supplements on the human intestinal microbiota. Gut microbiota 2018 Nov;67(11):1974-83. https://gut.bmj.com/content/67/11/1974 und https://pubmed.ncbi.nlm.nih.gov/28951525/, abgerufen am 23.08.2019.
Wielgosz-Grochowska, J. et al. (2022): Efficacy of an Irritable Bowel Syndrome Diet in the Treatment of Small Intestinal Bacterial Overgrowth: A Narrative Review. Nutrients. 2022 Aug; 14(16): 3382. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9412469/, abgerufen am 02.02.2024
Wilhelmi, M. et al. (2018): SIBO: «small intestinal bacterial overgrowth». Schweiz Med Forum 2018;18(09):191-200. https://medicalforum.ch/de/detail/doi/smf.2018.03208, abgerufen am 22.08.2019.
Zhong, C. et al. (2017): Probiotics for Preventing and Treating Small Intestinal Bacterial Overgrowth: A Meta-Analysis and Systematic Review of Current Evidence. J Clin Gastroenterol 2017 Apr:51:300-11. https://www.ncbi.nlm.nih.gov/pubmed/28267052, abgerufen am 22.08.2019.