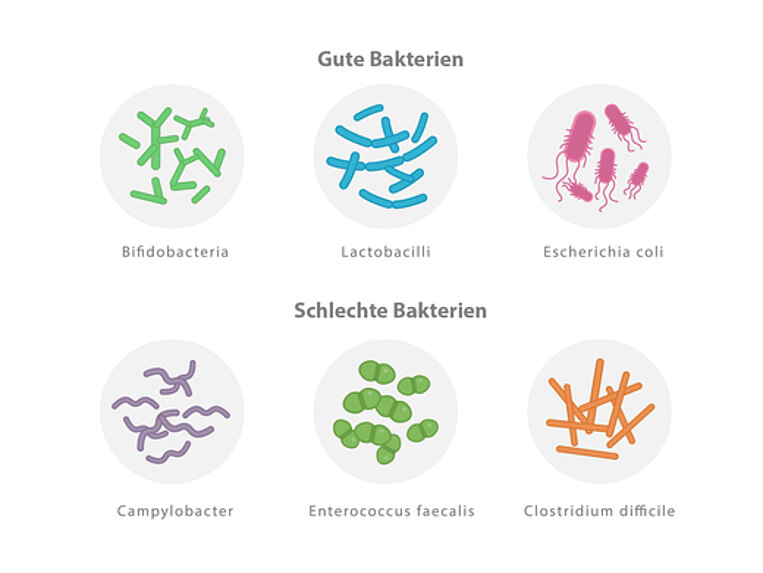
Unser Dickdarm ist von unzähligen Mikroorganismen besiedelt, vor allem von Bakterien. Diese werden in ihrer Gesamtheit als Darmflora bezeichnet. Darmbakterien übernehmen wichtige Stoffwechselaufgaben und unterstützen das Immunsystem. Überwiegen schädliche oder krank machende Bakterien, gerät der Darm aus dem Gleichgewicht. Dann spricht man von einer Darmflora-Störung oder Dysbiose. Symptome wie Verdauungsstörungen, zum Beispiel Durchfall oder Verstopfung, aber auch Müdigkeit und Kopfschmerzen können die Folge sein. Erfahren Sie, wie die Mikronährstoffmedizin die Darmflora im Dickdarm wieder in Balance bringt und die gesundheitsfördernden Bakterien bei ihren Aufgaben unterstützen kann.
Ursachen und Symptome
Was versteht man unter einer Dysbiose?
Der Verdauungstrakt, vor allem der Dickdarm, ist von einer Vielzahl an Kleinstlebewesen (Mikroorganismen) besiedelt, in erster Linie Bakterien. Im Darm sind mehr Bakterien als der Körper Zellen hat. Ihre Gesamtheit nennt man Darmflora (Mikrobiom). Sie bewahrt den Darm vor Infektionen, aktiviert das Immunsystem, produziert kurzkettige Fettsäuren sowie Vitamine und sorgt für einen optimalen pH-Wert. All das funktioniert nicht mehr, wenn krankmachende Bakterien überwiegen. Man spricht dann von einer Dysbiose (Ungleichgewicht).
Ursachen einer Darmflora-Störung
Die Darmflora ist ein empfindliches System, das durch unterschiedliche Faktoren aus dem Gleichgewicht gebracht werden kann – zum Beispiel durch:
- Infektionen: Durchfallbakterien oder der Magenkeim Helicobacter pylori reizen die Schleimhaut.
- falsche Ernährung: Eine ungesunde Ernährung mit fett- und zuckerreichen Lebensmitteln fördert das Wachstum ungesunder Bakterien.
- Stress: Auch durch körperlichen und seelischen Stress wird die Darmflora beeinflusst. Schädliche Bakterien haben leichteres Spiel.
- Verdauungsschwäche: Unverdaute Stoffe, die im Darm liegen bleiben, können eine Entgleisung der Darmflora bewirken. Darum stören auch Nahrungsmittelintoleranzen wie Glutenunverträglichkeit, Laktose- oder Fruktoseintoleranz das Gleichgewicht im Darm.
- Alkohol schadet den Bakterien und der Schleimhaut des Magen- und Darmtrakts. Dadurch beeinträchtigt er die Dichtigkeit der Darmwand.
- Umweltgifte: Beispielsweise können Quecksilber und Blei über die Nahrung aufgenommen werden und eine Dysbiose begünstigen.
- Medikamente: Nicht nur Antibiotika töten Bakterien im Darm. Sehr viele Medikamente beeinflussen die Darmflora mehr oder weniger stark. Zum Beispiel Magenmittel (PPI), Abführmittel, Antidiabetika (Metformin) oder die Antibabypille können das Gleichgewicht stören.
Symptome der Darmflora-Störung
Eine Darmflora-Störung äußert sich meist durch einen Blähbauch, oft verbunden mit Blähungen oder Verdauungsstörungen, Völlegefühl und Übelkeit. Auch Durchfall und Verstopfung treten häufig auf. Die Dysbiose kann aber nicht nur die Verdauung stören. Es kann auch zu Beschwerden wie Müdigkeit, Erschöpfung, Kopfschmerzen und Konzentrationsstörungen kommen. Menschen mit Darmflora-Störungen sind darüber hinaus anfälliger für Infekte.
Folgen einer Darmflora-Störung
Die Darmflora bestimmt, auf welche Stoffe unser Immunsystem reagiert. Bei einer Fehlbesiedelung kann das Immunsystem entweder sehr sensibel oder zu wenig reagieren. Dadurch greift es manchmal Bestandteile des Körpers an – was sich in Autoimmunkrankheiten äußern kann – oder es kann zu Infektionen kommen. Durch die Dysbiose kann auch die Darmschleimhaut undicht werden: Giftstoffe oder Bakterien dringen dann in den Körper ein. Man spricht von einem durchlässigen Darm oder dem Leaky-Gut-Syndrom.
Verschiedene Erkrankungen können in Zusammenhang mit einer Darmflora-Störung stehen. Allerdings ist bisher nicht klar, ob eine Dysbiose Ursache oder Folge dieser Krankheiten ist. Beispiele sind:
- Darmerkrankungen: chronisch-entzündliche Darmerkrankungen wie Morbus Crohn oder Reizdarmsyndrom
- Nahrungsmittelunverträglichkeiten wie Zöliakie
- Autoimmunerkrankungen wie rheumatoide Arthritis
- allergische Erkrankungen wie Heuschnupfen, Asthma, Neurodermitis oder Ekzeme
- Hauterkrankungen wie Schuppenflechte, Akne, Neurodermitis oder Ekzeme
- Krankheiten der Nerven und Psyche wie Depressionen, Migräne und
Neuerdings wird bei sehr viel mehr Erkrankungen eine Verbindung zur Darmflora vermutet: Multiple Sklerose, Depressionen, Krebs, Diabetes mellitus, starkes Übergewicht (Adipositas) und Herz-Kreislauf-Erkrankungen. Welchen Einfluss der Darm auf die Entstehung dieser Krankheiten hat, wird derzeit intensiv erforscht.
Ziele der Behandlung
Wie wird die Darmflora-Störung klassisch behandelt?
Eine klassische Therapie für Darmflora-Störungen gibt es derzeit nicht, ebenso fehlen Behandlungsleitlinien. Grundsätzlich gilt es, schädliche Einflüsse zu vermeiden. Da zum Beispiel Antibiotika die Zusammensetzung der Darmflora massiv verändern, müssen das Risiko und der Nutzen kritisch hinterfragt werden. Oft werden in der klassischen Therapie nur die Symptome behandelt, wie Durchfall, Blähungen oder Verstopfung.
In Zukunft muss man vermehrt auf die eigentlichen Ursachen achten, wie Medikamente. Auch eine ungünstige Ernährung hat grundlegende Folgen für die Darmflora. Vorteilhaft sind ballaststoffreiche Lebensmittel sowie wenig Zucker und Fette. Individuell unverträgliche Lebensmittel sowie Gifte wie Konservierungsstoffe und Alkohol sollten vermieden werden. Eine Ernährungsberatung und ein abgestimmter Ernährungsplan unterstützen die Behandlung einer Darmflorastörung.
Manchmal wird eine Darmsanierung zur Therapie einer gestörten Darmflora empfohlen. Dabei werden unterschiedliche Methoden angewandt – wie eine Darmreinigung über Einläufe, Abführmittel, Fastenkuren sowie eine Wiederherstellung der gesunden Darmflora (Darmsymbioselenkung) mit nützlichen Darmbakterien (Probiotika) und Ballaststoffen (Präbiotika).
Ziele der Mikronährstoffmedizin
Grundlegendes Ziel der Mikronährstoffmedizin ist es, die gesunde Darmflora wiederherzustellen – ähnlich wie in der klassischen Medizin. Bestimmte Stoffe können die Darmschleimhaut unterstützen und damit die Darmbarriere und die Immunabwehr stärken. Dies bringt den Darm wieder ins Gleichgewicht und verdrängt die schlechten Darmbakterien. In der Mikronährstoffmedizin hat sich Folgendes bewährt:
- Resistente Stärke dient den guten Darmbakterien als Nahrung.
- Probiotika versorgen den Dickdarm mit gesundheitsfördernden Bakterien.
- Omega-3-Fettsäurenwirken entzündungshemmend.
- Glutamin stärkt die Darmbarriere.
- Flavonoide regulieren möglicherweise die Darmflora.
Tipp
Sehr oft empfehlen Mikronährstoff-Experten bei einer Darmflora-Störung ein Kombinationspräparat, das B-Vitamine enthält. B-Vitamine sind wichtig für eine gesunde Darmschleimhaut. Der Körper benötigt sie zum Beispiel für die Zellteilung im Darm und für die Energiegewinnung in den Zellen. Vor allem bei entzündlichen Darmerkrankungen kann ein Mangel bestehen.
Behandlung mit Mikronährstoffen
Resistente Stärke dient Darmbakterien als Nahrung
Wirkweise von resistenter Stärke
Resistente Stärke ist ein Ballaststoff, der nicht verdaut werden kann. Für unsere Darmbakterien ist er jedoch sehr wichtig: Sie können daraus kurzkettige Fettsäuren herstellen, die den Zellen im Dickdarm Energie liefern. Insbesondere die kurzkettige Buttersäure (Butyrat) wirkt entzündungshemmend. Darüber hinaus senken kurzkettige Fettsäuren den pH-Wert und stellen somit optimale Bedingungen für eine gesundheitsfördernde Darmflora her. Erste teilweise hochwertige Studien bestätigen die Wirkung: Wurde die Ernährung um resistente Stärke ergänzt, veränderte sich die Bakterienzusammensetzung im Darm positiv.
Möglicherweise kann die Einnahme von resistenter Stärke auch bei Durchfallerkrankungen helfen: In einer ersten Studie mit 183 Kindern konnte die Dauer des Durchfalls deutlich verkürzt werden im Vergleich zur Standardtherapie. Auch eine weitere Vorstudie an Erwachsenen mit wässrigen Durchfällen belegt das: Im Vergleich zu einer Zuckerlösung senkte resistente Stärke die Dauer der Durchfälle um 55 Prozent und verringerte das Stuhlgewicht (und damit das verlorene Wasser) bereits nach 12 Stunden.
Fazit: Viele Daten belegen, dass resistente Stärke die Darmbesiedelung und Darmgesundheit verbessern kann. Dies hilft nicht nur bei Durchfall. Es dürfte günstig auf die Darmfunktion und den Stoffwechsel wirken. Weitere Studien werden folgen, um dies zu bestätigen.

Resistente Stärke: Dosierung und Einnahmeempfehlung
Bei einer Störung der Darmflora im Dickdarm empfehlen Mikronährstoff-Experten bis zu 25 Gramm resistente Stärke täglich. Nehmen Sie resistente Stärke (zum Beispiel in Form von Pulver) über den Tag verteilt zu den Mahlzeiten ein – zum Beispiel dreimal täglich jeweils 8 Gramm. Begleitend dazu ist es wichtig, viel zu trinken.
Tipp
Zu Beginn der Einnahme kann resistente Stärke Blähungen verursachen. Empfehlenswert ist es, mit der Einnahme langsam zu beginnen, bis sich der Darm an eine höhere Ballaststoffzufuhr gewöhnt hat. Sinnvoll sind zum Beispiel zuerst 8 Gramm für den ganzen Tag. Wenn resistente Stärke vertragen wird, kann die Dosis erhöht werden.
Resistente Stärke: zu beachten bei Erkrankungen
Verzichten Sie auf Ballaststoffe wie resistente Stärke bei akuten Entzündungen im Darm, etwa bei Divertikulitis oder einer akuten chronisch-entzündlichen Darmerkrankung. Ballaststoffe könnten die Symptome in dieser Zeit verschlimmern.
Probiotika können helfen, das bakterielle Ungleichgewicht zu beheben
Wirkweise von Probiotika
Probiotika enthalten lebende Bakterien, zum Beispiel Milchsäurebakterien. Nach der Einnahme siedeln sich die Bakterien im Dickdarm an und haben gesundheitsfördernde Effekte: Zum Beispiel konkurrieren sie mit schlechten Bakterien um Nährstoffe. Probiotika trainieren auch das Immunsystem. Sie aktivieren unter anderem die Produktion schützender Antikörper. Außerdem wird die Darmbarriere gestärkt und es wird verhindert, dass schädliche Stoffe in den Körper eindringen.
Eine Einnahme von Laktobazillen und Bifidobakterien kann das Gleichgewicht auf die Seite der nützlichen Bakterien verschieben. Dies zeigen zwei Übersichtsarbeiten. Gleichzeitig bessern sich verschiedene Erkrankungen, denn der Darm ist mit vielen Organen direkt verbunden. Übersichtsarbeiten belegen folgende Wirkungen:
- Darm: Bei Personen mit Reizdarmsyndrom besserten sich in einer Übersichtsarbeit Blähungen, Schmerzen und die Stuhlfrequenz.
- Lunge: Infektionen der Lunge, Asthma und COPD können wahrscheinlich über den Darm beeinflusst werden.
- Nerven und Psyche: Stress verändert die Darmflora und Probiotika können sie normalisieren. In Studien lindern sie zum Beispiel depressive Zustände. Forscher untersuchen derzeit die Wirkung auf ADHS, Schizophrenie, Parkinson und multiple Sklerose.
- Haut: Chronische Hautkrankheiten wie Schuppenflechte und Neurodermitis sprechen ebenfalls auf Probiotika an. Daten liegen auch für Akne und Rosazea vor.
Fazit: Bei einer Darmflorastörung ist die Lenkung der Darmbesiedelung (Symbioselenkung) mit Prä- und Probiotika sehr wichtig. Abschließende Urteile sind meist jedoch noch nicht möglich. Viele Studien weisen aber darauf hin, dass dadurch Erkrankungen gebessert werden können.

Tipp
Probiotika wurden auch im Zusammenhang mit einer Antibiotikaeinnahme untersucht. Eine Übersichtsarbeit ergab, dass Antibiotika-bedingte Durchfälle durch Probiotika seltener auftraten. Bakterienarten wie Lactobacillus rhamnosus und die Hefe Saccharomyces boulardii waren dabei besonders effektiv.
Dosierung und Einnahmeempfehlung von Probiotika
Um die Darmflora wieder ins Gleichgewicht zu bringen, müssen Probiotika täglich über einen längeren Zeitraum eingenommen werden. Damit die guten Bakterien im Dickdarm ankommen, sollten die Präparate mindestens eine Milliarde Keime enthalten (1 x 109 koloniebildende Einheiten).
Mikronährstoff-Experten empfehlen für eine gute Wirkung aber meist mehr – zum Beispiel mindestens 10 Milliarden Keime (10 x 109). Zudem raten sie meist zu einem Kombinationspräparat mit verschiedenen Laktobazillen und Bifidobakterien. Es wird vermutet, dass sie sich in ihrer Wirkung ergänzen.
Probiotika gibt es in Form von Pulver oder Kapseln. Optimal ist die Wirkung, wenn Sie Probiotika zu einer leichten Mahlzeit einnehmen. So können die Keime den Magen schnell passieren und werden durch die Magensäure nicht zu sehr geschädigt.
Tipp
Auch Sauerkraut, Joghurt und Käse können lebende Bakterien enthalten, jedoch häufig nicht in ausreichender Menge. Die Menge ist abhängig von der Zubereitung, Konservierung und Lagerungsdauer. Auch wenn eine hochwertige Studie zeigt, dass ein probiotischer Joghurt generell wirksam war, empfehlen Mikronährstoff-Experten meist ein Präparat mit einer genau definierten Keimanzahl.
Stuhluntersuchung (Mikrobiomanalyse)
Um zu untersuchen, ob Probiotika anschlagen, kann eine Stuhluntersuchung durchgeführt werden. Dazu muss eine Stuhlprobe in ein Labor geschickt werden. Wichtig ist, dass die Anweisungen vom Arzt oder Labor genau eingehalten werden: Wird die Stuhlprobe zum Beispiel nicht konserviert, vermehren sich bestimmte Bakterien stark, was das Ergebnis verfälscht.
Im Labor gibt es jetzt auch weniger empfindliche Verfahren. Derzeit am besten geeignet ist die Analyse der Erbinformation der Bakterien (DNA-Sequenzierung). Der Test gibt Auskunft über die Bakterienvielfalt im Darm und darüber, ob zu viele krankmachende Bakterienarten im Darm leben. Die Normwerte gibt das Labor an.
Probiotika: zu beachten in der Schwangerschaft, bei Erkrankungen und Medikamenteneinnahme
Bei Bluthochdruck in der Schwangerschaft sind Probiotika zu wenig getestet. Sie könnten die Beschwerden verstärken. Man sollte daher besser auf Ballaststoffe ausweichen.
Einige probiotische Bakterien bilden möglicherweise Histamin im Darm. Dazu zählen: Lactobacillus casei, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus reuteri, Lactococcus lactis und Enterococcus faecium. Daher kann eine Probiotikaeinnahme bei einer Histaminintoleranz Beschwerden hervorrufen.
Für Menschen, die ein stark geschwächtes Immunsystem haben, könnten Probiotika gefährlich werden. Daher sollten Schwerkranke, frisch Operierte oder sehr alte Personen nur in Rücksprache mit dem Arzt Probiotika einnehmen. Patienten mit zentralen Venenzugängen (zum Beispiel bei Chemotherapie), Herzklappenerkrankungen, Kurzdarmsyndrom und Frühgeborene sollten keine Probiotika bekommen.
Probiotika sollten nicht gleichzeitig mit Antibiotika eingenommen werden, da Antibiotika die probiotischen Bakterien abtöten würden. Um ihre Wirkung nicht zu beeinträchtigen, halten Sie einen Einnahmeabstand von zwei bis drei Stunden ein.
Omega-3-Fettsäuren wirken Entzündungen entgegen
Wirkweise von Omega-3-Fettsäuren
Omega-3-Fettsäuren lindern Entzündungen: Der Körper kann aus Omega-3-Fettsäuren, vor allem aus Eicosapentaensäure (EPA) und Docosahexaensäure (DHA), Stoffe herstellen, die antientzündlich wirken. Gleichzeitig hemmen sie die Produktion von entzündungsfördernden Botenstoffen.
Beobachtungsstudien zeigen, dass eine gestörte Darmflora mit chronischen Entzündungsprozessen und Stoffwechselstörungen in Verbindung steht. Diese können zu Erkrankungen wie Fettleibigkeit (Adipositas) oder Diabetes führen. Omega-3-Fettsäuren haben sich generell bei entzündungsbedingten Erkrankungen bewährt: In teils hochwertigen Studien hatten Omega-3-Fettsäuren eine positive Wirkung bei rheumatoider Arthritis und bei Verkalkungen der Blutgefäße. Auch bei chronisch-entzündlichen Darmerkrankungen könnten sie helfen.
Eventuell haben Omega-3-Fettsäuren auch einen förderlichen Effekt auf die Darmflora. Übersichtsarbeiten zeigten eine Abnahme potenziell schädlicher Darmbakterien, die zum Beispiel bei Reizdarm-Patienten erhöht sind. Gleichzeitig stieg die Zahl an nützlichen Bakterien, die entzündungshemmende kurzkettige Fettsäuren produzieren. Außerdem verbesserte sich die Darmbarriere.
Fazit: Bei Entzündungen sind Omega-3-Fettsäuren wichtige Helfer. Auch könnten sie einer der Bausteine sein, um die Darmflora günstig zu beeinflussen. Weitere Studien müssen folgen. Da unsere Ernährung meist arm ist an Omega-3-Fettsäuren, sollte man bei einer Darmflorastörung bewusst darauf achten.
Dosierung und Einnahmeempfehlung von Omega-3-Fettsäuren
Bei entzündungsbedingten Erkrankungen empfehlen Mikronährstoff-Experten täglich 1.000 bis 2.000 Milligramm Omega-3-Fettsäuren – idealerweise aus Fisch- oder Krillöl, da es EPA und DHA enthält. Achten Sie dabei auf einen höheren Gehalt an EPA (zum Beispiel 1.400 Milligramm), da EPA stark entzündungshemmend wirkt.
Omega-3-Fettsäuren wirken am besten, wenn die Einnahme mit etwas Fett aus der Mahlzeit ergänzt wird. Nehmen Sie die Präparate deshalb zu einer Mahlzeit ein.
Tipp
Bei Omega-3-Präparaten gibt es große Qualitätsunterschiede: Achten Sie auf Präparate, die gereinigt wurden. Sie sind frei von Schadstoffen wie Schwermetallen.
Omega-3-Fettsäuren im Labor bestimmen lassen
Ob Sie gut mit Omega-3-Fettsäuren versorgt sind, erfahren Sie durch den Omega-3-Index. Dabei misst das Labor den Anteil der Omega-3-Fettsäuren in den roten Blutzellen (Erythrozyten). Der Omega-3-Index wird in Prozent angegeben und sollte optimalerweise über 8 liegen. Dies bedeutet, dass 8 von 100 Fettsäuren in den roten Blutzellen hochwertige Omega-3-Fettsäuren sind.
Omega-3-Fettsäuren: zu beachten bei der Medikamenteneinnahme, Erkrankungen und vor Operationen
Bestimmte Herzrhythmusstörungen (Vorhofflimmern) könnten bei Vorerkrankungen häufiger auftreten, wenn mehr als 1.000 Milligramm Omega-3-Fettsäuren pro Tag eingesetzt werden. Liegen Herzrhythmusstörungen vor, sollte die Einnahme mit dem Arzt oder Mikronährstoff-Experten besprochen werden. Er kann das Risiko abwägen und begleitend die Versorgung kontrollieren.
Da Omega-3-Fettsäuren vermutlich blutverdünnend wirken, könnten sie ab einer Dosierung von 1.000 Milligramm die Wirkung von Blutgerinnungshemmern verstärken. Besprechen Sie daher die Einnahme mit Ihrem Arzt. Er kann die Blutgerinnungszeit (Quick-Wert) regelmäßig kontrollieren. Zu den Blutverdünnern zählen:
- Cumarin-Derivate (wie Marcumar® und Coumadin®)
- Acetylsalicylsäure (ASS, Aspirin®)
- Heparin (Clexane®)
- neue orale Antikoagulanzien: Apixaban (Eliquis®), Dabigatran (Pradaxa®), Edoxaban (Lixiana®) und Rivaroxaban (Xarelto®)
Möglicherweise beeinflussen Omega-3-Fettsäuren den Blutzucker. Daher sollten Diabetiker, die Medikamente einnehmen, ihre Blutzuckerwerte zu Beginn der Einnahme häufiger kontrollieren, um eine Unterzuckerung zu vermeiden. Eventuell ist eine Anpassung der Medikamente nötig.
Bei akuten Lebererkrankungen, einer akuten Bauchspeicheldrüsenentzündung oder einer Gallenblasenentzündung sollten Omega-3-Fettsäuren nicht eingenommen werden. Auch wenn Sie eine Blutgerinnungsstörung haben oder sich einer Operation unterziehen müssen, sollten Sie die Einnahme von Omega-3-Fettsäuren zuvor mit dem Arzt abklären. Einige Ärzte empfehlen, ein bis zwei Wochen vor der Operation auf Omega-3-Präparate zu verzichten.
Glutamin für eine starke Darmbarriere
Wirkweise von Glutamin
Die Aminosäure Glutamin ist vor allem im Dünndarm der wichtigste Lieferant für Energie. Außerdem reguliert Glutamin spezielle Eiweiße, welche die Darmwand abdichten. Daneben fördert es die Regeneration. Insgesamt stärkt Glutamin die Darmbarriere. Insbesondere bei einem „löchrigen Darm“ (Leaky-Gut-Syndrom) scheint eine Ergänzung daher vielversprechend: Erste Studien belegen, dass sich nach der Einnahme von Glutamin die Darmbarriere verbesserte – zum Beispiel bei Kindern und schwerkranken Personen.
Eine Störung der Darmflora steht vermutlich mit dem Auftreten von Übergewicht in Verbindung. In einer Vorstudie erhielten übergewichtige Teilnehmer 30.000 Milligramm Glutamin täglich. Dies konnte bereits nach zwei Wochen das Verhältnis der Darmbakterien Firmicutes und Bakteroidetes positiv verändern. Bei normalgewichtigen Menschen sind Bacteroidetes in der Überzahl, bei übergewichtigen Personen Firmicutes.
Info
Die Bakterienzusammensetzung beeinflusst direkt die Nutzung der Energie aus der Nahrung: Durch ein Überangebot an Firmicutes kann die Nahrung vermutlich besser aufgespalten und verwertet werden. Das führt leichter zu Übergewicht. Glutamin könnte die Bakterienzusammensetzung und die Energieausbeute verändern und so dabei helfen, Übergewicht zu reduzieren.
Dosierung und Einnahmeempfehlungen von Glutamin
Die empfohlene Dosis zur Stärkung der Darmbarriere beträgt 4.000 bis 10.000 Milligramm Glutamin täglich. Glutamin ist in Form von Kapseln oder Pulver erhältlich. Am besten verwertet der Körper Glutamin, wenn er es in mehreren kleinen Portionen über den Tag verteilt zur Verfügung hat. Verteilen Sie die Gesamtdosis daher über den Tag. Ideal ist die Einnahme eine halbe Stunde vor den Mahlzeiten: So hat Glutamin genügend Vorsprung, bevor andere Aminosäuren aus der Nahrung seine Aufnahme im Darm verringern.
Glutamin: zu beachten bei Erkrankungen und Chemotherapien
Bei Nieren- und Leberschäden sollte kein Glutamin eingesetzt werden. Wird Glutamin abgebaut, entsteht Stickstoff (Ammonium), der wiederum entgiftet werden muss. Bei Störungen der Nieren- und Leberfunktion ist die Entgiftung jedoch beeinträchtigt.
Bei einer Krebstherapie sollte der Einsatz von Glutamin immer mit dem Arzt abgestimmt werden. Unter anderem können Chemotherapien die Niere schädigen. Wenn größere Mengen an Glutamin zur Senkung der Nebenwirkungen einer Chemotherapie eingesetzt werden (zum Beispiel bei einer Therapie mit Cisplatin wie Teva® oder Cisplatin Accord®), sollte die Nierenfunktion zuvor geprüft werden. Glutamin könnte demgegenüber jedoch auch das Überleben der Krebszellen fördern.
Flavonoide beeinflussen möglicherweise die Darmflora und hemmen Entzündungen
Wirkweise von Flavonoiden
Flavonoide sind sekundäre Pflanzenstoffe. Ihre gesundheitsfördernde Wirkung ist teilweise gut untersucht. Über ihren Effekt auf die Darmbakterien ist bisher jedoch wenig bekannt. Flavonoide beeinflussen möglicherweise nicht nur die Zusammensetzung der Darmflora, auch die Darmflora beeinflusst die Verfügbarkeit und Wirkung von Flavonoiden: Darmbakterien verändern bestimmte Flavonoide zu ähnlichen Verbindungen, die der Körper auch aufnehmen kann.
In mehreren Studien wirkte sich eine Ernährung mit Pflanzenstoffen wie Flavonoiden bei Menschen positiv auf die Darmflora aus. Je nach Studie förderten sie nützliche Darmbakterien, hemmten schädliche Arten und erhöhten die Vielfalt der Bakterienstämme. Zudem wurde die Darmbarriere, die Stoffwechselaktivität der Darmflora und das Entzündungsgeschehen im Darm verbessert. Eine Übersichtsarbeit lässt diesen Effekt auch beim Trinken großer Mengen Grüntee (1 Liter) annehmen. Er enthält das Flavonoid Epigallocatechingallat (EGCG).
Wichtige Flavonoide für den Darm sind darüber hinaus Rutin und Quercetin. Die Darmflora wandelt Rutin in Quercetin um. Beide Flavonoide haben eine antientzündliche Wirkung. In Tierversuchen besserten sie chronisch-entzündliche Darmerkrankungen. Studien an erkrankten Personen gibt es jedoch noch nicht.
Fazit: Flavonoide beeinflussen die Darmflora. Studien haben diesen Zusammenhang belegt. Inwieweit sie jedoch bei Darmerkrankungen helfen, muss weiter untersucht werden. Aufgrund ihrer entzündungshemmenden Eigenschaften sollten Flavonoide jedoch Bestandteil der Nahrung sein.
Dosierung und Einnahmeempfehlung von Flavonoiden
Mikronährstoff-Experten empfehlen bei einer Darmflora-Störung grundsätzlich eine Ernährung, die reich ist an Flavonoiden – das bedeutet viel Obst und Gemüse. Zur Ergänzung können auch Präparate mit Rutin und Quercetin hilfreich sein. Sinnvoll sind zum Beispiel 150 Milligramm Rutin und 150 Milligramm Quercetin zusammen mit einer Mahlzeit.
Flavonoide: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen sowie Medikamenteneinnahme
Schwangere und Stillende sollten auf eine Einnahme von Quercetin verzichten. Es fehlen Untersuchungen zur Unbedenklichkeit. Die Einnahme von Rutin sollte mit dem Arzt abgesprochen sein.
Da Rutin und Quercetin über die Leber und Nieren ausgeschieden werden, ist bei Erkrankungen dieser Organe Vorsicht geboten. Nehmen Sie in diesen Fällen ohne ärztlichen Rat keine Präparate mit Rutin und Quercetin ein. Auch bei Wassereinlagerungen infolge von Herzerkrankungen ist die Einnahme von Rutin nicht angezeigt.
Da Quercetin und Rutin antioxidativ wirken, könnte in hoher Dosierung die Wirkung von Krebsmedikamenten gehemmt werden. Sprechen Sie eine Einnahme daher mit dem Arzt ab.
Quercetin könnte den Medikamentenabbau hemmen. Aus diesem Grund ist es wichtig, die kombinierte Einnahme mit dem Arzt abzusprechen. Quercetin sollte zum Beispiel nicht eingenommen werden mit: Benzodiazepinen (wie Diazepam®, Stesolid® oder Valiquid®), Calciumkanalblockern (Norvasc®, Amlovasc®), Immunsuppressiva (Azafalk®, Azaimun®), Statinen (wie Zocor®, SimvaHEXAL®), Antibiotika wie Gyrasehemmern und Chinolonen (wie Ciloxan®) oder Makrolidantibiotika (wie Claromycin®). Denkbar ist auch eine verstärkende Wirkung von Blutgerinnungshemmern (zum Beispiel Marcumar®).
Dosierungen auf einen Blick
Empfehlung am Tag bei Darmflora-Störung | |
|---|---|
Probiotika und Ballaststoffe | |
Probiotika (zum Beispiel mit Laktobazillen und Bifidobakterien) | 10 Milliarden (10 x 109) koloniebildende Einheiten (KBE) |
Resistente Stärke | 25 Gramm (g) |
Fettsäuren | |
Omega-3-Fettsäuren | 1.000 bis 2.000 Milligramm (mg) mit hohem EPA-Gehalt (zum Beispiel 1.400 Milligramm EPA) |
Aminosäuren | |
Glutamin | 4.000 bis 10.000 Milligramm (mg) |
Pflanzenstoffe | |
Flavonoide | zum Beispiel 150 Milligramm Quercetin und 150 Milligramm Rutin |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Laboruntersuchungen bei Darmflora-Störung | |
|---|---|
| Optimalwerte |
Stuhluntersuchung (Zusammensetzung der Darmflora) | je nach Labor |
Omega-3-Index | 8 Prozent (%) |
Zusammenfassung
Eine gesunde Darmflora ist Voraussetzung für unsere Gesundheit. Liegt ein Ungleichgewicht von nützlichen zu schädlichen Bakterien vor, spricht man von einer Darmflora-Störung (Dysbiose). Es kann zu vielen Symptomen wie Blähbauch, Durchfall und Müdigkeit kommen. Eine Darmflora-Störung steht außerdem mit verschiedenen Erkrankungen wie dem Leaky-Gut-Syndrom, Diabetes mellitus, Depressionen und Übergewicht in Verbindung.
Die Mikronährstoffmedizin kann helfen, die Darmflora wieder ins Gleichgewicht zu bringen. Hierbei haben sich vor allem Probiotika bewährt. Probiotika sind gesundheitsfördernde Bakterien wie Laktobazillen. Sie siedeln sich im Darm an und konkurrieren mit schädlichen Bakterien um Nährstoffe. Ballaststoffe, wie resistente Stärke, unterstützen die nützlichen Bakterien und liefern ihnen Energie.
Zudem wirken Omega-3-Fettsäuren entzündungshemmend und können möglicherweise auch die Zusammensetzung der Darmflora günstig beeinflussen. Glutamin ist ein wichtiger Nährstoff für die Darmzellen und hilft dabei, den Darm abzudichten und den Körper vor Giftstoffen zu schützen. Flavonoide, wie Quercetin und Rutin, könnten darüber hinaus die Behandlung entzündlicher Darmerkrankungen unterstützen. Sie sind auch selbst in der Lage, auf die Darmflora normalisierend einzuwirken.
Verzeichnis der Studien und Quellen
Amadieu, C. et al. (2022): Restoring an adequate dietary fiber intake by inulin supplementation: a pilot study showing an impact on gut microbiota and sociability in alcohol use disorder patients. Gut Microbes. 2022;14(1): 2007042. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8726664/, abgerufen am 14.03.2022.
Baja, J.S. (2019): Alcohol, liver disease and the gut microbiota. Nat Rev Gastroenterol Hepatol. 2019 Apr;16(4):235-46. https://pubmed.ncbi.nlm.nih.gov/30643227/, abgerufen am 14.03.2022.
Barbalho, S.M. et al (2016): Inflammatory bowel disease: can omega-3 fatty acids really help?. Ann Gastroenterol. 2016; 29(1):37-43. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4700845/, abgerufen am 22.07.2018.
Biesalski, H. K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. 1. Aufl. Georg Thieme Verlag Stuttgart.
Biesalski, H. K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Bindels, L.B. et al. (2015): Resistant starches for the management of metabolic diseases. Curr Opin Clin Nutr Metab Care. 2015 Nov;18(6):559-65. https://pubmed.ncbi.nlm.nih.gov/26406392/, abgerufen am 14.03.2022.
Biovis’ Diagnostik MVZ GmbH (Hrsg) (2018): Mikrobiom 2.0. https://www.biovis.eu/de/biovis-mikrobiom-2-0/, abgerufen am 14.03.2022.
Birt, D.F. et al. (2013): Resistant Starch: Promise for Improving Human Health. Adv Nutr. 2013 Nov. 4(6):587–601. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC3823506/, abgerufen am 14.03.2022.
Blaabjerg, S. et al. (2017): Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Outpatients-A Systematic Review and Meta-Analysis. Antibiotics (Basel). 2017; 12;6(4).https://www.ncbi.nlm.nih.gov/pubmed/29023420, abgerufen am 22.07.2018.
Bond, T. & Derbyshire, E. (2019): Tea Compounds and the Gut Microbiome: Findings from Trials and Mechanistic Studies. Nutrients. 2019 Oct 3;11(10):2364. https://pubmed.ncbi.nlm.nih.gov/31623411/, abgerufen am 14.03.2022.
Bron, P. et al. (2011): Emerging molecular insights into the interaction between probiotics and the host intestinal mucosa. Nat Rev Microbiol. 2011;10:66–78. https://www.ncbi.nlm.nih.gov/pubmed/22101918, abgerufen am 22.07.2018.
Cai, J. et al. (2018): Comparative efficacy and tolerability of probiotics for antibiotic-associated diarrhea: Systematic review with network meta-analysis. United European Gastroenterol J. 2018; 6(2):169–180. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5833232/, abgerufen am 22.07.2018.
Calder, P.C. (2017): Omega-3 fatty acids and inflammatory processes: from molecules to man. Biochem Soc Trans. 2017 15;45(5):1105-1115. https://www.ncbi.nlm.nih.gov/pubmed/28900017, abgerufen am 22.07.2018.
Cani, P. et al. (2009): Interplay between obesity and associated metabolic disorders: new insights into the gut microbiota. Curr Opin Pharmacol. 2009;9:737–743. https://www.ncbi.nlm.nih.gov/pubmed/19628432, abgerufen am 22.07.2018.
Cardona, F. et al. (2013): Benefits of polyphenols on gut microbiota and implications in human health. The Journal of Nutritional Biochemistry. 2013; 24(8):1415-1422. https://www.sciencedirect.com/science/article/pii/S0955286313000946, abgerufen am 22.07.2018.
Chudzik, A. et al. (2021): Probiotics, Prebiotics and Postbiotics on Mitigation of Depression Symptoms: Modulation of the Brain–Gut–Microbiome Axis. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8301955/, abgerufen am 07.12.2023.
Cione, E. et al. (2021): Resistant Starches and Non-Communicable Disease: A Focus on Mediterranean Diet. Foods. 2021 Sep; 10(9):2062. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8471366/, abgerufen am 14.03.2022.
Claus, S. et al. (2008): Systemic multicompartmental effects of the gut microbiome on mouse metabolic phenotypes. Mol Syst Biol. 2008;4:219. https://www.ncbi.nlm.nih.gov/pubmed/18854818, abgerufen am 22.07.2018.
Collado, M. et al. (2007): Role of commercial probiotic strains against human pathogen adhesion to intestinal mucus. Lett Appl Microbiol. 2007;45:454–460. https://www.ncbi.nlm.nih.gov/pubmed/17897389, abgerufen am 22.07.2018.
Costantini, L. et al (2017): Impact of Omega-3 Fatty Acids on the Gut Microbiota. Int J Mol Sci. 2017;7;18(12). https://www.ncbi.nlm.nih.gov/pubmed/29215589, abgerufen am 22.07.2018.
De Souza, A.Z. et al. (2015): Oral supplementation with L-glutamine alters gut microbiota of obese and overweight adults: A pilot study. Nutrition. 2015;31(6):884-9. https://www.ncbi.nlm.nih.gov/pubmed/25933498, abgerufen am 22.07.2018.
Deehan, E.C. et al. (2020): Precision Microbiome Modulation with Discrete Dietary Fiber Structures Directs Short-Chain Fatty Acid Production. Cell Host Microbe. 2020 Mar 11;27(3):389-404.e6. https://pubmed.ncbi.nlm.nih.gov/32004499/, abgerufen am 14.03.2022.
Del Bo, C. et al. (2020): A polyphenol-rich dietary pattern improves intestinal permeability, evaluated as serum zonulin levels, in older subjects: The MaPLE randomised controlled trial. Clin Nutr. 2021 May;40(5):3006-18. https://pubmed.ncbi.nlm.nih.gov/33388204/, abgerufen am 14.03.2022.
Di Nicolantonio, J.J. et al. (2014): Omega-3s and cardiovascular health. Ochsner J. 2014;14:399–412. https://www.ncbi.nlm.nih.gov/pubmed/25249807, abgerufen am 22.07.2018.
Du T. et al. (2022): The Beneficial Role of Probiotic Lactobacillus in Respiratory Diseases. Front Immunol. 2022; 13: 908010. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9194447/, abgerufen am 07.12.2023.
Esgalhado, M. et al. (2018): Could resistant starch supplementation improve inflammatory and oxidative stress biomarkers and uremic toxins levels in hemodialysis patients? A pilot randomized controlled trial. Food Funct. 2018 Dec 13;9(12):6508-16. https://pubmed.ncbi.nlm.nih.gov/30468238/, abgerufen am 14.03.2022.
Fang, Z. et al. (2021): Gut Microbiota, Probiotics, and Their Interactions in Prevention and Treatment of Atopic Dermatitis: A Review. Front Immunol. 2021; 12: 720393. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8317022/, abgerufen am 07.12.2023.
Fard, N.A. et al. (2023): A Potential Role for Gut Microbes in Mediating Effects of Omega-3 Fatty Acids in Inflammatory Bowel Diseases: A Comprehensive Review. Curr Microbiol. 2023 Oct 8;80(11):363. https://pubmed.ncbi.nlm.nih.gov/37807005/, abgerufen am 07.12.2023.
Feng, M. et al. (2018): LAT2 regulates glutamine-dependent mTOR activation to promote glycolysis and chemoresistance in pancreatic cancer. J Exp Clin Cancer Res. 2018 Nov 12;37(1):274. https://pubmed.ncbi.nlm.nih.gov/30419950/, abgerufen am 14.03.2022.
Fuentes‐Zaragoza, E. et al. (2011): Resistant starch as prebiotic: A review. Starch. 2011;63:(7):406-415. https://onlinelibrary.wiley.com/doi/full/10.1002/star.201000099, abgerufen am 22.07.2018.
Gao, C. et al. (2019): Resistant starch ameliorated insulin resistant in patients of type 2 diabetes with obesity: a systematic review and meta-analysis. Lipids Health Dis. 2019 Nov 24;18(1):205. https://pubmed.ncbi.nlm.nih.gov/31760943/, abgerufen am 14.03.2022.
Gröber, U. (2007): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 3. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Guandalini, S. (2011): Probiotics for prevention and treatment of diarrhea. J Clin Gastroenterol. 2011; 45 Suppl:149-53. https://www.ncbi.nlm.nih.gov/pubmed/21992955, abgerufen am 22.07.2018.
Guarino, M.P.L. et al. (2020): Mechanisms of Action of Prebiotics and Their Effects on Gastro-Intestinal Disorders in Adults. Nutrients. 2020 Apr;12(4):1037. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7231265/, abgerufen am 14.03.2022.
Guevara-Cruz, M. et al. (2020): Genistein stimulates insulin sensitivity through gut microbiota reshaping and skeletal muscle AMPK activation in obese subjects. BMJ Open Diabetes Res Care. 2020 Mar;8(1):e000948. https://pubmed.ncbi.nlm.nih.gov/32152146/, abgerufen am 14.03.2022.
Habtemariam, S. et al. (2018): Natural Therapies of the Inflammatory Bowel Disease: The Case of Rutin and its Aglycone, Quercetin. Mini Rev Med Chem. 2018;18(3):234-243. https://www.ncbi.nlm.nih.gov/pubmed/28117024, abgerufen am 22.07.2018.
Hemarajata, P. et al. (2013): Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation. Therap Adv Gastroenterol. 2013;6(1):39–51. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3539293, abgerufen am 22.07.2018.
Hu, X. et al. (2021): Effect of glutamine metabolism on chemoresistance and its mechanism in tumors. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2021 Feb 25;50(1):32-40. https://pubmed.ncbi.nlm.nih.gov/34117847/, abgerufen am 14.03.2022.
Hubert, M. (2017): Mikrobiom oft noch Jahre nach Antibiose verändert. Ärzte Zeitung online.2017.https://www.aerztezeitung.de/medizin/krankheiten/asthma/article/946429/menschliche-bakterienflora-mikrobiom-oft-noch-jahre-nach-antibiose-veraendert.html, abgerufen am: 22.07.2018.
Hughes, R.L. et al. (2021): Resistant Starch Type 2 from Wheat Reduces Postprandial Glycemic Response with Concurrent Alterations in Gut Microbiota Composition. Nutrients. 2021 Feb 17;13(2):645. https://pubmed.ncbi.nlm.nih.gov/33671147/, abgerufen am 14.03.2022.
Igwe, E.O. et al. (2019): A systematic literature review of the effect of anthocyanins on gut microbiota populations. J Hum Nutr Diet. 2019 Feb;32(1):53-62. https://pubmed.ncbi.nlm.nih.gov/29984532/, abgerufen am 14.03.2022.
Igwe, E.O. et al. (2020): Low anthocyanin plum nectar does not impact cognition, blood pressure and gut microbiota in healthy older adults: A randomized crossover trial. Nutr Res. 2020 Oct;82:74-87. https://pubmed.ncbi.nlm.nih.gov/32977254/, abgerufen am 14.03.2022.
Johnstone, A.M. et al. (2020): Nondigestible Carbohydrates Affect Metabolic Health and Gut Microbiota in Overweight Adults after Weight Loss. J Nutr. 2020 Jul 1;150(7):1859-70. https://pubmed.ncbi.nlm.nih.gov/32510158/, abgerufen am 14.03.2022.
Jumpertz, R. et al. (2011): Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am J Clin Nutr. 2011; 94:58–65. https://www.ncbi.nlm.nih.gov/pubmed/21543530, abgerufen am 22.07.2018.
Kawabata, K. et al. (2013): Flavonols enhanced production of anti-inflammatory substance(s) by Bifidobacterium adolescentis: prebiotic actions of galangin, quercetin, and fisetin. Biofactors. 2013; 9(4):422-429. https://www.ncbi.nlm.nih.gov/pubmed/23554103, abgerufen am 22.07.2018.
Ki Cha, B. et al. (2011): The effect of a multispecies probiotic mixture on the symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Gastroenterol. 2011; 46: 220–227. https://www.ncbi.nlm.nih.gov/pubmed/22157240, abgerufen am 22.07.2018.
Kim, H. et al. (2005): Metabolic and pharmacological properties of rutin, a dietary quercetin glycoside, for treatment of inflammatory bowel disease. Pharm Res. 2005; 22(9): 1499-509. https://www.ncbi.nlm.nih.gov/pubmed/16132362, abgerufen am 22.07.2018.
Kim, M.H. (2017): The Roles of Glutamine in the Intestine and Its Implication in Intestinal Diseases. Int J Mol Sci. 2017; 12; 18(5). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454963/, abgerufen am 22.07.2018.
Laffin, M.R. et al. (2019): Amylose resistant starch (HAM-RS2) supplementation increases the proportion of Faecalibacterium bacteria in end-stage renal disease patients: Microbial analysis from a randomized placebo-controlled trial. Hemodial Int . 2019 Jul;23(3):343-7. https://pubmed.ncbi.nlm.nih.gov/30924310/, abgerufen am 14.03.2022.
Larsen, N. et al. (2010): Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PLoS ONE. 2010;5:e9085. https://www.ncbi.nlm.nih.gov/pubmed/20140211, abgerufen am 22.07.2018.
Lee, B. et al. (2011): Irritable bowel syndrome, gut microbiota and probiotics. J Neurogastroenterol Motil. 2011;17: 252–266. https://www.ncbi.nlm.nih.gov/pubmed/21860817, abgerufen am 22.07.2018.
Ley, R.E. et al. (2006): Microbial ecology - human gut microbes associated with obesity. Nature. 2006; 444:1022–1023. https://www.ncbi.nlm.nih.gov/pubmed/28951525, abgerufen am 22.07.2018.
Liu, H. et al. (2020): Health beneficial effects of resistant starch on diabetes and obesity via regulation of gut microbiota: a review. Food Funct. 2020 Jul 22;11(7):5749-67. https://pubmed.ncbi.nlm.nih.gov/32602874/, abgerufen am 14.03.2022.
Liu, X. et al. (2021): Effect of probiotics on the nutritional status of severe stroke patients with nasal feeding that receive enteral nutrition: A protocol for systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore). 2021 Apr 30;100(17):e25657. https://pubmed.ncbi.nlm.nih.gov/33907128/, abgerufen am 14.03.2022.
Lockyer, S. et al. (2017): Health effects of resistant starch. Nutrition Bulletin. 2017; 42(1): 10-41. https://onlinelibrary.wiley.com/doi/full/10.1111/nbu.12244, abgerufen am 22.07.2018.
Macfarlane, S. et al. (2013): Synbiotic consumption changes the metabolism and composition of the gut microbiota in older people and modifies inflammatory processes: a randomised, double-blind, placebo-controlled crossover study. Aliment Pharmacol Ther. 2013;38(7): 804-16. https://www.ncbi.nlm.nih.gov/pubmed/23957631, abgerufen am 22.07.2018.
Mahmud, M.R. et al. (2022): Impact of gut microbiome on skin health: gut-skin axis observed through the lenses of therapeutics and skin diseases. Gut Microbes. 2022 Jan-Dec;14(1):2096995. https://pubmed.ncbi.nlm.nih.gov/35866234/, abgerufen am 07.12.2023.
Maier, L. et al. (2018): Extensive impact of non-antibiotic drugs on human gut bacteria. Nature. 2018;29:555(7698):623-628. https://www.ncbi.nlm.nih.gov/pubmed/29555994, abgerufen am 22.07.2018.
Mascaraque, C. et al. (2014): Rutin has intestinal antiinflammatory effects in the CD4+ CD62L+ T cell transfer model of colitis. Pharmacol Res. 2014;90:48-57. https://www.ncbi.nlm.nih.gov/pubmed/25281414, abgerufen am 22.07.2018.
Masisi, B.K. et al. (2020): The role of glutaminase in cancer. Histopathology. 2020 Mar;76(4):498-508. https://pubmed.ncbi.nlm.nih.gov/31596504/, abgerufen am 14.03.2022.
McFarlane, C. et al. (2019): Prebiotic, Probiotic, and Synbiotic Supplementation in Chronic Kidney Disease: A Systematic Review and Meta-analysis. J Ren Nutr. 2019 May;29(3):209-20. https://pubmed.ncbi.nlm.nih.gov/30366767/, abgerufen am 14.03.2022.
Meenu, M. & Xu, B. (2019): A critical review on anti-diabetic and anti-obesity effects of dietary resistant starch. Crit Rev Food Sci Nutr. 2019;59(18):3019-31. https://pubmed.ncbi.nlm.nih.gov/29846089/, abgerufen am 14.03.2022.
Molinari, R. et al. (2022): Polyphenols as modulators of pre-established gut microbiota dysbiosis: State-of-the-art. Biofactors. 2022 Mar;48(2):255-273. https://pubmed.ncbi.nlm.nih.gov/34397132/, abgerufen am 07.12.2023.
Monedero, V. et al. (2018): The Interactions between Host Glycobiology, Bacterial Microbiota, and Viruses in the Gut. Viruses. 2018 Feb 24;10(2):96. https://pubmed.ncbi.nlm.nih.gov/29495275/, abgerufen am 14.03.2022.
Montroy, J. et al. (2020): The effects of resistant starches on inflammatory bowel disease in preclinical and clinical settings: a systematic review and meta-analysis. BMC Gastroenterol. 2020 Nov 10;20(1):372. https://pubmed.ncbi.nlm.nih.gov/33167889/, abgerufen am 14.03.2022.
Nobaek, S. et al. (2000): Alteration of intestinal microflora is associated with reduction in abdominal bloating and pain in patients with irritable bowel syndrome. Am J Gastroenterol. 2000; 95:1231–1238. https://pubmed.ncbi.nlm.nih.gov/10811333/, abgerufen am 22.07.2018.
Nofrarías, M. et al. (2007): Long-term intake of resistant starch improves colonic mucosal integrity and reduces gut apoptosis and blood immune cells. Nutrition. Nov-Dec 2007;23(11-12):861-70. https://pubmed.ncbi.nlm.nih.gov/17936196/, abgerufen am 14.03.2022.
O’Shea, E. et al. (2011): Production of bioactive substances by intestinal bacteria as a basis for explaining probiotic mechanisms: bacteriocins and conjugated linoleic acid. Int J Food Microbiol. 2011;152:189–205. https://www.ncbi.nlm.nih.gov/pubmed/21742394, abgerufen am 22.07.2018.
O’Toole, P. et al. (2008): Probiotic bacteria influence the composition and function of the intestinal microbiota. Interdiscip Perspect Infect Dis. 2008:175–285. https://www.ncbi.nlm.nih.gov/pubmed/19277099, abgerufen am 22.07.2018.
Park, M. et al. (2020): Flavonoid-Rich Orange Juice Intake and Altered Gut Microbiome in Young Adults with Depressive Symptom: A Randomized Controlled Study. Nutrients . 2020 Jun 18;12(6):1815. https://pubmed.ncbi.nlm.nih.gov/32570775/, abgerufen am 14.03.2022.
Parolini, C. (2019): Effects of Fish n-3 PUFAs on Intestinal Microbiota and Immune System. Mar Drugs. 2019 Jun 22;17(6):374. https://pubmed.ncbi.nlm.nih.gov/31234533/, abgerufen am 14.03.2022.
Perna, S. et al. (2019): The Role of Glutamine in the Complex Interaction between Gut Microbiota and Health: A Narrative Review. Int J Mol Sci. 2019 Oct 22;20(20):5232. https://pubmed.ncbi.nlm.nih.gov/31652531/, abgerufen am 14.03.2022.
Pessemier, B. et al. (2021): Gut–Skin Axis: Current Knowledge of the Interrelationship between Microbial Dysbiosis and Skin Conditions. Microorganisms. 2021 Feb; 9(2): 353. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7916842/, abgerufen am 07.12.2023.
Pflughoeft, K. (2012): Human microbiome in health and disease. Annu Rev Pathol. 2012;7:99–122. https://www.ncbi.nlm.nih.gov/pubmed/21910623, abgerufen am 22.07.2018.
Qi, X. & Tester, R.F. (2019): Utilisation of dietary fibre (non-starch polysaccharide and resistant starch) molecules for diarrhoea therapy: A mini-review. Int J Biol Macromol. 2019 Feb 1;122:572-577. https://pubmed.ncbi.nlm.nih.gov/30391429/, abgerufen am 14.03.2022.
Qu, L. et al. (2022): COPD and Gut–Lung Axis: How Microbiota and Host Inflammasome Influence COPD and Related Therapeutics. Front Microbiol. 2022; 13: 868086. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9012580/, abgerufen am 07.12.2023.
Raghupathy, P. et al (2006): Amylase-resistant starch as adjunct to oral rehydration therapy in children with diarrhea. J Pediatr Gastroenterol Nutr. 2006;42(4):362-8. https://www.ncbi.nlm.nih.gov/pubmed/16641573, abgerufen am 22.07.2018.
Ramakrishna, B.S. et al. (2008): A randomized controlled trial of glucose versus amylase resistant starch hypo-osmolar oral rehydration solution for adult acute dehydrating diarrhea. PLoS One. 2008;13;3(2): e158. https://www.ncbi.nlm.nih.gov/pubmed/18270575, abgerufen am 22.07.2018.
Rapin, J.R. et al. (2010): Possible links between intestinal permeability and food processing: A potential therapeutic niche for glutamine. Clinics (Sao Paulo). 2010;65(6): 635-43. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2898551/, abgerufen am 22.07.2018.
Rinninella, E. et al. (2020): Food Additives, Gut Microbiota, and Irritable Bowel Syndrome: A Hidden Track. Int J Environ Res Public Health. 2020 Nov 27;17(23):8816. https://pubmed.ncbi.nlm.nih.gov/33260947/, abgerufen am 14.03.2022.
Rousseau, G. (2021): Microbiota, a New Playground for the Omega-3 Polyunsaturated Fatty Acids in Cardiovascular Diseases. Mar Drugs. 2021 Jan 23;19(2):54. https://pubmed.ncbi.nlm.nih.gov/33498729/, abgerufen am 14.03.2022.
Sender, R. et al. (2016Sender, R. et al. (2016): Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 2016 Aug; 14(8):e1002533. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4991899/, abgerufen am 14.03.2022.
Shadnoush, M. et al. (2015): Effects of Probiotics on Gut Microbiota in Patients with Inflammatory Bowel Disease: A Double-blind, Placebo-controlled Clinical Trial. Korean J Gastroenterol. 2015; 65(4): 215-21. https://www.ncbi.nlm.nih.gov/pubmed/25896155, abgerufen am 22.07.2018.
Shen, D. et al. (2017): Positive effects of resistant starch supplementation on bowel function in healthy adults: a systematic review and meta-analysis of randomized controlled trials. Int J Food Sci Nutr. 2017 Mar;68(2):149-157. https://pubmed.ncbi.nlm.nih.gov/27593182/, abgerufen am 14.03.2022.
Simon, E. et al. (2021): Probiotics, Prebiotics, and Synbiotics: Implications and Beneficial Effects against Irritable Bowel Syndrome. Nutrients. 2021 Jun; 13(6): 2112. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8233736/, abgerufen am 07.12.2023.
Sorboni, S.G et al. (2022): A Comprehensive Review on the Role of the Gut Microbiome in Human Neurological Disorders. Clin Microbiol Rev. 2022 Jan; 35(1): e00338-20. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8729913/, abgerufen am 07.12.2023.
Sorboni, S.G. et al. (2022): A Comprehensive Review on the Role of the Gut Microbiome in Human Neurological Disorders. Clin Microbiol Rev. 2022 Jan 19;35(1):e0033820. https://pubmed.ncbi.nlm.nih.gov/34985325/, abgerufen am 07.12.2023.
Spinler, J. et al. (2008): Human-derived probiotic Lactobacillus reuteri demonstrate antimicrobial activities targeting diverse enteric bacterial pathogens. Anaerobe. 2008;14:166–71. https://www.ncbi.nlm.nih.gov/pubmed/18396068, abgerufen am 22.07.2018.
Thomas, C. et al. (2010): Probiotics-host communication: modulation of signaling pathways in the intestine. Gut Microbes 2010; 1: 148–163. https://www.ncbi.nlm.nih.gov/pubmed/20672012, abgerufen am 22.07.2018.
Toscano, M. et al. (2017): Effect of Lactobacillus rhamnosus HN001 and Bifidobacterium longum BB536 on the healthy gut microbiota composition at phyla and species level: A preliminary study. World J Gastroenterol. 2017; 21;23(15):2696-2704. https://www.ncbi.nlm.nih.gov/pubmed/28487606, abgerufen am 22.07.2018.
Upadhyaya, B. et al. (2016): Impact of dietary resistant starch type 4 on human gut microbiota and immunometabolic functions. Scientific Reports volume 6, Article number: 28797 (2016). https://www.nature.com/articles/srep28797, abgerufen am 02.04.2019.
Verediano, T.A. et al. (2021): Effects of Anthocyanin on Intestinal Health: A Systematic Review. Nutrients. 2021 Apr 17;13(4):1331. https://pubmed.ncbi.nlm.nih.gov/33920564/, abgerufen am 14.03.2022.
Vetrani, C. et al. (2020): Diets naturally rich in polyphenols and/or long-chain n-3 polyunsaturated fatty acids differently affect microbiota composition in high-cardiometabolic-risk individuals. Acta Diabetol. 2020 Jul;57(7):853-60. https://pubmed.ncbi.nlm.nih.gov/32114641/, abgerufen am 14.03.2022.
Vijay, A. & Valdes, A.M. (2021): Role of the gut microbiome in chronic diseases: a narrative review. Eur Jou Clinc Nut. 2021 Sep; 76: 489-501. https://www.nature.com/articles/s41430-021-00991-6, abgerufen am 07.12.2023.
Ward, R.E. et al. (2016): A High Flavonoid Diet Reduces Gut Permeability, Short Chain Fatty Acid Production and Decreases Gut Inflammation in Overweight and Obese Men and Women. Faseb Journal. 2016;30:1. https://www.fasebj.org/doi/abs/10.1096/fasebj.30.1_supplement.420.5, abgerufen am 22.07.2018.
Warner, B.B. et al. (2016): Gut bacteria dysbiosis and necrotising enterocolitis in very low birthweight infants: a prospective case-control study. The Lancet. 2016; 387;10031:1928–1936. https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(16)00081-7/fulltext, abgerufen am 22.07.2018.
Watson, H. et al. (2017): A randomised trial of the effect of omega-3 polyunsaturated fatty acid supplements on the human intestinal microbiota. Gut. 2017; 26;2017-314968. https://www.ncbi.nlm.nih.gov/pubmed/28951525, abgerufen am 22.07.2018.
Weersma, R.K. et al. (2020): Interaction between drugs and the gut microbiome. Gut. 2020 Aug; 69(8): 1510–19. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7398478/, abgerufen am 14.03.2022.
Wu, X. et al. (2021): Gastrointestinal microbiome and gluten in celiac disease. Ann Med. 2021; 53(1): 1797–1805. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8519548/, abgerufen am 07.12.202 .
Xi, N. et al. (2011): Probiotics in Clostridium difficile Infection. J Clin Gastroenterol. 2011; 45:154–158. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5322762/, abgerufen am 22.07.2018.
Xiong, H. et al. (2023): The Interaction between Flavonoids and Intestinal Microbes: A Review. Foods. 2023 Jan; 12(2): 320. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9857828/, abgerufen am 07.12.2023.
Xiong, K. et al. (2021): Effects of resistant starch on glycaemic control: a systematic review and meta-analysis. Br J Nutr. 2021 Jun 14;125(11):1260-9. https://pubmed.ncbi.nlm.nih.gov/32959735/, abgerufen am 14.03.2022.
Yang, X. et al (2017): Resistant Starch Regulates Gut Microbiota: Structure, Biochemistry and Cell Signalling. Cell Physiol Biochem. 2017;42:306–318. https://www.karger.com/Article/FullText/477386, abgerufen am 22.07.2018.
Yoshida, S. et al. (2001): Glutamine supplementation in cancer patients. Nutrition. 2001 Sep;17(9):766-8. https://pubmed.ncbi.nlm.nih.gov/11527675/, abgerufen am 14.03.2022.
Zhang, L. et al. (2019): Metabolic phenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial. Sci Rep . 2019 Mar 20;9(1):4736. https://pubmed.ncbi.nlm.nih.gov/30894560/, abgerufen am 14.03.2022.
Zhang, Y. et al. (2019): Potential of Omega-3 Polyunsaturated Fatty Acids in Managing Chemotherapy- or Radiotherapy-Related Intestinal Microbial Dysbiosis. Adv Nutr . 2019 Jan 1;10(1):133-47. https://pubmed.ncbi.nlm.nih.gov/30566596/, abgerufen am 14.03.2022.
Zhou, Z. et al (2013): Effect of resistant starch structure on short‐chain fatty acids production by human gut microbiota fermentation in vitro. Starch. 2013; 65;(5-6): 509-516. https://onlinelibrary.wiley.com/doi/abs/10.1002/star.201200166, abgerufen am 22.07.2018.

