Die Aminosäure Cystein ist Baustein fast aller Eiweiße. Als Bestandteil des Struktureiweißes Keratin sorgt es für starke Haare und Nägel. Auch das Immunsystem braucht Cystein für die Aktivität und Kontrolle von Entzündungen. Ein mögliches Einsatzgebiet in der Mikronährstoffmedizin ist daher die Unterstützung der Wundheilung. Außerdem ist Cystein ein Grundstoff für Antioxidantien, welche oxidativen Stress lindern. Damit trägt es vermutlich zur Vorbeugung von Alterserkrankungen bei. Cystein ist auch an der Entgiftung in der Leber beteiligt. Erfahren Sie hier, wie Cystein wirkt und wann man es einsetzt.
Eigenschaften und Vorkommen in Lebensmitteln
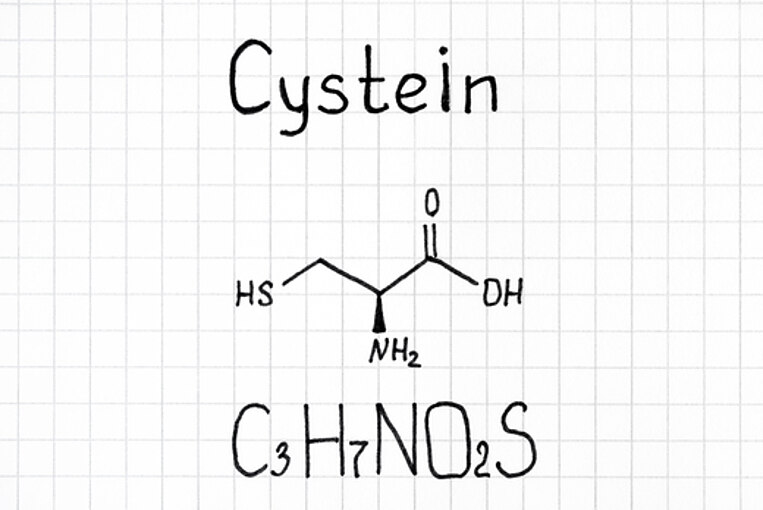
Was ist Cystein und welche Eigenschaften hat es?
Cystein ist eine schwefelhaltige Aminosäure. Sie kann aus den Aminosäuren Methionin und Serin vom Körper selbst gebildet werden. Methionin muss jedoch über die Ernährung zugeführt werden, weshalb Cystein zu den bedingt lebensnotwendigen (semi-essenziellen) Aminosäuren zählt. Als Aminosäure ist Cystein Baustein von Eiweißen. In der Lebensmittelindustrie wird es auch als Zusatzstoff zur Behandlung von Mehl eingesetzt (E 920).
Es gibt zwei Formen: L- und D-Cystein. Im Körper spielt nur L-Cystein eine Rolle. Daher ist im Folgenden auch immer diese Form gemeint, wenn von Cystein gesprochen wird.
Info
Von Cystein leitet sich die Verbindung N-Acetylcystein ab. Sie wird unter anderem bei Atemwegserkrankungen als Hustenlöser eingesetzt.
Cysteingehalt in Lebensmitteln
Cystein kommt als Eiweißbestandteil besonders in tierischen sowie eiweißreichen pflanzlichen Lebensmitteln vor. Hohe Mengen sind zum Beispiel enthalten in Fisch, Meeresfrüchten, Fleisch sowie Eiern und Käse, Hülsenfrüchten, Nüssen und Pilzen.
In der Lebensmittelherstellung wird Cystein außerdem als Backhilfsmittel in Teigwaren und als Fleisch- und Röstaroma in vegetarischen Lebensmitteln verwendet. Daneben wird es Säuglingsmilchnahrung zugesetzt.
Je nach Ernährungsform nimmt man in Westeuropa zusammen 2.000 bis 4.000 Milligramm Cystein und Methionin pro Tag zu sich. In den USA wird die Aufnahme von Cystein allein auf 1.000 Milligramm pro Tag geschätzt.
5 wichtige Cystein-Lieferanten: | Milligramm (mg) pro 100 Kilokalorien (kcal) | Milligramm pro 100 Gramm (g) |
|---|---|---|
Steinpilze | 1.650 | 480 |
Seezunge | 440 | 419 |
Limabohnen | 410 | 280 |
Sojabohnen | 400 | 590 |
Macadamianuss | 140 | 980 |
Bedarf und Funktionen im Körper
Wie hoch ist der tägliche Bedarf an Cystein?

In Deutschland wurde keine Zufuhrempfehlung festgelegt, denn die Leber bildet Cystein selbst. So deckt sie einen großen Teil des Tagesbedarfs von etwa 780 bis 900 Milligramm ab. Für die Bildung wird die Aminosäure Methionin benötigt. Sie muss allerdings über die Nahrung aufgenommen werden.
In den USA wird dagegen für Erwachsene ein Bedarf an Cystein von 6,6 Milligramm pro Kilogramm Körpergewicht angegeben, der über die Ernährung sicherzustellen ist. Bei einem Gewicht von 60 Kilogramm sind dies knapp 400 Milligramm.
Nur Neugeborene sind noch nicht in der Lage, Cystein selbst herzustellen. Deshalb sind sie auf eine Aufnahme über Muttermilch oder Säuglingsmilch angewiesen.
Aufnahme und Speicherung von Cystein
Cystein wird bei der Verdauung von Eiweiß im Magen und Dünndarm freigesetzt. Es wird über Transporter in der Darmwand aufgenommen. Anschließend wird Cystein zur Leber befördert oder über den Blutkreislauf verteilt. Die Zellen nehmen es auf und nutzen es für den Stoffwechsel.
Info
Die Zellen können Cystein zwar sehr gut aufnehmen, allerdings oxidiert es schnell und liegt dann als Cystin vor. Dieses wird deutlich schlechter aufgenommen. Darum wird in Mikronährstoffpräparaten häufig die Verbindung N-Acetylcystein eingesetzt.
Beim Abbau von Cystein entstehen Stoffe wie Harnstoff, Ammoniak, Harnsäure, Schwefelverbindungen und Kreatinin. Sie werden über den Urin ausgeschieden. Etwa 80 bis 85 Prozent verlassen den Körper über die Nieren. Der nicht im Darm aufgenommene Rest wird mit dem Stuhl entsorgt.
Welche Wirkung hat Cystein?
Cystein ist in fast allen Eiweißen des Körpers enthalten und erfüllt dabei spezielle Funktionen: Es stabilisiert die dreidimensionale Struktur von Eiweißen und sorgt als Bestandteil vieler Enzyme für ihre Funktion (aktives Zentrum zum Beispiel bei Cysteinproteasen).
Oxidativer Stress und Entgiftung: Cystein trägt zum oxidativen Gleichgewicht bei (Redoxgleichgewicht). Es ist die Vorstufe von Taurin, Schwefelwasserstoff und Glutathion. Diese Verbindungen beeinflussen chemische Prozesse und fangen Radikale ab. Dadurch hemmen sie oxidativen Stress, vor allem an Eiweißverbindungen und Zellhüllen (Membranen). Zudem ist Glutathion an der Entgiftung von schädlichen körperfremden Stoffen beteiligt.
Zuckerstoffwechsel: Cystein und daraus hergestellter Schwefelwasserstoff sind Signalstoffe, die den Blutzucker beeinflussen. Sie senken die Insulinausschüttung. Bei Diabetes findet man gestörte Spiegel an Cystein und Schwefelwasserstoff. Die genaue Bedeutung kennt man noch nicht. Offensichtlich aber ist die antioxidative Wirkung von Cystein bei Diabetes wichtig: Oxidativer Stress vermindert die Insulinwirkung (Insulinresistenz).
Fettstoffwechsel: Cystein und seine Vorstufe Methionin sind wichtig für die Bildung von bestimmten Fetten. Diese werden für den Aufbau der Zellmembran gebraucht. Untersuchungen zeigen außerdem, dass Cystein und Schwefelwasserstoff als Signalstoffe die Einlagerung von Fetten in die Zellen steigern. Schwefelwasserstoff dämpft darüber hinaus Entzündungen im Fettgewebe. Fettzellen produzieren eine Reihe von entzündungsfördernden Stoffen.
Blutdruck: Schwefelwasserstoff aus Cystein wirkt auf die Gefäße. Er verstärkt unter anderem die gefäßerweiternde Wirkung des Signalstoffs Stickstoffmonoxid (NO) und trägt so zur Blutdrucksenkung bei.
Aufbau von Haut, Haaren und Nägeln: Cystein ist ein Grundstoff des Struktureiweißes Keratin. Der Cysteingehalt in den Nägeln und Haaren beträgt etwa 10 bis 14 Prozent. Cystein vernetzt die Keratinmoleküle und sorgt so für Festigkeit. Je mehr Vernetzungen es gibt, umso härter ist das Keratin. Daher ist Cystein wichtig für den Aufbau von Haut, Haaren und Nägeln.
Muskel: Cystein ist ein wichtiger Eiweißbaustein der Muskulatur. Vor allem im Sport sollte es für die Bildung von Muskeln in ausreichendem Maß zur Verfügung stehen. Vermutlich verbessert Cystein die Muskelfunktion. Darüber hinaus wird es bei der Muskelarbeit verbraucht.
Immunsystem: Cystein und daraus hergestellter Schwefelwasserstoff regulieren die Immunantwort. Schon eine leichte Anhebung des Cysteinspiegels regt die Aktivität und Bildung einiger Immunzellen an. Demgegenüber verbraucht ein aktives Immunsystem vermehrt Cystein, sodass es bei Erkrankungen mit einer Immunschwäche (wie HIV) vermehrt verloren geht. In dieser Situation konnte die Immunfunktion durch die Ergänzung von N-Acetylcystein gebessert werden. Außerdem wirkt Schwefelwasserstoff aus Cystein antientzündlich. Daten liegen zum Beispiel vor zu Rheuma, Asthma, Heuschnupfen und Magen-Darm-Erkrankungen.
Mangel erkennen und beheben
Anzeichen eines Cysteinmangels
Ein Mangel an Cystein wird selten festgestellt. Der Körper kann es aus anderen Aminosäuren selbst bilden. Möglich ist aber eine Unterversorgung, wenn nicht genug Vorläuferaminosäuren zur Verfügung stehen (vor allem Methionin).
Eindeutige Symptome einer Unterversorgung sind nicht erfasst. Allerdings ist Cystein an vielen Stoffwechselvorgängen und der Immunfunktion beteiligt. Daher ist denkbar, dass sich eine zu geringe Versorgung durch oxidativen Stress oder eine erhöhte Anfälligkeit für Infektionen äußert. Auch könnten eine schlechte Haut- und Haargesundheit sowie eine schlechte Wundheilung auf eine Unterversorgung hindeuten.
Wer hat ein erhöhtes Risiko einer Unterversorgung?
In bestimmten Situationen kann ein erhöhtes Risiko für eine Unterversorgung bestehen. Dazu gehören:
Mangel- und Unterernährung: Bei einer unausgewogenen Ernährung ist eine Unterversorgung mit Cystein oder der Vorstufe Methionin möglich. Auch können bei Magen-Darm-Erkrankungen Eiweiße schlecht gespalten und Aminosäuren ins Blut aufgenommen werden. Zudem ist Cystein in einer künstlichen Ernährung durch Infusionen oft nicht enthalten.
Vegetarier und Veganer: Bei einer vegetarischen oder veganen Ernährung ist die Eiweißzusammensetzung nicht immer optimal. Viele Eiweißquellen enthalten zu wenig Methionin, ohne das Cystein nicht gebildet werden kann.
Alkoholkrankheit: Eine alkoholische Lebererkrankung beeinträchtigt die Verfügbarkeit von Cystein. Es kommt vermehrt zu oxidativem Stress und einem hohen Verbrauch von Glutathion. Um neues Glutathion herzustellen, ist Cystein nötig. Eine allgemeine Mangelernährung durch die Alkoholabhängigkeit und eine Störung des Stoffwechsels behindern den Nachschub an Cystein zusätzlich.
Alter und chronische Erkrankungen: Im Alter ist der Bedarf an Antioxidantien wie Glutathion erhöht. Der oxidative Stress nimmt zu, während der Cysteinspiegel fällt. Auch bei vielen Erkrankungen besteht ein erhöhter Bedarf. Dazu gehören Infektionen, Atemwegserkrankungen (COPD, Bronchitis), Leberschäden, Rheuma und Gelenkentzündungen (Arthritis), Parkinson und Gefäßverkalkung (Arteriosklerose).
Ist ein Cystein-Bluttest sinnvoll?
In der Regel wird Cystein im Blut nicht gemessen. Die Werte schwanken stark und sind abhängig von der Nahrungsaufnahme. Die Normalwerte liegen im Blutserum zwischen 33 bis 82 Mikromol pro Liter.
Cystein im Serum in Mikromol pro Liter (µmol/l) | |
|---|---|
Normalwert | 33 bis 82 (Mittelwert 38) |
Unterversorgung mit Cystein ausgleichen
Es liegen keine genauen Daten zur Dosierung bei einer Unterversorgung vor. In Studien wurden bei Erkrankungen, bei denen eine Cystein-Unterversorgung vorliegen kann, 50 bis 200 Milligramm pro Tag eingesetzt.
Dosierungsempfehlung von Cystein am Tag | |
|---|---|
Unterversorgung | 50 bis 200 Milligramm (mg) |
Einsatz bei Krankheiten und gesundem Altern
Cystein stärkt vermutlich Haare und Nägel
In Haaren und Nägeln ist Keratin das häufigste Eiweiß. Cystein ist für die Vernetzung von Keratin zuständig. Keratin wiederum macht Haare und Nägel stabil. Die Wachstumsrate, die Haardicke und die Eiweißbildung im Haar hängen demnach von der Versorgung mit Cystein ab. Ein Mangel dürfte die Gesundheit von Haaren und Nägeln beeinträchtigen. Bei Haarausfall sollte Cystein auf alle Fälle verfügbar sein.
In mehreren kleinen hochwertigen Studien und Vorstudien wirkte Cystein in Kombination mit anderen Mikronährstoffen gegen diffusen oder angeborenen Haarausfall. Dabei wurden weniger Haarausfall, mehr Haarwachstum und eine erhöhte Dichte oder Qualität der Haare gemessen. Oft normalisierte sich auch die Wachstumsphase des Haars wieder. Kombinationspräparate enthielten unter anderem Vitamin A, Vitamin B1, Pantothensäure, Kupfer, Zink, Gelatine (Kollagen), medizinische Hefe, Hirsesamen-Extrakt und Methionin.
Noch ist unklar, welchen Einfluss Cystein allein hat. Es wurde nur mit anderen Mikronährstoffen zusammen getestet, da viele Stoffe am Haarwachstum beteiligt sind. Aufgrund der vielversprechenden Ergebnisse sind täglich 50 bis 100 Milligramm Cystein als Bestandteil eines Kombinationspräparats einen Versuch wert. Das Präparat sollte vier bis sechs Monate lang eingenommen werden.
Tipp
Welche weiteren Mikronährstoffe für ein gesundes Haarwachstum wichtig sind, erfahren Sie im Text zum Thema Haarausfall.

Cystein für die Wundheilung
Als Bestandteil von Struktureiweißen und Enzymen wird Cystein bei der Erneuerung von Geweben benötigt. Zudem hat es antioxidative, entzündungshemmende und durchblutungsfördernde Eigenschaften. Das ist wichtig für eine gute Wundheilung. Möglicherweise verbessert Cystein so die Wundheilung von außen (Haut) und innen (Schleimhaut).
In zwei Vorstudien beschleunigte Cystein nach einer Augenoperation die Heilung der Augenhornhaut. Auch eine Ergänzung zusammen mit allen lebensnotwendigen Aminosäuren linderte in einer kleinen Vorstudie Druckgeschwüre der Haut (Dekubitus). Etwa die Hälfte der Geschwüre wurde sogar vollständig geheilt.
Darüber hinaus gibt es Studien zum Schutz der Schleimhäute: In einer hochwertigen Studie senkte Cystein Blutungen und förderte die Heilung von Schäden einer Magenschleimhautentzündung durch Schmerzmittel (nicht steroidales Antirheumatikum (NSAR)). Forscher vermuten auch einen Schutz vor Schäden durch Alkohol an der Magenschleimhaut. Untersucht wurden Personen mit dem Magenkeim Helicobacter pylori. Zudem verbesserte Cystein die Wirkung eines entzündungshemmenden Medikaments bei Zwölffingerdarmgeschwüren. In der hochwertigen Studie sank die Rückfallrate von 61 auf 6 Prozent im Jahr nach der Einnahme.
Fazit: Cystein ist wichtig für die Wundheilung. Allerdings gibt es bisher nur wenig Belege. Zur Unterstützung können Kombinationspräparate für die Haut mit 100 bis 200 Milligramm sinnvoll sein, zum Beispiel mit B-Vitaminen und Zink. In den ersten Studien wurden auch 400 bis 800 Milligramm pro Tag eingesetzt. Bei dieser Dosierung sollte vorher mit einem Arzt oder Mikronährstoff-Experten gesprochen werden.
Cystein gegen oxidativen Stress: Anti-Aging, Diabetes und Herz-Kreislauf-Gesundheit
Cystein ist ein Baustein von Glutathion – eines der wichtigsten Antioxidantien. Glutathion schützt die Zellen vor freien Radikalen und hemmt Entzündungen. Ein Mangel spielt eine Schlüsselrolle beim Altern und bei der Entstehung von Erkrankungen wie Herz-Kreislauf-Erkrankungen, Krebs sowie Diabetes. Besonders bei chronischen Entzündungen ist Glutathion wichtig, um oxidativen Schaden vom Gewebe abzuwenden.
Laut einer Beobachtungsstudie ist eine cysteinreiche Ernährung mit einem niedrigen Schlaganfallrisiko verbunden. Zudem wurde eine vermehrte Umwandlung (Oxidation) von Cystein zu Cystin bei Risikofaktoren beobachtet, wie steigendem Alter, Rauchen, Übergewicht und Alkoholkonsum. Vermutlich löst die oxidierte Form Cystin entzündungsfördernde Signale aus.
In einer Vorstudie wurde gezeigt, dass das oxidative Gleichgewicht im Blut mit dem Cysteingehalt der Nahrung zusammenhing: Eine angemessene Zufuhr von Aminosäuren führte zu erhöhten Cysteinspiegeln und zu weniger oxidativem Stress. In einer Übersichtsarbeit kommen Forscher zu dem Schluss, dass Präparate mit Cystein oxidativen Stress bei Typ-2-Diabetes senken. Gezeigt wurde dies für die Kombination mit Chrom oder cysteinreichem Eiweiß. Das dürfte auch die Insulinwirkung und die Blutzuckerspiegel verbessern.
Fazit: Erste Daten deuten darauf hin, dass Cystein oxidativen Stress lindert. Mikronährstoff-Experten empfehlen für einen guten antioxidativen Schutz 30 bis 50 Milligramm Cystein zusammen mit weiteren Antioxidantien, zum Beispiel Vitamin C und E. Da zu viel Cystein auch nachteilig wirken kann, sollte es nicht überdosiert werden.
Expertenwissen
Bei einer bestimmten genetischen Veranlagung (Polymorphismus der Glutamatcysteinligase) kann der Köper aus Cystein nur wenig Glutathion herstellen. Dann tritt vermehrt oxidativer Stress auf und es kommt oft zu Folgeerkrankungen wie Schizophrenie, Herz-Kreislauf-Erkrankungen, Schlaganfall und Asthma. Auch im Alter oder bei Diabetes kann dies der Fall sein. Ob hier eine Ergänzung mit Cystein hilft, muss noch geprüft werden. Auf alle Fälle braucht der Körper ausreichend Antioxidantien.
Cystein für die Entgiftung
Cystein ist für die Entgiftung von Fremdstoffen wie Medikamenten wichtig. Dabei braucht der Körper auch vermehrt Glutathion, das aus Cystein hergestellt wird:
- Glutathion kann die Leberentgiftung bei der Umwandlung nicht ausscheidbarer Stoffe unterstützen. Es wird durch Enzyme an bestimmte Schadstoffe angehängt, wodurch diese wasserlöslich werden. So ermöglicht Glutathion die Ausscheidung der Stoffe über die Gallenflüssigkeit und den Urin. Cystein ist außerdem an der Entgiftung von Alkohol und Paracetamol beteiligt.
- Cystein bindet Schwermetalle. Es ist ein Baustein von metallbindenden Eiweißen (Metallothioninen), welche die Metalle „festhalten“. Laborversuche zeigen dies unter anderem für Blei, Cadmium, Silber, Quecksilber, Bismut und Arsen. Diese Eiweiße entgiften damit Schwermetalle, können aber auch zu Ablagerungen im Körper führen.
Expertenwissen
Zwar wird durch Cystein die Ausscheidung von Quecksilber gefördert, es mobilisiert das Schwermetall jedoch auch. Das zeigen Tier- und Zellstudien. Cystein könnte daher die Aufnahme von Methylquecksilber in die Zellen und ins Gehirn fördern. Dabei bildet sich ein Komplex mit Methylquecksilber, der über Transporter für Methionin ins Gehirn gelangen kann. Passiert dies, kann es schädlich sein. Cystein sollte daher nicht allein und auch nicht dauerhaft hoch dosiert ergänzt werden. Möglicherweise kann die Komplexbildung durch Antioxidantien wie Vitamine abgefangen werden.
In einer Beobachtungsstudie mit älteren Personen stieg durch eine Paracetamol-Behandlung der Bedarf an Aminosäuren zur Entgiftung. Wird dieser nicht gedeckt, ist eine verminderte antioxidative Abwehr möglich. Darüber hinaus zeigen zwei Vorstudien: Ein Präparat, das Cystein langsam freisetzt, senkte ein krebserregendes Abbauprodukt von Alkohol (Acetaldehyd) um bis zu zwei Drittel. Somit könnte Cystein das Krebsrisiko im oberen Magen-Darm-Trakt mindern. Bisher liegen jedoch wenige Studien vor. Etwas mehr Daten gibt es dagegen zur Verbindung N-Acetylcystein bei Vergiftungen mit Schwermetallen wie Blei oder zu Nebenwirkungen durch Paracetamol.
Fazit: Cystein wird theoretisch für Entgiftungsreaktionen gebraucht. Studien gibt es aber erst wenige. Insgesamt sollte für eine gute Entgiftung jedoch ausreichend Cystein über die Ernährung verfügbar sein. Mikronährstoff-Experten empfehlen dafür 150 Milligramm pro Tag. Idealerweise wird es mit anderen Stoffen kombiniert, wie Antioxidantien.
Bei einer akuten Belastung empfehlen Mikronährstoff-Experten auch manchmal eine höhere Dosierung, zum Beispiel 200 bis 800 Milligramm N-Acetylcystein. Die genaue Dosis legt dann der Therapeut fest. Auch sollte er die Behandlung begleiten.
Dosierungen auf einen Blick
Dosierungsempfehlung von Cystein pro Tag in Milligramm (mg) | |
|---|---|
Haarausfall und Nagelprobleme | 50 bis 100 (in Kombination mit anderen Mikronährstoffen) |
Wundheilung | 100 bis 200 (in Kombination mit anderen Mikronährstoffen) 400 bis 800 (hoch dosiert, unter therapeutischer Kontrolle) |
Oxidativer Stress (Anti-Aging, Diabetes und Herz-Kreislauf-Erkrankungen) | 30 bis 50 (in Kombination mit weiteren Antioxidantien) |
Entgiftung | 150 (in Kombination mit weiteren Antioxidantien) akute Belastung: 200 bis 800 als N-Acetylcystein (unter therapeutischer Kontrolle) |
Einnahmeempfehlung
Wann und wie sollte man Cystein zusätzlich einnehmen?
Cystein wird normalerweise zum Großteil aus Methionin in der Leber hergestellt. Über die Ernährung bekommt man es zudem vor allem über Pilze, Fisch und Fleisch. Eine Portion Steinpilze liefert beispielsweise bis zu 480 Milligramm. Bei einer ausgewogenen Ernährung ist die Einnahme daher im Normalfall nicht nötig.
Für einen gezielten Einsatz in bestimmten Situationen empfehlen Mikronährstoff-Experten jedoch Präparate. Der Gehalt von Cystein in Lebensmitteln schwankt, sodass sich die Menge nicht genau bestimmen lässt.
Cystein wird am besten zum Essen eingenommen. Das verbessert die Verträglichkeit für den Magen. Müssen gleichzeitig Präparate mit hoch dosierten Mineralstoffen ergänzt werden, ist ein Abstand von zwei Stunden ratsam. Dazu gehört zum Beispiel Eisen oder Zink bei einem Mangel. Cystein könnte die Aufnahme von Zink und Eisen verbessern, sodass die Dosierung schlechter kontrollierbar wird.
Grundsätzlich ist Cystein im Körper instabil und wird schnell umgebaut (oxidiert). Um dies zu verhindern, sollte auf eine ausreichende Versorgung mit Antioxidantien geachtet werden – entweder durch Obst und Gemüse oder durch eine Ergänzung über ein Kombinationspräparat.
Worauf man beim Kauf von Cystein achten sollte
Meist empfehlen Mikronährstoff-Experten ein Kombinationspräparat. Dieses sollte zum Beispiel Antioxidantien enthalten, um einen schnellen Umbau (Oxidation) von Cystein zu verhindern. Daneben könnte die Kombination mit B-Vitaminen sinnvoll sein. Sie sorgen dafür, dass der Körper Cystein aus Methionin selbst herstellen kann. Dazu gehören Vitamin B2, B6, B12 und Folsäure.
Cystein wird traditionell aus tierischen Ausgangsstoffen gewonnen wie Federn oder Haaren. Es gibt aber auch vegane Alternativen, bei denen es mittels Fermentation durch Bakterien hergestellt wird. In guten Produkten wird dabei auf gentechnikfreie Rohstoffe geachtet.
Zudem ist es wichtig, dass Präparate keine Rückstände aus der Herstellung enthalten, wie Lösungsmittel, Mikroorganismen, Beiprodukte aus der Fermentation oder Schwermetalle. Seriöse Hersteller achten daher auf die korrekte Produktion und hohe Reinheit der Präparate.
Darüber hinaus sind hochwertige Präparate frei von Allergenen, überflüssigen Zusatzstoffen wie Aroma- oder Farbstoffe sowie Süßungsmittel.
Überdosierung, Wechselwirkungen und Hinweise bei Erkrankungen
Ist eine Überdosierung mit Cystein möglich?
Cystein gilt in den Mengen, wie sie in der Nahrung vorkommen, als ungefährlich und sicher. Pro Tag sind dies schätzungsweise 1.000 Milligramm.
Studien zur Sicherheit und Verträglichkeit über Präparate gibt es bisher wenig, sodass keine klaren Höchstwerte abgeleitet werden können. Experten für Lebensmittelsicherheit aus Norwegen schätzen eine Dosierung bis 750 Milligramm pro Tag als unproblematisch ein. Ab täglich 1.000 Milligramm vermuten sie nachteilige Auswirkungen auf die Gesundheit.
Ein dauerhaft erhöhter Cysteinspiegel kann die Zellen und Nerven schädigen. Im Tierversuch steigerten sehr hohe Dosen die Sterberate um die Hälfte. Zur Sicherheit sollte Cystein langfristig nicht über mehrere Monate in hohen Dosen von über 200 bis 400 Milligramm genommen werden.
Cystein: zu beachten bei Diabetesmedikamenten und beginnendem Diabetes
Cystein könnte den Zuckerstoffwechsel verbessern. Vor allem Diabetiker, die zuckersenkende Medikamente einnehmen, sollten den Blutzucker engmaschig kontrollieren, um eine Unterzuckerung zu vermeiden. Menschen mit Diabetes haben oft sehr niedrige Werte an Cystein und daraus gebildetem Schwefelwasserstoff.
In bestimmten Diabetesstadien können die Spiegel jedoch auch erhöht sein. Dies ist möglicherweise verbunden mit einer geringeren Abgabe von Insulin ins Blut und einer Schädigung der Bauchspeicheldrüse. Es ist nicht bekannt, wie sich Cystein auf die Diabetesentwicklung auswirkt. Daher sollten bei beginnendem Diabetes ohne ärztlichen Rat keine hoch dosierten Präparate eingesetzt werden.
Cystein kann die Antibiotikawirkung hemmen
Es wurde festgestellt, dass hohe Dosen an Cystein die Wirkung von Antibiotika verringern. Noch kann nicht abgeleitet werden, welche Dosis unproblematisch wäre. Sicherheitshalber sollte Cystein daher nicht bei einer Antibiotikabehandlung eingenommen werden. Zu den betroffenen Wirkstoffen gehören beispielsweise Ampicillin (wie Binotal®), Amoxicillin (wie Amoxibeta®, Amoxypen®) und Cefazolin (wie Basocef®).
Vorsicht bei Blutdruckmedikamenten (Nitrate)
Blutdruckmittel aus der Gruppe der Nitrate erweitern die Blutgefäße. Cystein und Schwefelwasserstoff können diese Wirkung verstärken, wie Laborversuche zeigen. Daher sollte es nicht mit solchen Blutdrucksenkern kombiniert werden. Das betrifft beispielsweise Nitroglycerin (wie Deponit®, Nitrangin®), Isosorbiddinitrat (wie Isoket®) oder Isosorbidmononitrat (wie Mono Mack®).
Zu beachten bei Parkinson-Medikamenten, Nervenkrankheiten und dem Down-Syndrom
Bei der Behandlung mit dem Parkinsonmittel L-Dopa wurden erhöhte Spiegel an Cystein gefunden. Zudem könnten L-Dopa und Cystein beim Vorliegen von oxidativem Stress zu Stoffen umgebaut werden, welche die Nerven schädigen. Bei Parkinson sollte die Ergänzung daher unter ärztlicher Aufsicht erfolgen.
Zudem wurden bei anderen Nervenerkrankungen wie Amyotropher Lateralsklerose oder Alzheimer sowie dem Down-Syndrom Entgleisungen im Cysteinabbau beobachtet. Ursache sind veränderte Gene. Eine Einnahme sollte daher mit einem Experten abgesprochen werden.
Cystein ist in der Schwangerschaft und Stillzeit nicht empfehlenswert
Bisher gibt es zu wenig Daten zur Sicherheit von Cystein in der Schwangerschaft und Stillzeit. Erste Labor- und Tierversuche zeigen Risiken für Fehlentwicklungen. Daher sollte in dieser Zeit auf Präparate verzichtet werden. Eine übliche Zufuhr über Lebensmittel ist dagegen unbedenklich.
Cystein: zu beachten bei Risikofaktoren für Herz-Kreislauf-Erkrankungen
Bei Herz-Kreislauf-Erkrankungen ist oft zu viel oxidiertes Cystein (Cystin) im Blut. Höhere Konzentrationen findet man auch bei Risikofaktoren wie höherem Alter, Rauchen und Alkoholmissbrauch. Cystin fördert wahrscheinlich eine Arterienverkalkung. Bei Herz-Kreislauf-Erkrankungen oder bestehenden Risikofaktoren sollte daher der oxidative Status überwacht werden, wenn Cystein hoch dosiert für längere Zeit eingenommen wird. Antioxidantien wie Vitamine sollten theoretisch das Problem beheben.
Es ist möglich, dass Personen mit erhöhtem Homocysteinspiegel auch einen erhöhten Cysteinwert haben. Cystein könnte dann ähnlich schädlich für die Gefäße sein. Personen mit einem erhöhten Homocysteinspiegel sollten die Ergänzung mit dem Arzt oder Mikronährstoff-Experten besprechen.
Cystein könnte Übergewicht begünstigen
Bei Übergewicht und Fettleibigkeit beobachteten Forscher erhöhte Cysteinspiegel. Ein hoher Spiegel könnte mit Fettleibigkeit verbunden sein: In Fettzellen hemmt es den Fettabbau und fördert die Speicherung. Zudem senkte eine Ergänzung im Tierversuch den Energieverbrauch und förderte Fettleibigkeit. Da noch nicht klar ist, wie die Zusammenhänge bei Menschen sind, sollten Betroffene hoch dosiertes Cystein nicht dauerhaft einnehmen.
Vorsicht bei einer Glutamat-Unverträglichkeit
Cystein könnte die Beschwerden einer Glutamat-Unverträglichkeit verstärken. Glutamat ist als Geschmacksverstärker bekannt und löst bei einigen Personen Beschwerden aus wie Kopfschmerzen, Kribbeln, Juckreiz, Hautrötungen, Herzklopfen oder Übelkeit. Cystein könnte bei empfindlichen Menschen genauso wirken und die Symptome, ausgelöst durch Glutamat, verstärken. Es sollte dann nur vorsichtig eingesetzt werden.
Zu beachten bei chronischen Entzündungen und Autoimmunerkrankungen
Cystein kann das Immunsystem je nach Situation dämpfen oder anregen. Es könnte somit Entzündungen verstärken. Der Spiegel an oxidiertem Cystein (Cystin) steigt dann ebenfalls an. Cystin wiederum regt weiße Blutkörperchen an, weitere Entzündungssignale auszusenden. Bei stillen Entzündungen sollte Cystein daher vorsichtig eingesetzt werden. Möglicherweise ist es hilfreich, den oxidativen Stress zu überwachen und bei Bedarf mit antioxidativen und entzündungshemmenden Mikronährstoffen gegenzusteuern.
Vorsicht gilt auch bei einer Bauchspeicheldrüsenentzündung sowie bei Verbrennungen und Sepsis. Hier ist Schwefelwasserstoff wahrscheinlich ursächlich an der Entzündung beteiligt.
Personen mit COPD, Rheuma sowie Autoimmunerkrankungen sollten vor der Einnahme mit dem Arzt oder Mikronährstoff-Experten sprechen. Es kann ein gestörter Cysteinabbau vorliegen, wodurch die Spiegel zu stark steigen könnten.
Vorsicht bei Nierenschwäche oder Nierensteinen
Personen mit Nierenschwäche dürfen Eiweiße und Aminosäuren nur in vorher festgelegten Mengen aufnehmen. Zur Sicherheit sollte mit einem Arzt gesprochen werden.
Bei einem bestimmten Gendefekt wird vermehrt Cystein mit dem Urin ausgeschieden. Das kann zu Cystein-haltigen Steinen in den Nieren und der Blase führen. Betroffene dürfen es dann nicht einnehmen.
Bei Krebs mit dem Arzt sprechen

Bei Krebs oder einer Krebstherapie sollte Cystein nur in Rücksprache mit einem Arzt eingesetzt werden. Der Arzt kann entscheiden, ob die Ergänzung zusätzlich zur Ernährung nötig ist und die sinnvolle Dosierung festlegen. Denn Krebszellen brauchen wie gesunde Zellen für ihren Stoffwechsel Cystein, sodass es zu viel schaden könnte.
Durch die antioxidative Wirkung von Cystein könnte die Wirksamkeit einer Krebstherapie abgeschwächt werden. Einige Krebsmittel verursachen oxidativen Stress. Dieser soll den Tumor abtöten. Eine Resistenz von Krebszellen gegen eine Krebstherapie durch zu viel Cystein wurde bei Eierstock-, Lungen-, Prostata- und Dickdarmkrebs beobachtet.
Zusammenfassung
Cystein ist eine Aminosäure, die der Körper selbst bilden kann. Es ist aber auch in eiweißreichen Lebensmitteln wie Pilzen, Fisch und Meeresfrüchten, Hülsenfrüchten oder Nüssen enthalten.
Cystein ist Baustein von Eiweißen. Auch wird es zur Stabilisierung der Struktur von Eiweißen benötigt, wie von Keratin. Keratin verleiht Haut, Haaren und Nägeln ihre Festigkeit. Zusammen mit anderen Mikronährstoffen dürfte Cystein gegen Haarausfall helfen. Es könnte außerdem den Wiederaufbau von Geweben unterstützen und möglicherweise die Wundheilung beschleunigen. Dabei stärkt Cystein vermutlich auch das Immunsystem, verbessert die Durchblutung und lindert Entzündungen.
Aus Cystein werden verschiedene Antioxidantien hergestellt, etwa Glutathion. Dadurch lindert es oxidativen Stress und chronische Entzündungen. Das bringt möglicherweise Vorteile bei Alterserkrankungen.
Darüber hinaus ist Cystein an der Entgiftung beteiligt: Die Leber braucht es, um unlösliche Giftstoffe für die Ausscheidung mit dem Urin löslich zu machen. Cystein hat auch eine Schutzfunktion, da es für den Abbau von Alkohol und Paracetamol gebraucht wird. Zudem bindet es Metalle, weshalb es zur Entgiftung von Schwermetallen wichtig sein könnte.
Verzeichnis der Studien und Quellen
Ajsuvakova, O.P. et al. (2020): Sulfhydryl groups as targets of mercury toxicity. Coord Chem Rev. 2020 Aug 15;417:213343. https://pubmed.ncbi.nlm.nih.gov/32905350/, abgerufen am 29.07.2021.
Aune, D. et al. (2013): Dairy products and the risk of type 2 diabetes: a systematic review and dose-response meta-analysis of cohort studies. Am J Clin Nutr. 2013 Oct;98(4):1066-83. https://pubmed.ncbi.nlm.nih.gov/23945722/, abgerufen am 29.07.2021.
Badaloo, A. et al. (2002): Cysteine supplementation improves the erythrocyte glutathione synthesis rate in children with severe edematous malnutrition. Am J Clin Nutr. 2002 Sep;76(3):646-52. https://pubmed.ncbi.nlm.nih.gov/12198013/, abgerufen am 29.07.2021.
Badillo-Ramírez, I. et al. (2019): 5-S-cysteinyl-dopamine a neurotoxic endogenous metabolite of dopamine: Implications for Parkinson's disease. Neurochemistry International. 129:104514. https://www.researchgate.net/profile/Selva-Rivas-Arancibia/publication/334756203, abgerufen am 29.07.2021.
Bak, D.W. et al. (2018): Cysteine Reactivity Across the Sub-Cellular Universe. Curr Opin Chem Biol. 2019 Feb;48:96–105. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6382561/, abgerufen am 29.07.2021.
Bełtowski, J. (2019): Synthesis, Metabolism, and Signaling Mechanisms of Hydrogen Sulfide: An Overview. Methods Mol Biol. 2019;2007:1-8. https://pubmed.ncbi.nlm.nih.gov/31148102/, abgerufen am 29.07.2021.
Bełtowski, J. et al. (2018): Hydrogen sulfide in the regulation of insulin secretion and insulin sensitivity: Implications for the pathogenesis and treatment of diabetes mellitus. Biochemical Pharmacology. 149. https://www.researchgate.net/publication/322258018, abgerufen am 29.07.2021.
Bhatia, M. (2012): Role of Hydrogen Sulfide in the Pathology of Inflammation. Scientifica 2012 Oct;(3):159680. https://www.researchgate.net/publication/258924248, abgerufen am 29.07.2021.
Blachier, F. et al. (2020): Sulfur-Containing Amino Acids and Lipid Metabolism. J Nutr. 2020 Oct 1;150(1):2524-31. https://pubmed.ncbi.nlm.nih.gov/33000164/, abgerufen am 29.07.2021.
Bonifácio, V.D.B. et al. (2021): Cysteine metabolic circuitries: druggable targets in cancer. British Journal of Cancer 2021;124;862–79. https://www.nature.com/articles/s41416-020-01156-1, abgerufen am 29.07.2021.
Brancaleone, V. et al. (2008): Biosynthesis of H2S is impaired in non-obese diabetic (NOD) mice. Br J Pharmacol. 2008 Nov;155(5):673–80. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2584926/, abgerufen am 29.07.2021.
Brandão, R. et al. (2006): DMPS and N-acetylcysteine induced renal toxicity in mice exposed to mercury. Biometals. 2006 Aug;19(4):389-98. https://pubmed.ncbi.nlm.nih.gov/16841248/, abgerufen am 29.07.2021.
Bundesministerium für Ernährung und Landwirtschaft. (2014): Bundeslebensmittelschlüssel. BLS-Version 3.02. https://www.blsdb.de/, abgerufen am 29.07.2021.
Bundeszentrum für Ernährung. (2019): Linsen als Eiweißquelle. https://www.bzfe.de/service/news/aktuelle-meldungen/news-archiv/meldungen-2019/april/linsen-als-eiweissquelle/, abgerufen am 29.07.2021.
Calkins, K.L. et al. (2041): Effect of High-Dose Cysteine Supplementation on Erythrocyte Glutathione: a Double-Blinded, Randomized Placebo Controlled Pilot Study in Critically Ill Neonates. JPEN J Parenter Enteral Nutr. 2016 Feb;40(2):226–34. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4573914/, abgerufen am 29.07.2021.
Calvo, J. et al. (2017): Copper metallothioneins. IUBMB. 2017 Apr;69(4);236-45. https://iubmb.onlinelibrary.wiley.com/doi/full/10.1002/iub.1618, abgerufen am 29.07.2021.
Carter, R.N. & Morton, N.M. (2016): Cysteine and hydrogen sulphide in the regulation of metabolism: insights from genetics and pharmacology. J Pathol. 2016 Jan;238(2):321–32. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4832394, abgerufen am 29.07.2021.
Combs, J.A. & DeNicola, G.M. (2019): The Non-Essential Amino Acid Cysteine Becomes Essential for Tumor Proliferation and Survival. Cancers (Basel). 2019 May;11(5):678. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6562400/, abgerufen am 29.07.2021.
Cramer, S.L. et al. (2017): Systemic depletion of L-cyst(e)ine with cyst(e)inase increases reactive oxygen species and suppresses tumor growth. Nat Med. 2017 Jan;23(1):120-127. https://pubmed.ncbi.nlm.nih.gov/27869804/, abgerufen am 29.07.2021.
Daher, B. et al. (2020): Cysteine Depletion, a Key Action to Challenge Cancer Cells to Ferroptotic Cell Death. Front Oncol. 2020;10:723. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7221143/, abgerufen am 29.07.2021.
Derosa, G. et al. (2020): Change of some oxidative stress parameters after supplementation with whey protein isolate in patients with type 2 diabetes. Nutrition. 2020 May;73:110700. https://pubmed.ncbi.nlm.nih.gov/32065880/, abgerufen am 29.07.2021.
Deutsche Gesellschaft für Ernährung e. V. (DGE) (2020): Ausgewählte Fragen und Antworten zur Position der DGE zu veganer Ernährung. https://www.dge.de/wissenschaft/weitere-publikationen/faqs/vegane-ernaehrung/, abgerufen am 29.07.2021.
Diagnostisches Centrum für Mineralanalytik und Spektroskopie DCMS GmbH (Hrsg.) (o.J.): Aminosäuren-Komplettprofil. https://www.diagnostisches-centrum.de/aminogramm.html, abgerufen am 03.08.2021.
DocMedicus (Lexikon) (o.J.): Cystein. http://www.vitalstoff-lexikon.de/Aminosaeuren/-Cystein/, abgerufen am 29.07.2021.
DocMedicus (Lexikon) (o.J.): Lebensmittel Cystein. http://www.vitalstoff-lexikon.de/Aminosaeuren/-Cystein/Lebensmittel.html, abgerufen am 29.07.2021.
Dong, Z. et al. (2020): Association of sulfur amino acid consumption with cardiometabolic risk factors: Cross-sectional findings from NHANES III. EClinicalMedicin. 2020 Feb;19;100248. https://www.thelancet.com/journals/eclinm/article/PIIS2589-5370(19)30257-3/fulltext, abgerufen am 29.07.2021.
Dröge, W. & Breitkreuz, R. (2000): Glutathione and immune function. Proc Nutr Soc . 2000 Nov;59(4):595-600. https://pubmed.ncbi.nlm.nih.gov/11115795/, abgerufen am 29.07.2021.
Dröge, W. (2005): Oxidative stress and ageing: is ageing a cysteine deficiency syndrome? Philos Trans R Soc Lond B Biol Sci. 2005 Dec 29;360(1464):2355–72. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1569588/, abgerufen am 29.07.2021.
Dröge, W. et al. (1991): Modulation of lymphocyte functions and immune responses by cysteine and cysteine derivatives. Am J Med. 1991 Sep 30;91(3C):140-4. https://pubmed.ncbi.nlm.nih.gov/1928206/, abgerufen am 29.07.2021.
El-Khairy, L. et al. (1999): Lifestyle and cardiovascular disease risk factors as determinants of total cysteine in plasma: the Hordaland Homocysteine Study. Am J Clin Nutr. 1999 Dec;70(6):1016-24. https://pubmed.ncbi.nlm.nih.gov/10584046/, abgerufen am 29.07.2021.
Elshorbagy, A.K. et al. (2012): Cysteine and obesity: consistency of the evidence across epidemiologic, animal and cellular studies. Curr Opin Clin Nutr Metab Care. 2012 Jan;15(1):49-57. https://pubmed.ncbi.nlm.nih.gov/22108094/, abgerufen am 29.07.2021.
European Food Safety Authority (EFSA) (2006): TOLERABLE UPPER INTAKE LEVELS FOR VITAMINS AND MINERALS. https://www.efsa.europa.eu/sites/default/files/efsa_rep/blobserver_assets/ndatolerableuil.pdf, abgerufen am 29.07.2021.
European Patent Office. (2011): Verfahren zur Reinigung von L-Cystein. EP1958933B1. https://patents.google.com/patent/EP1958933B1/de, abgerufen am 29.07.2021.
Forum Bio- und Gentechnologie e.V. (Hrsg.) (2018): Cystein, Cystin | E920. https://www.transgen.de/datenbank/zusatzstoffe/2025.cystein-cystin-e920.html, abgerufen am 29.07.2021.
Foundation OrthoKnowledge (Hrsg.) (o.J.): L-Cystein: die zentrale Verbindung des Schwefelstoffwechsels im Körper. https://www.orthoknowledge.eu/forschung/l-cystein/l-cystein/, abgerufen am 29.07.2021.
Fulghesu, A.M. et al. (2002): N-acetyl-cysteine treatment improves insulin sensitivity in women with polycystic ovary syndrome. Fertil Steril. 2002 Jun;77(6):1128-35. https://pubmed.ncbi.nlm.nih.gov/12057717/, abgerufen am 29.07.2021.
Gehring, W. & Gloor, M. (2000): Use of the phototrichogram to assess the stimulation of hair groth - An in vitro study of women with androgenetic alopecia 75. 419-423. https://www.researchgate.net/publication/292926716, abgerufen am 29.07.2021.
Gheibi, S. et al. (2020): Regulation of carbohydrate metabolism by nitric oxide and hydrogen sulfide: Implications in diabetes. Biochemical Pharmacology. 2020 Jun;176;113819. https://www.sciencedirect.com/science/article/abs/pii/S0006295220300290, abgerufen am 29.07.2021.
Go, Y.M & Jones, D.P. (2011): Cysteine/cystine redox signaling in cardiovascular disease. Free Radic Biol Med. 2011 Feb 15;50(4):495-509. https://pubmed.ncbi.nlm.nih.gov/21130865/, abgerufen am 29.07.2021.
Goluch-Koniuszy, Z.S. (2016): Nutrition of women with hair loss problem during the period of menopause. Prz Menopauzalny. 2016 Mar;15(1):56–61. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4828511/, abgerufen am 29.07.2021.
Gould, R.L. & Pazdro, R. (2019): Impact of Supplementary Amino Acids, Micronutrients, and Overall Diet on Glutathione Homeostasis. Nutrients. 2019 May;11(5):1056. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6566166/, abgerufen am 29.07.2021.
Gul, Z. & Monga, M. (2014): Medical and Dietary Therapy for Kidney Stone Prevention. Korean J Urol. 2014 Dec;55(12):775–9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4265710/, abgerufen am 29.07.2021.
Gunnerud, U.J. et al. (2013): Effects of whey proteins on glycaemia and insulinaemia to an oral glucose load in healthy adults; a dose-response study. Eur J Clin Nutr. 2013 Jul;67(7):749-53. https://pubmed.ncbi.nlm.nih.gov/23632747/, abgerufen am 29.07.2021.
Gutman, J.B.L. & Kongshavn, P.L. (2019): Cysteine/cystine-rich undenatured whey protein supplement in patients' pressure ulcers outcomes: an open label study. J Wound Care. 2019 Jul 1;28(Sup7):16-23. https://pubmed.ncbi.nlm.nih.gov/31295075/, abgerufen am 29.07.2021.
Heard, K. et al. (2014): A single-arm clinical trial of a 48-hour intravenous N-acetylcysteine protocol for treatment of acetaminophen poisoning. Clin Toxicol (Phila). 2014 Jun;52(5):512-8. https://pubmed.ncbi.nlm.nih.gov/24708414/, abgerufen am 29.07.2021.
Hellström, P.M. et al. (2017): Slow-release L-cysteine capsule prevents gastric mucosa exposure to carcinogenic acetaldehyde: results of a randomised single-blinded, cross-over study of Helicobacter-associated atrophic gastritis. Scand J Gastroenterol. 2017 Feb;52(2):230-7. https://pubmed.ncbi.nlm.nih.gov/27806647/, abgerufen am 29.07.2021.
Hertel, H. et al. (1989): Low dosage retinol and L-cystine combination improve alopecia of the diffuse type following long-term oral administration. Hautarzt. 1989 Aug;40(8):490-5. https://pubmed.ncbi.nlm.nih.gov/2676911/, abgerufen am 29.07.2021.
Hosking, A.M. et al. (2019): Complementary and Alternative Treatments for Alopecia: A Comprehensive Review. Skin Appendage Disord. 2019;5:72–89. https://www.karger.com/Article/FullText/492035, abgerufen am 29.07.2021.
Imsande, J. (2001): Selection of Soybean Mutants with Increased Concentrations of Seed Methionine and Cysteine. Crop Science. 2001 Mar;41(2). https://www.researchgate.net/publication/242421043_Selection_of_Soybean_Mutants_with_Increased_Concentrations_of_Seed_Methionine_and_Cysteine, abgerufen am 29.07.2021.
Jain, S.K. et al. (2014): Vitamin D and l-cysteine levels correlate positively with GSH and negatively with insulin resistance levels in the blood of type 2 diabetic patients. Eur J Clin Nutr. 2014 Oct;68(10):1148–53. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4192028/, abgerufen am 29.07.2021.
Jain, S. K. (2012): L-cysteine supplementation as an adjuvant therapy for type-2 diabetes. Can J Physiol Pharmacol. 2012 Aug;90(8):1061-4. https://pubmed.ncbi.nlm.nih.gov/22783875/, abgerufen am 29.07.2021.
Jain, S.K. et al. (2012): Effect of chromium dinicocysteinate supplementation on circulating levels of insulin, TNF-α, oxidative stress, and insulin resistance in type 2 diabetic subjects: randomized, double-blind, placebo-controlled study. Mol Nutr Food Res. 2012 Aug;56(8):1333-41. https://pubmed.ncbi.nlm.nih.gov/22674882/, abgerufen am 29.07.2021.
Kasperczyk, S. et al. (2014): Effect of N-acetylcysteine administration on the expression and activities of antioxidant enzymes and the malondialdehyde level in the blood of lead-exposed workers. Environ Toxicol Pharmacol. 2014 Mar;37(2):638-47. https://pubmed.ncbi.nlm.nih.gov/24577230/, abgerufen am 29.07.2021.
Kasperczyk, S. et al. (2014): Effect of treatment with N-acetylcysteine on non-enzymatic antioxidant reserves and lipid peroxidation in workers exposed to lead. Ann Agric Environ Med. 2014;21(2):272-7. https://pubmed.ncbi.nlm.nih.gov/24959775/, abgerufen am 29.07.2021.
Kasperczyk, S. et al. (2016): Effect of N-acetylcysteine administration on homocysteine level, oxidative damage to proteins, and levels of iron (Fe) and Fe-related proteins in lead-exposed workers. Toxicol Ind Health. 2016 Sep;32(9):1607-18. https://pubmed.ncbi.nlm.nih.gov/25731901/, abgerufen am 29.07.2021.
Kato, M. et al. (2011): L-cysteine as a regulator for arsenic-mediated cancer-promoting and anti-cancer effects. Toxicol In Vitro. 2011 Apr;25(3):623-9. https://pubmed.ncbi.nlm.nih.gov/21195159/, abgerufen am 29.07.2021.
Keller, A.C. et al. (2019): Elevated plasma homocysteine and cysteine are associated with endothelial dysfunction across menopausal stages in healthy women. J Appl Physiol (1985). 2019 Jun 1;126(6):1533-1540. https://pubmed.ncbi.nlm.nih.gov/30896357/, abgerufen am 29.07.2021.
Kho, C.J. & de Lumen, B.O. (1988): Identification and isolation of methionine-cysteine rich proteins in soybean seed. Plant Foods Hum Nutr. 1988;38(4):287-96. https://pubmed.ncbi.nlm.nih.gov/3237631/, abgerufen am 29.07.2021.
Kikuchi, N. et al. (1980): Effects of cysteine compounds on antibiotics I. Effects of L-cysteine and its derivatives on the potency of antibiotics (author's transl). The Japanese Journal of Antibiotics. 1980 Feb;33(2):117-24. https://europepmc.org/article/med/7373852, abgerufen am 29.07.2021.
Klaassen, C.D. et al. (2009): Metallothionein Protection of Cadmium Toxicity. Toxicol Appl Pharmacol. 2009 Aug 1;238(3):215–20. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2740813/, abgerufen am 29.07.2021.
Krishnan, H.B. et al. (2015): Introgression of leginsulin, a cysteine-rich protein, and high-protein trait from an Asian soybean plant introduction genotype into a North American experimental soybean line. J Agric Food Chem. 2015 Mar 25;63(11):2862-9. https://pubmed.ncbi.nlm.nih.gov/25756929/, abgerufen am 29.07.2021.
Kumaran, S. et al. (2009): Assembly of the Cysteine Synthase Complex and the Regulatory Role of Protein-Protein Interactions. Journal of Biological Chemistry. 2009 Nov;284:10268-75. https://www.ars.usda.gov/research/publications/publication/?seqNo115=236366, abgerufen am 29.07.2021.
Kurz, M.A. et al. (1991): Mechanisms responsible for the heterogeneous coronary microvascular response to nitroglycerin. Circ Res. 1991 Mar;68(3):847-55. https://pubmed.ncbi.nlm.nih.gov/1742870/, abgerufen am 29.07.2021.
Larsson, S.C. et al. (2015): Dietary cysteine and other amino acids and stroke incidence in women. Stroke. 2015 Apr;46(4):922-6. https://pubmed.ncbi.nlm.nih.gov/25669310/, abgerufen am 29.07.2021.
Lu, S.C. (2009): REGULATION OF GLUTATHIONE SYNTHESIS. Mol Aspects Med. 2009;30(1-2):42–59. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2704241/, abgerufen am 29.07.2021.
Lu, S.C. (2013): Glutathione synthesis. Biochim Biophys Acta. 2013 May;1830(5):3143-53. https://pubmed.ncbi.nlm.nih.gov/22995213/, abgerufen am 29.07.2021.
Martina, V. et al. (2008): Long-term N-acetylcysteine and L-arginine administration reduces endothelial activation and systolic blood pressure in hypertensive patients with type 2 diabetes. Diabetes Care. 2008 May;31(5):940-4. https://pubmed.ncbi.nlm.nih.gov/18268065/, abgerufen am 29.07.2021.
McLeay, Y. et al. (2017): Dietary thiols in exercise: oxidative stress defence, exercise performance, and adaptation. J Int Soc Sports Nutr. 2017 Apr 27;14:12. https://pubmed.ncbi.nlm.nih.gov/28465675/, abgerufen am 29.07.2021.
McPherson, R.A. & Hardy, G. (2011): Clinical and nutritional benefits of cysteine-enriched protein supplements. Curr Opin Clin Nutr Metab Care. 2011 Nov;14(6):562-8. https://pubmed.ncbi.nlm.nih.gov/21986479/, abgerufen am 29.07.2021.
medlexi.de (2021): Cystein. https://medlexi.de/Cystein, abgerufen am 29.07.2021.
Meduri, A. et al. (2009): Role of cysteine in corneal wound healing after photorefractive keratectomy. Ophthalmic Res. 2009;41(2):76-82. https://pubmed.ncbi.nlm.nih.gov/19122468/, abgerufen am 29.07.2021.
Meduri, A. et al. (2014): Effect of the combination of basic fibroblast growth factor and cysteine on corneal epithelial healing after photorefractive keratectomy in patients affected by myopia. Indian J Ophthalmol. 2014 Apr;62(4):424-8. https://pubmed.ncbi.nlm.nih.gov/24145571/, abgerufen am 29.07.2021.
Merz Pharma. (2018): pantogar®. https://www.merz.ch/produkte/pantogar/, abgerufen am 29.07.2021.
Messerschmitt, T.M. (2008): Die schwefelhaltigen Aminosäuren. Ernährung & Medizin. 2008;23(4):170-6. https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&ved=2ahUKEwjlzqOLmrXvAhVSA2MBHXynDwEQFjABegQIBBAD&url=https%3A%2F%2Fwww.thieme-connect.de%2Fproducts%2Fejournals%2Fpdf%2F10.1055%2Fs-0028-1121955.pdf&usg=AOvVaw09W04YXd-6A7JtMRQ_rMDn, abgerufen am 29.07.2021.
Morganti, P. et al. (1998): Effect Of Gelatin-Cystine And Serenoa Repens Extract On Free Radicals Level And Hair Growth. J Appl Cosmetol. 1998 Sep;16:57-64. https://www.researchgate.net/publication/294672324_Effect_of_gelatin-cystine_and_serenoa_repens_extract_on_free_radicals_level_and_hair_growth, abgerufen am 29.07.2021.
Mustikaningtyas, D. et al. (2019): Cysteine content obtained from the variation of temperature and acidity on soybean extraction. J. Phys.: Conf. Ser. 2019;1321:032038. https://iopscience.iop.org/article/10.1088/1742-6596/1321/3/032038/pdf#:~:text=And%20cysteine%20levels%20are%205.13,g%2C%204.93%20mg%2Fg.&text=The%20highest%20cysteine%20content%20is,temperature%2C%20and%20using%20heat%20dryer, abgerufen am 29.07.2021.
Neri, S. et al. (2005): Effects of antioxidant supplementation on postprandial oxidative stress and endothelial dysfunction: a single-blind, 15-day clinical trial in patients with untreated type 2 diabetes, subjects with impaired glucose tolerance, and healthy controls. Clin Ther. 2005 Nov;27(11):1764-73. https://pubmed.ncbi.nlm.nih.gov/16368447/, abgerufen am 29.07.2021.
Newsholme, P. et al. (2012): Reactive oxygen and nitrogen species generation, antioxidant defenses, and β-cell function: a critical role for amino acids. J Endocrinol. 2012 Jul;214(1):11-20. https://pubmed.ncbi.nlm.nih.gov/22547566/, abgerufen am 29.07.2021.
Noda, T. et al. (2002): Exogenous cysteine and cystine promote cell proliferation in CaCo-2 cells. Cell Prolif. 2002 Apr;35(2):117-29. https://pubmed.ncbi.nlm.nih.gov/11952646/, abgerufen am 29.07.2021.
Norwegian Scientific Committee for Food Safety (VKM). (2015): Risk assessment of “other substances” - L-cysteine and L-cystine. VKM Report 2015:20. https://vkm.no/download/18.645b840415d03a2fe8f26083/1502799604126/2353d160fe.pdf, abgerufen am 29.07.2021.
Ozkan, Y. et al. (2002): Plasma total homocysteine and cysteine levels as cardiovascular risk factors in coronary heart disease. Int J Cardiol. 2002 Mar;82(3):269-77. https://pubmed.ncbi.nlm.nih.gov/11911915/, abgerufen am 29.07.2021.
Ozkilic, A.C. et al. (2006): The role of N-acetylcysteine treatment on anti-oxidative status in patients with type II diabetes mellitus. J Basic Clin Physiol Pharmacol. 2006;17(4):245-54. https://pubmed.ncbi.nlm.nih.gov/17338280/, abgerufen am 29.07.2021.
Parcell, S. (2002): Sulfur in Human Nutrition and Applications in Medicine. Alternative Medicine Review. 2002;7(1);22-44. http://archive.foundationalmedicinereview.com/publications/7/1/22.pdf, abgerufen am 29.07.2021.
Park, Y. et al. (2010): Postprandial cysteine/cystine redox potential in human plasma varies with meal content of sulfur amino acids. J Nutr. 2010 Apr;140(4):760-5. https://pubmed.ncbi.nlm.nih.gov/20164364/, abgerufen am 29.07.2021.
Patel, M.A. & Shah, G.B. (2010): Possible Role of Hydrogen Sulfide in Insulin Secretion and in Development of Insulin Resistance. J Young Pharm. 2010 Apr-Jun;2(2):148–51. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3021689/, abgerufen am 29.07.2021.
Paul, B.D. & Snyder, S.H. (2018): Gasotransmitter Hydrogen Sulfide Signaling in Neuronal Health and Disease. Biochem Pharmacol. 2018 Mar;149:101–9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5868969/, abgerufen am 29.07.2021.
Petri, H. et al. (1990): The efficacy of drug therapy in structural lesions of the hair and in diffuse effluvium--comparative double blind study. Revue Suisse de Medecine Praxis. 1990 Nov;79(47):1457-62. https://europepmc.org/article/med/1709511, abgerufen am 29.07.2021.
Pharmazeutische Zeitung. (2000): Aminosäuredefizite schwächen das Immunsystem. Pharmazeutische Zeitung. 2000;44. https://www.pharmazeutische-zeitung.de/inhalt-44-2000/pharm4-44-2000/, abgerufen am 29.07.2021.
Plaza, N.C. et al. (2018): Effects of the Usage of L-Cysteine (L-Cys) on Human Health. Molecules. 2018 Mar;23;575. https://pdfs.semanticscholar.org/69c9/7d04fcd15be3baba9e4e5ed57d7672846a25.pdf, abgerufen am 29.07.2021.
Poloni, S. et al. (2015): Stearoyl-CoA Desaturase-1: Is It the Link between Sulfur Amino Acids and Lipid Metabolism? Biology (Basel). 2015 Jun;4(2):383–96. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4498306/, abgerufen am 29.07.2021.
Tamba-Berehoiu, R.M. et al. (2013): Assessment Of The E 920 Additive (L -Cysteine) In Relation To Some Problems Of Modern Food Industry. Scientific Papers Series Management, Economic Engineering in Agriculture and Rural Development 2013 Jan;13(1);413-8. https://www.researchgate.net/publication/288604427, abgerufen am 29.07.2021.
Pujos-Guillot, E. et al. (2012): Therapeutic paracetamol treatment in older persons induces dietary and metabolic modifications related to sulfur amino acids. Age (Dordr). 2012 Feb;34(1):181-93. https://pubmed.ncbi.nlm.nih.gov/21340541/, abgerufen am 29.07.2021.
Rehman, T. et al. (2020): Cysteine and homocysteine as biomarker of various diseases. Food Sci Nutr. 2020 Sep;8(9):4696–707. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7500767/, abgerufen am 29.07.2021.
Rubino, F.M. (2015): Toxicity of Glutathione-Binding Metals: A Review of Targets and Mechanisms. Toxics. 2015 Mar;3(1):20–62. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5634692/, abgerufen am 29.07.2021.
Salaspuro, V. et al. (2002): Removal of acetaldehyde from saliva by a slow-release buccal tablet of L-cysteine. International Journal of Cancer. 2002 Jan;97(3);361-4. https://onlinelibrary.wiley.com/doi/full/10.1002/ijc.1620?sid=nlm%3Apubmed, abgerufen am 29.07.2021.
Salim, A.S. (1992): Sulphydryl-containing agents stimulate the healing of duodenal ulceration in man. Pharmacology. 1992;45(3):170-80. https://pubmed.ncbi.nlm.nih.gov/1438525/, abgerufen am 29.07.2021.
Salim, A.S. (1993): Sulfhydryl-containing agents in the treatment of gastric bleeding induced by nonsteroidal anti-inflammatory drugs. Can J Surg . 1993 Feb;36(1):53-8. https://pubmed.ncbi.nlm.nih.gov/8443719/, abgerufen am 29.07.2021.
Salman, Z.K. et al. (2013): The combined effect of metformin and L-cysteine on inflammation, oxidative stress and insulin resistance in streptozotocin-induced type 2 diabetes in rats. Eur J Pharmacol. 2013 Aug 15;714(1-3):448-55. https://pubmed.ncbi.nlm.nih.gov/23845213/, abgerufen am 29.07.2021.
Stipanuk, M.H. et al. (2009): Cysteine Dioxygenase: A Robust System for Regulation of Cellular Cysteine Levels. Amino Acids. 2009 May;37(1):55–63. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2736881/, abgerufen am 29.07.2021.
Vidak, E. et al. (2019): Cysteine Cathepsins and Their Extracellular Roles: Shaping the Microenvironment. Cells. 2019 Mar;8(3):264. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6468544/, abgerufen am 29.07.2021.
Villa, P. et al. (2007): Hyperhomocysteinemia and cardiovascular risk in postmenopausal women: the role of folate supplementation. Clin Chem Lab Med. 2007;45(2):130-5. https://pubmed.ncbi.nlm.nih.gov/17311496/, abgerufen am 29.07.2021.
Wacker Chemie AG (Hrsg.). (o.J.): Aminosäuren. https://www.wacker.com/cms/de-de/products/product-groups/amino-acids/amino-acid.html, abgerufen am 29.07.2021.
Wagner, C.A. (2009): Hydrogen sulfide: a new gaseous signal molecule and blood pressure regulator. J Nephrol. Mar-Apr 2009;22(2):173-6. https://pubmed.ncbi.nlm.nih.gov/19384833/, abgerufen am 29.07.2021.
Wong, D.L. et al. (2017): Lead(II) Binding in Metallothioneins. Met Ions Life Sci. 2017 Apr 10;17 https://pubmed.ncbi.nlm.nih.gov/28731302/, abgerufen am 29.07.2021.
World Health Organization (WHO) (2007): Protein and amino acid requirements in human nutrition. WHO Technical Report Series no. 935. https://apps.who.int/iris/bitstream/handle/10665/43411/WHO_TRS_935_eng.pdf;jsessionid=46BD89ED8F1A72D4779AD87B0B388F77?sequence=1, abgerufen am 29.07.2021.
Wu, G. et al. (2004): Glutathione metabolism and its implications for health. J Nutr. 2004 Mar;134(3):489-92. https://pubmed.ncbi.nlm.nih.gov/14988435/, abgerufen am 29.07.2021.
Wu, J. et al. (2021): Cyst(e)ine in nutrition formulation promotes colon cancer growth and chemoresistance by activating mTORC1 and scavenging ROS. Signal Transduct Target Ther. 2021 May 28;6(1):188. https://pubmed.ncbi.nlm.nih.gov/34045438/, abgerufen am 29.07.2021.
Wu, L. et al. (2009): Pancreatic islet overproduction of H2S and suppressed insulin release in Zucker diabetic rats. Lab Invest. 2009 Jan;89(1):59-67. https://pubmed.ncbi.nlm.nih.gov/19002107/, abgerufen am 29.07.2021.
Yin, J. et al. (2016): L-Cysteine metabolism and its nutritional implications. Mol Nutr Food Res. 2016 Jan;60(1):134-46. https://pubmed.ncbi.nlm.nih.gov/25929483/, abgerufen am 29.07.2021.
Yusuf, M. et al. (2005): Streptozotocin-induced diabetes in the rat is associated with enhanced tissue hydrogen sulfide biosynthesis. Biochem Biophys Res Commun. 2005 Aug 12;333(4):1146-52. https://pubmed.ncbi.nlm.nih.gov/15967410/, abgerufen am 29.07.2021.
Zhu, L. et al. (2020): Hydrogen Sulfide, Adipose Tissue and Diabetes Mellitus. Diabetes Metab Syndr Obes. 2020;13:1873–86. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7276333/, abgerufen am 29.07.2021.