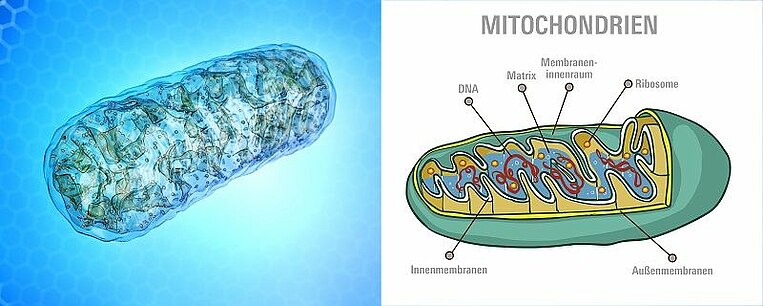
Die Energie des Körpers wird in den Zellkraftwerken produziert, den Mitochondrien. Wenn sie nicht richtig funktionieren, spricht man von einer Mitochondriopathie. Dann steht nicht genug Energie zur Verfügung. Der Körper wird geschwächt und es kommt zu oxidativem Stress. Die Symptome reichen von Müdigkeit bis zu Muskelschwäche, Nervenstörungen und Organschäden. Lesen Sie hier, wie Sie mit Vitaminen, Mineralstoffen, Fettsäuren und pflanzlichen Wirkstoffen die Beschwerden der Mitochondriopathie behandeln und Folgeerkrankungen vorbeugen.
Ursachen und Symptome
Was ist eine Mitochondriopathie?
Nur gesunde Mitochondrien liefern Energie: Mitochondrien sind die Kraftwerke der Zellen und für die Energieproduktion verantwortlich. Werden sie geschädigt, kommt es zu einem Energiemangel und zu einer Ansammlung von Abfallprodukten. Die Zellen können dann ihre Funktion nicht mehr korrekt ausführen. Besonders betroffen sind Gewebe mit hohem Energieverbrauch wie Muskeln (Herz) und Nerven. Diese krankhaften Veränderungen nennen Mediziner Mitochondriopathien oder mitochondriale Erkrankungen.
Info
Energiegewinnung in den Mitochondrien: Zucker, Fette und Aminosäuren werden zunächst zu kleinen Bausteinen abgebaut. Die Prozesse nennt man zum Beispiel Glykolyse oder Beta-Oxidation und Citratzyklus. Aus den entstandenen Produkten gewinnen schließlich die Mitochondrien viel Energie: Den entscheidenden Prozess nennt man Atmungskette. Sie findet in den Membranen der Mitochondrien statt. Dabei wird unter Verbrauch von Sauerstoff die universelle Energiewährung des Körpers hergestellt, das ATP (Adenosintriphosphat). Diese ist die Grundlage für alle energieverbrauchenden Lebensvorgänge, zum Beispiel für den Stoffwechsel, für das Denken und alle Muskelbewegungen.
Arten und Ursachen von Mitochondriopathien
Man unterscheidet zwischen vererbten und erworbenen Mitochondriopathien:
Bei vererbten (primären) Mitochondriopathien ist die Erbsubstanz (DNA) verändert, sodass wichtige Enzyme der Mitochondrien nicht korrekt gebildet werden. Diese Gendefekte werden von den Eltern an die Nachkommen weitergegeben. Primäre Mitochondriopathien werden meist früh in der Kindheit sichtbar.
Erworbene (sekundäre) Mitochondriopathien werden im Laufe des Lebens durch zellschädigende Stoffe oder Erkrankungen hervorgerufen. Sie werden mit zunehmendem Alter häufiger. Auslöser dafür können sein:
- Schwermetall- und Chemikalienbelastung, Rauchen
- Sauerstoffmangel (zum Beispiel bei Störungen der Durchblutung)
- Belastungen des Körpers durch körperlichen oder seelischen Stress (Burn-out, Stress)
- fehlende Mikronährstoffe und Mangelernährung
- Störungen im Zuckerstoffwechsel und Übergewicht
- schwere Erkrankungen, chronische Entzündungen und Infektionen
Expertenwissen
COVID-19 könnte eine Ursache für Mitochondriopathien sein. Die infizierten Zellen geben die DNA ihrer Mitochondrien ins Blut ab (mtDNA). Dieser Vorgang wiederum verstärkt Entzündungen. Menschen, bei denen diese Bestandteile vermehrt im Blut gefunden werden, haben einen schwereren Verlauf. Darüber hinaus vermuten Forscher, dass COVID-19 auch andere Viren aktiviert, wie Herpesviren. Wird zum Beispiel Herpesvirus 6A oder 6B aktiviert, ist eine Schädigung der Mitochondrien zu beobachten.
Forscher diskutieren außerdem, dass das chronische Erschöpfungssyndrom (CFS) [Link] mit viralen Infektionen sowie einer Schädigung der Mitochondrien zusammenhängen könnte.
Bei viralen Infektionen und einem CFS sollte daher immer an die Versorgung der Mitochondrien gedacht werden.
Mitochondrien-schädigende Medikamente sind zum Beispiel:
- Antibiotika wie Tetracyclin (zum Beispiel Tefilin® oder Imex®), Doxorubicin (zum Beispiel Adriblastin®) und Epirubicin (zum Beispiel Farmorubicin®)
- Medikamente gegen Diabetes wie Metformin (zum Beispiel Diabesin®, Mediabet® und Glucophage®)
- Antiepileptika wie Valproinsäure (zum Beispiel Convulex®, Leptilan®, Orfiril®)
- Schmerzmittel wie Paracetamol (zum Beispiel Paracetamol-ratiopharm®, Paracetamol STADA®, Paracetamol Sandoz®) oder Ibuprofen (zum Beispiel Dolormin®, Neuralgin®)
- Statine gegen hohe Cholesterinwerte wie Simvastatin (zum Beispiel Zocor®)
- Medikamente gegen Krebs wie Cisplatin (zum Beispiel Cisplatin Teva®, Cis-GRY®) oder Doxorubicin (wie Ribodoxo® oder Adrimedac®)
Durch solche Auslöser entstehen im Körper chemisch sehr reaktive Verbindungen, die andere Moleküle zerstören können. Man unterscheitet dabei:
- oxidativen Stress (Überproduktion von reaktiven Sauerstoff-Verbindungen und Mangel an Antioxidantien)
- nitrosativen Stress (Überproduktion von reaktiven Stickstoff-Verbindungen und Mangel an Antioxidantien)
Symptome und Folgeerkrankungen von Mitochondriopathien
Das Krankheitsbild der Mitochondriopathie ist nicht einheitlich, sondern zeichnet sich durch unterschiedliche Symptome aus. In der Regel sind mehrere Organe und Gewebe betroffen, vor allem diejenigen, die einen hohen Energiebedarf haben. Dazu zählen alle Muskeln (die Skelett- und Herzmuskulatur), das zentrale Nervensystem, die Netzhaut des Auges, die Leber und die Nieren.
Einige Betroffene haben nur leichte Beschwerden wie Muskelschwäche bei körperlicher Anstrengung, andere leiden an schweren Nervenschäden. Zunehmend wächst die Erkenntnis, dass Mitochondriopathien an der Entstehung zahlreicher (Alters-)Erkrankungen und Stoffwechselstörungen beteiligt sein könnten. Symptome und vermutete Folgen sind zum Beispiel:
Organ | Symptom | Vermutete Folgeerkrankungen |
|---|---|---|
Herz | Herzflattern, Luftnot, Schwäche | Herzschwäche, Herzrhythmusstörungen |
Blutgefäße | Durchblutungsstörungen | Arteriosklerose |
Gehirn und Nerven | taube, prickelnde Hände und Füße, gestörte Reflexe, epileptische Anfälle, geistige Behinderung, Schlaganfall-ähnliche Zustände | Polyneuropathie, Alzheimer, Migräne, amyotrophe Lateralsklerose |
Muskeln | unwillkürliche Muskelzuckungen, Muskelschmerzen, Muskelschwäche, Bewegungsstörungen | mitochondriale Myopathien (Muskelerkrankungen), |
Leber und Bauchspeicheldrüse | - | Fettleber, Leberinsuffizienz, Leberversagen, |
Niere | Wassereinlagerungen (Ödeme), Übersäuerung und Eiweißverlust über den Urin | Nierenschwäche |
Augen | Sehstörungen durch Netzhautdefekte, Schädigung des Sehnervs, Lähmung der Augenmuskeln, Augenzittern | altersabhängige Makuladegeneration (AMD), Blindheit |
Ohren | Schwerhörigkeit | Hörverlust, Tinnitus |
Nase | Schmeck- und Riechstörung | Verlust des Geruchsinns |
Ziele der Behandlung
Wie wird Mitochondriopathie klassisch behandelt?

Bisher gibt es keine Therapie, die eine Mitochondriopathie heilen kann. Die Behandlungsmöglichkeiten sind sehr begrenzt. Ziel ist es, die Symptome zu lindern und Komplikationen zu vermeiden. Um eine Verschlechterung der Beschwerden zu verhindern, sollten bestimmte Medikamente in Rücksprache mit dem Arzt gemieden werden. Das betrifft zum Beispiel einige Antibiotika (wie Tetrazykline, Aminoglycoside), Medikamente gegen Epilepsie (Valproinsäure) oder gegen Diabetes (Metformin) sowie Cholesterinsenker (Statine).
Experten empfehlen Betroffenen, starke Reize zu meiden, etwa Hitze, Kälte sowie Aufenthalte in großen Höhen. Auch Fastenkuren sind ungünstig: Kleinere Mahlzeiten sollten am besten gut über den Tag verteilt werden. Zwei- bis dreimal wöchentlich ist ein kombiniertes Ausdauer- und Krafttraining sinnvoll – allerdings ohne die maximale Leistungsgrenze zu erreichen. Ein Ernährungsberater kann dabei helfen, den Protein- und Eiweißbedarf richtig abzuschätzen.
Nur für wenige Substanzen gibt es bisher wissenschaftliche Belege, dass sie zur Therapie von Mitochondriopathien eingesetzt werden können. In der klassischen Medizin greifen Ärzte deshalb meist erst dann ein, wenn klar ist, welcher Stoff fehlt. Je nach Situation und Erkrankung sind dies Coenzym Q10 (als Ubichinon, Ubichinol, Idebenon), Vitamin B1, Vitamin B2, Alpha-Liponsäure, Folsäure, Vitamin E, Magnesium, Kreatin, Arginin, Succinat oder L-Carnitin.
Wie der Arzt bei der Therapie vorgeht, bleibt immer eine Einzelfallentscheidung, die vom Krankheitsbefund abhängt. Zunächst sollte ein Behandlungsversuch über sechs Monate erfolgen, um zu prüfen, ob die Präparate wirksam sind. Die Folgeerkrankungen werden fachgerecht behandelt (etwa mit Diabetesmedikamenten, Sehhilfen oder Hörgeräten).
Ziele der Mikronährstoffmedizin
Die Mikronährstoffmedizin konzentriert sich bei der Behandlung von Mitochondriopathien auf folgende Ziele:
- Gifte beseitigen und Mitochondrien schützen,
- Bildung neuer Mitochondrien anregen,
- Energieproduktion unterstützen sowie
- Entzündungen lindern.
Schutz und Stärkung der Mitochondrien kann durch die Einnahme bestimmter Mikronährstoffe erreicht werden. Diese nennt man mitotrope Nährstoffe – sie sind für die Energieproduktion in den Mitochondrien unabdingbar. Dazu zählen:
- Coenzym Q10 wird für die Energieproduktion gebraucht.
- L-Carnitin ist wichtig für das Einschleusen von Fett in die Mitochondrien.
- Alpha-Liponsäure ist ein Cofaktor bei der Energieproduktion in den Mitochondrien.
- B-Vitamine sind unentbehrlich für verschiedene Stoffwechselprozesse in den Mitochondrien.
- Magnesium sorgt für die Speicherung und Freisetzung von Energie.
- Antioxidantien schützen Mitochondrien vor oxidativem Stress.
- Pflanzenstoffe könnten die Bildung neuer Mitochondrien unterstützen.
- Omega-3-Fettsäuren wirken dämpfend auf Entzündungen.
- Arginin und Citrullin unterstützen die Durchblutung.
- Kreatin ist eine Energiereserve im Gewebe.
Wenn nicht genau bekannt ist, welche mitochondrielle Erkrankung vorliegt, sollte immer nur ein Stoff eingenommen werden. Erst wenn dieser eine Besserung bringt, kann man einen weiteren hinzunehmen. Idealerweise überwacht ein Mikronährstoff-Experte die Therapie.
Behandlung mit Mikronährstoffen
Coenzym Q10: Wichtiger Schutz für die Mitochondrien und mehr
Wirkweise von Coenzym Q10
Coenzym Q10 (Ubichinon) ist Bestandteil der Atmungskette in den Mitochondrien. Es ist für die letzten Schritte der Energieproduktion notwendig. Zudem ist Coenzym Q10 ein Antioxidans. Während andere Antioxidantien nur die Zelle erreichen, gelangt Coenzym Q10 direkt hinein: Als Radikalfänger schützt es dort die Mitochondrien vor schädlichen freien Radikalen (oxidativen Stress).
Coenzym Q10 könnte die Muskelstärke bei Mitochondriopathien verbessern: In einer kleinen hochwertigen Studie erzielten Betroffene bei einem Ausdauertest etwas bessere Ergebnisse. Andere Forscher fanden in Vorstudien ebenfalls heraus, dass Coenzym Q10 bei bestimmten Mitochondriopathien (Kearns-Sayre-Syndrom) Anzeichen von Muskelermüdung verringern kann. Auch das Muskelzittern verschwand. Ähnliche Ergebnisse liegen vor für Muskelerkrankungen, wie Friedreich-Ataxie oder Duchenne-Muskeldystrophie. Es gibt jedoch auch Studien, in denen Coenzym Q10 keinen Einfluss zeigte.
Eine schwache Mitochondrienfunktion trägt auch zu Nervenerkrankungen bei. Dabei werden häufig niedrige Coenzym-Q10-Werte festgestellt. Es ist noch nicht geklärt, ob durch Coenzym Q10 Nervenkrankheiten behandelt werden können. Erste Studien zeigen aber, dass es sich günstig auswirkt auf Alzheimer, Parkinson, Fibromyalgie und chronisches Erschöpfungssyndrom (CFS). Auch für Depressionen, Migräne und Augenerkrankungen wie grüner Star und altersbedingte Makuladegeneration (AMD) wird eine positive Wirkung angenommen.
Wenn Cholesterinsenker (Statine) die Herstellung von Coenzym Q10 beeinträchtigen, sollte immer an eine Ergänzung gedacht werden. Coenzym Q10 kann die Nebenwirkungen von Statinen lindern.
Fazit: Zwar gibt es unterschiedliche Studienergebnisse, sicher ist aber: Coenzym Q10 ist für die Mitochondrien sehr wichtig. Bei einigen Erkrankungen mit Schäden an den Mitochondrien konnte Coenzym Q10 die Beschwerden lindern. Laut offiziellen Leitlinien kann Coenzym Q10 vermutlich bei allen Mitochondriopathien eingesetzt werden.
Dosierung und Einnahmeempfehlung von Coenzym Q10
Bei Mitochondriopathien können pro Tag 100 bis 200 Milligramm Coenzym Q10 ergänzt werden. Manchmal empfehlen Mikronährstoff-Experten auch bis zu 300 Milligramm. Am besten sollte es zu den Mahlzeiten eingenommen werden, da das Fett aus Lebensmitteln die Coenzym-Q10-Aufnahme im Darm verbessert.
Tipp
Coenzym Q10 nimmt der Körper in Form von Ubiquinol besser auf als Ubichinon. Studien zeigen, dass sich mit Ubiquinol höhere Werte im Blut erzielen lassen als mit Ubichinon. Zudem muss Ubiquinol nicht erst aktiviert werden, da es bereits die aktive Form ist.
Coenzym Q10: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Zwar ist Coenzym Q10 ein natürlicher Stoff, es liegen aber nicht genügend Daten für Schwangere und Stillende vor. Mengen über 30 Milligramm sollten nicht ohne Rücksprache mit dem Arzt genommen werden. Auch bei Kindern und Jugendlichen ist Coenzym Q10 nicht ausreichend untersucht.
Coenzym Q10 kann den Blutzuckerspiegel verringern. Deshalb sind bei Diabetes engmaschige Blutzuckermessungen notwendig, um eine Unterzuckerung zu vermeiden.
Personen, die Medikamente zur Regulierung des Blutdrucks einnehmen, sollten die Einnahme von Coenzym Q10 vorsichtshalber mit dem Arzt absprechen: Es wirkt blutdrucksenkend. Dazu zählen zum Beispiel Captopril (Lopirin Cor®) oder Hydrochlorothiazid (Esidrix®).
Coenzym Q10 kann die Wirkung von den Blutgerinnungshemmern Phenprocoumon (zum Beispiel Marcumar®, Falithrom® und Marcuphen®) und Warfarin (Coumadin®) herabsetzen. Dies kann bereits bei 30 bis 100 Milligramm Coenzym Q10 auftreten. Deshalb sollte die Einnahme mit dem Arzt abgesprochen werden.
Menschen mit Lungenerkrankungen (Asthma), die Medikamente mit Theophyllin nehmen (wie Bronchoretard®, Tromphyllin®), sollten kein Coenzym Q10 ergänzen. Es verzögert den Abbau des Medikaments.
Während einer Strahlen- oder Chemotherapie sollte Coenzym Q10 nicht ohne Wissen des Arztes eingesetzt werden. Es könnte die Wirkung beeinträchtigen.
L-Carnitin: Fette in Energie umwandeln
Wirkweise von L-Carnitin
L-Carnitin ist unerlässlich für die Energiegewinnung aus Fett: Die Bausteine der Fette (Fettsäuren) können nur in die Mitochondrien gelangen, wenn sie an L-Carnitin gebunden sind. L-Carnitin trägt zudem zur Entgiftung der Mitochondrien bei, indem es überschüssige mittel- und langkettige Fettsäuren abtransportiert. Bei einem L-Carnitin-Mangel sammeln sich giftige Stoffwechselzwischenprodukte in der Zelle und es kommt zur Störung des Energiestoffwechsels.
Ein L-Carnitin-Mangel wird mit dem chronischen Erschöpfungssyndrom in Zusammenhang gebracht: In einer kleinen Studie zeigten Betroffene mit höheren L-Carnitin-Werten schwächere Beschwerden als diejenigen mit niedrigem Gehalt im Blut. Auch bei Teilnehmern einer Vorstudie, die L-Carnitin einnahmen, schnitt es gut ab: L-Carnitin war deutlich besser verträglich und wirksamer als ein Kontrollwirkstoff (Amantadin). Dieser wird versuchsweise beim chronischen Erschöpfungssyndrom eingesetzt. Beide Stoffe erhielten die Teilnehmer zwei Monate lang. Die größten Verbesserungen durch L-Carnitin traten zwischen der vierten und achten Studienwoche auf.
Mitochondriale Myopathien sind eine Gruppe von seltenen angeborenen Muskelerkrankungen. In einer kleinen hochwertigen Studie steigerte die zweimonatige Einnahme von L-Carnitin die Leistungsfähigkeit bei Ausdauerbelastungen stärker als ein Scheinmedikament.
Fazit: L-Carnitin ist für die Energiegewinnung und Entgiftung der Mitochondrien wichtig. Erste Studien zeigen, dass es Betroffenen mit gestörter Mitochondrienfunktion helfen kann. L-Carnitin gehört daher zu den Wirkstoffen, die man bei einer Mitochondriopathie probieren kann.
L-Carnitin: Dosierung und Einnahmeempfehlung
Mikronährstoff-Experten raten bei Mitochondriopathien zu 2.000 bis 4.000 Milligramm L-Carnitin täglich. Die Einnahme von Mengen über 2.000 Milligramm sollte optimalerweise ärztlich begleitet und nicht dauerhaft überschritten werden. In einer ersten Studie wurde es zwei Monate lang eingesetzt.
Ab 2.000 Milligramm wird empfohlen, die L-Carnitin-Gesamtdosis über den Tag zu verteilen, zum Beispiel dreimal 1.000 Milligramm, da der Darm nur eine bestimmte Menge auf einmal aufnehmen kann. L-Carnitin kann entweder zu den Mahlzeiten eingenommen werden oder unabhängig davon – die Einnahme zu einer Mahlzeit erhöht allerdings die Verträglichkeit für den Magen.
L-Carnitin: zu beachten bei Erkrankungen und Medikamenteneinnahme
Personen mit Nierenschwäche sollten die Einnahme von L-Carnitin mit dem Arzt absprechen, wenn die Dosierung langfristig 1.000 Milligramm pro Tag übersteigt.
Aus L-Carnitin entstehen bei einer gestörten Darmflora Substanzen, die in großen Mengen negativ bei Herz-Kreislauf- und Stoffwechselerkrankungen sein könnten (TMAO, Trimethylamin-N-oxid). Eine regelmäßige Einnahme sollte bei Herz-Kreislauf-Erkrankungen (wie Arteriosklerose), Lebererkrankungen (etwa Fettleber), Diabetes sowie Diabetes-Vorstufen (metabolischem Syndrom) nur auf ärztlichen Rat hin erfolgen. TMAO kann bei Bedarf im Labor bestimmt werden.
Wird L-Carnitin bei einem Herzinfarkt plötzlich abgesetzt, könnten sich dadurch die Schäden am Herzen verschlimmern. Dies zeigt ein Tierversuch. Bei einem Herzinfarkt sollte der Arzt über die Carnitin-Einnahme informiert werden.
Bei Prostata- und Blasenkrebs ist der Fettstoffwechsel aktiviert. Betroffene sollten kein L-Carnitin ergänzen. Auch ist noch nicht klar, wie sich eine langfristige Zufuhr auf Darmkrebs auswirkt.
In seltenen Fällen verstärkt L-Carnitin die Wirkung von einigen Blutgerinnungshemmern. Betroffen sind Wirkstoffe vom Cumarin-Typ wie Phenprocoumon (Marcuphen® oder Falithrom®) und Warfarin (Coumadin®). Die Ergänzung von L-Carnitin sollte dann mit dem Arzt abgesprochen sein.
L-Carnitin kann den Blutzucker beeinflussen. Bei Diabetes sind eine regelmäßige Kontrolle der Werte und eine Absprache mit dem Arzt empfehlenswert. Werden blutzuckersenkende Medikamente wie Metformin (Siofor®, Diabesin®) oder Sulfonylharnstoffe (Maninil®, Euglucon®) eingenommen, muss der Arzt eventuell die Dosierung ändern. Es könnte sonst zu einer Unterzuckerung kommen.
Alpha-Liponsäure: Cofaktor von Enzymen in den Mitochondrien
Wirkweise von Alpha-Liponsäure
Alpha-Liponsäure ist ein Cofaktor vieler Enzymsysteme, die in den Mitochondrien zur Energieproduktion gebraucht werden. Darüber hinaus ist sie ein wichtiges Antioxidans (Radikalfänger), das die Mitochondrien schützt sowie andere Antioxidantien regeneriert – zum Beispiel Coenzym Q10. Daneben fördert Alpha-Liponsäure die Bildung neuer Mitochondrien.
Bei Mitochondriopathien zeigte Alpha-Liponsäure positive Effekte in Kombination mit weiteren Stoffen: In einer ersten hochwertigen Studie senkten Alpha-Liponsäure, Kreatin und Coenzym Q10 bei Betroffenen oxidativen Stress. Auch einer Abnahme der Muskelfunktion konnte entgegengewirkt werden.
Zudem scheint die Kombination von Alpha-Liponsäure mit anderen mitochondrialen Nährstoffen wirksamer zu sein, wenn es um die geistige Leistung geht. Ein weiterer Nährstoff ist L-Carnitin. Beispielsweise kann Alzheimer eine Folge einer mitochondrialen Fehlfunktion sein. Insbesondere in frühen Phasen könnte das Fortschreiten der Erkrankung mit Alpha-Liponsäure laut Vorstudien stark verlangsamt werden.
Fazit: Der Körper braucht Alpha-Liponsäure zur Energieproduktion. Studien sind allerdings kaum vorhanden. Dennoch ist Alpha-Liponsäure bei oxidativem Stress aufgrund von mitochondrialer Fehlfunktion einen Versuch wert.
Alpha-Liponsäure: Dosierung und Einnahmeempfehlung
Bei einer Mitochondriopathie empfehlen Mikronährstoff-Experten täglich 400 bis 600 Milligramm Alpha-Liponsäure. Vor allem die Kombination mit Coenzym Q10 sowie L-Carnitin ist vielversprechend.
Die Wirksamkeit von Alpha-Liponsäure ist am besten, wenn sie nüchtern eingenommen wird: Dann wird sie optimal vom Körper aufgenommen. Mineralstoffe hemmen die Aufnahme im Darm.
Info
Hochwertige Präparate mit Alpha-Liponsäure enthalten zusätzlich Biotin. Bei regelmäßiger Einnahme von Alpha-Liponsäure kann es zu einer Unterversorgung mit Biotin kommen.
Zudem sollte bei einer langfristigen Einnahme Eisen kontrolliert werden: Alpha-Liponsäure könnte einen Eisenmangel verstärken. In einer Studie kam es zur Senkung des Eisens im Blut. Dabei wurden zwölf Wochen lang 600 Milligramm Alpha-Liponsäure ergänzt.
Alpha-Liponsäure: zu beachten in der Schwangerschaft und Stillzeit und bei Medikamenteneinnahme
Schwangere und Stillende sollten Alpha-Liponsäure nur nach Rücksprache mit einem Arzt einnehmen: Große Studien fehlen. Erste Untersuchungen zeigen jedoch, dass 600 Milligramm Alpha-Liponsäure pro Tag keine negativen Auswirkungen hatten.
Alpha-Liponsäure kann die Wirkung von Medikamenten bei Diabetes erhöhen und eine Unterzuckerung bewirken. Betroffen sind Glibenclamid (zum Beispiel Euglucon®), Glimepirid (zum Beispiel Amaryl®, Glimmegama®) und Metformin (zum Beispiel Competact®, Diabesin®). Am Anfang der Alpha-Liponsäure-Therapie sollte der Blutzuckerspiegel engmaschig kontrolliert werden.
Personen, die Schilddrüsenhormone (L-Thyroxin wie Winthrop®, L-Thyroxin beta®) einnehmen, sollten die Ergänzung von Alpha-Liponsäure mit dem Arzt absprechen. Die Aktivierung der Schilddrüsenhormone könnte gebremst werden.
Bei einer Krebstherapie sollte Alpha-Liponsäure nur in Rücksprache mit dem Arzt eingenommen werden.
B-Vitamine sind essenziell für den Energiestoffwechsel
Wirkweise von B-Vitaminen

B-Vitamine sind an mehreren Stellen der Energiegewinnung wichtig:
- Vitamin B1 schleust Kohlenhydrate zur Energiegewinnung in den Citratzyklus. Ein Mangel verursacht eine verminderte Aktivität von Vitamin-B1-abhängigen Enzymen. Folgen sind eine gedrosselte Energieproduktion und unumkehrbare Schäden der Mitochondrien.
- Die aktive Form von Vitamin B2 ist ein Teil von Enzymen, die unter anderem beim letzten Schritt der Energieherstellung gebraucht werden. Zudem hilft Vitamin B2, oxidativen Stress zu vermeiden: Es ist an der Regeneration eines antioxidativen Schutzstoffs (Glutathion) beteiligt.
- Vitamin B12 wird benötigt, damit Fette und Kohlenhydrate zu Energie umgewandelt werden. Zudem trägt es zum Schutz der Nervenzellen bei, weshalb Vitamin B12 besonders bei Nervenbeschwerden eingesetzt wird. Daneben hilft Vitamin B12, nitrosativen Stress zu senken: Es fängt reaktive Stickstoffverbindungen ab, die bei Entzündungen produziert werden.
- Der Folsäurespiegel in der Nervenflüssigkeit kann bei Mitochondriopathien erniedrigt sein. Grund ist starker oxidativer Stress, denn dabei wird Folsäure abgebaut.
- Niacin ist als aktive Wirkform am Abbau von Kohlenhydraten und Fetten beteiligt. Ein Mangel könnte mit einer gestörten Mitochondrienfunktion und einer geringen Energieproduktion zusammenhängen.
Bei Migräne tragen vermutlich oxidativer Stress, Fehlfunktionen bei der Energieproduktion sowie Entzündungen zur Entstehung von Schmerzattacken bei. Die Mehrheit der bisherigen Studien deutet darauf hin, dass Vitamin B2 die Energieproduktion der Zellen verbessert und Migräneattacken vorbeugt. Zudem treten mit Vitamin B2 die Attacken seltener auf, sind kürzer und weniger stark ausgeprägt.
Auch bei Autismus spielen vermutlich Mitochondriopathien eine Rolle. Kinder mit Autismus weisen häufiger defekte Mitochondrien auf. Zudem haben sie weniger Folsäure im Nervenwasser. Erste Studien mit B-Vitaminen zeigen positive Effekte – besonders Vitamin B12 und Folsäure in Kombination mit Coenzym Q10 und L-Carnitin. Auch laut einer Übersichtsarbeit wurden die Symptome deutlich gebessert.
Bei der Erbkrankheit Leigh-Syndrom liegt ein Defekt des Energiestoffwechsels durch geschädigte Mitochondrien vor. Patienten haben häufig zu wenig Vitamin B1 im Nervenwasser. Neben Krampfanfällen ist eine obstruktive Schlafapnoe ein häufiges Problem. Diese Atmungsstörung führt während des Schlafes zu einem Zusammenbruch des Rachenraumes, wodurch die Sauerstoffversorgung beeinträchtigt ist. Laut ersten Berichten lindert hoch dosiertes Vitamin B1 in Kombination mit Coenzym Q10, L-Carnitin, Vitamin C und E die Beschwerden der Schlafapnoe bei Leigh-Syndrom-Patienten. In manchen Fällen halfen auch Vitamin B1 und Biotin.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Da B-Vitamine im Stoffwechsel und bei der Energiegewinnung eng zusammenarbeiten, ist die Ergänzung des gesamten Vitamin-B-Komplexes im Rahmen der Mikronährstoffmedizin empfehlenswert. Folgende Dosierungen sind bei Mitochondriopathien sinnvoll:
- Vitamin B1: 2 bis 5 Milligramm
- Vitamin B2: 4 bis 7 Milligramm
- Vitamin B12: 10 bis 15 Mikrogramm
- Folsäure: 200 bis 400 Mikrogramm (als direkt verwertbare 5-Methyltetrahydrofolsäure (5-MTHF))
- Niacin: 45 bis 60 Milligramm
Manchmal empfehlen Mikronährstoff-Experten auch eine höhere Dosierung – zum Beispiel, wenn ein Mangel festgestellt wurde.
B-Vitamine: zu beachten bei Schwangerschaft und Stillzeit, Erkrankungen und Medikamenteneinnahme
Schwangere und stillende Frauen sollten hoch dosierte B-Vitamine nur bei einem nachgewiesenen Mangel und in Rücksprache mit dem Arzt einnehmen.
Nierenpatienten sollten Vitamin B12 nicht in Form von Cyanocobalamin einnehmen, sondern als Methylcobalamin, da hoch dosiertes Cyanocobalamin für sie vermutlich schädlich ist.
Menschen mit schwerer Herz-Kreislauf-Schwäche, einem kürzlich aufgetretenen Herzinfarkt, akuten Blutungen, Magengeschwüren und schweren Lebererkrankungen sollten nicht mehr als 30 Milligramm Niacin pro Tag einnehmen.
Niacin sollte nicht zeitgleich mit Antibiotika aus der Gruppe der Tetracycline (Fluorex Plus®, Mysteclin®) eingenommen werden, da es deren Aufnahme behindert. Empfohlen wird ein Einnahmeabstand von zwei bis drei Stunden. Auch Folsäure vermindert die Wirkung von Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®).
Magnesium schützt vor Energiemangel
Wirkweise von Magnesium
Auch Magnesium kann die Mitochondrien unterstützen, denn es hat vielfältige Aufgaben im Energiehaushalt: Es ist zum Beispiel an der Speicherung und Freisetzung der Energie beteiligt. Fehlt Magnesium, kommt es zu einem Energiemangel. Zudem treten bei Magnesiummangel vermehrt Muskelkrämpfe oder Kopfschmerzen auf. Eine weitere Folge ist die Entstehung von nitrosativem Stress, der eine Ursache von Defekten in Mitochondrien ist. Häufig steht ein Magnesiummangel mit Mitochondriopathien in Zusammenhang.
Chronisches Erschöpfungssyndrom: In einer ersten Studie an 138 Patienten wies ein Großteil einen Magnesiummangel auf. Gleichzeitig wurde bei ihnen eine mitochondriale Fehlfunktion diagnostiziert. Je ausgeprägter diese Fehlfunktion war, desto ausgeprägter waren die Beschwerden der Krankheit. Das Spritzen von Magnesium in die Muskulatur verbesserte in einer hochwertigen Studie die Symptome des chronischen Erschöpfungssyndroms sowie das emotionale Befinden. Weitere Studien müssen nun zeigen, ob alle Patienten darauf ansprechen.
Nervenerkrankungen: Da Magnesium wichtig für die Weiterleitung von Nervensignalen ist, wird derzeit der Einsatz bei verschiedenen Nervenerkrankungen diskutiert. Mögliche Anwendungsgebiete sind Migräne, Epilepsie, Depressionen, Parkinson und Alzheimer. Inwiefern Magnesium bei diesen Erkrankungen wirksam ist, muss zukünftig durch Studien geprüft werden.
Fazit: Zwar fehlen Studien zu Mitochondriopathien, da Magnesium jedoch für den Energiestoffwechsel wichtig ist, sollte es ausreichend verfügbar sein.
Dosierung und Einnahmeempfehlung von Magnesium
Bei Mitochondriopathien und den Folgeerkrankungen ist es empfehlenswert, täglich 200 bis 900 Milligramm Magnesium einzunehmen. Bei einer dauerhaften Einnahme höherer Dosierungen (über 250 Milligramm) ist es sinnvoll, wenn ein Arzt die Blutwerte überwacht.
Da Magnesium in Dosierungen von über 300 Milligramm bei empfindlichen Menschen Durchfall auslösen kann, sollte es bei höheren Mengen auf den ganzen Tag aufgeteilt werden.
Magnesium im Labor bestimmen lassen
Ab einer regelmäßigen Dosierung von über 250 Milligramm Magnesium pro Tag empfiehlt es sich, die Werte im Blut zu kontrollieren.
Magnesium kommt hauptsächlich in roten Blutzellen vor. Deshalb sollte es am besten im Vollblut gemessen werden. Dieses enthält alle roten Blutzellen und eine Messung ist daher aussagekräftiger als eine Bestimmung im Serum (Blutflüssigkeit ohne rote Blutzellen). Normalwerte liegen zwischen 1,38 bis 1,50 Millimol pro Liter. Mikronährstoff-Experten empfehlen Patienten, ihre Magnesiumwerte ein- bis zweimal im Jahr überprüfen zu lassen.
Magnesium: zu beachten bei Nierenerkrankungen und Medikamenteneinnahme
Patienten mit chronischen Nierenerkrankungen sollten Magnesium nicht zusätzlich einnehmen. Geschädigte Nieren können überschüssiges Magnesium nicht gut ausscheiden. Das Magnesium aus Mineralstoffpräparaten würde sich daher im Blut anreichern.
Magnesium kann bei gleichzeitiger Einnahme mit Arzneimitteln die Wirkung herabsetzen, da es sich an sie bindet. Daher sollten Arzneimittel mit einem Abstand von mindestens zwei Stunden eingenommen werden. Dazu zählen:
bestimmte Antibiotika wie Ciprofloxacin (zum Beispiel Ciloxan®), Enoxacin (zum Beispiel Enoxor®), Levofloxacin (zum Beispiel Tavanic®) und Doxycyclin (zum Beispiel Supracyclin®)
Osteoporose-Wirkstoffe (Bisphosphonate) wie Alendronat (zum Beispiel Fosamax®, Tevanate®), Clodronat (zum Beispiel Bonefos®) oder Etidronat (zum Beispiel Didronel®)
Chelatbildnern wie Penicillamin (Metalcaptase®)
Antioxidantien schützen Mitochondrien vor oxidativem Stress
Wirkweise von Antioxidantien
Bei einer mitochondrialen Fehlfunktion fallen vermehrt oxidative Abfallstoffe an. Da sie zur Alterung der Mitochondrien beitragen, sollten ausreichend antioxidative Vitamine und Mineralstoffe verfügbar sein. Zum Beispiel schützen die Vitamine C und E sowie der Mineralstoff Selen Mitochondrien vor oxidativem Stress. Außerdem können Vitamin C und Selen nitrosativem Stress vorbeugen.
Erste kleine Studien zeigen, dass die Gabe von Vitamin C über Infusionen bei Patienten mit chronischem Erschöpfungssyndrom zur Besserung der Symptome beitragen könnte. In einer Beobachtungsstudie wiesen Fibromyalgie-Patienten deutlich niedrigere Selenwerte als gesunde Teilnehmer auf. Daher sollten Betroffene auf eine ausreichende Selenversorgung achten.
Ein weiteres wichtiges Antioxidans ist Glutathion. Forscher zeigten in einer ersten Studie, dass Betroffene mit Mitochondriopathien einen gestörten Antioxidantien-Haushalt hatten. Zum Beispiel haben sie zu wenig Glutathion. Die Ergänzung von Glutathion oder dessen Bausteinen wie Cystein und Glycin könnte daher vielversprechend sein. Darauf deuten Tierstudien und erste Studien an Menschen hin.
Fazit: Es gibt viele Hinweise, dass Antioxidantien vor Mitochondriopathien schützen. Größere Studien müssen die Ergebnisse noch bestätigen. Die Versorgung sollte jedoch ausgeglichen sein.
Dosierung und Einnahmeempfehlung von Antioxidantien
Bei Mitochondriopathien werden 300 bis 500 Milligramm Vitamin C, 70 bis 100 Mikrogramm Selen und 20 bis 40 Milligramm Vitamin E empfohlen. Als Basisabsicherung mit Antioxidantien sind Mikronährstoffpräparate mit allen acht Vitamin-E-Formen vorzuziehen (vollständiger Vitamin-E-Komplex). Gut versorgt ist man außerdem mit 50 bis 100 Milligramm Glutathion pro Tag.
Präparate sollten am besten zum Essen eingenommen werden. Einerseits sind sie so verträglicher, andererseits werden einige Mikronährstoffe so besser im Darm aufgenommen.
Info
Vitamin C kann die Aufnahme von Selen aus der Verbindung Natriumselenit hemmen. Deshalb sollte ein Einnahmeabstand von ein bis zwei Stunden zwischen Vitamin C und Selen eingehalten werden. Achten Sie bei Kombinationspräparaten darauf, dass die Verbindung Natriumselenat enthalten ist. Selen aus der Nahrung wird nicht durch Vitamin C gehemmt.
Im Labor bestimmen lassen: Antioxidantienstatus und Selen
Hoch dosierte Antioxidantien sollten nur so lange zugeführt werden, bis der oxidative Stress ausgeglichen ist. Um zu bestimmen, wie gut der Körper mit Antioxidantien versorgt ist, kann man den Gesamt-Antioxidantienstatus messen. Es gelten die jeweils von den Labors angegebenen Normalwerte, da sie je nach Messmethode schwanken können.
Auch können die geschädigten Zellbestandteile gemessen werden oder die Gehalte der Antioxidantien im Blut. Empfehlenswert ist die Bestimmung von Selen. Idealerweise wird Selen im Vollblut bestimmt. Vollblut enthält alle Blutzellen und zeigt die Langzeitversorgung mit Selen. Die Werte sollten zwischen 120 und 150 Mikrogramm pro Liter liegen.
Antioxidantien: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
In der Schwangerschaft wird eine Vitamin-C-Zufuhr von 110 Milligramm empfohlen. Für Stillende sind 150 Milligramm ratsam. Höhere Mengen sollte man mit dem Arzt absprechen. Wahrscheinlich sind aber bis 1.800 Milligramm pro Tag sicher.
Da Vitamin C die Eisenaufnahme verbessert, sollten bei Menschen mit krankhafter Eisenüberladung (Hämochromatose) höhere Vitamin-C-Gaben nur unter ärztlicher Aufsicht erfolgen.
Selen sollte bei Nierenerkrankungen nur eingenommen werden, wenn ein Arzt den Blutspiegel regelmäßig kontrolliert. Durch eine eingeschränkte Nierenfunktion kann die Selenausscheidung vermindert sein. Dadurch besteht die Gefahr einer Überdosierung.
Selen könnte das Risiko für Diabetes beeinflussen: Zu hohe und zu niedrige Blutwerte sind ungünstig. Ohne Blutkontrolle sollten Menschen mit Diabetes und hohem Risiko kein Selen einnehmen.
Hoch dosierte Antioxidantien wie Vitamin C könnten die Wirksamkeit einer Krebstherapie reduzieren. Dies gilt zum Beispiel für den Blutkrebs-Wirkstoff Bortezomib (wie Velcade®) und für Doxorubicin (wie Adriblastin®, Ribodoxo®), Methotrexat (wie Bendatrexat®, Lantarel®) oder Cisplatin (wie Cis-GRY®). Die Ergänzung sollte bei Krebs immer mit dem Arzt abgesprochen werden.
Pflanzenstoffe könnten die Bildung neuer Mitochondrien anregen
Wirkweise von Pflanzenstoffen
Sekundäre Pflanzenstoffe sind wichtige Antioxidantien aus der Nahrung. In Tierversuchen verhinderten sie oxidativen Stress an den Mitochondrien und trugen dazu bei, dass der Energiestoffwechsel dort störungsfrei ablief.
Es gibt auch Hinweise, dass bestimmte Pflanzenstoffe die Bildung neuer Mitochondrien anregen, zum Beispiel Epigallocatechingallat (EGCG) aus Grüntee, Resveratrol aus Trauben und Curcumin aus Kurkuma. So zeigen sehr viele Vorstudien, dass Resveratrol positiv auf die Mitochondrien wirken könnte. Auf die Symptome verschiedener Erkrankungen fanden Forscher allerdings noch keine Effekte (COPD, mitochondriale Myopathie, Diabetes). Zusammen mit einem Sportprogramm könnte Resveratrol jedoch die Muskelfunktion von alten Menschen verbessern.
Zudem könnte die Einnahme von Anthocyanidinen, die ebenfalls in roten Trauben oder Rotwein vorkommen, bei Fibromyalgie hilfreich sein. In einer kleinen hochwertigen Studie linderten Anthocyanidine Schlafstörungen und Erschöpfungssymptome deutlich stärker als ein Scheinmedikament.
In Tier- und Laborstudien korrigierte Ginkgo-Extrakt Fehlfunktionen der Mitochondrien und steigerte deren Energieausbeute. Forscher vermuten, dass Ginkgo deshalb auch bei Alzheimer positiv wirkt.
Fazit: Theoretisch könnten Pflanzenstoffe bei einer Mitochondriopathie positiv wirken. Hochwertige Studien liegen aber noch nicht vor. Viele Studien zu Alterserkrankungen werden aber erwartet.
Dosierung und Einnahmeempfehlung von Pflanzenstoffen
Mikronährstoff-Experten empfehlen bei Mitochondriopathien eine Ernährung, die reich an Obst und Gemüse ist. Bei Präparaten empfiehlt sich eine Kombination aus verschiedenen Pflanzenstoffen, da Pflanzenstoffe auch in der Nahrung als Mischung vorkommen. In guten Kombinationspräparaten ist die Dosierung deshalb aufeinander abgestimmt. Sinnvolle Dosierungen sind zum Beispiel:
- 50 bis 80 Milligramm Anthocyanidine
- 10 bis 30 Milligramm Resveratrol
- 50 bis 80 Milligramm Ginkgo-Extrakt
- 10 bis 30 Milligramm EGCG
- 10 bis 30 Milligramm Curcumin
Es kann sinnvoll sein, wenn der Mikronährstoff-Experte den antioxidativen Status im Blut überwacht.
Pflanzenstoffe: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Die Studienlage ist nicht ausreichend, um die Einnahme von Pflanzenstoffen für Schwangere oder Stillende empfehlen zu können. Resveratrol darf nur nach Rücksprache mit dem Arzt ergänzt werden. Eine obst- und gemüsereiche Ernährung ist dagegen kein Problem.
Ginkgo sollte bei bekanntem Krampfleiden (Epilepsie) nicht angewandt werden.
Curcumin sollte nicht bei Gallensteinen angewendet werden. Es regt die Produktion von Gallensäure an. Wenn ein Stein den vermehrten Gallenfluss behindert, kann das schwere Beschwerden (Gallenkolik) auslösen. Auch Personen, die zu einer Überproduktion an Gallensaft neigen, sollten auf Curcumin verzichten. Es kann zu Durchfall kommen.
Ginkgo-Extrakt könnte die Blutungsneigung erhöhen. Er sollte vor einer Operation oder Zahnbehandlung abgesetzt werden. Bei Blutgerinnungsstörungen muss der Arzt gefragt werden.
Zudem beeinflussen Pflanzenstoffe den Abbau oder die Wirkung von Medikamenten. Vor der Einnahme zusammen mit Medikamenten sollte man sich bei einem Fachmann über die Wechselwirkungen erkundigen. Weitere Informationen finden sie hier: Ginkgo, Resveratrol, Grüntee-EGCG und Curcumin.
Omega-3-Fettsäuren halten Entzündungen in Schach
Wirkweise von Omega-3-Fettsäuren
Oxidativer Stress schädigt nicht nur die Mitochondrien, er erzeugt auch Entzündungen. Das begünstigt wiederum Folgeerkrankungen, zum Beispiel Diabetes. Omega-3-Fettsäuren wie Eicosapentaensäure (EPA) aus Fischöl wirken entzündungshemmend. Darüber hinaus haben sie antioxidative Eigenschaften. Omega-3-Fettsäuren werden in die Membran der Mitochondrien eingebaut – dort, wo sie direkt gebraucht werden. Die Fettsäuren könnten deshalb die Mitochondrien schützen.
Eine erste Studie zeigt eine Verbesserung der Mitochondrienfunktion bei einer Fettleber. Daneben wurde durch Omega-3-Fettsäuren der Abbau der Mitochondrien verlangsamt, der nach körperlicher Inaktivität folgt.
Vermutlich haben Omega-3-Fettsäuren bei Erkrankungen, die mit einer Fehlfunktion der Mitochondrien in Zusammenhang stehen, einen positiven Einfluss. Dazu gehören Parkinson, Alzheimer, Herz-Kreislauf-Erkrankungen und Diabetes.
Dosierung und Einnahmeempfehlung von Omega-3-Fettsäuren
Im Rahmen der Mikronährstoffmedizin liegen die Dosierungen bei Mitochondriopathien meist zwischen 1.000 und 2.000 Milligramm Omega-3-Fettsäuren pro Tag. Empfehlenswert ist ein Präparat, das EPA enthält. Omega-3-Fettsäuren sollten immer mit einer fetthaltigen Mahlzeit eingenommen werden, da sie sonst im Darm nicht gut aufgenommen werden.
Tipp
Die Omega-3-Fettsäure EPA kommt in Fischöl vor. Achten Sie bei Fischölpräparaten auf die Qualität. Hochwertige Präparate sind speziell gereinigt, sodass keine unerwünschten Rückstände enthalten sind. Krill- und Algenöl sind von Natur aus reiner, liefern aber eine etwas andere Zusammensetzung der Omega-3-Fettsäuren. Algenöl eignet sich zudem für Vegetarier und Veganer.
Omega-3-Fettsäuren im Labor bestimmen lassen: Omega-3-Index
Mithilfe eines Bluttests kann der Anteil der Omega-3-Fettsäuren in den roten Blutkörperchen (Erythrozyten) bestimmt werden – der sogenannte Omega-3-Index. Er wird in Prozent angegeben. Ein durchschnittliches Ergebnis von 5 bis 8 Prozent bedeutet, dass 5 bis 8 von 100 Fettsäuren in den roten Blutkörperchen wertvolle Omega-3-Fettsäuren sind. Als optimal gilt ein Wert von über 8 Prozent.
Omega-3-Fettsäuren: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei akuten Lebererkrankungen, einer akuten Bauchspeicheldrüsenentzündung oder einer Gallenblasenentzündung sollten Omega-3-Fettsäuren nicht eingenommen werden.
Möglicherweise senken Omega-3-Fettsäuren den Blutzucker. Diabetiker, die Medikamente einnehmen, sollten ihre Blutzuckerwerte zu Beginn der Einnahme häufiger kontrollieren, um eine Unterzuckerung zu vermeiden. Eventuell ist eine Anpassung der Medikamente nötig.
Bestimmte Herzrhythmusstörungen (Vorhofflimmern) könnten bei Vorerkrankungen häufiger auftreten, wenn mehr als 1.000 Milligramm Omega-3-Fettsäuren pro Tag eingesetzt werden. Liegen Herzrhythmusstörungen vor, sollte man die Einnahme mit dem Arzt oder Mikronährstoff-Experten besprechen. Er kann das Risiko abwägen und begleitend den Omega-3-Index kontrollieren.
Bei Herz-Kreislauf-Erkrankungen könnten Omega-3-Fettsäuren blutverdünnend wirken. Daher sollten Personen mit einer Blutgerinnungsstörung die Einnahme zuvor mit dem Arzt abklären. Gleiches gilt vor einer geplanten Operation. In einer Vorstudie stieg das Blutungsrisiko nicht (2.000 Milligramm). Bisher gibt es jedoch wenig Daten.
Ab 1.000 Milligramm könnten Omega-3-Fettsäuren die Wirkung von Blutgerinnungshemmern verstärken. Besprechen Sie daher die Einnahme mit dem Arzt. Er kontrolliert die Gerinnungswerte und passt gegebenenfalls die Dosierung an. Dies gilt für die Wirkstoffe Phenprocoumon (wie Marcumar®), Warfarin (Coumadin®), Acetylsalicylsäure (ASS, Aspirin®), Heparin (Clexane®) und neue orale Antikoagulanzien wie Apixaban (Eliquis®) oder Rivaroxaban (Xarelto®).
Arginin und Citrullin gleichen einen Mangel an Stickstoffmonoxid aus
Wirkweise von Arginin und Citrullin
Die Aminosäuren Arginin und Citrullin verbessern die Durchblutung: Sie sind Vorstufen von Stickstoffmonoxid (NO). Dies ist ein Botenstoff, der zum Beispiel die Weitstellung der Blutgefäße antreibt. NO ermöglicht eine gute Versorgung der Gewebe mit Sauerstoff und Zucker für die Energiegewinnung.
Bei Defekten der Mitochondrien (zum Beispiel bei MELAS-Syndrom) ist ein NO-Mangel möglich: Es wird weniger davon bereitgestellt. Auch die Vorläufer von NO, Arginin und Citrullin, sind weniger verfügbar. Dadurch wird die Durchblutung schwächer. Dies kann wiederum zur Entstehung von Komplikationen beitragen, wie schlaganfallähnliche Episoden, Muskelschwäche und Übersäuerung.
Laut einer Übersichtsarbeit erhöhte die Ergänzung von Arginin die NO-Produktion und verbesserte die Durchblutung. Darüber hinaus linderte Arginin bei Betroffenen mit dem MELAS-Syndrom die schlaganfallähnlichen Episoden. In einer ersten Studie steigerte Citrullin die NO-Produktion sogar mehr als Arginin. Citrullin ist besser und länger verfügbar, da andere Organe es nicht verbrauchen. Die Ergänzung von Arginin und Citrullin könnte zudem Muskelschwäche reduzieren.
Fazit: Insgesamt müssen noch hochwertige Studien folgen, um die ersten Ergebnisse zu bestätigen. Vor allem bei Mitochondriopathien mit einem NO-Mangel und Durchblutungsstörungen könnte die Ergänzung jedoch sinnvoll sein.
Dosierung und Einnahmeempfehlung von Arginin und Citrullin
Für eine gute Versorgung mit Arginin und Citrullin empfehlen Mikronährstoff-Experten die Ergänzung von jeweils 2.000 bis 4.000 Milligramm pro Tag. Präparate sollten am besten zwischen den Mahlzeiten eingenommen werden, da der Körper Arginin und Citrullin so am besten aufnimmt.
Langfristig (mehrere Monate) sollten Arginin und Citrullin nur unter Kontrolle durch einen Mikronährstoff-Experten eingenommen werden. Ist man überversorgt, könnte zu viel NO sogenannten nitrosativen Stress erhöhen. Bei längerer Einnahme wird empfohlen, Arginin und Citrullin mit Antioxidantien zu kombinieren. Sie können den Stress hemmen.
Arginin und Citrullin: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Zur Einnahme von Arginin und Citrullin in der Schwangerschaft und Stillzeit liegen keine ausreichenden Daten vor. Deshalb ist von einer Einnahme ohne ärztliche Aufsicht abzuraten.
Arginin sollte nicht bei wiederkehrenden Herpesinfektionen eingenommen werden. Es kann ruhende Viren aktivieren und eine Infektion auslösen.
Patienten mit schwerer Arteriosklerose, einem Herzinfarkt und Herzrhythmusstörungen sollten Arginin und Citrullin nur unter ärztlicher Kontrolle einnehmen. Gleiches gilt bei Nervenerkrankungen wie Demenz und Netzhauterkrankungen: Die NO-Produktion kann entgleist sein.
Bei Krebs sollte man die Einnahme von L-Arginin mit dem Arzt besprechen. Er muss diese mit der Krebstherapie abstimmen.
Citrullin und Arginin könnten den Blutzuckerspiegel senken. Eine engmaschige Blutzuckerkontrolle ist bei Diabetes wichtig. Zudem kann der NO-Stoffwechsel entgleist sein, wodurch eine dauerhafte Einnahme die Insulinresistenz verstärken könnte. Es sollte daher vorher mit dem Arzt gesprochen werden. Eventuell passt dieser die Dosis von zuckersenkenden Medikamenten an, zum Beispiel bei Metformin (Diabesin®, Siofor®).
Bei einer Nierenschwäche können Eiweiße und Aminosäuren nicht ausreichend verarbeitet werden. Daher muss eine Ergänzung von Arginin und Citrullin bei der vom Arzt erlaubten Menge berücksichtigt werden. Auch bei Lebererkrankungen und einer Bauchspeicheldrüsenentzündung sollte vorher ein Arzt gefragt werden.
Sprechen Sie die Einnahme von Arginin und Citrullin mit Ihrem Arzt ab, wenn Sie Medikamente einnehmen, die gefäßerweiterndes NO freisetzen. Die Wirkung kann durch die beiden Aminosäuren verstärkt werden. Dazu gehören Medikamente gegen Herzerkrankungen wie Nitrate (Mono Mack®), Molsidomin (Corvaton®) und Nitroprussid (Nipruss®) sowie das Potenzmittel Sildenafil (Viagra®).
Eine verstärkende Wirkung wurde auch bei Blutdrucksenkern beobachtet. Dazu gehören beispielsweise Furosemid (Lasix®), Captopril (Cor tensobon®) und viele andere.
Kreatin sorgt für Energiereserven im Gewebe
Wirkweise von Kreatin
Kreatinphosphat ist der Energiespeicher im Muskel und Gehirn. Wenn schnell Energie benötigt wird, greift der Körper darauf zurück. Er kann dann in den Mitochondrien mehrere Sekunden lang daraus Energie gewinnen, bis andere Versorgungssysteme einspringen.
Laut zwei Übersichtsartikeln erhöhte die Einnahme von Kreatin bei Menschen mit mitochondrialen Erkrankungen (wie MELAS-Syndrom) die Fitness. Eine kleine Vorstudie zeigt außerdem, dass Kreatin kurze Kraftanstrengungen verbessert.
Darüber hinaus könnten Betroffene von Kreatin profitieren, wenn sie Erkrankungen haben, denen möglicherweise eine mitochondriale Fehlfunktion zugrunde liegt – wie chronische Erschöpfung sowie Nerven- und Muskelerkrankungen.
Fazit: Kreatin liefert dem Muskel für kurze Zeit Energie. Es könnte bei Mitochondriopathien kurzzeitig die Symptome lindern. Die Studienlage ist jedoch noch wenig aussagekräftig.
Dosierung und Einnahmeempfehlung von Kreatin
Mikronährstoff-Experten empfehlen Kreatinpräparate meist in Form einer Kur, zum Beispiel zwölf Wochen lang. Die Dosierung liegt bei 2.000 bis 10.000 Milligramm und sollte auf drei Portionen aufgeteilt werden. Da die Eigenproduktion von Kreatin möglicherweise bei längerer Einnahme gedrosselt wird, ist nach der Kur eine Einnahmepause von mindestens zwei Wochen ratsam.
Während der Kreatinkur sollte man auf eine ausreichende Flüssigkeitszufuhr achten. Idealerweise wird Kreatin am Morgen vor dem Frühstück ergänzt (nüchtern). Kreatin sollte nicht mit Kaffee eingenommen werden: Koffein vermindert seine Aufnahme in die Muskulatur.
Kreatin: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenten
Wegen Datenmangels wird Schwangeren und Stillenden geraten, ohne ärztliche Anordnung kein Kreatin einzunehmen.
Personen mit Nierenerkrankungen (wie Zystenniere) oder mit einem erhöhten Risiko für Nierenkrankheiten (Diabetiker oder Menschen mit Bluthochdruck) sollten Kreatin nicht einnehmen. Für Senioren mit Nierenschwäche liegen bisher zu wenige Studien vor, um das Gesundheitsrisiko durch Kreatin zu beurteilen. Hierzu sollte immer ein Arzt befragt werden.
Dosierungen auf einen Blick
Mikronährstoff-Empfehlung pro Tag bei Mitochondriopathie | |
|---|---|
Vitamine | |
Vitamin B1 | 2 bis 5 Milligramm (mg) |
Vitamin B2 | 4 bis 7 Milligramm |
Vitamin B12 | 10 bis 15 Mikrogramm (µg) |
Folsäure | 200 bis 400 Mikrogramm |
Niacin | 45 bis 60 Milligramm |
Vitamin C | 300 bis 500 Milligramm |
Vitamin E | 20 bis 40 Milligramm |
Mineralstoffe | |
Magnesium | 200 bis 900 Milligramm |
Selen | 70 bis 100 Mikrogramm |
Sonstige Nährstoffe | |
Coenzym Q10 | 100 bis 300 Milligramm |
L-Carnitin | 2.000 und 4.000 Milligramm |
Alpha-Liponsäure | 400 bis 600 Milligramm |
Glutathion | 50 bis 100 Milligramm |
Omega-3-Fettsäuren | 1.000 bis 2.000 Milligramm |
Arginin und Citrullin | jeweils 2.000 bis 4.000 Milligramm |
Kreatin | 2.000 bis 10.000 Milligramm (als zwölfwöchige Kur) |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei Mitochondriopathien | |
|---|---|
Normalwerte | |
Magnesium (Vollblut) | 1,38 bis 1,50 Millimol pro Liter (mmol/l) |
Gesamt-Antioxidantienstatus | je nach Labor |
Selen (Vollblut) | 120 bis 150 Mikrogramm pro Liter (µg/l) |
Omega-3-Index (Erythrozyten) | 5 bis 8 Prozent (%) |
Zusammenfassung
Bei einer Mitochondriopathie ist der Energiestoffwechsel der Mitochondrien gestört oder fällt ganz aus. Bei der Behandlung von Mitochondriopathien stützt sich die Mikronährstoffmedizin auf mehrere Säulen: Gifte beseitigen, welche die Mitochondrien schädigen, Entzündungen lindern und Mitochondrien schützen.
Bestimmte Mikronährstoffe, sogenannte mitotrope Nährstoffe, sind für die Energieproduktion in den Mitochondrien unentbehrlich. Sie können die Mitochondrien stärken – und dadurch den Verlauf von Mitochondriopathien positiv beeinflussen. Dazu zählen Coenzym Q10, L-Carnitin, Alpha-Liponsäure und B-Vitamine wie Vitamin B1, B2, B12, Niacin und Folsäure. Auch der Mineralstoff Magnesium wird für die Energiegewinnung in den Mitochondrien benötigt.
Antioxidantien wie die Vitamine C und E, Selen, Glutathion sowie verschiedene Pflanzenstoffe – zum Beispiel Anthocyanidine, Epigallocatechingallat, Resveratrol und Curcumin – schützen die Mitochondrien vor Schäden durch freie Radikale. Daneben könnten einige Pflanzenstoffe die Bildung neuer Mitochondrien anregen. Omega-3-Fettsäuren wirken dagegen entzündungshemmend und dämpfen dadurch Folgen von oxidativem Stress.
Arginin und Citrullin gleichen zudem einen Mangel an Stickstoffmonoxid (NO) aus, der an der Entstehung von Komplikationen beteiligt sein könnte. Daneben sorgt Kreatin für Energiereserven im Gewebe.
Verzeichnis der Studien und Quellen
Airhart, S.E. et al. (2017): An open-label, non-randomized study of the pharmacokinetics of the nutritional supplement nicotinamide riboside (NR) and its effects on blood NAD+ levels in healthy volunteers. PLoS One 2017;12(12):e0186459. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5718430/, abgerufen am: 30.06.2021.
Al Jasmi, F. et al. (2020): Endothelial Dysfunction and the Effect of Arginine and Citrulline Supplementation in Children and Adolescents With Mitochondrial Diseases. J Cent Nerv Syst Dis 2020 Feb 29;12:1179573520909377. https://pubmed.ncbi.nlm.nih.gov/32165851/, abgerufen am: 30.06.2021.
Almannai, M. & El-Hattab, A.W. (2021): Nitric Oxide Deficiency in Mitochondrial Disorders: The Utility of Arginine and Citrulline. Front Mol Neurosci. 2021;14:682780. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8374159/, abgerufen am 31.05.2022.
Almannai, M. et al. (2020): Clinical trials in mitochondrial disorders, an update. Mol Genet Metab 2020;131(1-2):1-13. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7537630/, abgerufen am: 30.06.2021.
Alway, S.E. et al. (2017): Resveratrol Enhances Exercise-Induced Cellular and Functional Adaptations of Skeletal Muscle in Older Men and Women. J Gerontol A Biol Sci Med Sci. 2017 Nov 9;72(12):1595-606. https://pubmed.ncbi.nlm.nih.gov/28505227/, abgerufen am 31.05.2022.
Aslfalah, H. et al. (2019): Reduction in maternal serum values of glucose and gamma-glutamyltransferase after supplementation with alpha-lipoic acid in women with gestational diabetes mellitus J Obstet Gynaecol Res. 2019 Feb;45(2):313-7. https://pubmed.ncbi.nlm.nih.gov/30328246/, abgerufen am 31.05.2022.
Aylett, S.B. et al. (2013): Levels of 5-methyltetrahydrofolate and ascorbic acid in cerebrospinal fluid are correlated: implications for the accelerated degradation of folate by reactive oxygen species. Neurochem Int. 2013 Dec;63(8):750-5. https://pubmed.ncbi.nlm.nih.gov/24140430/, abgerufen am 31.05.2022.
Bae, J.H. & Kim, G. (2018): Systematic review and meta-analysis of omega-3-fatty acids in elderly patients with depression. Nutr Res 2018 Feb;50:1-9. https://www.ncbi.nlm.nih.gov/pubmed/29540267, abgerufen am: 09.10.2018.
Bagheri, H. et al. (2020): Effects of curcumin on mitochondria in neurodegenerative diseases. Biofactors 2020 Jan;46(1):5-20. https://pubmed.ncbi.nlm.nih.gov/31580521/, abgerufen am: 30.06.2021.
Barcelos, I. et al. (2021): Mitochondrial Medicine Therapies: Rationale, Evidence, and Dosing Guidelines. Curr Opin Pediatr. 2020 Dec;32(6):707–18. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7774245/, abgerufen am 31.05.2022.
Beijers, R.J. et al. (2020): Resveratrol and metabolic health in COPD: A proof-of-concept randomized controlled trial. Clin Nutr. 2020 Oct;39(10):2989-97. https://pubmed.ncbi.nlm.nih.gov/31996311/, abgerufen am 31.05.2022.
Biesalski, H.K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. Georg Thieme Verlag Stuttgart New York.
Biesalski, H.K. et al. (2010): Ernährungsmedizin. 4. Aufl. Georg Thieme Verlag Stuttgart.
Booth, N.E. et al. (2012): Mitochondrial dysfunction and the pathophysiology of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS). Int J of Clin Exp Med 2012;5(3):208–220. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3403556/, abgerufen am: 09.10.2018.
Bottani, E. et al. (2020): Therapeutic Approaches to Treat Mitochondrial Diseases: "One-Size-Fits-All" and "Precision Medicine" Strategies. Pharmaceutics 2020 Nov 11;12(11):1083. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7696526/, abgerufen am: 30.06.2021.
Bundesinstitut für Risikobewertung (BfR) (2012): Die Einnahme von Nicotinsäure in überhöhter Dosierung kann die Gesundheit schädigen. Stellungnahme Nr. 018/2012. https://www.bfr.bund.de/cm/343/die-einnahme-von-nicotinsaeure-in-ueberhoehter-dosierung-kann-die-gesundheit-schaedigen.pdf, abgerufen am 31.05.2022.
Castro-Marrero, J. et al. (2021): Effect of Dietary Coenzyme Q10 Plus NADH Supplementation on Fatigue Perception and Health-Related Quality of Life in Individuals with Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: A Prospective, Randomized, Double-Blind, Placebo-Controlled Trial. Nutrients. 2021 Jul 30;13(8):2658. https://pubmed.ncbi.nlm.nih.gov/34444817/, abgerufen am 31.05.2022.
Chudzik M, Burzyńska M, Kapusta J. Use of 1-MNA to Improve Exercise Tolerance and Fatigue in Patients after COVID-19. Nutrients. 2022 Jul 22;14(15):3004. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9331270/, abgerufen am 17.10.2023.
Colombo, B. et al. (2014): Riboflavin and migraine: the bridge over troubled mitochondria. Neurol Sci 2014 May;35(1):141-4. https://www.ncbi.nlm.nih.gov/pubmed/24867851, abgerufen am: 09.10.2018.
Cooper, J.M. et al. (2008): Coenzyme Q10 and vitamin E deficiency in Friedreich's ataxia: predictor of efficacy of vitamin E and coenzyme Q10 therapy. Eur J Neurol. 2008 Dec;15(12):1371-9. https://pubmed.ncbi.nlm.nih.gov/19049556/, abgerufen am 31.05.2022.
Cordero, M.D. et al. (2014): Can coenzyme q10 improve clinical and molecular parameters in fibromyalgia? Antioxid Redox Signal 2013 Oct 20;19(12):1356-61. https://www.ncbi.nlm.nih.gov/pubmed/23458405, abgerufen am: 09.10.2018.
Cordero, M.D. et al. (2014): NLRP3 inflammasome is activated in fibromyalgia: the effect of coenzyme Q10. Antioxid Redox Signal 2014 Mar 10;20(8):1169-80. https://www.ncbi.nlm.nih.gov/pubmed/23886272, abgerufen am: 09.10.2018.
Cox, I.M. et al. (1991): Red blood cell magnesium and chronic fatigue syndrome. Lancet 1991 Mar 30;337(8744):757-60. https://www.ncbi.nlm.nih.gov/pubmed/1672392, abgerufen am: 09.10.2018.
Crigna, A.T. et al. (2020): Cell-free nucleic acid patterns in disease prediction and monitoring—hype or hope? EPMA J. 2020 Dec;11(4):603–27. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7594983/, abgerufen am 31.05.2022.
Dabbagh, O. et al. (1994): The clinical spectrum of biotin-treatable encephalopathies in Saudi Arabia. Brain Dev. 1994 Nov;16 Suppl:72-80. https://pubmed.ncbi.nlm.nih.gov/7726384/, abgerufen am 31.05.2022.
Daussin, F.N. et al. (2021): Effects of (-)-epicatechin on mitochondria. Nutr Rev 2021 Jan 1;79(1):25-41. https://pubmed.ncbi.nlm.nih.gov/32989466/, abgerufen am: 30.06.2021.
de Las Heras, N. et al. (2020): Implications of Oxidative Stress and Potential Role of Mitochondrial Dysfunction in COVID-19: Therapeutic Effects of Vitamin D. Antioxidants (Basel). 2020 Sep 21;9(9):897. https://pubmed.ncbi.nlm.nih.gov/32967329/, abgerufen am 31.05.2022.
de Ligt, M. et al. (2018): Resveratrol improves ex vivo mitochondrial function but does not affect insulin sensitivity or brown adipose tissue in first degree relatives of patients with type 2 diabetes. Mol Metab. 2018 Jun;12:39-47. https://pubmed.ncbi.nlm.nih.gov/29706321/, abgerufen am 31.05.2022.
De Oliveira, M.R. et al. (2016): Epigallocatechin gallate and mitochondria-A story of life and death. Pharmacol Res 2016 Feb;104:70-85. https://pubmed.ncbi.nlm.nih.gov/26731017/, abgerufen am: 30.06.2021.
Delhey, L.M. et al. (2017): The Effect of Mitochondrial Supplements on Mitochondrial Activity in Children with Autism Spectrum Disorder. J Clin Med 2017;6(2):18. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5332922/, abgerufen am: 09.10.2018.
Derosa, G. et al. (2019): Coenzyme q10 liquid supplementation in dyslipidemic subjects with statin-related clinical symptoms: a double-blind, randomized, placebo-controlled study. Drug Des Devel Ther. 2019 Oct 21;13:3647-55. https://pubmed.ncbi.nlm.nih.gov/31695332/, abgerufen am 31.05.2022.
Devika, P.T. (2008): Epigallocatechin-gallate (EGCG) prevents mitochondrial damage in isoproterenol-induced cardiac toxicity in albino Wistar rats: a transmission electron microscopic and in vitro study. Pharmacol Res 2008;57(5):351-357. https://www.ncbi.nlm.nih.gov/pubmed/18456509, abgerufen am: 09.10.2018.
Dohlmann, T.L. et al. (2019): Statin Treatment Decreases Mitochondrial Respiration But Muscle Coenzyme Q10 Levels Are Unaltered: The LIFESTAT Study. J Clin Endocrinol Metab. 2019 Jul 1;104(7):2501-8. https://pubmed.ncbi.nlm.nih.gov/30299473/, abgerufen am 31.05.2022.
dos Santos, S.M. et al. (2019): Mitochondrial Dysfunction and Alpha-Lipoic Acid: Beneficial or Harmful in Alzheimer's Disease? Oxid Med Cell Longev. 2019;2019:8409329. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6914903/, abgerufen am 31.05.2022.
Dos Santos, S.M. et al. (2019): Mitochondrial Dysfunction and Alpha-Lipoic Acid: Beneficial or Harmful in Alzheimer’s Disease? Oxidative Medicine and Cellular Longevity 2019 Nov 30;1-14. https://www.hindawi.com/journals/omcl/2019/8409329/, abgerufen am: 30.06.2021.
Drug.com (Hrsg) (2021): Coenzyme Q10. https://www.drugs.com/coenzyme-q10.html, abgerufen am 31.05.2022.
Eckert, A. et al. (2005): Stabilization of mitochondrial membrane potential and improvement of neuronal energy metabolism by Ginkgo biloba extract EGb 761. Ann N Y Acad Sci 2005 Nov;1056: 474-485. https://pubmed.ncbi.nlm.nih.gov/16387710/, abgerufen am: 09.10.2018.
Edwards, A.M. et al. (2000): Food Supplements in the Treatment of Primary Fibromyalgia: A Double-blind, Crossover Trial of Anthocyanidins and Placebo. Journal of Nutritional and Environmental Medicine 2000;10(3):189-199. https://www.tandfonline.com/doi/abs/10.1080/13590840050134863, abgerufen am: 09.10.2018.
El-Hattab, A. (2016): The Effect of Arginine and Citrulline Supplementation on Endothelial Dysfunction in Mitochondrial Diseases. https://clinicaltrials.gov/ct2/show/NCT02809170, abgerufen am: 30.06.2021.
El-Hattab, A.W. et al. (2017): Therapies for mitochondrial diseases and current clinical trials. Mol Genet Metab. 2017 Nov;122(3):1–9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5773113/, abgerufen am 31.05.2022.
Enns, G.M. et al. (2014): Degree of glutathione deficiency and redox imbalance depend on subtype of mitochondrial disease and clinical status. PLoS One 2014 Jun 18;9(6):e100001. https://pubmed.ncbi.nlm.nih.gov/24941115/, abgerufen am: 30.06.2021.
Erb, C. & Konieczka, K. (2018): Mitochondrial Dysfunctions and Role of Coenzyme Q10 in Patients with Glaucoma. Klin Monbl Augenheilkd 2018 Feb;235(2):157-62. https://www.ncbi.nlm.nih.gov/pubmed/29448286, abgerufen am: 09.10.2018.
Fan, C. et al. (2013): n-3 fatty acids modulate adipose tissue inflammation and oxidative stress. Curr Opin Clin Nutr Metab Care 2013;16(2):124-32. https://www.ncbi.nlm.nih.gov/pubmed/23222801, abgerufen am: 09.10.2018.
Feng, B. et al. (2020): Mitochondrial Dysfunction and Therapeutic Targets in Auditory Neuropathy. Neural Plast 2020 Aug 28;2020:8843485. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7474759/, abgerufen am: 30.06.2021.
Filler, K. et al. (2014): Association of mitochondrial dysfunction and fatigue: A review of the literature. BBA Clin 2014 Jun 1;1:12–23. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4136529/, abgerufen am: 09.10.2018.
Finsterer, J. (2005): Mitochondrial neuropathy. Clin Neurol Neurosurg. 2005 Apr;107(3):181-6. https://pubmed.ncbi.nlm.nih.gov/15823672/, abgerufen am 31.05.2022.
Fu, X. et al. (2003): Mutation analysis of copper transporter genes in patients with ethylmalonic encephalopathy, mitochondriopathies and copper deficiency phenotypes. J Inherit Metab Dis. 2003;26(1):55-66. https://pubmed.ncbi.nlm.nih.gov/12872841/, abgerufen am 31.05.2022.
Galasko, D.R. et al. (2012): Alzheimer’s Disease Cooperative Study. Antioxidants for Alzheimer disease: a randomized clinical trial with cerebrospinal fluid biomarker measures. Arch Neurol 2012 Jul;69(7):836-41. https://www.ncbi.nlm.nih.gov/pubmed/22431837, abgerufen am: 09.10.2018.
Galvan, D.L. et al. (2017): The hallmarks of mitochondrial dysfunction in chronic kidney disease. Kidney Int 2017 Nov;92(5):1051-1057. https://pubmed.ncbi.nlm.nih.gov/28893420/, abgerufen am: 30.06.2021.
Gao, L. et al. (2012): Effects of coenzyme Q10 on vascular endothelial function in humans: a meta-analysis of randomized controlled trials. Atherosclerosis 2012 Apr;221(2):311-6. https://pubmed.ncbi.nlm.nih.gov/22088605/, abgerufen am: 30.06.2021.
García-Corzo, L. et al. (2014): Curcumin Protects from Cardiac Reperfusion Damage by Attenuation of Oxidant Stress and Motochondrial Dysfunction. Cardiovasc Toxicol 2011 Dec;11(4):357-64. https://pubmed.ncbi.nlm.nih.gov/21769543/, abgerufen am: 09.10.2018.
Gimenes, A.C. et al. (2015): Effect of L-carnitine on exercise performance in patients with mitochondrial myopathy. Braz J Med Biol Res 2015 Apr;48(4):354-62. https://www.ncbi.nlm.nih.gov/pubmed/25714882, abgerufen am: 09.10.2018.
Glover, E. et al. (2010): A randomized trial of coenzyme Q10 in mitochondrial disorders. Muscle Nerve 2010 Nov;42(5):739-48. https://www.ncbi.nlm.nih.gov/pubmed/20886510, abgerufen am: 09.10.2018.
González-Salazar, A. et al. (2011): Curcumin Protects from Cardiac Reperfusion Damage by Attenuation of Oxidant Stress and Mitochondrial Dysfunction. Cardiovasc Toxicol 2011 Dec;11(4):357-64. https://pubmed.ncbi.nlm.nih.gov/21769543/, abgerufen am: 09.10.2018.
Gordon, N. (2009): Cerebral folate deficiency. Dev Med Child Neurol. 2009 Mar;51(3):180-2. https://pubmed.ncbi.nlm.nih.gov/19260931/, abgerufen am 31.05.2022.
Gröber, U. (2007): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 3. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2011): Mikronährstoffe. Metabolic Tuning – Prävention – Therapie. 3. Aufl. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart.
Gröber, U. (2012): Die mitochondriale Toxizität von Arzneimitteln. MMP 2012 Dec;35(12):445-56. http://www.mikronaehrstoff.de/pdf/Groe_Mitotox_von%20Arzneimitteln_MMP_2012.pdf, abgerufen am: 09.10.2018.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gueven, N. & Faldu, D. (2013): Therapeutic strategies for Leber's hereditary optic neuropathy: A current update. Intractable Rare Dis Res 2013;2(4):130-135. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4204556/, abgerufen am: 30.06.2021.
Ha, T. et al. (2018): Structural Modification of (-)-Epigallocatechin Gallate (EGCG) Shows Significant Enhancement in Mitochondrial Biogenesis. J Agric Food Chem 2018 Apr 18;66(15):3850-59. https://pubmed.ncbi.nlm.nih.gov/29514455/, abgerufen am: 30.06.2021.
Harper, S.A. et al. (2021): Resveratrol and exercise combined to treat functional limitations in late life: A pilot randomized controlled trial. Exp Gerontol. 2021 Jan;143:111111. https://pubmed.ncbi.nlm.nih.gov/33068691/, abgerufen am 31.05.2022.
Heianza, Y. et al. (2022): Ten-year changes in plasma L-carnitine levels and risk of coronary heart disease. Eur J Nutr. 2022 Apr;61(3):1353-62. https://pubmed.ncbi.nlm.nih.gov/34799774/, abgerufen am 31.05.2022.
Herbst, E.A.F. et al. (2014): Omega-3 supplementation alters mitochondrial membrane composition and respiration kinetics in human skeletal muscle. J Physiol 2014 Mar 15;592(6):1341-52. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3961091/, abgerufen am: 09.10.2018.
Hu, C. et al. (2021): Effect of antioxidants coenzyme Q10 and β-carotene on the cytotoxicity of vemurafenib against human malignant melanoma. Oncol Lett. 2021 Mar;21(3):208. https://pubmed.ncbi.nlm.nih.gov/33574947/, abgerufen am 31.05.2022.
Hu, C. et al. (2021): Effect of antioxidants coenzyme Q10 and β-carotene on the cytotoxicity of vemurafenib against human malignant melanoma. Oncol Lett. 2021 Mar;21(3):208. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7816282/, abgerufen am 31.05.2022.
Hyland, K. et al. (2010): Cerebral folate deficiency. J Inherit Metab Dis. 2010 Oct;33(5):563-70. https://pubmed.ncbi.nlm.nih.gov/20668945/, abgerufen am 31.05.2022.
Igamberdiev, A.U. & Kleczkowski, L.A. (2015): Optimization of ATP synthase function in mitochondria and chloroplasts via the adenylate kinase equilibrium. Front Plant Sci 2015;6:10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4309032/, abgerufen am: 09.10.2018.
Kaliszewska, A. et al. (2021): The Interaction of Diet and Mitochondrial Dysfunction in Aging and Cognition. Int J Mol Sci. 2021 Apr;22(7):3574. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8036520/, abgerufen am 31.05.2022.
Kandezi, N. et al. (2020): Novel Insight to Neuroprotective Potential of Curcumin: A Mechanistic Review of Possible Involvement of Mitochondrial Biogenesis and PI3/Akt/ GSK3 or PI3/Akt/CREB/BDNF Signaling Pathways. Int J Mol Cell Med 2020 Winter;9(1):1-32. https://pubmed.ncbi.nlm.nih.gov/32832482/, abgerufen am: 30.06.2021.
Katyare, S. & Mali, A. (2016): Omega-3 Fatty Acids and Mitochondrial Functions. In: Omega-3 Fatty Acids [Internet]. Springer International Publishing Switzerland;2016. https://www.researchgate.net/publication/308190524_Omega-3_Fatty_Acids_and_Mitochondrial_Functions, abgerufen am: 30.06.2021.
Kley, R.A. et al. (2013): Creatine for treating muscle disorders. Cochrane Database Syst Rev. 2013 Jun 5;2013(6):CD004760. https://pubmed.ncbi.nlm.nih.gov/23740606/, abgerufen am 31.05.2022.
Kodama, M. et al. (1996): The value of the dehydroepiandrosterone-annexed vitamin C infusion treatment in the clinical control of chronic fatigue syndrome (CFS). II. Characterization of CFS patients with special reference to their response to a new vitamin C infusion treatment. In Vivo 10(6):585-596. https://www.ncbi.nlm.nih.gov/pubmed/8986468, abgerufen am: 09.10.2018.
Kornblum C. et al. (2021): Mitochondriale Erkrankungen. Leitlinien für Diagnostik und Therapie in der Neurologie. AWMF-Registernummer: 030/049. https://www.awmf.org/uploads/tx_szleitlinien/030-049l_S1_Mitochondriale-Erkrankungen_2021-02_01.pdf, abgerufen am 31.05.2022.
Kung, H.C. et al. (2021): Oxidative Stress, Mitochondrial Dysfunction, and Neuroprotection of Polyphenols with Respect to Resveratrol in Parkinson's Disease. Biomedicines. 2021 Jul 30;9(8):918. https://pubmed.ncbi.nlm.nih.gov/34440122/, abgerufen am 31.05.2022.
Lang, S. (2020): Coenzym Q10. https://www.apotheken.de/gesundheit/gesund-leben/nahrungsergaenzungs-mittel/12604-coenzym-q10, abgerufen am 31.05.2022.
Langsjoen, P.H. & Langsjoen, A.M. (2014): Comparison study of plasma coenzyme Q10 levels in healthy subjects supplemented with ubiquinol versus ubiquinone. Clin Pharmacol Drug Dev 2014;3(1):13-7. https://www.ncbi.nlm.nih.gov/pubmed/27128225, abgerufen am: 09.10.2018.
Lee, H. & Jose, P.A. (2021): Coordinated Contribution of NADPH Oxidase- and Mitochondria-Derived Reactive Oxygen Species in Metabolic Syndrome and Its Implication in Renal Dysfunction. Front Pharmacol. 2021;12:670076. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8129499/, abgerufen am 31.05.2022.
Lemperle, M. & Kesten, S. (2017): Nitrosativer Stress als Ursache erworbener Mitochondriopathien – Mitochondrien schützen und stärken mit Mikronährstoffen, OM & Ernährung 2017;159:20-25. https://www.omundernaehrung.com/nitrosativer-stress-als-ursache-erworbener-mitochondriopathien.html, abgerufen am: 09.10.2018.
Lepretti, M. et al. (2018): Omega-3 Fatty Acids and Insulin Resistance: Focus on the Regulation of Mitochondria and Endoplasmic Reticulum Stress. Nutrients. 2018 Mar;10(3):350. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5872768/, abgerufen am 31.05.2022.
Li, C. et al. (2005): [Expression of multiple drug resistance-associated proteins in non-small cell lung cancer tissues and its clinical significance]. Zhongguo Fei Ai Za Zhi 2005 Dec 20;8(6):523-6. https://pubmed.ncbi.nlm.nih.gov/21208541/, abgerufen am: 30.06.2021.
Li, Z. et al. (2015): The effect of creatine and coenzyme q10 combination therapy on mild cognitive impairment in Parkinson's disease. Eur Neurol 73(3-4):205-11. https://www.ncbi.nlm.nih.gov/pubmed/25792086, abgerufen am: 09.10.2018.
Liskova, A. et al. (2021): Mitochondriopathies as a Clue to Systemic Disorders—Analytical Tools and Mitigating Measures in Context of Predictive, Preventive, and Personalized (3P) Medicine. Int J Mol Sci. 2021 Feb;22(4):2007. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7922866/, abgerufen am 31.05.2022.
Liu, J. (2008): The effects and mechanisms of mitochondrial nutrient alpha-lipoic acid on improving age-associated mitochondrial and cognitive dysfunction: an overview. Neurochem Res 2008 Jan;33(1):194-203. https://pubmed.ncbi.nlm.nih.gov/17605107/, abgerufen am: 30.06.2021.
Løkken, N. et al. (2021): No effect of resveratrol in patients with mitochondrial myopathy: A cross-over randomized controlled trial. J Inherit Metab Dis. 2021 Sep;44(5):1186-98. https://pubmed.ncbi.nlm.nih.gov/33934389/, abgerufen am 31.05.2022.
Longley, K. (2008) Explaining “Unexplained Illnesses”: Disease Paradigm for Chronic Fatigue Syndrome, Multiple Chemical Sensitivity, Fibromyalgia, Post-Traumatic Stress Disorder, Gulf War Syndrome, and Others, by Martin L. Pall, PhD, Journal of Musculoskeletal Pain, 16:4, 355-356. https://www.tandfonline.com/doi/abs/10.1080/10582450802479784?journalCode=imup20, abgerufen am: 09.10.2018.
Maes, M. et al. (2009): Coenzyme Q10 deficiency in myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS) is related to fatigue, autonomic and neurocognitive symptoms and is another risk factor explaining the early mortality in ME/CFS due to cardiovascular disorder. Neuro Endocrinol Lett 2009;30(4):470-6. https://www.ncbi.nlm.nih.gov/pubmed/20010505, abgerufen am: 09.10.2018.
Maes, M. et al. (2009): Lower plasma Coenzyme Q10 in depression: a marker for treatment resistance and chronic fatigue in depression and a risk factor to cardiovascular disorder in that illness. Neuro Endocrinol Lett 2009;30(4):462-9. https://www.ncbi.nlm.nih.gov/pubmed/20010493, abgerufen am: 09.10.2018.
Mahidol University (Hrsg.) (2007): A Randomized, Double-blind, Placebo-controlled Trial of Curcumin in Leber's Hereditary Optic Neuropathy (LHON). https://clinicaltrials.gov/ct2/show/NCT00528151, abgerufen am: 30.06.2021.
Malaguarnera, L. (2019): Influence of Resveratrol on the Immune Response. Nutrients. 2019 Apr 26;11(5):946. https://pubmed.ncbi.nlm.nih.gov/31035454/, abgerufen am 31.05.2022.
Mancuso, M. et al. (2010): Oxidative stress biomarkers in mitochondrial myopathies, basally and after cysteine donor supplementation. J Neurol 2010 May;257(5):774-81. https://pubmed.ncbi.nlm.nih.gov/19960200/, abgerufen am: 30.06.2021.
Mandani, M. et al. (2021): Alpha-lipoic acid supplementation effects on serum values of some oxidative stress biomarkers in women with gestational diabetes. Gynecol Endocrinol. 2021 Dec;37(12):1111-5. https://pubmed.ncbi.nlm.nih.gov/34369837/, abgerufen am 31.05.2022.
Marashly, E.T. & Bohlega, S.A. (2017): Riboflavin Has Neuroprotective Potential: Focus on Parkinson's Disease and Migraine. Front Neurol 2017 Jul 20;8:333. https://www.ncbi.nlm.nih.gov/pubmed/28775706, abgerufen am: 09.10.2018.
Marí, M. et al. (2009): Mitochondrial glutathione, a key survival antioxidant. Antioxid Redox Signal 2009 Nov;11(11):2685-700. https://pubmed.ncbi.nlm.nih.gov/19558212/, abgerufen am: 30.06.2021.
Marriage, B. et al. (2011): Nutritional cofactor treatment in mitochondrial disorders. J Am Diet Assoc. 2003;103:1029-38. https://www.em-consulte.com/article/524750/nutritional-cofactor-treatment-in-mitochondrial-di, abgerufen am 31.05.2022.
Marshall, R.P. et al. (2022): Role of Creatine Supplementation in Conditions Involving Mitochondrial Dysfunction: A Narrative Review. Nutrients. 2022 Feb;14(3):529. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8838971/, abgerufen am 31.05.2022.
McGlory, C. et al. (2019): Omega-3 fatty acid supplementation attenuates skeletal muscle disuse atrophy during two weeks of unilateral leg immobilization in healthy young women. FASEB J 2019 Mar;33(3):4586-4597. https://pubmed.ncbi.nlm.nih.gov/30629458/, abgerufen am: 30.06.2021.
Mehrzadi, S. et al. (2020): Mitochondrial dysfunction in age-related macular degeneration: melatonin as a potential treatment. Expert Opin Ther Targets. 2020 Apr;24(4):359-78. https://pubmed.ncbi.nlm.nih.gov/32116056/, abgerufen am 31.05.2022.
Memon, A.A. et al. (2021): Association of mitochondrial DNA copy number with prevalent and incident type 2 diabetes in women: A population-based follow-up study. Sci Rep 2021 Feb 25;11(1):4608. https://pubmed.ncbi.nlm.nih.gov/33633270/, abgerufen am: 30.06.2021.
Mermigkis, C. et al. (2013): Medical treatment with thiamine, coenzyme Q, vitamins E and C, and carnitine improved obstructive sleep apnea in an adult case of Leigh disease. Sleep Breath 2013 Dec;17(4):1129-35. https://www.ncbi.nlm.nih.gov/pubmed/23389837, abgerufen am: 09.10.2018.
Millichap, L.E. et al. (2021): Targetable Pathways for Alleviating Mitochondrial Dysfunction in Neurodegeneration of Metabolic and Non-Metabolic Diseases. Int J Mol Sci. 2021 Nov;22(21):11444. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8583882/, abgerufen am 31.05.2022.
Miotto, P.M. et al. (2019): Supplementation with dietary ω-3 mitigates immobilization-induced reductions in skeletal muscle mitochondrial respiration in young women. FASEB J 2019 Jul;33(7):8232-8240. https://pubmed.ncbi.nlm.nih.gov/30970218/, abgerufen am: 30.06.2021.
Miyamae, T. et al. (2013): Increased oxidative stress and coenzyme Q10 deficiency in juvenile fibromyalgia: amelioration of hypercholesterolemia and fatigue by ubiquinol-10 supplementation. Redox Rep 2013;18(1):12-9. https://www.ncbi.nlm.nih.gov/pubmed/23394493, abgerufen am: 09.10.2018.
Monastra, G. et al. (2016): Immunomodulatory activities of alpha lipoic acid with a special focus on its efficacy in preventing miscarriage. Expert Opin Drug Deliv. 2016 Dec;13(12):1695-1708. https://pubmed.ncbi.nlm.nih.gov/27292272/, abgerufen am 31.05.2022.
Moonen, H.P.F.X. & Van Zanten, A.R.H. (2020): Mitochondrial dysfunction in critical illness during acute metabolic stress and convalescence: consequences for nutrition therapy. Curr Opin Crit Care 2020 Aug;26(4):346-354. https://pubmed.ncbi.nlm.nih.gov/32487844/, abgerufen am: 30.06.2021.
Morvan, D. & Demidem, A. (2018): NMR metabolomics of fibroblasts with inherited mitochondrial Complex I mutation reveals treatment-reversible lipid and amino acid metabolism alterations. Metabolomics. 2018;14(5):55. https://pubmed.ncbi.nlm.nih.gov/29937703/, abgerufen am 31.05.2022.
Most, J. et al. (2016): Combined epigallocatechin-3-gallate and resveratrol supplementation for 12 wk increases mitochondrial capacity and fat oxidation, but not insulin sensitivity, in obese humans: a randomized controlled trial. Am J Clin Nutr. 2016 Jul;104(1):215-27. https://pubmed.ncbi.nlm.nih.gov/27194304/, abgerufen am 31.05.2022.
Mukherjee, R. & Brasch, N.E. (2011): Mechanistic Studies on the Reaction between Cob(II)alamin and Peroxynitrite: Evidence for a Dual Role for Cob(II)alamin as a Scavenger of Peroxynitrous Acid and Nitrogen Dioxide. Chemistry 2011 Oct 10;17(42):11805-12. https://www.ncbi.nlm.nih.gov/pubmed/21922568, abgerufen am: 09.10.2018.
Müller, W.E. et al. (2019): Therapeutic efficacy of the Ginkgo special extract EGb761® within the framework of the mitochondrial cascade hypothesis of Alzheimer's disease. World J Biol Psychiatry 2019 Mar;20(3):173-189. https://pubmed.ncbi.nlm.nih.gov/28460580/, abgerufen am: 09.10.2018.
Myhill, S. et al. (2009): Chronic fatigue syndrome and mitochondrial dysfunction. Int J Clin Exp Med. 2009;2(1):1–16. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2680051/, abgerufen am 31.05.2022.
Natarajan, V. et al. (2020): Mitochondrial Dysfunction in Age-Related Metabolic Disorders. Proteomics 2020 Mar;20(5-6):e1800404. https://pubmed.ncbi.nlm.nih.gov/32131138/, abgerufen am: 30.06.2021.
National Institutes of Health (NIH) (2020): Dietary Supplements for Primary Mitochondrial Disorders. Fact Sheet for Health Professionals. https://ods.od.nih.gov/factsheets/PrimaryMitochondrialDisorders-HealthProfessional/, abgerufen am: 30.06.2021.
Niu, W. et al. (2021): Resveratrol improves muscle regeneration in obese mice through enhancing mitochondrial biogenesis. J Nutr Biochem. 2021 Dec;98:108804. https://pubmed.ncbi.nlm.nih.gov/34171502/, abgerufen am 31.05.2022.
Norwegian Scientific Committee for Food Safety (VKM) (2015): Risk assessment of "other substances" – Coenzyme Q10. VKM Report 2015:26. https://vkm.no/download/18.645b840415d03a2fe8f26085/1502712503082/Risk%20assessment%20of%20%22other%20substances%22%20%E2%80%93%20Coenzyme%20Q10.pdf, abgerufen am 31.05.2022.
Okada, L.S.D.R.R. et al. (2018): Omega-3 PUFA modulate lipogenesis, ER stress, and mitochondrial dysfunction markers in NASH - Proteomic and lipidomic insight. Clin Nutr 2018 Oct;37(5):1474-1484. https://pubmed.ncbi.nlm.nih.gov/29249532/, abgerufen am 30.06.2021.
Olivas-Aguirre, M. et al. (2020): Phenolic Compounds Cannabidiol, Curcumin and Quercetin Cause Mitochondrial Dysfunction and Suppress Acute Lymphoblastic Leukemia Cells. Int J Mol Sci 2020 Dec 28;22(1):204. https://pubmed.ncbi.nlm.nih.gov/33379175/, abgerufen am: 30.06.2021.
Orsucci, D. et al. (2019): Mitochondrial disorders and drugs: what every physician should know. Drugs Context. 2019;8:212588. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6668504/, abgerufen am 31.05.2022.
Ortigoza-Escobar, J.D. et al. (2016): Free-thiamine is a potential biomarker of thiamine transporter-2 deficiency: a treatable cause of Leigh syndrome. Brain. 2016 Jan;139(Pt 1):31-8. https://pubmed.ncbi.nlm.nih.gov/26657515/, abgerufen am 31.05.2022.
Ostojic, S.M. (2018): Plasma creatine as a marker of mitochondrial dysfunction. Med Hypotheses. 2018 Apr;113:52-3. https://pubmed.ncbi.nlm.nih.gov/29523294/, abgerufen am 31.05.2022.
Ozer, E.K. et al. (2017): Coenzyme Q10 improves the survival, mesenteric perfusion, organs and vessel functions in septic rats. Biomed Pharmacother 2017 Jul;91:912-919. https://pubmed.ncbi.nlm.nih.gov/28501779/, abgerufen am: 30.06.2021.
Pagano, G. et al. (2020): Aging-Related Disorders and Mitochondrial Dysfunction: A Critical Review for Prospect Mitoprotective Strategies Based on Mitochondrial Nutrient Mixtures. Int J Mol Sci 2020;21(19):7060. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7582285/, abgerufen am: 30.06.2021.
Parente, E. et al. (2017): Safety of oral alpha-lipoic acid treatment in pregnant women: a retrospective observational study. Eur Rev Med Pharmacol Sci. 2017 Sep;21(18):4219-4227. https://pubmed.ncbi.nlm.nih.gov/29028075/, abgerufen am 31.05.2022.
Parikh, S. et al. (2009): A modern approach to the treatment of mitochondrial disease. Curr Treat Options Neurol 2009;11(6):414-430. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3561461/, abgerufen am: 30.06.2021.
Park, S.Y. et al. (2020): Acute mitochondrial antioxidant intake improves endothelial function, antioxidant enzyme activity, and exercise tolerance in patients with peripheral artery disease. Am J Physiol Heart Circ Physiol 2020 Aug 1;319(2):H456-H467. https://pubmed.ncbi.nlm.nih.gov/32706261/, abgerufen am: 30.06.2021.
Picca, A. et al. (2020): Mitochondrial Dysfunction, Oxidative Stress, and Neuroinflammation: Intertwined Roads to Neurodegeneration. Antioxidants (Basel). 2020 Aug;9(8):647. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7466131/, abgerufen am 31.05.2022.
Piotrowicz, K. et al. (2021): Post-COVID-19 acute sarcopenia: physiopathology and management. Aging Clin Exp Res. 2021 Oct;33(10):2887-98. https://pubmed.ncbi.nlm.nih.gov/34328636/, abgerufen am 31.05.2022.
Plioplys, A.V. & Plioplys, S. (1995): Serum levels of carnitine in chronic fatigue syndrome: clinical correlates. Neuropsychobiology 1995;32(3):132-8. https://www.ncbi.nlm.nih.gov/pubmed/8544970, abgerufen am: 09.10.2018.
Polley, K.R. et al. (2016): Influence of exercise training with resveratrol supplementation on skeletal muscle mitochondrial capacity. Appl Physiol Nutr Metab. 2016 Jan;41(1):26-32. https://pubmed.ncbi.nlm.nih.gov/26638911/, abgerufen am 31.05.2022.
Prahalathan, C. et al. (2005): Lipoic acid ameliorates adriamycin-induced testicular mitochondriopathy. Reprod Toxicol. May-Jun 2005;20(1):111-6. https://pubmed.ncbi.nlm.nih.gov/15808794/, abgerufen am 31.05.2022.
Prasun, P. (2020): Mitochondrial dysfunction in metabolic syndrome. Biochim Biophys Acta Mol Basis Dis 2020 Oct 1;1866(10):165838. https://pubmed.ncbi.nlm.nih.gov/32428560/, abgerufen am: 30.06.2021.
Prusty, B.K. et al. (2018): HHV-6 encoded small non-coding RNAs define an intermediate and early stage in viral reactivation. NPJ Genom Med. 3, 25. https://pubmed.ncbi.nlm.nih.gov/30210807/, abgerufen am 17.10.2023.
Pyo, I.S. et al. (2020): Mechanisms of Aging and the Preventive Effects of Resveratrol on Age-Related Diseases. Molecules. 2020 Oct 12;25(20):4649. https://pubmed.ncbi.nlm.nih.gov/33053864/, abgerufen am 31.05.2022.
Ramaekers, V.T. et al. (2002): Psychomotor retardation, spastic paraplegia, cerebellar ataxia and dyskinesia associated with low 5-methyltetrahydrofolate in cerebrospinal fluid: a novel neurometabolic condition responding to folinic acid substitution. Neuropediatrics. 2002 Dec;33(6):301-8. https://pubmed.ncbi.nlm.nih.gov/12571785/, abgerufen am 31.05.2022.
Rattay, T.W. et al. (2021): Chromium and cobalt intoxication mimicking mitochondriopathy. Neurol Res Pract. 2021;3:40. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8265103/, abgerufen am 31.05.2022.
Rehman, H. et al. (2013): Green Tea Polyphenols Stimulate Mitochondrial Biogenesis and Improve Renal Function after Chronic Cyclosporin A Treatment in Rats. PLoS ONE 2013 Jun 3;8(6):e65029. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3670924/, abgerufen am: 09.10.2018.
Reinhard, P. et al. (1998): Selenium status in fibromyalgia. Toxicol Lett 96-97:177-180. https://www.ncbi.nlm.nih.gov/pubmed/9820664, abgerufen am: 09.10.2018.
Rinninella, E. et al. (2018): Nutritional support in mitochondrial diseases: the state of the art. European Review for Medical and Pharmacological Sciences 2018; 22: 4288-98. https://www.europeanreview.org/wp/wp-content/uploads/4288-4298.pdf, abgerufen am 31.05.2022.
Rodriguez, M.C. et al. (2007): Beneficial effects of creatine, CoQ10, and lipoic acid in mitochondrial disorders. Muscle Nerve 2007 Feb;35(2):235-42. https://pubmed.ncbi.nlm.nih.gov/17080429/, abgerufen am: 30.06.2021.
Román-Pintos, L.M. et al. (2016): Diabetic Polyneuropathy in Type 2 Diabetes Mellitus: Inflammation, Oxidative Stress, and Mitochondrial Function. J Diabetes Res. 2016;2016:3425617. https://pubmed.ncbi.nlm.nih.gov/28058263/, abgerufen am 31.05.2022.
Rossignol, D.A. & Frye, R.E. (2012): Mitochondrial dysfunction in autism spectrum disorders: a systematic review and meta-analysis. Mol Psychiatry 2012 Mar;17(3):290-314. https://www.ncbi.nlm.nih.gov/pubmed/21263444, abgerufen am: 09.10.2018.
Rossignol, D.A. & Frye, R.E. (2021): Cerebral Folate Deficiency, Folate Receptor Alpha Autoantibodies and Leucovorin (Folinic Acid) Treatment in Autism Spectrum Disorders: A Systematic Review and Meta-Analysis. J Pers Med. 2021 Nov 3;11(11):1141. https://pubmed.ncbi.nlm.nih.gov/34834493/, abgerufen am 31.05.2022.
Rossman, M.J. et al. (2018): Chronic Supplementation With a Mitochondrial Antioxidant (MitoQ) Improves Vascular Function in Healthy Older Adults. Hypertension 2018 Jun;71(6):1056-1063. https://pubmed.ncbi.nlm.nih.gov/29661838/, abgerufen am: 30.06.2021.
Salnikova, D. et al. (2021): Mitochondrial Dysfunction in Vascular Wall Cells and Its Role in Atherosclerosis. Int J Mol Sci. 2021 Aug;22(16):8990. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8396504/, abgerufen am 31.05.2022.
Sándor, P.S. et al. (2005): Efficacy of coenzyme Q10 in migraine prophylaxis: a randomized controlled trial. Neurology 2005 Feb 22;64(4):713-5. https://www.ncbi.nlm.nih.gov/pubmed/15728298, abgerufen am: 09.10.2018.
Saxena, S. et al. (2019): Critical role of mitochondrial dysfunction and impaired mitophagy in diabetic nephropathy. J Cell Physiol 2019 Nov;234(11):19223-19236. https://pubmed.ncbi.nlm.nih.gov/31032918/, abgerufen am: 30.06.2021.
Scheibenbogen, C. et al. (2014): Chronisches Fatigue-Syndrom. Heutige Vorstellung zur Pathogenese, Diagnostik und Therapie. Einleitung. tägl. prax. 2014;55:567–74. https://docplayer.org/8661067-Chronisches-fatigue-syndrom-heutige-vorstellung-zur-pathogenese-diagnostik-und-therapie-einleitung.html, abgerufen am 31.05.2022.
Shemiakova, T. et al. (2021): Atherosclerosis as Mitochondriopathy: Repositioning the Disease to Help Finding New Therapies. Front Cardiovasc Med. 2021 May 4;8:660473. https://pubmed.ncbi.nlm.nih.gov/34017868/, abgerufen am 31.05.2022.
Shenoy, S. et al. (2020): Coronavirus (Covid-19) sepsis: revisiting mitochondrial dysfunction in pathogenesis, aging, inflammation, and mortality. Inflamm Res. 2020 Nov;69(11):1077-1085. https://pubmed.ncbi.nlm.nih.gov/32767095/, abgerufen am 31.05.2022.
Shi, W. et al. (2018): The critical role of epigallocatechin gallate in regulating mitochondrial metabolism. Future Med Chem 2018 Apr 1;10(7):795-809. https://pubmed.ncbi.nlm.nih.gov/29671630/, abgerufen am: 30.06.2021.
Shoeibi, A. et al. (2017): Effectiveness of coenzyme Q10 in prophylactic treatment of migraine headache: an open-label, add-on, controlled trial. Acta Neurol Belg 2017 Mar;117(1):103-109. www.ncbi.nlm.nih.gov/pubmed/27670440, abgerufen am: 09.10.2018.
Singh, K.K. et al. (2020): Decoding SARS-CoV-2 hijacking of host mitochondria in COVID-19 pathogenesis. Am J Physiol Cell Physiol 2020 Aug 1;319(2):C258-C267. https://pubmed.ncbi.nlm.nih.gov/32510973/, abgerufen am 23.01.2023.
Sinha, A. et al. (2019): Carnitine Is Associated With Atherosclerotic Risk and Myocardial Infarction in HIV‐Infected Adults. J Am Heart Assoc. 2019 May 7;8(9):e011037. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6512101/, abgerufen am 31.05.2022.
Soltani, R. et al. (2020): Coenzyme Q10 improves the survival and reduces inflammatory markers in septic patients. Bratisl Lek Listy 2020;121(2):154-158. https://pubmed.ncbi.nlm.nih.gov/32115970/, abgerufen am: 30.06.2021.
Soto-Urquieta, M.G. et al. (2014): Curcumin restores mitochondrial functions and decreases lipid peroxidation in liver and kidneys of diabetic db/db mice. Biol Res 2014 Dec 22;47:74. https://www.ncbi.nlm.nih.gov/pubmed/25723052, abgerufen am: 09.10.2018.
Sperl, W. et al. (2011): Mitochondriopathien - Ein Update. Monatsschr Kinderheilkd 2011;159:848–854. https://www.springermedizin.de/mitochondriopathien/8049120, abgerufen am: 09.10.2018.
Spurney, C.F. et al. (2011): CINRG Pilot trial of Coenzyme Q10 in steroid treated Duchenne Muscular Dystrophy. Muscle Nerve. 2011 Aug; 44(2): 174–8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3136634/, abgerufen am 31.05.2022.
Srivastava, S. (2016): Emerging therapeutic roles for NAD(+) metabolism in mitochondrial and age-related disorders. Clin Transl Med 2016 Dec;5(1):25. https://pubmed.ncbi.nlm.nih.gov/27465020/, abgerufen am: 30.06.2021.
Su, F. et al. (2003): Glutathion S transferase pi indicates chemotherapy resistance in breast cancer. J Surg Res 2003 Jul;113(1):102-8. https://pubmed.ncbi.nlm.nih.gov/12943817/, abgerufen am: 30.06.2021.
Sun, F.F. et al. (2015): Enhanced expression of stem cell markers and drug resistance in sphere-forming non-small cell lung cancer cells. Int J Clin Exp Pathol 2015 Jun 1;8(6):6287-300. https://pubmed.ncbi.nlm.nih.gov/26261505/, abgerufen am: 30.06.2021.
Taghizadeh, S. et al. (2021): Izadi A, Shirazi S, Parizad M, Pourghassem Gargari B. The effect of coenzyme Q10 supplementation on inflammatory and endothelial dysfunction markers in overweight/obese polycystic ovary syndrome patients. Gynecol Endocrinol 2021 Jan;37(1):26-30. https://pubmed.ncbi.nlm.nih.gov/32544011/, abgerufen am: 30.06.2021.
Tan, W. & Airik, R. (2021): Primary coenzyme Q10 nephropathy, a potentially treatable form of steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2021 Nov;36(11):3515-27. https://pubmed.ncbi.nlm.nih.gov/33479824/, abgerufen am 31.05.2022.
Targhetta, V.P. et al. (2021): Through DNA sensors and hidden mitochondrial effects of SARS-CoV-2. J Venom Anim Toxins Incl Trop Dis. 2021;27:e20200183. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8383803/, abgerufen am 31.05.2022.
Tarnopolsky, M.A. (2011): Creatine as a therapeutic strategy for myopathies. Amino Acids . 2011 May;40(5):1397-407. https://pubmed.ncbi.nlm.nih.gov/21399918/, abgerufen am 31.05.2022.
Tarnopolsky, M.A. et al. (1997): A randomized, controlled trial of creatine monohydrate in patients with mitochondrial cytopathies. Muscle Nerve. 1997 Dec;20(12):1502-9. https://pubmed.ncbi.nlm.nih.gov/9390662/, abgerufen am 31.05.2022.
Thompson, D.F. & Saluja, H.S. (2017): Prophylaxis of migraine headaches with riboflavin: A systematic review. J Clin Pharm Ther 2017 Aug;42(4):394-403. https://www.ncbi.nlm.nih.gov/pubmed/28485121, abgerufen am: 09.10.2018.
Thorne Research, Inc. (Hrsg.) (2006): Alpha-Lipoic Acid. Monograph. Alternative Medicine Review. 2006 Sep;11(3):232-7. https://altmedrev.com/wp-content/uploads/2019/02/v11-3-232.pdf, abgerufen am 31.05.2022.
Timmers, S. et al. (2016): Resveratrol as Add-on Therapy in Subjects With Well-Controlled Type 2 Diabetes: A Randomized Controlled Trial. Diabetes Care. 2016 Dec;39(12):2211-7. https://pubmed.ncbi.nlm.nih.gov/27852684/, abgerufen am 31.05.2022.
Tinker, R.J. et al. (2021): Current and Emerging Clinical Treatment in Mitochondrial Disease. Mol Diagn Ther 2021 Mar 01;25:181-206. hhttps://link.springer.com/article/10.1007/s40291-020-00510-6, abgerufen am: 30.06.2021.
Traverso, N. et al. (2013): Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev 2013;2013:972913. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3673338/, abgerufen am: 30.06.2021.
Tucci, C.D. et al. (2018): Alpha lipoic acid in obstetrics and gynecology. Gynecol Endocrinol. 2018 Sep;34(9):729-33. https://pubmed.ncbi.nlm.nih.gov/29726290/, abgerufen am 31.05.2022.
Udhayabanu, T. et al. (2017): Riboflavin Responsive Mitochondrial Dysfunction in Neurodegenerative Diseases.J Clin Med 2017 May 5;6(5):52. https://www.ncbi.nlm.nih.gov/pubmed/28475111, abgerufen am: 09.10.2018.
Valenti, D. et al. (2013): Epigallocatechin-3-gallate prevents oxidative phosphorylation deficit and promotes mitochondrial biogenesis in human cells from subjects with Down's syndrome. Biochim Biophys Acta 2013 Apr;1832(4):542-52. https://pubmed.ncbi.nlm.nih.gov/23291000/, abgerufen am: 30.06.2021.
Valero, T. (2014): Mitochondrial biogenesis: pharmacological approaches. Curr Pharm Des 2014;20(35):5507-9. https://pubmed.ncbi.nlm.nih.gov/24606795/, abgerufen am: 30.06.2021.
Victor, V.M. & Rocha, M. (2007): Targeting antioxidants to mitochondria: a potential new therapeutic strategy for cardiovascular diseases. Curr Pharm Des. 2007;13(8):845-63. https://pubmed.ncbi.nlm.nih.gov/17430185/, abgerufen am 31.05.2022.
Victor, V.M. et al. (2009): Oxidative stress and mitochondrial dysfunction in atherosclerosis: mitochondria-targeted antioxidants as potential therapy. Curr Med Chem. 2009;16(35):4654-67. https://pubmed.ncbi.nlm.nih.gov/19903143/, abgerufen am 31.05.2022.
Vollono, C. et al. (2018): Migraine in mitochondrial disorders: Prevalence and characteristics. Cephalalgia. 2018 May;38(6):1093-1106. https://www.ncbi.nlm.nih.gov/pubmed/28762753, abgerufen am: 09.10.2018.
Wang, B.Y. et al. (2021): Gut Metabolite Trimethylamine-N-Oxide in Atherosclerosis: From Mechanism to Therapy. Front Cardiovasc Med. 2021;8:723886. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8650703/, abgerufen am 31.05.2022.
Wang, L. et al. (2020): Macrophage and Adipocyte Mitochondrial Dysfunction in Obesity-Induced Metabolic Diseases. World J Mens Health 2020 Oct 23. https://pubmed.ncbi.nlm.nih.gov/33151047/, abgerufen am: 30.06.2021.
Wesselink, E. et al. (2019): Feeding mitochondria: Potential role of nutritional components to improve critical illness convalescence. Clin Nutr 2019 Jun;38(3):982-995. https://pubmed.ncbi.nlm.nih.gov/30201141/, abgerufen am: 30.06.2021.
Wesselink, E. et al. (2019): Feeding mitochondria: Potential role of nutritional components to improve critical illness convalescence. Clin Nutr 2019 Jun;38(3):982-995. https://www.clinicalnutritionjournal.com/action/showPdf?pii=S0261-5614%2818%2932426-9, abgerufen am: 30.06.2021.
Wu, S. & Zou, M.H. (2020): AMPK, Mitochondrial Function, and Cardiovascular Disease. Int J Mol Sci. 2020 Jul 15;21(14):4987. https://pubmed.ncbi.nlm.nih.gov/32679729/, abgerufen am 31.05.2022.
Yoritaka, A. et al. (2015): Randomized, double-blind, placebo-controlled pilot trial of reduced coenzyme Q10 for Parkinson's disease. Parkinsonism Relat Disord. 21(8):911-6. https://www.ncbi.nlm.nih.gov/pubmed/26054881, abgerufen am: 09.10.2018.
Zhang, X. et al. (2017): Therapeutic Potential of Co-enzyme Q10 in Retinal Diseases. Curr Med Chem. 2017;24(39):4329-4339. https://www.ncbi.nlm.nih.gov/pubmed/28762311, abgerufen am: 09.10.2018.
Zhang, X. et al. (2021): Mitochondrial dysfunction and potential mitochondrial protectant treatments in tendinopathy. Ann N Y Acad Sci. 2021 Apr;1490(1):29-41. https://pubmed.ncbi.nlm.nih.gov/33843069/, abgerufen am 31.05.2022.
Zlatohlavek, L. et al. (2012): The effect of coenzyme Q10 in statin myopathy. Neuro Endocrinol Lett. 2012;33(2):98-101. https://pubmed.ncbi.nlm.nih.gov/23183519/, abgerufen am 31.05.2022.