Nitrosativer Stress ist für den Körper wichtig, zum Beispiel um Bakterien abzuwehren. Er muss aber streng kontrolliert werden, sonst kommt es zu Schäden. Bei der Beseitigung greifen viele Systeme ineinander. Besonderen Stellenwert hat der Schutz der Zellmembranen und der Zellkraftwerke (Mitochondrien). Darum sind auch viele Stoffe notwendig wie Vitamine, Mineralstoffe, Fettsäuren und sekundäre Pflanzenstoffe. Lesen Sie, was bei nitrosativem Stress zu beachten ist und wie man die Stoffe einsetzt.
Ursachen und Symptome
Was ist nitrosativer Stress und wie entsteht er?
Bei nitrosativem Stress entstehen im Körper aus stickstoffhaltigen Molekülen aggressive Radikale (Stickstoffradikale). Bei dem bekannteren oxidativen Stress sind diese Radikale dagegen Sauerstoffverbindungen (Sauerstoffradikale).
Manchmal erzeugt der Körper oxidativen und nitrosativen Stress gezielt, um zum Beispiel Krankheitserreger abzuwehren. Nebenbei braucht er das Radikal Stickstoffmonoxid (NO) als Botenstoff, um die Gefäßweite und den Blutdruck zu regulieren. Ein wenig nitrosativer Stress ist für den Körper somit wichtig. Danach muss er aber wieder beseitigt werden. Wenn im Körper zu wenig Antioxidantien verfügbar sind, ist das nicht ausreichend möglich. Dann zerstört nitrosativer Stress Zellstrukturen wie Membranen, Eiweiße und die Erbsubstanz. Auch die Energiekraftwerke (Mitochondrien) können Schaden nehmen.
Ursachen für nitrosativen Stress sind:
- chronische Infektionen und Entzündungen, Autoimmunerkrankungen
- nitratreiche Ernährung (Spinat, Rote Bete, Trinkwasser), Nitrit aus Pökelsalz (Fleischprodukte)
- ungünstige Bakterien in Mund, Magen und Darm
- Umweltbelastungen durch Schwermetalle und Pestizide, Luftverschmutzung
- Genussgifte wie Zigaretten und Alkohol
- Stoffwechselerkrankungen wie Diabetes Typ 2 und Übergewicht
- Schlaganfall, Durchblutungsstörungen
- Lungenerkrankungen wie Asthma und COPD
- Wirbelsäulenverletzungen (HWS-Trauma)
- Medikamente, auf Dauer zu hoch dosierte Eisensupplemente, Chemotherapie
Nitrosativer Stress kann im Blut bestimmt werden. Nitrotyrosin ist ein guter Marker dafür. Er sollte unter 200 Nanomol pro Liter im Plasma liegen. Plasma ist die Flüssigkeit des Blutes in einer ungerinnbar gemachten Blutprobe.
Anzeichen und Folgen von nitrosativem Stress
Nitrosativer Stress verursacht keine Symptome. Daher wird er jahrelang nicht bemerkt. Möglich sind aber nach längerer Zeit unspezifische Beschwerden wie Müdigkeit, Muskelschwäche oder Schmerzen.
Defekte Mitochondrien führen nicht nur zu einer geringeren Energieproduktion; sie erzeugen selbst auch oxidativen Stress. Ein Teufelskreis beginnt. Nitrosativer und oxidativer Stress beschleunigen das Altern und Gewebeschäden: Er liegt praktisch allen Alters-, Herz-Kreislauf- und Nervenerkrankungen zugrunde.
Häufige Folgen von nitrosativem Stress sind:
- chronisches Erschöpfungssyndrom (CFS), Muskelschwäche, Schmerzerkrankungen
- Herz-Kreislauf-Erkrankungen, Bluthochdruck, Arteriosklerose
- Nervenkrankheiten wie Parkinson, Alzheimer oder ein Schlaganfall
- psychische Erkrankungen wie Depressionen, Schizophrenie, Zwangsstörungen
- Augenschäden wie diabetische Retinopathie, Glaukom, altersbedingte Makuladegeneration (AMD)
- Krebs

Ziele der Behandlung
Wie wird nitrosativer Stress klassisch behandelt?
Bisher gibt es keine Möglichkeit, nitrosativen Stress gut zu verfolgen. In der klassischen Medizin behandelt man daher nur akute Infektionen oder konkrete Folgeerkrankungen.
Ziele der Mikronährstoffmedizin
Ziel der Mikronährstoffmedizin ist es, ein Gleichgewicht zwischen Radikalen und abfangenden Stoffen zu erreichen und so die Zellen vor Schäden zu schützen. Damit dies funktioniert, braucht der Körper verschiedene Antioxidantien (Vitamine, Mineralstoffe und sekundäre Pflanzenstoffe).
Daneben kann man die Mitochondrien gezielt schützen. Geschädigte Mitochondrien produzieren weniger Energie und geben nitrosative und oxidative Stoffe in die Zelle ab. Der Stress nimmt weiter zu. Daher ist es wichtig, ihre Funktion zu unterstützen. Es sollte aber vorbeugend eingegriffen werden, damit keine Folgeerkrankungen entstehen:
- B-Vitamine sind wichtig für die Energiegewinnung.
- Coenzym Q10 unterstützt die Energiegewinnung und das Herz.
- L-Carnitin entgiftet die Mitochondrien.
- Alpha-Liponsäure schützt vor allem die Nerven.
- Magnesium hilft im Energiestoffwechsel.
- Vitamin C und E wirken als antioxidative Schutzstoffe.
- Pflanzenstoffe steigern das antioxidative Potenzial.
- Zink, Selen, Kupfer und Mangan werden von den körpereigenen Schutzsystemen gebraucht.
- Glutathion sorgt für die körpereigene Entgiftung.
- Omega-3-Fettsäuren lindern Entzündungen.
Behandlung mit Mikronährstoffen
B-Vitamine für die Energiegewinnung und gegen Homocystein
Wirkweise von B-Vitaminen
Einige B-Vitamine sind bei der Gewinnung von Energie in den Mitochondrien beteiligt, zum Teil auch beim Abfangen von oxidativem und nitrosativem Stress. B-Vitamine helfen außerdem, das Stoffwechselgift Homocystein abzubauen. Homocystein trägt sonst zu Nervenschäden bei. Es erzeugt ebenfalls nitrosativen und oxidativen Stress. Daneben unterstützen B-Vitamine Regenerationsprozesse, sodass das geschädigte Gewebe heilen kann sowie Entzündungen und Schmerzen abklingen können:
- Biotin und Vitamin B2 sind wichtig für die Nutzung von Fett, Aminosäuren und Zucker zur Energieproduktion. Vitamin B1 spielt für die Nutzung von Zucker eine wesentliche Rolle. Vitamin B2 und Niacin braucht man außerdem bei den letzten Schritten der Energiegewinnung und der Nutzung von Sauerstoff.
- Vitamin B12 schützt Mitochondrien vor NO. Es kann oxidativen und nitrosativen Stress direkt abfangen, wird dabei aber zerstört und daher verbraucht. Folgen eines Mangels können Nervenschäden sein, was ein charakteristisches Anzeichen von nitrosativem Stress ist.
Beobachtungsstudien zeigen, dass Menschen mit Schädigungen der Halswirbelsäule oft einen Vitamin-B12-Mangel haben. Auch Tierversuche belegen Ähnliches. Andere Forscher beobachteten, dass Menschen mit einer Schädigung der Nerven in der Halswirbelsäule oxidativen Stress schlechter abfangen können (geringe antioxidative Kapazität). Das beschleunigt die Alterung. Bei Frauen wurde festgestellt, dass das Erbgut schneller altert, wenn die Spiegel an Vitamin B12 niedrig sind.
Vitamin B12 hat einzelnen Patienten mit degenerativen Halswirbelschäden geholfen. Das zeigen erste Behandlungsversuche. Aufgrund von Tierversuchen vermuten Forscher, dass B-Vitamine (B1, B6 und B12) auch sinnvoll sein könnten nach Operationen an der Wirbelsäule, bei Durchblutungsstörungen oder bei einem Schleudertrauma. Weiter diskutiert wird eine Wirkung bei Schädigungen des Gehörs, Alzheimer, Diabetes und weiteren Erkrankungen bis hin zu Herzversagen.
Fazit: B-Vitamine sind im Energiestoffwechsel wichtig. Sie beseitigen vermutlich auch oxidativen und nitrosativen Stress. Tierversuche belegen den Nutzen bei Nervenschäden, Studien am Menschen gibt es jedoch nur wenige. Bei allen Nervenproblemen und Schmerzzuständen gehören B-Vitamine zum ersten Behandlungsversuch.
Dosierung und Einnahmeempfehlung von B-Vitaminen
Bei nitrosativem Stress empfehlen Mikronährstoff-Experten ein Präparat, das alle B-Vitamine enthält, da sich ihre Wirkung ergänzt. Für eine gute Verträglichkeit sollten Präparate zum Essen genommen werden. Pro Tag sind folgende Dosierungen sinnvoll:
- Vitamin B1: 2 bis 5 Milligramm
- Vitamin B2: 3 bis 6 Milligramm
- Vitamin B6: 3 bis 5 Milligramm
- Vitamin B12: 200 bis 400 Mikrogramm (als Methylcobalamin)
- Folsäure: 200 bis 400 Mikrogramm (als direkt verfügbares 5-MTHF (5-Methyltetrahydrofolat))
- Biotin: 100 bis 200 Mikrogramm
- Niacin: 30 bis 60 Milligramm
- Pantothensäure: 10 bis 20 Milligramm
Vitamin B12 und Homocystein im Labor bestimmen lassen
Es ist vor allem sinnvoll, den Status von Vitamin B12 und Homocystein bestimmen zu lassen.
Die beste Möglichkeit bei nitrosativem Stress, Vitamin B12 im Blut zu bestimmen, ist die Messung von Methylmalonsäure. Dies ist ein empfindlicher Marker für oxidativen Stress und Mitochondrien-Schäden. Normale Werte im Serum liegen bei bis zu 32 Mikrogramm pro Liter.
Für den Homocysteinspiegel gibt es einen Standardtest. Damit kann man auf die Versorgung mit Vitamin B6, Vitamin B12 und Folsäure schließen: Fehlen sie, steigt der Homocysteinspiegel. Die Werte sollten unter 10 Mikromol pro Liter liegen.
B-Vitamine: zu beachten in der Schwangerschaft/Stillzeit, bei Erkrankungen und Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sollten Frauen hoch dosierte B-Vitamine nur bei einem nachgewiesenen Mangel und in Rücksprache mit dem Arzt einnehmen.
Bei älteren Menschen ist es wichtig, vor der Einnahme von hoch dosiertem Vitamin B12 einen Folsäuremangel auszuschließen. Nierenpatienten sollten Vitamin B12 nicht in Form von Cyanocobalamin einnehmen, sondern als Methylcobalamin. Cyanocobalamin ist für Betroffene hoch dosiert vermutlich schädlich.
Nach dem Setzen von Gefäßstützen (Stents) und nach einem Herzinfarkt ist die Gabe kombinierter B-Vitamine noch nicht ausreichend erforscht. Möglicherweise wirken sie hoch dosiert negativ (Vitamin B6: ab 40 bis 50 Milligramm pro Tag, Vitamin B12: ab 60 Mikrogramm pro Tag und Folsäure: ab 800 Mikrogramm pro Tag).
Folsäure vermindert die Wirkung von Antibiotika mit den Wirkstoffen Trimethoprim (Infectotrimet®), Proguanil (Paludrine®) und Pyrimethamin (Daraprim®). Die Mittel sollten nicht gleichzeitig eingenommen werden.
Zwar kann eine gute Versorgung mit Vitamin B12 und Folsäure Krebs vorbeugen, unter bestimmten Bedingungen können jedoch dauerhaft hohe Dosierungen das Fortschreiten von zum Beispiel Darm- und Prostatakrebs begünstigen. Sprechen Sie bei Krebs immer zuerst mit dem Arzt, bevor Sie hoch dosiert Vitamin B12 und Folsäure einnehmen.
Coenzym Q10 unterstützt die Energiegewinnung und das Herz
Wirkweise von Coenzym Q10

Coenzym Q10 fängt nitrosativen und oxidativen Stress ab. Auch sorgt es dafür, dass in den letzten Schritten der Energiegewinnung in den Mitochondrien mithilfe von Sauerstoff Energie entsteht. Ein Coenzym-Q10-Mangel kann zu Müdigkeit und Muskelschwäche führen. Beobachtende Studien zeigen, dass Personen mit chronischer Müdigkeit oder Depressionen vermehrt von oxidativem und nitrosativem Stress betroffen sind. Dabei beobachteten Forscher auch veränderte Mitochondrien, eine beeinträchtige Energiegewinnung sowie geringere Mengen an Coenzym Q10.
Erste Studien zur Einnahme liegen vor:
- Körperliche Leistung: In einer ersten kleinen hochwertigen Studie fanden Forscher eine positive Wirkung von Coenzym Q10 bei Menschen mit Schäden an den Mitochondrien. Es zeigte sich, dass Sauerstoff und Zucker bei sportlicher Leistung etwas besser genutzt wurden.
- Nervenschäden: Nervenzellen brauchen besonders viel Energie. Bei Alzheimer und Parkinson bewirkte die Einnahme von Coenzym Q10 zusammen mit Vitamin C und E, dass weniger oxidativer Stress entstand. Patienten mit Fibromyalgie profitierten ebenfalls von Coenzym Q10. Sie litten weniger unter Schmerzen und Müdigkeit. Auch nahm die entzündliche Aktivität ab und es wurden mehr Mitochondrien hergestellt. Das zeigt eine kleine hochwertige Studie. Möglich ist auch ein Effekt auf andere Nervenschäden: Ein Tierversuch zeigt einen Schutz vor Alkoholschäden.
- Psyche: Nitrosativer Stress im Gehirn ist an psychischen Erkrankungen beteiligt wie Depressionen. Gleichzeitig kann man bei Betroffenen weniger Coenzym Q10 im Blut nachweisen. Eine antidepressive Wirkung ist bisher aber nur in Tierversuchen belegt.
- Herz-Kreislauf-Erkrankungen: Oxidativer und nitrosativer Stress treten bei Gefäßerkrankungen auf und tragen zu Bluthochdruck, Arteriosklerose und Herzschwäche bei. Coenzym Q10 könnte Gefäßerkrankungen verringern und die Sterblichkeit bei Herzversagen reduzieren. Bei Herzerkrankungen empfehlen viele Mikronährstoff-Experten Coenzym Q10.
Fazit: Nitrosativer Stress ist bei vielen Krankheiten beteiligt. Es gibt zahlreiche Hinweise, dass Coenzym Q10 dabei lindernd wirkt. Noch ist nicht klar, ob die Reduktion von nitrosativem Stress ursächlich für die Besserung ist oder ob andere Mechanismen zum Tragen kommen. Auf alle Fälle ist die Ergänzung einen Versuch wert.
Dosierung und Einnahmeempfehlung von Coenzym Q10
Mikronährstoff-Experten empfehlen bei Erkrankungen, bei denen nitrosativer Stress beteiligt ist, 100 bis 300 Milligramm Coenzym Q10 pro Tag. Es sollte zu den Mahlzeiten eingenommen werden. Das Fett aus Lebensmitteln unterstützt die Aufnahme im Darm.
Coenzym Q10: zu beachten in der Schwangerschaft/Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Die Einnahme von Coenzym Q10 sollte in der Schwangerschaft und Stillzeit mit einem Arzt abgesprochen werden.
Coenzym Q10 kann den Blutzuckerspiegel verringern. Deshalb sind bei Diabetes engmaschige Blutzuckermessungen notwendig, um eine Unterzuckerung zu vermeiden.
Coenzym Q10 kann bereits bei geringen Dosen von 30 bis 100 Milligramm die Wirkung einiger Blutgerinnungshemmer herabsetzen. Betroffen sind sogenannte Cumarin-Derivate mit den Wirkstoffen Warfarin (Coumadin®) und Phenprocoumon (Marcumar®, Falithrom®, Phenpro®). Die Einnahme sollte daher mit dem Arzt abgesprochen werden.
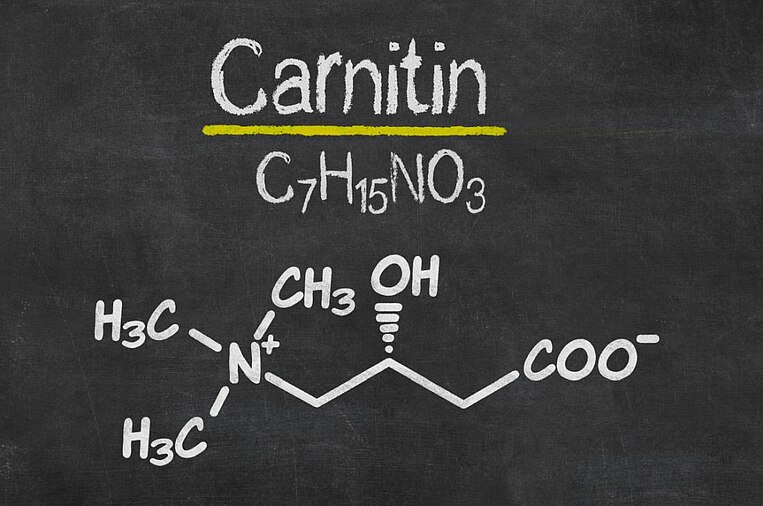
L-Carnitin entgiftet die Mitochondrien
Wirkweise von L-Carnitin
L-Carnitin bringt Fettsäuren zur Energieproduktion in die Mitochondrien. Daneben trägt es zur ihrer Entgiftung bei, indem es nicht verwertbare Stoffe heraustransportiert. L-Carnitin ist daher wichtig für alle Organe, die viele Mitochondrien haben, zum Beispiel für den Herzmuskel. Daneben wirkt L-Carnitin auch antioxidativ. Ein Mangel wird neben Veränderungen an den Mitochondrien sehr oft bei Müdigkeit gefunden, zum Beispiel bei Patienten mit chronischer Müdigkeit durch Fibromyalgie.
Einige Studien zur Einnahme von L-Carnitin liegen vor:
- Nerven: Eine erste Studie mit Multiple-Sklerose-Patienten zeigt, dass Acetyl-L-Carnitin nitrosativen Stress im Nervenwasser verringerte. Zudem gibt es erste Studienergebnisse bei Patienten mit chronischer Müdigkeit. Ihnen halfen Acetyl-L-Carnitin und Propionyl-L-Carnitin gegen die Müdigkeit.
- Herz: Nitrosativer Stress trägt zu Herzschäden bei. Bei Herzpatienten gibt es Erfolge mit L-Carnitin: Beispielsweise verbesserte es die Leistungsfähigkeit des Herzmuskels bei Herzschwäche. Dies zeigt eine Studienauswertung. Ein Einfluss auf die Überlebensrate oder die Leistung beim Gehen wurde jedoch nur in einigen Studien gefunden. Liegen gleichzeitig noch Risikofaktoren wie hohe Fettwerte und Diabetes vor, muss dies auch behandelt werden, damit L-Carnitin positiv wirkt
Fazit: Verschiedene L-Carnitin-Formen können zur Entgiftung der Mitochondrien und zum Abbau der Fette beitragen. Vor allem zur Behandlung von Herzerkrankungen liegen viele Studien vor.
Dosierung und Einnahmeempfehlung von L-Carnitin
Mikronährstoff-Experten empfehlen bei nitrosativem Stress zur Unterstützung der Mitochondrien täglich 200 bis 400 Milligramm L-Carnitin. Bei bereits geschädigten Mitochondrien und damit zusammenhängenden Erkrankungen wird unter Rücksprache auch manchmal eine höhere Dosierung empfohlen – zum Beispiel 1.000 bis 2.000 Milligramm. Bei Nervenschäden ist vor allem die Form Acetyl-L-Carnitin sinnvoll.
L-Carnitin sollte zum Essen und über den Tag verteilt genommen werden. Das verbessert die Verträglichkeit. Zudem sollte eine Einzeldosis unter 2.000 Milligramm liegen. Der Darm kann nur eine gewisse Menge auf einmal aufnehmen. Der Rest wird von Bakterien in möglicherweise ungünstige Stoffe umgewandelt (TMAO, Trimethylamin-N-oxid). Präparate mit Acetyl-L-Carnitin sollten morgens eingenommen werden. Es kann stimulierend wirken und den Schlaf erschweren.
L-Carnitin: zu beachten bei Erkrankungen und Medikamenteneinnahme
Menschen mit Funktionsstörungen der Niere sollten die Einnahme von hoch dosiertem L-Carnitin (über 1.000 Milligramm) mit dem Arzt absprechen. Die Langzeiteinnahme ist nicht gut untersucht.
Eine regelmäßige L-Carnitin-Einnahme sollte bei einem hohen Risiko für Herz-Kreislauf-Erkrankungen ärztlich begleitet werden. Nimmt der Darm nicht das gesamte L-Carnitin auf, könnten durch eine gestörte Darmflora ungünstige Stoffwechselprodukte entstehen (TMAO), die das Risiko weiter steigern. Eine Rücksprache mit dem Arzt ist auch geboten bei Diabetes, einem gestörten Blutzucker (Diabetes-Vorformen) und Lebererkrankungen wie einer Fettleber. Carnitin könnte die Empfindlichkeit für Insulin verschlechtern und die Fetteinlagerung in die Leber verstärken.
Wird L-Carnitin bei einem Herzinfarkt plötzlich abgesetzt, könnten sich die Schäden am Herzen verschlimmern. Dies zeigt ein Tierversuch. Bei einem Herzinfarkt sollte der Arzt über die Einnahme informiert werden.
Bei Krebs sollte die Einnahme von L-Carnitin mit dem Arzt abgesprochen werden. Bei bestimmten Krebsarten mit erhöhtem Fettstoffwechsel könnte es das Krebswachstum fördern. Dazu zählen zum Beispiel Blasen- und Prostatakrebs. Auch ist noch unklar, wie sich eine langfristige L-Carnitin-Zufuhr auf Darmkrebs auswirkt.
In seltenen Fällen kann L-Carnitin die Wirkung von Blutgerinnungshemmern vom Cumarin-Typ verstärken. Deshalb ist eine Rücksprache mit dem Arzt nötig. Dazu zählen Phenprocoumon (Falithrom®, Marcumar®), Ethylbiscoumacetat (Tromexan®) und Warfarin (Coumadin®).
L-Carnitin könnte bei Diabetikern die Zuckerwerte verbessern. Wird es mit blutzuckersenkenden Medikamenten eingenommen, besteht die Gefahr einer Unterzuckerung. Dazu zählen unter anderem Metformin (Diabesin® und Glucophage®) und Sulfonylharnstoffe (Euglucon® oder Maninil®). Eventuell muss die Dosierung angepasst werden. Eine regelmäßige Kontrolle des Blutzuckerspiegels und eine Absprache mit dem Arzt sind empfehlenswert.
Alpha-Liponsäure schützt vor allem die Nerven
Wirkweise von Alpha-Liponsäure
Alpha-Liponsäure wirkt entzündungshemmend. Auch kann sie oxidativen und nitrosativen Stress abfangen. Im Gegensatz zu anderen Antioxidantien gelangt Alpha-Liponsäure direkt in das Gehirn und die Nerven. So ist der Stoff zur Bekämpfung von Nervenschäden besonders geeignet. Daneben bindet Alpha-Liponsäure Schwermetalle, die ebenfalls solchen Stress auslösen. Sie spielt außerdem für die Energiegewinnung in den Mitochondrien eine wesentliche Rolle. Damit gehört Alpha-Liponsäure zu den Stoffen, die Mitochondrien schützen und unterstützen.
Die Wirksamkeit wurde vor allem bei Nervenschäden positiv bewertet: Die teils hochwertigen Studien ergaben, dass Alpha-Liponsäure messbare Verbesserungen der Nervenbeschwerden bei Diabetes bewirkte. Dazu gehören Symptome wie brennender Schmerz, Taubheit und Kribbeln.
Auch bei anderen Nervenproblemen kommt Alpha-Liponsäure infrage. Dazu gehören die altersbedingte Abnahme der geistigen Leistungsfähigkeit sowie Alzheimer und Parkinson. Das diskutieren Forscher in einem Übersichtsartikel. Daneben schützt Alpha-Liponsäure vermutlich vor Nervenschäden bei Schwerhörigkeit, einem Karpaltunnelsyndrom oder grünem Star. Wie gut und vor allem wie lange Alpha-Liponsäure wirkt, ist jedoch noch unklar. Das schlussfolgern andere Forscher in Übersichtsartikeln.
Dosierung und Einnahmeempfehlung von Alpha-Liponsäure
Mikronährstoff-Experten empfehlen bei nitrosativem Stress zum Schutz der Nerven 200 bis 400 Milligramm Alpha-Liponsäure pro Tag. Liegen schon Erkrankungen vor, kann die Dosis höher sein.
Die Einnahme von Alpha-Liponsäure sollte nüchtern erfolgen – zum Beispiel etwa eine Stunde vor einer Mahlzeit. Mineralstoffe aus der Nahrung hemmen die Aufnahme von Alpha-Liponsäure im Darm. Auch Mineralstoffpräparate sollten daher mit zwei Stunden Abstand genommen werden.
Tipp
Bei Einnahme über einen langen Zeitraum sollte auch Biotin ergänzt werden: Alpha-Liponsäure hemmt die Wirkung von Biotin. Gute Präparate enthalten bereits Biotin.
Alpha-Liponsäure: zu beachten in der Schwangerschaft/Stillzeit und bei Medikamenteneinnahme
In der Schwangerschaft und Stillzeit sollte Alpha-Liponsäure nur nach Rücksprache mit dem Arzt ergänzt werden.
Bei der Einnahme von Diabetes-Medikamenten (wie Metformin zum Beispiel Diabesin® oder Janumet®) sowie Insulin kann es in Einzelfällen durch Alpha-Liponsäure zu einer Unterzuckerung kommen. Deshalb sollte der Blutzuckerspiegel engmaschig überwacht werden. Möglicherweise ist in Rücksprache mit dem Arzt eine Anpassung der Medikamentendosis nötig.
Personen, die Schilddrüsenhormone (wie L-Thyroxin Winthrop®, L-Thyroxin beta®) einnehmen, sollten die Einnahme von Alpha-Liponsäure mit dem Arzt absprechen. Die Wirkung des Medikaments könnte gebremst werden.
Auch eine Krebstherapie mit Cisplatin könnte durch Alpha-Liponsäure beeinträchtigt werden. Gleichzeitig gibt es Hinweise, dass Alpha-Liponsäure Nebenwirkungen auf die Ohren verringert. Bei Krebs sollte Alpha-Liponsäure nur in Rücksprache mit dem Arzt eingenommen werden.
Magnesium hilft, Energie zu erzeugen und zu nutzen
Wirkweise von Magnesium
Magnesium hat viele Funktionen. Insbesondere Mitochondrien brauchen Magnesium, um Energie zu gewinnen. Auch bei der Nutzung der Energie ist es wichtig. Daneben unterdrückt Magnesium die Überproduktion des Radikals NO sowie nitrosativen Stress. Maßgeblich beteiligt daran ist ein spezieller Rezeptor (NMDA-Rezeptor), der für eine starke Nervenaktivierung sorgt. Dieser wird durch Magnesium gehemmt, was die Nerven beruhigt. Besonders wirksam ist wahrscheinlich die Verbindung mit Taurin (Magnesiumtaurat), da auch Taurin den Rezeptor hemmt.
Im Tierversuch führte nitrosativer Stress durch einen Magnesiummangel zu Entzündungen und Herzschäden. Ein Magnesiummangel ist häufig bei Diabetes, Alkoholismus oder bei der Einnahme von Entwässerungsmitteln (Thiaziddiuretika). In einer kleinen beobachtenden Studie fanden Forscher bei Diabetikern mit Komplikationen weniger Magnesium und mehr nitrosativen Stress.
Ein Tierversuch deutet an, dass Magnesium nitrosativen Stress nach Nervenschäden mildern kann. Dabei war auch die Aktivität der Mitochondrien im Gehirn besser. Nitrosativer Stress, Entzündungen und eine Störung der Mitochondrien-Funktion sind Kennzeichen des chronischen Erschöpfungssyndroms (CFS). In einer kleinen hochwertigen Studie konnten Forscher CFS-Symptome erfolgreich mit Magnesium-Injektionen bekämpfen: Die Patienten hatten mehr Energie, eine bessere Stimmung und weniger Schmerzen.
Fazit: Zu Magnesium bei nitrosativem Stress gibt es bisher nur wenige Daten. Die meisten Studien wurden im Zusammenhang mit CFS gemacht. Da Magnesium die Funktion der Mitochondrien und die Energieproduktion unterstützt, sollte es bei nitrosativem Stress ausreichend verfügbar sein.
Dosierung und Einnahmeempfehlung von Magnesium
Bei einer Therapie gegen nitrosativen Stress können täglich 100 bis 200 Milligramm Magnesium sinnvoll sein. Magnesium sollte am besten zur Mahlzeit eingenommen werden: Eiweiße fördern die Aufnahme im Darm. Auch sind Kapseln oder Tabletten verträglicher, wenn sie nicht auf leeren Magen eingenommen werden.
Magnesium: zu beachten bei Erkrankungen und Medikamenten
Bei Nierenerkrankungen sollte Magnesium nicht zusätzlich eingenommen werden. Geschwächte Nieren können überschüssiges Magnesium nicht gut ausscheiden. Es könnte sich im Blut anreichern.
Magnesium kann die Wirkung einiger Medikamente herabsetzen, da es sich mit ihnen verbindet. Hierzu zählen Antibiotika, vor allem Gyrasehemmer (Ciprofloxacin (zum Beispiel Ciloxan®) und Enoxacin (zum Beispiel Enoxor®)) und Tetrazykline (Tetracyclin (zum Beispiel Achromycin®, Tefilin®) und Doxycyclin (zum Beispiel Supracyclin®, Vibramycin®)) sowie Medikamente gegen Osteoporose (Bisphosphonate wie Pamidronat (Aredia®) und Risedronat (Actonel®)).
Vitamine als antioxidative Schutzstoffe: Vitamin C und E
Wirkweise von Vitamin C und E
Vitamin C verhindert, dass sich Stickstoffverbindungen in wässrigen Zellbereichen bilden. Es wendet daher oxidative und nitrosative Schäden ab. Die Wirkung von Vitamin C kann außerdem mit vielen antioxidativen Stoffen ergänzt werden, zum Beispiel mit Vitamin E. Vitamin E schützt vor allem die Membranen der Zellen (fetthaltige Zellbereiche).
Beobachtende Studien zeigen, dass bei Menschen mit psychischen Beschwerden Antioxidantien wie Vitamin C und E im Blut verringert sind und nitrosativer Stress erhöht ist. Wie wirksam eine Einnahme von Vitamin C und E nitrosativen Stress bekämpft, ist bisher kaum belegt. In ersten Studien konnte er jedoch bei Herzoperationen gesenkt werden: Durch die Operation kommt es zur Unterbrechung der Durchblutung, was mit nitrosativem Stress verbunden ist. Dieser Stress wurde mit einer Kombination aus Vitamin C, E und Omega-3-Fettsäuren gelindert. Auch zeigen Tierversuche, dass Vitamin C und E nitrosativen Stress lindern, der durch Schwermetalle ausgelöst wurde.
Fazit: Es gibt viele Studien zu Vitamin E und C bei Erkrankungen, die durch oxidativen Stress verursacht werden. Zu nitrosativem Stress liegen kaum Daten vor. Da auf oxidativen Stress auch nitrosativer Stress folgt, könnten die Ergebnisse übertragbar sein. Insgesamt ist es aber schwierig, einen Nutzen von isolierten Antioxidantien wie Vitamin C und E nachzuweisen. Der positive Effekt einer antioxidantienreichen Ernährung übrigens ist unumstritten. Darum sollten in der Mikronährstoffmedizin niedrig dosierte Kombinationspräparate zum Einsatz kommen.

Dosierung und Einnahmeempfehlung von Vitamin C und E
Mikronährstoff-Experten empfehlen bei nitrosativem Stress eine Basisabsicherung mit Antioxidantien – vor allem mit 100 bis 200 Milligramm Vitamin C und 20 bis 30 Milligramm Vitamin E. Präparate sollten am besten zum Essen eingenommen werden: Fett verbessert die Aufnahme von Vitamin E und Vitamin C wird so verträglicher.
Antioxidativen Stress im Labor bestimmen lassen
Bei nitrosativem Stress kann es hilfreich sein, auch den antioxidativen Status prüfen zu lassen. Nitrosativer und oxidativer Stress gehen oft Hand in Hand. Das Ergebnis gibt Auskunft, ob ein Antioxidantien-Mangel vorliegt. Der Status wird mithilfe von Blut- oder Urinproben bestimmt.
Ein Gesamt-Antioxidantienstatus von 1,13 bis 1,57 Millimol pro Liter Blutserum ist ideal. Das Blutserum ist die Flüssigkeit des Blutes ohne die Blutzellen. Oft wenden aber Labore unterschiedliche Messmethoden oder Messeinheiten an. Deshalb gelten die Angaben des entsprechenden Labors.
Vitamin C: zu beachten bei Erkrankungen und Medikamenteneinnahme
Da Vitamin C die Eisenaufnahme verbessert, sollten Menschen mit einer Eisenspeicherkrankheit (Hämochromatose) Vitamin C nicht zusätzlich einnehmen.
Vitamin C könnte die Wirkung des Blutkrebs-Wirkstoffs Bortezomib (zum Beispiel Velcade®) abschwächen. Das zeigt eine Tierstudie. Nehmen Sie Vitamin C bei Krebs deshalb nur nach Absprache mit dem Arzt ein.
Sekundäre Pflanzenstoffe steigern das antioxidative Potenzial
Wirkweise von sekundären Pflanzenstoffen
Pflanzen enthalten zahlreiche Schutzstoffe (Polyphenole). Sie wirken auf vielen Ebenen, unter anderem
- fangen sie oxidativen und nitrosativen Stress ab,
- können sie im Körper Enzyme aktivieren, die oxidativen und nitrosativen Stress beseitigen,
- senken sie Entzündungen, die durch oxidativen und nitrosativen Stress gefördert werden.
Beobachtungsstudien zeigen, dass Menschen, die viele polyphenolreiche Lebensmittel essen, seltener an Herz-Kreislauf-Erkrankungen leiden, die mit oxidativem und nitrosativem Stress einhergehen. Wichtige Polyphenole sind: Resveratrol und OPC aus Trauben, Curcumin aus Kurkuma, EGCG (Epigallocatechingallat) aus grünem Tee, Hydroxytyrosol aus Oliven und Quercetin aus Früchten und Gemüse. Neben Polyphenolen liefert Ginkgo auch weitere Wirkstoffe wie Ginkgolide.
Studien zeigen Folgendes:
- Curcumin: Tierversuche belegen, dass es nitrosativen Stress senkt. Daneben verstärkt Curcumin die Aktivität von Enzymen, die oxidativen Stress abwehren. Allerdings wird nur wenig im Darm des Menschen aufgenommen. Trotzdem wurden Wirkungen nachgewiesen, zum Beispiel bei Depressionen, die mit nitrosativem Stress zusammenhängen können.
- Ginkgo: Labor- und Tierversuche bestätigen, dass Ginkgo nitrosativen und oxidativen Stress beseitigen kann. Es gibt außerdem viele erfolgreiche Studien zu Erkrankungen, bei denen oxidativer Stress beteiligt ist. Das sind Herzmuskelerkrankungen, grauer Star, Hörprobleme und Durchblutungsstörungen. Ginkgo lindert Entzündungen und hat zudem eine Wirkung bei Nervenerkrankungen wie Alzheimer.
- Catechine: Vor allem EGCG aus Grüntee wirkt antioxidativ und schützt die Mitochondrien. Tierversuche belegen auch eine Wirkung gegen nitrosativen Stress in verschiedenen Situationen wie Durchblutungsstörungen, Alzheimer und Vergiftungen.
- Quercetin: Quercetin bremst nitrosativen Stress und fördert die Produktion neuer Mitochondrien in den Muskeln. Es wehrt im Tierversuch bei Sauerstoffmangel nitrosativen Stress ab und schützt das Herz. Auch schützt Quercetin die Tiere vor Giften, die nitrosativen Stress auslösen.
Fazit: Zwar liegen kaum Studien am Menschen vor, es gibt jedoch viele theoretische Hinweise: Pflanzenstoffe wirken über viele Mechanismen positiv auf die Gesundheit. Da jeder Stoff ein leicht anderes Wirkspektrum hat, sollte die Ernährung möglichst vielfältig sein oder Kombinationspräparate eingesetzt werden.
Dosierung und Einnahmeempfehlung von sekundären Pflanzenstoffen
Mikronährstoff-Experten empfehlen bei nitrosativem Stress eine Mischung verschiedener Pflanzenstoffe in geringer Dosierung, damit sie einer abwechslungsreichen Ernährung entsprechen. Sinnvoll sind zum Beispiel:
- Curcumin: 50 bis 100 Milligramm
- Ginkgo-Extrakt: 80 bis 100 Milligramm
- Grüntee-Catechine: 10 bis 20 Milligramm
- Quercetin: 30 bis 50 Milligramm
Pflanzenstoffe sollten zum Essen eingenommen werden. Einige werden so besser aufgenommen (Curcumin), andere sind so wiederum besser verträglich (EGCG).
Sekundäre Pflanzenstoffe: zu beachten in der Schwangerschaft/Stillzeit, bei Erkrankungen und Medikamenteneinnahme
Die Studienlage ist nicht ausreichend, um die Einnahme von Pflanzenstoffen Schwangeren oder Stillenden zu empfehlen. Eine pflanzenstoffreiche Ernährung durch Obst und Gemüse ist dagegen bedenkenlos möglich.
Curcumin fördert die Gallensaftproduktion und sollte deshalb nicht bei Gallensteinen eingesetzt werden. Es könnte zu einem Gallenstau mit starken Schmerzen (Koliken) kommen.
Ginkgo sollte bei Epilepsie nicht angewandt werden.
Wechselwirkungen zwischen Pflanzenstoffen und Medikamenten sind möglich. Pflanzenstoffe beeinflussen Enzyme der Leber, die normalerweise Medikamente verstoffwechseln. Es können sich Wirkungen und Nebenwirkungen der Medikamente verändern. Besprechen Sie daher die kombinierte Einnahme zur Sicherheit mit dem Arzt.
Viele Pflanzenstoffe und Extrakte wirken in hoher Dosierung blutverdünnend (wie Ginkgo und Curcumin). Wenn Sie Blutverdünner wie Acetylsalicylsäure (Aspirin®), Phenprocoumon (Marcumar®) und Warfarin (Coumadin®) nehmen, sollten Sie mit Ihrem Arzt sprechen. Er kann die Blutgerinnungszeit (Quick-Wert) kontrollieren und eventuell neu einstellen.
Bestimmte Stoffe in Grüntee blockieren die Aufnahme von Medikamenten im Darm. Das gilt für den Betablocker Bisoprolol (zum Beispiel Bisoprolol®) oder den Blutdrucksenker Nifedipin (wie Adalat®). Zwischen der Einnahme sollten deshalb mindestens vier Stunden liegen.
Krebsmedikamente wirken manchmal über oxidativen Stress. Ob Sie bei einer Krebstherapie hoch dosierte antioxidative Pflanzenstoffe nehmen dürfen, sollten Sie mit dem Arzt absprechen.
Zink, Selen, Kupfer und Mangan: zelluläres Schutzsystem stärken
Wirkweise von Zink, Selen, Kupfer und Mangan
Der Körper hat Schutzsysteme, um oxidativen und nitrosativen Stress abzufangen. Das sind unter anderem Enzyme, die Mineralstoffe wie Zink, Selen, Kupfer und Mangan enthalten. Ohne diese Mineralstoffe sind die Enzyme nicht aktiv. Daneben sind noch Hilfsstoffe notwendig wie Vitamin C, E und Glutathion.
Zum Beispiel ist bei Depressionen nitrosativer Stress häufig zu beobachten. Gleichzeitig fehlen den Betroffenen Antioxidantien wie Zink. Bei Selen sind die Daten ähnlich, aber weniger deutlich. Ein Zinkmangel gilt als einer der Faktoren, die zum Versagen von Antidepressiva beitragen.
Im Tierversuch zeigten Forscher auch, dass Selen bei diabetischen Mäusen Anzeichen von Depressionen und Ängsten linderte. Gleichzeitig sanken Radikale und Spuren von oxidativem Stress im Blut. Außerdem belegten Forscher, dass Selen und Zink die Versuchstiere vor experimentellen Durchblutungsstörungen im Gehirn schützte: Es traten weniger Nervenschäden auf.
Fazit: Studien an Menschen zu nitrosativem Stress und Mineralstoffen gibt es kaum. Erste Studien und Tierversuche lassen jedoch vermuten, dass antioxidative Mineralstoffe zum Beispiel antidepressiv wirken. Da Selen, Zink, Kupfer und Mangan theoretisch wichtig sind für die Abwehr von oxidativem und nitrosativem Stress, sollte kein Mangel vorliegen.
Dosierung und Einnahmeempfehlung von Zink, Selen, Kupfer und Mangan
Bei nitrosativem Stress empfehlen Mikronährstoff-Experten eine Basisabsicherung mit Mineralstoffen. Folgende Dosierungen sind zum Beispiel sinnvoll:
- Zink: 5 bis 10 Milligramm
- Selen: 50 bis 100 Mikrogramm
- Kupfer: 0,5 bis 1 Milligramm
- Mangan: 1 bis 2 Milligramm
Nehmen Sie Mineralstoffe zum Essen ein. So werden sie gut aufgenommen und besser vertragen.
Tipp
Sollen Vitamin C und Selen kombiniert werden, achten Sie darauf, dass das Präparat Natriumselenat enthält. Die Aufnahme von Natriumselenat wird nicht durch Vitamin C beeinträchtigt, wohl aber die Aufnahme von Natriumselenit.
Zink, Selen, Kupfer und Mangan im Labor bestimmen lassen
Bei nitrosativem Stress kann es sinnvoll sein, die Spiegel an antioxidativen Mineralstoffen bestimmen zu lassen – insbesondere von Selen. Es kann überdosiert werden. Die Messung sollte im Vollblut erfolgen, da dies die Langzeitversorgung widerspiegelt. Normal sind 120 bis 150 Mikrogramm pro Liter.
Bei bereits bestehenden Nervenerkrankungen sollten die Spiegel von Kupfer und Mangan nicht zu hoch liegen. Normal sind:
- 4 bis 15 Mikrogramm Mangan pro Liter Vollblut.
- 16 bis 45 Milligramm Coeruloplasmin pro Deziliter Blutserum (Blutflüssigkeit). Coeruloplasmin ist das Transporteiweiß von Kupfer.
Selen, Kupfer, Zink und Mangan: zu beachten bei Erkrankungen und Medikamenteneinnahme
Personen mit Nierenerkrankungen sollten keine Mineralstoffe einnehmen, ohne dass ein Arzt ihre Spiegel im Blut prüft. Durch eine eingeschränkte Nierenfunktion kann die Ausscheidung vermindert sein. Es besteht die Gefahr einer Überdosierung.
Menschen mit Diabetes oder hohem Risiko sollten Selen nicht ohne Blutkontrolle einnehmen. Es besteht der Verdacht, dass eine Überdosierung das Risiko für Diabetes erhöhen könnte.
Betroffene mit der Kupferspeicherkrankheit „Morbus Wilson“ dürfen kein Kupfer ergänzen. Frauen, die hormonelle Verhütungsmittel (Antibabypille) einnehmen, haben oft erhöhte Kupferspiegel. Die regelmäßige Ergänzung sollte daher mit dem Arzt abgesprochen sein.
Arbeiter in der Industrie (wie Stahl, Keramik, Leder) sind möglicherweise mit Mangan belastet. Sie sollten kein zusätzliches Mangan aufnehmen.
Bei Nervenerkrankungen wie Parkinson, Alzheimer und Amyotropher Lateralsklerose können die Kupfer- oder Manganspiegel erhöht sein. Da man nicht weiß, ob dies an der Entstehung beteiligt ist, sollte die hoch dosierte Einnahme mit dem Arzt besprochen werden. Gleiches gilt bei Krebs oder einer Krebstherapie.
Bei schweren Leber- und Gallenerkrankungen sollten Kupfer und Mangan nicht zusätzlich ergänzt werden: Die Ausscheidung kann beeinträchtigt sein.
Zink reduziert die Wirkung von Antibiotika aus der Gruppe der Gyrasehemmer (Ciprobay®, Ciloxan®) und Tetrazykline (Doxybene®, Doxycyclin®) sowie von Osteoporose-Medikamenten, sogenannten Bisphosphonaten (Fosamax®, Bondronat®). Es ist ratsam, einen Einnahmeabstand von mindestens zwei Stunden einzuhalten.
Glutathion: wichtiger Regulator für oxidativen und nitrosativen Stress
Wirkweise von Glutathion
Glutathion ist ein „Messfühler“ für oxidativen Stress: Sein oxidativer Zustand ist eines der Signale, welches das Schicksal der Zelle bestimmt (Teilung und kontrolliertes Sterben). Glutathion sorgt außerdem dafür, dass Enzyme und Eiweiße unter nitrosativem Stress nicht zerstört werden, indem es die geschädigten Gruppen abfängt. Es gibt dann oft einen Mangel an „unverbrauchtem“ (reduziertem) Glutathion. Der Körper braucht daher rechtzeitig „neues“ Glutathion sowie andere Antioxidantien, um „verbrauchtes“ Glutathion zu regenerieren.
Patienten mit Multipler Sklerose haben beispielsweise vermehrt Spuren von nitrosativem Stress im Nervenwasser. Gleichzeitig nimmt die Menge an reduziertem Glutathion ab. Forscher vermuten, dass dies ursächlich mit den Nervenschäden zusammenhängt. Ähnliches wird für andere Nervenschäden berichtet sowie für Schlaganfall, Herz-Kreislauf-Erkrankungen und Diabetes.
In einer hochwertigen Studie konnten Forscher zeigen, dass die Einnahme von Glutathion die Menge an reduziertem Glutathion im Blut erhöht. Gleiches wurde in einer Vorstudie mit der Glutathion-Vorstufe N-Acetylcystein bei Parkinson-Patienten gezeigt. Allerdings blieb ein Marker für oxidativen Stress unverändert. Auch war im Gehirn keine höhere Menge an reduziertem Glutathion zu finden. In zwei anderen Vorstudien stieg dagegen der Glutathion-Gehalt im Gehirn.
Fazit: Die Frage, ob eine Glutathion-Einnahme auf nitrosativen Stress positiv wirkt, kann noch nicht endgültig beantwortet werden. Glutathion schützt vor allem Eiweiße der Zellen vor der Zerstörung. Für eine gute Wirkung von Glutathion braucht der Körper auch andere Antioxidantien. In zukünftigen Studien sollte man begleitend Antioxidantien testen.
Dosierung und Einnahmeempfehlung von Glutathion
Mikronährstoff-Experten empfehlen bei nitrosativem Stress die Einnahme eines Kombinationspräparats mit Glutathion in einer Dosierung von 10 bis 30 Milligramm. Dazu sollte ein breites Spektrum an unterschiedlichen Antioxidantien verfügbar sein. Zum Beispiel wird Vitamin C gebraucht, um verbrauchtes Glutathion zu regenerieren.
Glutathion sollte zwischen den Mahlzeiten eingenommen werden, zum Beispiel eine Stunde davor oder zwei Stunden danach. So wird die Aufnahme nicht durch Bestandteile der Nahrung gehemmt.
Glutathion: zu beachten bei Medikamenteneinnahme
Hoch dosiertes Glutathion könnte die Wirkung von Krebsmedikamenten beeinträchtigen. Nehmen Sie es deshalb bei Krebs nur in Rücksprache mit dem Arzt ein.
Omega-3-Fettsäuren schützen Membranen und Mitochondrien
Wirkweise von Omega-3-Fettsäuren
Nitrosativer Stress schädigt Fettsäuren in den Zellmembranen. Das kann auf die Dauer Organe beeinträchtigen, die viele Zellen enthalten – zum Beispiel Nervensystem und Augen. Omega-3-Fettsäuren werden in Membranen eingebaut und wirken antioxidativ. Zudem regen sie die Bildung antioxidativer Enzyme an. Auf diese Weise schützen Omega-3-Fettsäuren auch die Mitochondrien, vor allem im Nervensystem.
Omega-3-Fettsäuren dämpfen außerdem die entzündliche Aktivität. EPA (Eicosapentaensäure) und DHA (Docosahexaensäure) können Entzündungen aktiv beenden. Wenn Entzündungen über Jahre bestehen, drohen durch nitrosativen Stress Alterserkrankungen und Herz-Kreislauf-Erkrankungen.
Nitrosativer Stress kann zum Beispiel durch übermäßige sportliche Aktivität entstehen. Zwar stärkt Sport selbst schon die Stressabwehr, mit DHA waren die Schäden durch Stickstoffradikale jedoch noch einmal geringer. Das zeigt eine erste kleine Studie. Weiter nehmen Forscher an, dass Omega-3-Fettsäuren zusammen mit Antioxidantien nitrosativen Stress bei grünem Star lindern können. Auch bei Alzheimer könnten Omega-3-Fettsäuren verlangsamend wirken. Dabei sind viele Mechanismen am Werk – auch eine Senkung von nitrosativem Stress im Gehirn.
Fazit: Erste Ergebnisse lassen ahnen, dass Omega-3-Fettsäuren bei nitrosativem Stress lindernd eingreifen. Da Entzündungen nitrosativen Stress erzeugen und Omega-3-Fettsäuren Entzündungen lindern, sollten sie zusammen mit Antioxidantien Teil der Mikronährstofftherapie sein.
Info
Omega-3-Fettsäuren sind selbst auch sehr empfindlich gegen nitrosativen und oxidativen Stress. Wenn die Fettsäuren geschädigt sind, setzen Mitochondrien oxidativ wirkende Verbindungen frei. Das belastet die Zelle ebenfalls. Daher sollte eine breite Mischung an niedrig dosierten Antioxidantien ebenfalls im Köper verfügbar sein.
Dosierung und Einnahmeempfehlung von Omega-3-Fettsäuren
Mikronährstoff-Experten empfehlen bei nitrosativem Stress 1.000 bis 2.000 Milligramm Omega-3-Fettsäuren. Vor allem EPA und DHA sind wichtig. Sie sind in fetthaltigem Fisch und Fischölpräparaten enthalten. Omega-3-Präparate sollten immer zum Essen eingenommen werden: Das Fett aus dem Essen verbessert die Aufnahme der Fettsäuren im Darm.
Tipp
Achten Sie bei Fischöl auf die Qualität und kaufen Sie nur besonders gereinigte Präparate. Diese sind frei von unerwünschten Rückständen wie Schwermetallen. Krillöl enthält grundsätzlich weniger Schadstoffe, da Krill am Anfang der Nahrungskette steht.
Omega-3-Fettsäuren im Labor bestimmen lassen
Grundsätzlich kann es bei chronischen Erkrankungen sinnvoll sein, die Versorgung mit Omega-3-Fettsäuren durch einen Bluttest zu messen. Gut geeignet ist der Omega-3-Index, denn er liefert gleichzeitig Informationen zum Risiko für Herz-Kreislauf-Erkrankungen.
Dabei wird der Anteil an EPA und DHA in den roten Blutkörperchen bestimmt. Der Omega-3-Index wird in Prozent angegeben. Idealerweise sollte er bei mindestens 8 Prozent liegen.
Omega-3-Fettsäuren: zu beachten bei Erkrankungen und Medikamenteneinnahme
Personen, die eine plötzlich aufgetretene (akute) Lebererkrankung haben oder eine akute Bauchspeicheldrüsen- oder Gallenblasenentzündung, sollten keine Omega-3-Fettsäuren einnehmen.
Hoch dosierte Omega-3-Fettsäuren wirken blutverdünnend. Sprechen Sie deshalb mit dem Arzt, ob Präparate vor einer geplanten Operation abgesetzt werden sollten oder bei einer Blutgerinnungsstörung geeignet sind.
Omega-3-Fettsäuren könnten ab einer Dosierung von 1.000 Milligramm pro Tag blutverdünnende Medikamente verstärken. Halten Sie daher Rücksprache mit dem Arzt. Betroffen sind zum Beispiel die Wirkstoffe Phenprocoumon (wie Marcumar®), Acetylsalicylsäure (ASS wie Aspirin®), Heparin (wie Clexane®) oder Dabigatran (wie Pradaxa®).
Dosierungen auf einen Blick
Empfehlung pro Tag bei nitrosativem Stress | |
|---|---|
Vitamine | |
Vitamin B1 | 2 bis 5 Milligramm (mg) |
Vitamin B2 | 3 bis 6 Milligramm |
Vitamin B6 | 3 bis 5 Milligramm |
Vitamin B12 | 200 bis 400 Mikrogramm (µg) (als Methylcobalamin) |
Folsäure | 200 bis 400 Mikrogramm (als 5-Methyltetrahydrofolat) |
Biotin | 100 bis 200 Mikrogramm |
Niacin | 30 bis 60 Milligramm |
Pantothensäure | 9 bis 18 Milligramm |
Vitamin C | 100 bis 200 Milligramm |
Vitamin E | 20 bis 30 Milligramm |
Mineralstoffe | |
Magnesium | 100 bis 200 Milligramm |
Zink | 5 bis 10 Milligramm |
Selen | 50 bis 100 Mikrogramm |
Kupfer | 0,5 bis 1 Milligramm |
Mangan | 1 bis 2 Milligramm |
Pflanzenstoffe | |
Curcumin | 50 bis 100 Milligramm |
Ginkgo-Extrakt | 80 bis 100 Milligramm |
| Grüntee-Catechine | 10 bis 20 Milligramm |
Quercetin | 30 bis 50 Milligramm |
Fettsäuren | |
Omega-3-Fettsäuren | 1.000 bis 2.000 Milligramm |
Sonstige | |
Coenzym Q10 | 100 bis 300 Milligramm |
L-Carnitin | 200 bis 400 Milligramm |
Alpha-Liponsäure | 200 bis 400 Milligramm |
Glutathion | 10 bis 30 Milligramm |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei nitrosativem Stress | |
|---|---|
Normalwerte | |
Homocystein | unter 10 Mikromol pro Liter (µmol/l) |
Methylmalonsäure (Serum) | bis 32 Mikrogramm pro Liter (µg/l) |
Antioxidantienstatus (Serum) | 1,13 bis 1,57 Millimol pro Liter (mmol/l) |
Selen (Vollblut) | 120 bis 150 Mikrogramm pro Liter |
Coeruloplasmin (Serum) | 16 bis 45 Milligramm pro Deziliter (mg/dl) |
Mangan (Vollblut) | 4 bis 15 Mikrogramm pro Liter |
Omega-3-Index | mindestens 8 Prozent (%) |
Zusammenfassung
Ein wenig nitrosativer Stress hat im Körper wichtige Funktionen, wenn er kontrolliert werden kann. Nimmt nitrosativer Stress jedoch überhand, kann er zerstörerisch wirken und Alterserkrankungen beschleunigen. Folgen von nitrosativem Stress sind Müdigkeit, Schmerzen und entzündliche Erkrankungen.
Einer der Angriffspunkte von nitrosativem Stress sind die Zellkraftwerke (Mitochondrien). Sie sollten daher gezielt unterstützt werden. Coenzym Q10, L-Carnitin, Alpha-Liponsäure und Magnesium gehören zu den typischen Stoffen für Mitochondrien. Sie dürfen für eine reibungslose Funktion nicht fehlen. Auch die B-Vitamine sind für die Energieproduktion in den Mitochondrien wichtig. Vitamin B12 kann nitrosativen Stress zudem entgiften.
Zusätzlich kommen antioxidative Vitamine wie Vitamin C und E zum Abfangen der gefährlichen Verbindungen infrage. Der Körper hat außerdem eigene Schutzsysteme. Diese brauchen Stoffe wie Glutathion, Zink, Selen, Kupfer und Mangan. Als Antioxidantien kommen auch sekundäre Pflanzenstoffe infrage. Dazu zählen Curcumin, Catechine aus Grüntee und Ginkgolide aus Ginkgo. Zudem helfen Omega-3-Fettsäuren dabei, die durch nitrosativen Stress zerstörten ungesättigten Fette auszutauschen. Daneben dürften sie auch nitrosativen Stress abfangen.
Verzeichnis der Studien und Quellen
Aboul-Fotouh, S. (2013): Coenzyme Q10 displays antidepressant-like activity with reduction of hippocampal oxidative/nitrosative DNA damage in chronically stressed rats. Pharmacology, biochemistry, and behavior, 104, 105–112. https://www.ncbi.nlm.nih.gov/pubmed/23313551, abgerufen am 08.02.2021.
Abraham, S. K. & Khandelwal, N. (2013): Ascorbic acid and dietary polyphenol combinations protect against genotoxic damage induced in mice by endogenous nitrosation. Mutation research, 757(2), 167–172. https://www.ncbi.nlm.nih.gov/pubmed/23973768, abgerufen am 08.02.2021.
Abrahams, S. et al. (2019): Antioxidant effects of curcumin in models of neurodegeneration, aging, oxidative and nitrosative stress: A review. Neuroscience, 406, 1–21. https://www.ncbi.nlm.nih.gov/pubmed/30825584, abgerufen am 08.02.2021.
Achete de Souza, G. et al. (2020): Effects of Ginkgo biloba on Diseases Related to Oxidative Stress. Planta medica, 86(6), 376–386. https://www.ncbi.nlm.nih.gov/pubmed/32097975, abgerufen am 08.02.2021.
Agathos, E. et al. (2018): Effect of α-lipoic acid on symptoms and quality of life in patients with painful diabetic neuropathy. The Journal of international medical research, 46(5), 1779–1790. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5991249/, abgerufen am 08.02.2021.
Albuquerque, R. G. et al. (2019): Benefits of selenium in the treatment of depression and sleep disorders : Commentaries of the article "The selenium-containing compound 3-((4-chlorophenyl)selanyl)-1-methyl-1H-indole reverses depressive-like behavior induced by acute restraint stress in mice: modulation of oxido-nitrosative stress and inflammatory pathway". Sleep & breathing = Schlaf & Atmung vol. 23,3 (2019): 933-934. https://pubmed.ncbi.nlm.nih.gov/30840199/, abgerufen am 08.02.2021.
Al-Maskari, M. Y. et al. (2012): Folate and vitamin B12 deficiency and hyperhomocysteinemia promote oxidative stress in adult type 2 diabetes. Nutrition (Burbank, Los Angeles County, Calif.), 28(7-8), e23–e26. https://www.ncbi.nlm.nih.gov/pubmed/22595450, abgerufen am 08.02.2021.
Altun, I. & Kurutaş, E. B. (2016): Vitamin B complex and vitamin B12 levels after peripheral nerve injury. Neural regeneration research vol. 11,5 (2016): 842-5. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4904479/, abgerufen am 21.02.2021.
an Breda, S. G. et al. (2019): Impact of high drinking water nitrate levels on the endogenous formation of apparent N-nitroso compounds in combination with meat intake in healthy volunteers. Environmental health : a global access science source, 18(1), 87. https://www.ncbi.nlm.nih.gov/pubmed/31623611, abgerufen am 08.02.2021.
Anderson, G. et al. (2013): Schizophrenia is primed for an increased expression of depression through activation of immuno-inflammatory, oxidative and nitrosative stress, and tryptophan catabolite pathways. Progress in neuro-psychopharmacology & biological psychiatry, 42, 101–114. https://www.ncbi.nlm.nih.gov/pubmed/22930036, abgerufen am 08.02.2021.
Ankush, R D et al. “Hypomagnesaemia in type-2 diabetes mellitus patients: A study on the status of oxidative and nitrosative stress.” Indian journal of clinical biochemistry : IJCB vol. 24,2 (2009): 184-9. https://pubmed.ncbi.nlm.nih.gov/23105830/,/ abgerufen am 08.02.2021.
Aquilano, K. et al. (2014): Glutathione: new roles in redox signaling for an old antioxidant. Front. Pharmacol., 26 August 2014. https://www.frontiersin.org/articles/10.3389/fphar.2014.00196/full, abgerufen am 08.02.2021.
Bampi, S. R. et al. (2019): Repeated administration of a selenium-containing indolyl compound attenuates behavioural alterations by streptozotocin through modulation of oxidative stress in mice. Pharmacology, biochemistry, and behavior vol. 183 (2019): 46-55. https://pubmed.ncbi.nlm.nih.gov/31207269/, abgerufen am 08.02.2021.
Bene, J. et al. (2018): Role of carnitine and its derivatives in the development and management of type 2 diabetes. Nutrition & diabetes, 8(1), 8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5856836/, abgerufen am 08.02.2021.
Calabrese, V. et al. (2002): Nitric oxide synthase is present in the cerebrospinal fluid of patients with active multiple sclerosis and is associated with increases in cerebrospinal fluid protein nitrotyrosine and S-nitrosothiols and with changes in glutathione levels. Journal of neuroscience research, 70(4), 580–587. https://www.ncbi.nlm.nih.gov/pubmed/12404512, abgerufen am 08.02.2021.
Calabrese, V. et al. (2003): Disruption of thiol homeostasis and nitrosative stress in the cerebrospinal fluid of patients with active multiple sclerosis: evidence for a protective role of acetylcarnitine. Neurochemical research vol. 28,9 (2003): 1321-8. https://pubmed.ncbi.nlm.nih.gov/12938853/, abgerufen am 08.02.2021.
Cantó, A. et al. (2019): Nitrosative Stress in Retinal Pathologies: Review. Antioxidants (Basel, Switzerland), 8(11), 543. https://www.ncbi.nlm.nih.gov/pubmed/31717957, abgerufen am 08.02.2021.
Casaril, A: M. et al. (2019): The selenium-containing compound 3-((4-chlorophenyl)selanyl)-1-methyl-1H-indole reverses depressive-like behavior induced by acute restraint stress in mice: modulation of oxido-nitrosative stress and inflammatory pathway. Psychopharmacology vol. 236,10 (2019): 2867-2880. https://pubmed.ncbi.nlm.nih.gov/30610349/, abgerufen am 08.02.2021.
Chico, L. et al. (2017): Physical exercise and oxidative stress in muscular dystrophies: is there a good balance?. Archives italiennes de biologie, 155(1-2), 11–24. https://www.ncbi.nlm.nih.gov/pubmed/28715594, abgerufen am 08.02.2021.
Chiş, I. C. et al. (2018): Protective effects of quercetin from oxidative/nitrosative stress under intermittent hypobaric hypoxia exposure in the rat's heart. Physiology international vol. 105,3 (2018): 233-246. https://pubmed.ncbi.nlm.nih.gov/30282485/, abgerufen am 08.02.2021.
Coles, L. D. et al. (2018): Repeated-Dose Oral N-Acetylcysteine in Parkinson's Disease: Pharmacokinetics and Effect on Brain Glutathione and Oxidative Stress. Journal of clinical pharmacology, 58(2), 158–167. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5762253/, abgerufen am 08.02.2021.
Combet, E. et al. (2007): Fat transforms ascorbic acid from inhibiting to promoting acid-catalysed N-nitrosation. Gut, 56(12), 1678–1684. https://www.ncbi.nlm.nih.gov/pubmed/17785370, abgerufen am 08.02.2021.
Combet, E. et al. (2010): Dietary phenolic acids and ascorbic acid: Influence on acid-catalyzed nitrosative chemistry in the presence and absence of lipids. Free radical biology & medicine, 48(6), 763–771. https://www.ncbi.nlm.nih.gov/pubmed/20026204, abgerufen am 08.02.2021.
Cordero, M. D. et al. (2013): Can coenzyme q10 improve clinical and molecular parameters in fibromyalgia?. Antioxidants & redox signaling, 19(12), 1356–1361. https://www.ncbi.nlm.nih.gov/pubmed/23458405, abgerufen am 08.02.2021.
Cox, I. M. et al. (1991): Red blood cell magnesium and chronic fatigue syndrome. The Lancet Volume 337, ISSUE 8744, P757-760, March 30, 1991. https://www.thelancet.com/journals/lancet/article/PII0140-6736(91)91371-Z/abstract?code=lancet-site, abgerufen am 08.02.2021.
Crotty, G. F. et al. (2017): Targeting urate to reduce oxidative stress in Parkinson disease. Experimental neurology, 298(Pt B), 210–224. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5693633/, abgerufen am 08.02.2021.
Darwish, M. A. et al. (2017): Vitamin E mitigates cisplatin-induced nephrotoxicity due to reversal of oxidative/nitrosative stress, suppression of inflammation and reduction of total renal platinum accumulation. Journal of biochemical and molecular toxicology vol. 31,1 (2017): 1-9. https://pubmed.ncbi.nlm.nih.gov/27550472/, abgerufen am 08.02.2021.
de Melo, L. et al. (2017): Shared metabolic and immune-inflammatory, oxidative and nitrosative stress pathways in the metabolic syndrome and mood disorders. Progress in neuro-psychopharmacology & biological psychiatry, 78, 34–50. https://www.ncbi.nlm.nih.gov/pubmed/28438472, abgerufen am 08.02.2021.
Denda, H. et al. (2011): Clinical significance of cerebrospinal fluid nitric oxide concentrations in degenerative cervical and lumbar diseases. European spine journal : official publication of the European Spine Society, the European Spinal Deformity Society, and the European Section of the Cervical Spine Research Society vol. 20,4 (2011): 604-11. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3065603/, abgerufen am 08.02.2021.
Domitrović, R. et al. (2012): Differential hepatoprotective mechanisms of rutin and quercetin in CCl(4)-intoxicated BALB/cN mice. Acta pharmacologica Sinica vol. 33,10 (2012): 1260-70. https://pubmed.ncbi.nlm.nih.gov/22902988, abgerufen am 08.02.2021.
El-Shafey, M. M. et al. (2015): Quercetin protects against acetaminophen-induced hepatorenal toxicity by reducing reactive oxygen and nitrogen species. Pathophysiology : the official journal of the International Society for Pathophysiology vol. 22,1 (2015): 49-55. https://pubmed.ncbi.nlm.nih.gov/25547049/, abgerufen am 08.02.2021.
Fatima, S. et al. (2016): Combined treatment of epigallocatechin gallate and Coenzyme Q10 attenuates cisplatin-induced nephrotoxicity via suppression of oxidative/nitrosative stress, inflammation and cellular damage. Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association, 94, 213–220. https://www.ncbi.nlm.nih.gov/pubmed/27265264, abgerufen am 08.02.2021.
Filler, K. et al. (2014): Association of mitochondrial dysfunction and fatigue: A review of the literature. BBA Clin. 2014 Jun; 1: 12–23. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4136529/, abgerufen am 08.02.2021.
Ford, T. C. et al. (2018): The Effect of a High-Dose Vitamin B Multivitamin Supplement on the Relationship between Brain Metabolism and Blood Biomarkers of Oxidative Stress: A Randomized Control Trial. Nutrients, 10(12), 1860. https://www.ncbi.nlm.nih.gov/pubmed/30513795, abgerufen am 08.02.2021.
Gao, X. et al. (2014): Dietary trimethylamine N-oxide exacerbates impaired glucose tolerance in mice fed a high fat diet. Journal of bioscience and bioengineering, 118(4), 476–481. https://www.ncbi.nlm.nih.gov/pubmed/24721123, abgerufen am 08.02.2021.
Guest, J. et al. (2015): Novel relationships between B12, folate and markers of inflammation, oxidative stress and NAD(H) levels, systemically and in the CNS of a healthy human cohort. Nutritional neuroscience, 18(8), 355–364. https://www.ncbi.nlm.nih.gov/pubmed/26263423, abgerufen am 08.02.2021.
Hattiwale, S. H. et al. (2013): Protective effect of L-ascorbic acid on nickel induced pulmonary nitrosative stress in male albino rats. Biometals : an international journal on the role of metal ions in biology, biochemistry, and medicine vol. 26,2 (2013): 329-36. https://pubmed.ncbi.nlm.nih.gov/23463385/, abgerufen am 08.02.2021.
Hodgson, J. M. & Watts, G. F. (2003): Can coenzyme Q10 improve vascular function and blood pressure? Potential for effective therapeutic reduction in vascular oxidative stress. BioFactors (Oxford, England), 18(1-4), 129–136. https://www.ncbi.nlm.nih.gov/pubmed/14695928, abgerufen am 08.02.2021.
Hopper, I. et al. (2020): Nutraceuticals in Patients With Heart Failure: A Systematic Review. Journal of cardiac failure, 26(2), 166–179. https://www.ncbi.nlm.nih.gov/pubmed/31704198, abgerufen am 08.02.2021.
Huang, W. B. & Fan, Q. (2011): Cod liver oil: a potential protective supplement for human glaucoma. International journal of ophthalmology vol. 4,6 (2011): 648-51. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3340802/, abgerufen am 08.02.2021.
Jafri, A. et al. (2018): Protective effect of magnesium acetyltaurate and taurine against NMDA-induced retinal damage involves reduced nitrosative stress. Molecular vision, 24, 495–508. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6066271/, abgerufen am 08.02.2021.
Jargar, J. G. et al. (2012): α-Tocopherol ameliorates nickel induced testicular oxidative and nitrosative stress in albino rats. Journal of basic and clinical physiology and pharmacology vol. 23,2 (2012): 77-82. https://pubmed.ncbi.nlm.nih.gov/23092795/, abgerufen am 08.02.2021.
Jiménez-Fernández, S. et al. (2015): Oxidative stress and antioxidant parameters in patients with major depressive disorder compared to healthy controls before and after antidepressant treatment: results from a meta-analysis. The Journal of clinical psychiatry, 76(12), 1658–1667. https://www.ncbi.nlm.nih.gov/pubmed/26579881, abgerufen am 08.02.2021.
Kandhare, A. D. et al. (2013): Elucidation of molecular mechanism involved in neuroprotective effect of Coenzyme Q10 in alcohol-induced neuropathic pain. Fundamental & clinical pharmacology, 27(6), 603–622. https://www.ncbi.nlm.nih.gov/pubmed/23057828, abgerufen am 08.02.2021.
Karwowska, M. & Kononiuk, A. (2020): Nitrates/Nitrites in Food-Risk for Nitrosative Stress and Benefits. Antioxidants (Basel, Switzerland), 9(3), 241. https://www.ncbi.nlm.nih.gov/pubmed/32188080, abgerufen am 08.02.2021.
Katyare, S. & Mali, A. (2016): Omega-3 Fatty Acids and Mitochondrial Functions. Omega-3 Fatty Acids (pp.229-233). https://www.researchgate.net/publication/308190524_Omega-3_Fatty_Acids_and_Mitochondrial_Functions, abgerufen am 08.02.2021.
Khurana, S. et al. (2013): Polyphenols: benefits to the cardiovascular system in health and in aging. Nutrients vol. 5,10 3779-827. 26 Sep. 2013. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3820045/, abgerufen am 08.02.2021.
Kim, C. Y. et al. (2009): Neuroprotective effect of epigallocatechin-3-gallate against beta-amyloid-induced oxidative and nitrosative cell death via augmentation of antioxidant defense capacity. Archives of pharmacal research vol. 32,6 (2009): 869-81. https://pubmed.ncbi.nlm.nih.gov/19557365/, abgerufen am 08.02.2021.
Klotz, L. O. et al. (2003): Role of copper, zinc, selenium and tellurium in the cellular defense against oxidative and nitrosative stress. The Journal of nutrition, 133(5 Suppl 1), 1448S–51S. https://www.ncbi.nlm.nih.gov/pubmed/12730440, abgerufen am 08.02.2021.
Koskenkorva-Frank, T. S. et al. (2013): The complex interplay of iron metabolism, reactive oxygen species, and reactive nitrogen species: insights into the potential of various iron therapies to induce oxidative and nitrosative stress. Free radical biology & medicine vol. 65 (2013): 1174-1194. https://pubmed.ncbi.nlm.nih.gov/24036104/, abgerufen am 08.02.2021.
Kramer, J. H. et al. (2009): Neurogenic inflammation and cardiac dysfunction due to hypomagnesemia. The American journal of the medical sciences vol. 338,1 (2009): 22-7. https://pubmed.ncbi.nlm.nih.gov/19593099/, abgerufen am 08.02.2021.
Kurutas, E. B. (2016): The importance of antioxidants which play the role in cellular response against oxidative/nitrosative stress: current state. Nutrition journal, 15(1), 71. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4960740/, abgerufen am 08.02.2021.
Labor Dr. Philadelphy. (2020): Qualitätspolitik und Leitbild. https://www.phillab.at/index.php?id=45, abgerufen am 08.02.2021.
Lemperle, M. & Kesten, S. (2017): Nitrosativer Stress als Ursache erworbener Mitochondriopathien. OM & Ernährung 2017;159.
Liepinsh, E. et al. (2016): Decreased acylcarnitine content improves insulin sensitivity in experimental mice models of insulin resistance. Pharmacological research vol. 113,Pt B (2016): 788-795. https://pubmed.ncbi.nlm.nih.gov/26621248/, abgerufen am 08.02.2021.
Lopresti, A. L. et al. (2014): Curcumin for the treatment of major depression: a randomised, double-blind, placebo controlled study. Journal of affective disorders vol. 167 (2014): 368-75. https://pubmed.ncbi.nlm.nih.gov/25046624, abgerufen am 08.02.2021.
Lundberg, J. O. et al. (2018): Metabolic Effects of Dietary Nitrate in Health and Disease. Cell Metabolism Volume 28, ISSUE 1, P9-22, July 03, 201. https://www.cell.com/cell-metabolism/fulltext/S1550-4131(18)30389-9#articleInformation, abgerufen am 08.02.2021.
Maes, M. & Leunis, J. C. (2014): Attenuation of autoimmune responses to oxidative specific epitopes, but not nitroso-adducts, is associated with a better clinical outcome in Myalgic Encephalomyelitis/chronic fatigue syndrome. Neuro endocrinology letters, 35(7), 577–585. https://www.ncbi.nlm.nih.gov/pubmed/25617880, abgerufen am 08.02.2021.
Maes, M. (2011): An intriguing and hitherto unexplained co-occurrence: Depression and chronic fatigue syndrome are manifestations of shared inflammatory, oxidative and nitrosative (IO&NS) pathways. Progress in neuro-psychopharmacology & biological psychiatry, 35(3), 784–794. https://www.ncbi.nlm.nih.gov/pubmed/20609377, abgerufen am 08.02.2021.
Maes, M. et al. (2009): Lower plasma Coenzyme Q10 in depression: a marker for treatment resistance and chronic fatigue in depression and a risk factor to cardiovascular disorder in that illness. Neuro endocrinology letters, 30(4), 462–469. https://www.ncbi.nlm.nih.gov/pubmed/20010493, abgerufen am 08.02.2021.
Maes, M. et al. (2011): A review on the oxidative and nitrosative stress (O&NS) pathways in major depression and their possible contribution to the (neuro)degenerative processes in that illness. Progress in neuro-psychopharmacology & biological psychiatry, 35(3), 676–692. https://www.ncbi.nlm.nih.gov/pubmed/20471444, abgerufen am 08.02.2021.
Maes, M. et al. (2011): Multiple aberrations in shared inflammatory and oxidative & nitrosative stress (IO&NS) pathways explain the co-association of depression and cardiovascular disorder (CVD), and the increased risk for CVD and due mortality in depressed patients. Progress in neuro-psychopharmacology & biological psychiatry, 35(3), 769–783. https://www.ncbi.nlm.nih.gov/pubmed/20561554, abgerufen am 08.02.2021.
Maia, A. et al. (2019): Oxidative and nitrosative stress markers in obsessive-compulsive disorder: a systematic review and meta-analysis. Acta psychiatrica Scandinavica, 139(5), 420–433. https://www.ncbi.nlm.nih.gov/pubmed/30873609, abgerufen am 08.02.2021.
Martorell, M. et al. (2015): Docosahexaenoic acid supplementation promotes erythrocyte antioxidant defense and reduces protein nitrosative damage in male athletes. Lipids vol. 50,2 (2015): 131-48. https://pubmed.ncbi.nlm.nih.gov/25503390/, abgerufen am 08.02.2021.
Mattera, R. et al. (2017): Effects of Polyphenols on Oxidative Stress-Mediated Injury in Cardiomyocytes. Nutrients, 9(5), 523. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5452253/, abgerufen am 08.02.2021.
Maurya, P. K. et al. (2016): The role of oxidative and nitrosative stress in accelerated aging and major depressive disorder. Progress in neuro-psychopharmacology & biological psychiatry, 65, 134–144. https://www.ncbi.nlm.nih.gov/pubmed/26348786, abgerufen am 08.02.2021.
Misra, U. K. et al. (2017): Oxidative Stress Markers in Vitamin B12 Deficiency. Molecular neurobiology, 54(2), 1278–1284. https://www.ncbi.nlm.nih.gov/pubmed/26843105, abgerufen am 08.02.2021.
Molz, P. & Schröder, N. (2017): Potential Therapeutic Effects of Lipoic Acid on Memory Deficits Related to Aging and Neurodegeneration. Frontiers in pharmacology, 8, 849. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5732919/, abgerufen am 08.02.2021.
Morris, G. & Maes, M. (2014): Mitochondrial dysfunctions in myalgic encephalomyelitis/chronic fatigue syndrome explained by activated immuno-inflammatory, oxidative and nitrosative stress pathways. Metabolic brain disease vol. 29,1 (2014): 19-36. https://pubmed.ncbi.nlm.nih.gov/24557875, abgerufen am 08.02.2021.
Morris, G. & Maes, M. (2014): Oxidative and Nitrosative Stress and Immune-Inflammatory Pathways in Patients with Myalgic Encephalomyelitis (ME)/Chronic Fatigue Syndrome (CFS). Current neuropharmacology vol. 12,2 (2014): 168-85. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3964747/, abgerufen am 08.02.2021.
Mozos, I. & Luca, C. T. (2017): Crosstalk between Oxidative and Nitrosative Stress and Arterial Stiffness. Current vascular pharmacology, 15(5), 446–456. https://www.ncbi.nlm.nih.gov/pubmed/28155616, abgerufen am 08.02.2021.
Nicolson, G. L. (2014): Mitochondrial Dysfunction and Chronic Disease: Treatment With Natural Supplements. Integr Med (Encinitas). 2014 Aug; 13(4): 35–43. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4566449/, abgerufen am 08.02.2021.
Nouri, A. et al. (2019): The Role of Vitamin B12 in the Management and Optimization of Treatment in Patients With Degenerative Cervical Myelopathy. Global spine journal, 9(3), 331–337. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6542160/, abgerufen am 08.02.2021.
Oellegaard, J. et al. (2017): Trimethylamine N-oxide (TMAO) as a New Potential Therapeutic Target for Insulin Resistance and Cancer. Current Pharmaceutical Design 23(25). https://www.researchgate.net/publication/317848952_Trimethylamine_N-oxide_TMAO_as_a_New_Potential_Therapeutic_Target_for_Insulin_Resistance_and_Cancer, abgerufen am 08.02.2021.
Office of Dietary Supplements. (2020): Dietary Supplements for Primary Mitochondrial Disorders. https://ods.od.nih.gov/factsheets/PrimaryMitochondrialDisorders-HealthProfessional/, abgerufen am 08.02.2021.
Onyango A. N. (2018): Cellular Stresses and Stress Responses in the Pathogenesis of Insulin Resistance. Oxidative medicine and cellular longevity, 2018, 4321714. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6079365/, abgerufen am 08.02.2021.
Oviedo-Solís, C. I. et al. (2018): Strawberry polyphenols decrease oxidative stress in chronic diseases. Gaceta medica de Mexico vol. 154,1 (2018): 80-86. https://pubmed.ncbi.nlm.nih.gov/29420521/, abgerufen am 08.02.2021.
Papanas, N. & Ziegler, D. (2014): Efficacy of α-lipoic acid in diabetic neuropathy. Expert opinion on pharmacotherapy vol. 15,18 (2014): 2721-31. https://pubmed.ncbi.nlm.nih.gov/25381809/, abgerufen am 08.02.2021.
Parissis, J. T. et al. (2009): Effects of Darbepoetin Alfa on plasma mediators of oxidative and nitrosative stress in anemic patients with chronic heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. The American journal of cardiology, 103(8), 1134–1138. https://www.ncbi.nlm.nih.gov/pubmed/19361602, abgerufen am 08.02.2021.
Paulis G. (2018): Inflammatory mechanisms and oxidative stress in prostatitis: the possible role of antioxidant therapy. Research and reports in urology, 10, 75–87. https://www.ncbi.nlm.nih.gov/pubmed/30271757, abgerufen am 08.02.2021.
Petersen, F. et al. (2017): The effects of polyunsaturated fatty acids and antioxidant vitamins on atrial oxidative stress, nitrotyrosine residues, and connexins following extracorporeal circulation in patients undergoing cardiac surgery. Molecular and cellular biochemistry vol. 433,1-2 (2017): 27-40. https://pubmed.ncbi.nlm.nih.gov/28337705/, abgerufen am 08.02.2021.
Pinazo-Duran, M. D. et al. (2018): Strategies to Reduce Oxidative Stress in Glaucoma Patients. Current neuropharmacology, 16(7), 903–918. https://www.ncbi.nlm.nih.gov/pubmed/28677495, abgerufen am 08.02.2021.
Pizzino, G. et al (2017): Oxidative Stress: Harms and Benefits for Human Health. Oxidative medicine and cellular longevity, 2017, 8416763. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5551541/, abgerufen am 08.02.2021.
Plioplys, A. V. & Plioplys, S. (1995): Serum levels of carnitine in chronic fatigue syndrome: clinical correlates. Neuropsychobiology, 32(3), 132–138. https://www.ncbi.nlm.nih.gov/pubmed/8544970, abgerufen am 08.02.2021.
Polytarchou, K. et al. (2020): Methylmalonic acid and vitamin B12 in patients with heart failure. Hellenic journal of cardiology: HJC = Hellenike kardiologike epitheorese, 61(5), 330–337. https://www.ncbi.nlm.nih.gov/pubmed/31740360 , abgerufen am 08.02.2021.
Prasad, K. N. & Bondy, S. C. (2020): Increased oxidative stress, inflammation, and glutamate: Potential preventive and therapeutic targets for hearing disorders. Mechanisms of ageing and development, 185, 111191. https://www.ncbi.nlm.nih.gov/pubmed/31765645, abgerufen am 08.022021.
Richie, J. P. Jr. et al. (2015): Randomized controlled trial of oral glutathione supplementation on body stores of glutathione. European journal of nutrition vol. 54,2 (2015): 251-63. https://pubmed.ncbi.nlm.nih.gov/24791752/, abgerufen am 08.02.2021.
Rizor, A. et al. (2019): Astrocytic Oxidative/Nitrosative Stress Contributes to Parkinson's Disease Pathogenesis: The Dual Role of Reactive Astrocytes. Antioxidants (Basel, Switzerland), 8(8), 265. https://www.ncbi.nlm.nih.gov/pubmed/31374936, abgerufen am 08.02.2021.
Rodrigo, R. et al. (2013): A randomized controlled trial to prevent post-operative atrial fibrillation by antioxidant reinforcement. Journal of the American College of Cardiology vol. 62,16 (2013): 1457-65. https://pubmed.ncbi.nlm.nih.gov/23916928/, abgerufen am 08.02.2021.
Salameh, A. et al. (2018): Epigallocatechin Gallate Reduces Ischemia/Reperfusion Injury in Isolated Perfused Rabbit Hearts. International journal of molecular sciences vol. 19,2 628. 23 Feb. 2018 https://pubmed.ncbi.nlm.nih.gov/29473846/, abgerufen am 08.02.2021.
Salehi, B. et al. (2019): Insights on the Use of α-Lipoic Acid for Therapeutic Purposes. Biomolecules, 9(8), 356. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6723188/, abgerufen am 08.02.2021.
Serini, S. & Calviello, G. (2016): Reduction of Oxidative/Nitrosative Stress in Brain and its Involvement in the Neuroprotective Effect of n-3 PUFA in Alzheimer's Disease. Current Alzheimer research, 13(2), 123–134. https://www.ncbi.nlm.nih.gov/pubmed/26391044, abgerufen am 08.02.2021.
Siwek, M. et al. (2013): Oxidative stress markers in affective disorders. Pharmacol Rep. 2013;65(6):1558-71. https://www.ncbi.nlm.nih.gov/pubmed/24553004, abgerufen am 08.02.2021.
Solomon L. R. (2016): Low Cobalamin Levels as Predictors of Cobalamin Deficiency: Importance of Comorbidities Associated with Increased Oxidative Stress. The American journal of medicine, 129(1), 115.e9–115.e16. https://www.ncbi.nlm.nih.gov/pubmed/26239093, abgerufen am 08.02.2021.
Song, X. et al. (2017): Efficacy and Safety of L-Carnitine Treatment for Chronic Heart Failure: A Meta-Analysis of Randomized Controlled Trials. BioMed research international, 2017, 6274854. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5406747/, abgerufen am 08.02.2021.
Soodaeva, S. et al. (2019): Features of Oxidative and Nitrosative Metabolism in Lung Diseases. Oxidative medicine and cellular longevity, 2019, 1689861. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6556356/, abgerufen am 08.02.2021.
Stepien, K. M. et al. (2017): Evidence of Oxidative Stress and Secondary Mitochondrial Dysfunction in Metabolic and Non-Metabolic Disorders. Journal of clinical medicine, 6(7), 71. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5532579/, abgerufen am 08.02.2021.
Sullivan, E. M. et al. (2018): Mechanisms by Which Dietary Fatty Acids Regulate Mitochondrial Structure-Function in Health and Disease. Advances in nutrition (Bethesda, Md.), 9(3), 247–262. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5952932/, abgerufen am 08.02.2021.
Swardfager, W. et al. (2013). Potential roles of zinc in the pathophysiology and treatment of major depressive disorder. Neuroscience and biobehavioral reviews, 37(5), 911–929. https://www.ncbi.nlm.nih.gov/pubmed/23567517, abgerufen am 08.02.2021.
Synder, M. J. et al. (2016): Treating Painful Diabetic Peripheral Neuropathy: An Update. Am Fam Physician. 2016 Aug 1;94(3):227-234. https://www.aafp.org/afp/2016/0801/p227.html, abgerufen am 08.02.2021.
Tang, J. et al. (2007): Alpha-lipoic acid may improve symptomatic diabetic polyneuropathy. The neurologist vol. 13,3 (2007): 164-7. https://pubmed.ncbi.nlm.nih.gov/17495764/, abgerufen am 08.02.2021.
Tipoe, G. L. et al. (2010): Epigallocatechin-3-gallate (EGCG) reduces liver inflammation, oxidative stress and fibrosis in carbon tetrachloride (CCl4)-induced liver injury in mice. Toxicology vol. 273,1-3 (2010): 45-52. https://pubmed.ncbi.nlm.nih.gov/20438794/, abgerufen am 08.02.2021.
Tomas-Sanchez, C. et al. (2018): Prophylactic Zinc and Therapeutic Selenium Administration Increases the Antioxidant Enzyme Activity in the Rat Temporoparietal Cortex and Improves Memory after a Transient Hypoxia-Ischemia. Oxidative medicine and cellular longevity vol. 2018 9416432. 6 Sep. 2018. https://pubmed.ncbi.nlm.nih.gov/30258527, abgerufen am 08.02.2021.
Tseng, H. C. et al. (2020): Protective Effect of (-)Epigallocatechin-3-gallate on Rotenone-Induced Parkinsonism-like Symptoms in Rats. Neurotoxicity research vol. 37,3 (2020): 669-682. https://pubmed.ncbi.nlm.nih.gov/31811588, abgerufen am 08.02.2021.
Tucker, L. A. (2019): Serum and Dietary Folate and Vitamin B12 Levels Account for Differences in Cellular Aging: Evidence Based on Telomere Findings in 5581 U.S. Adults. Oxidative medicine and cellular longevity, 2019, 4358717. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6800923/, abgerufen am 08.02.2021.
Ungvári, Z. et al. (2005): Role of oxidative-nitrosative stress and downstream pathways in various forms of cardiomyopathy and heart failure. Current vascular pharmacology vol. 3,3 (2005): 221-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2225532/, abgerufen am 08.02.2021.
Uys, J. D. et al. (2011): Chapter Eighteen - Nitrosative Stress-Induced S-Glutathionylation of Protein Disulfide Isomerase. Methods in EnzymologyVolume 490, 2011, Pages 321-332. https://www.sciencedirect.com/science/article/pii/B9780123851147000180, abgerufen am 08.02.2021.
van de Lagemaat, E. E. et al. (2019): Vitamin B12 in Relation to Oxidative Stress: A Systematic Review. Nutrients, 11(2), 482. https://www.ncbi.nlm.nih.gov/pubmed/30823595, abgerufen am 08.02.2021.
Vermeulen, R. C. W. & Scholte, H. R. (2004): Exploratory open label, randomized study of acetyl- and propionylcarnitine in chronic fatigue syndrome. Psychosomatic medicine vol. 66,2 (2004): 276-82. https://pubmed.ncbi.nlm.nih.gov/15039515/, abgerufen am 08.02.2021.
Wang, J. et al. (2018): Zinc, Magnesium, Selenium and Depression: A Review of the Evidence, Potential Mechanisms and Implications. Nutrients vol. 10,5 584. 9 May. 2018. https://pubmed.ncbi.nlm.nih.gov/29747386/, abgerufen am 08.02.2021.
Wang, M. & Xu, T. (2019): Methyl B12 protects PC12 cells against cytotoxicity induced by Aβ25-35. Journal of cellular biochemistry, 10.1002/jcb.28475. Advance online publication. https://www.ncbi.nlm.nih.gov/pubmed/30793354, abgerufen am 08.02.2021.
Weglicki, W. B. et al. (2011): Cardiovascular and intestinal responses to oxidative and nitrosative stress during prolonged magnesium deficiency. The American journal of the medical sciences vol. 342,2 (2011): 125-8. https://pubmed.ncbi.nlm.nih.gov/21747282/, abgerufen am 08.02.2021.
Wigner, P. et al. (2018): The molecular aspects of oxidative & nitrosative stress and the tryptophan catabolites pathway (TRYCATs) as potential causes of depression. Psychiatry research, 262, 566–574. https://www.ncbi.nlm.nih.gov/pubmed/28951145, abgerufen am 08.02.2021.
Womersley, J. S. & Uys, J. D. (2016): Chapter Three - S-Glutathionylation and Redox Protein Signaling in Drug Addiction. Progress in Molecular Biology and Translational ScienceVolume 137, 2016, Pages 87-121. https://www.sciencedirect.com/science/article/pii/S1877117315002033, abgerufen am 08.02.2021.
Xu, M. et al. (2003): Effects of magnesium sulfate on brain mitochondrial respiratory function in rats after experimental traumatic brain injury. Chinese Journal of Traumatology (English Edition) 5(6):361-4. https://www.researchgate.net/publication/11024347_Effects_of_magnesium_sulfate_on_brain_mitochondrial_respiratory_function_in_rats_after_experimental_traumatic_brain_injury, abgerufen am 08.02.2021.
Yang, X. et al. (2007): Interventional effect of magnesium sulfate on nitric oxide synthase activity after acute craniocerebral injury. Neural Regeneration Research 2(4):251-253. https://www.researchgate.net/publication/247358675_Interventional_effect_of_magnesium_sulfate_on_nitric_oxide_synthase_activity_after_acute_craniocerebral_injury, abgerufen am 08.02.2021.
Yu, C. Z. et al. (2014): Systematic administration of B vitamins attenuates neuropathic hyperalgesia and reduces spinal neuron injury following temporary spinal cord ischaemia in rats. European journal of pain (London, England), 18(1), 76–85. https://www.ncbi.nlm.nih.gov/pubmed/24038589, abgerufen am 08.02.2021.
Ziegler, D. et al. (2006): Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial. Diabetes care vol. 29,11 (2006): 2365-70. https://pubmed.ncbi.nlm.nih.gov/17065669/, abgerufen am 08.02.2021.
Ziegler, D. et al. (2011): Efficacy and safety of antioxidant treatment with α-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial. Diabetes care vol. 34,9 (2011): 2054-60. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3161301/, abgerufen am 08.02.2021.